香蕉花多糖抗氧化活性及穩定性研究
唐雅園,王雪峰,韋 珍,吳夢柯,楊兆杏,向 昱,何雪梅,*,孫 健,3,*
(1.廣西壯族自治區農業科學院 農產品加工研究所,廣西南寧 530007;2.廣西果蔬貯藏與加工新技術重點實驗室,廣西南寧 530007;3.廣西香蕉保鮮與加工工程技術研究中心,廣西南寧 530007)
香蕉(Musaspp.)是我國大宗高效的經濟果樹,種植面積和產量居世界前列,我國主要的香蕉種植區域有廣東、廣西、云南、海南、福建五大省份[1]。在規模化的香蕉生產中,香蕉花是香蕉成熟采摘后產生的幾乎與果實等量的廢棄物,但現階段還未得到充分利用。長期丟棄在蕉園的香蕉花容易引起病蟲害,這不僅造成蕉園環境二次污染,也導致大量植物資源的浪費[2]。因此,充分研究和利用香蕉花這一廢棄資源,加強香蕉花綜合開發力度,生產高附加值的產品,對保護環境、減少資源浪費和提高香蕉產業經濟效益有著重要意義。
中醫記載香蕉花味甘、微辛,具有化痰軟堅、平肝熄風、活血調經、美膚養顏、安神減壓等功效[3]。我國南部部分地區居民將香蕉花用來煮水或煎食。在斯里蘭卡、老撾、菲律賓等東南亞地區,香蕉花也長期作為蔬菜和藥材食用[4-5]。香蕉花的活性成分包括多糖類[6]、酚類、黃酮類和皂苷類[7],其中植物多糖是由超過10 個單糖分子脫水縮合而成的一類結構復雜的天然高分子碳水化合物,安全性高、副作用小,具有抗氧化、降血糖、抗腫瘤、提高免疫、調節腸道菌群等生物活性[8]。
在正常情況下,機體內產生的自由基通過低分子化合物和酶的作用維持著動態平衡,然而隨著機體年齡增大,體內自由基積累過多,自由基具有的強氧化性會導致疾病的產生,如糖尿病、腫瘤、心血管疾病等[9]。可見,天然抗氧化劑的攝入對預防和治療多種疾病具有重要意義。越來越多的植物多糖被證實是一類天然的抗氧化劑,主要通過清除過量的自由基[10]、提高抗氧化酶活性[11]、抑制脂質過氧化[12]進而發揮抗氧化活性。與動物多糖和微生物多糖相比,植物多糖具有來源廣泛、易于獲得、得率較高等特點,已在功能食品、食品添加劑、日化用品、生物醫藥等領域得到廣泛應用[13]。近年來,許多研究表明香蕉花的酚類[14-17]、黃酮類[18-20]等活性成分具有很好的抗氧化活性,而關于香蕉花多糖的抗氧化活性及穩定性報道較少。因此,本文評價香蕉花多糖的抗氧化活性,進一步模擬不同的食品加工條件考察香蕉花多糖的抗氧化穩定性,為香蕉花多糖作為天然抗氧化劑的開發利用提供理論依據。
1 材料與方法
1.1 材料與儀器
香蕉花 來源于廣西壯族自治區農業科學院武鳴里建科學研究基地的桂蕉1 號(2022 年8 月采摘);1,1-二苯基-2-三硝基苯肼(DPPH) 美國Sigma 公司;半乳糖醛酸、沒食子酸、蘆丁、總抗氧化能力(T-AOC)檢測試劑盒(FRAP 法,BC1315) 北京索萊寶科技有限公司;羥自由基測試試劑盒(A018-1-1)、抑制與產生超氧陰離子自由基測定試劑盒(A052-1-1) 南京建成生物工程研究所;硝酸鋁(Al(NO3)3)、維生素C(VC)、磷酸氫二鈉(Na2HPO4)、檸檬酸、蔗糖、葡萄糖、苯甲酸鈉、氯化鈉(NaCl)、氯化鉀(KCl)、氯化銅(CuCl2)、氯化鐵(FeCl3) 天津市大茂化學試劑廠;所有試劑均為分析純。
WGLL-230BE 型電熱鼓風干燥箱 天津市泰斯特儀器有限公司;UV-1800 型紫外分光光度計上海美析儀器有限公司;HH-S4 型數顯恒溫水浴鍋金壇市萬華實驗儀器廠;RE-52A 型旋轉蒸發儀上海亞榮生化儀器廠;LGJ-18 型冷凍干燥機 北京松源華興科技發展有限公司;3-18ks 型臺式高速冷凍離心機 美國Sigma 公司;BioTek Epoch 全波長酶標儀 美國BioTek 公司;G80F20CSL-B8(R1)型微波爐 廣東格蘭仕微波生活電器制造有限公司;YAMATO SQ510C 型立式壓力蒸汽滅菌器 日本Yamato Scientific 公司。
1.2 實驗方法
1.2.1 香蕉花多糖的制備及組成成分分析
1.2.1.1 多糖提取與純化 新鮮的香蕉花采摘后,將花蕾部分分離、清洗瀝干,熱風干燥后粉碎過80 目篩。向香蕉花粉末中加入體積分數90%乙醇去除色素類和脂質類成分,剩余物經過濾、凍干得到脫色香蕉花粉末[21]。香蕉花多糖提取方法參考前期建立的熱水提醇沉法[22],脫色香蕉花粉末按固液比1:50(g/mL)加入去離子水,提取溫度設置為90 ℃,提取時間設置為2 h,提取2 次,合并兩次提取液并按體積比1:4(v/v)加入體積分數95%乙醇,于4 ℃靜置12 h。收集沉淀并將沉淀完全溶解于去離子水中,按體積比1:4(v/v)加入Sevag 溶液去除蛋白類成分。脫蛋白的多糖溶液旋轉蒸發濃縮,最后凍干得到香蕉花多糖,稱量并按公式(1)計算香蕉花多糖得率。
1.2.1.2 多糖組成成分分析 香蕉花多糖的總糖含量采用苯酚-硫酸法,糖醛酸含量采用硫酸-咔唑法[23],蛋白含量采用考馬斯亮藍(Bradford)法[22],總多酚含量采用福林酚法[24],總黃酮含量測定采用Al(NO3)3比色法[25]。
1.2.2 香蕉花多糖抗氧化活性分析
1.2.2.1 總抗氧化能力(T-AOC)測定 采用Fe3+還原試劑盒(FRAP 法)測定香蕉花多糖的總抗氧化能力[26],操作步驟參照試劑盒說明書進行,香蕉花多糖溶液質量濃度范圍0.01~1.0 mg/mL,陽性對照為相同質量濃度范圍的VC溶液。
1.2.2.2 DPPH 自由基清除能力 參考何雪梅等[27]的方法,移取0.2 mL 不同質量濃度的香蕉花多糖溶液(0.1~1.0 mg/mL)或無水乙醇(空白對照),加入0.2 mL 的DPPH 溶液,振蕩混勻,避光靜置于室溫30 min 后,于517 nm 處測定吸光度值。DPPH 自由基清除率按公式(2)計算,陽性對照為相同質量濃度范圍的VC溶液。
式中,A0為DPPH 溶液和無水乙醇的吸光度值;Ai為DPPH 溶液和不同質量濃度的多糖溶液的吸光度值;Aj為多糖溶液和無水乙醇的吸光度值。
1.2.2.3 羥基自由基清除能力 采用羥自由基測定試劑盒測定香蕉花多糖的羥基自由基清除能力,操作步驟參照試劑盒說明書進行,香蕉花多糖溶液質量濃度范圍0.05~0.8 mg/mL,陽性對照為相同質量濃度范圍的VC溶液。
1.2.2.4 超氧陰離子自由基清除能力 采用抑制與產生超氧陰離子自由基測定試劑盒測定香蕉花多糖的超氧陰離子自由基清除能力,操作步驟按照試劑盒說明書進行,香蕉花多糖溶液質量濃度范圍0.05~10 mg/mL,陽性對照為相同質量濃度范圍的VC溶液。
1.2.3 香蕉花多糖抗氧化穩定性分析
1.2.3.1 光照對多糖抗氧化穩定性的影響 參考孟良玉等[28]的方法并略作改動,配制質量濃度0.1 mg/mL 的香蕉花多糖溶液,置于燒杯中,并用保鮮膜封住杯口。燒杯分別置于自然光、日光燈和避光處存放,每隔2 d 取樣,測定香蕉花多糖溶液的羥基自由基清除能力。
1.2.3.2 pH 對多糖抗氧化穩定性的影響 參考劉曉藝等[29]的方法并略作改動,將香蕉花多糖樣品分別溶解在pH 為3、4、5、6、7、8 的Na2HPO4-檸檬酸緩沖液中,配制成質量濃度0.1 mg/mL 的香蕉花多糖溶液,并用HCl 或NaOH 溶液微調pH,室溫避光放置2 h 后[30],測定香蕉花多糖溶液的羥基自由基清除能力。
1.2.3.3 溫度對多糖抗氧化穩定性的影響 參考宋姍姍等[31]的方法并略作改動,配制質量濃度0.1 mg/mL 的香蕉花多糖溶液,置于試管中,并用封口膜密封。試管分別置于40、60、80、100 ℃的避光條件下保溫,每隔0.5 h 取樣,取出后冷卻至室溫,測定香蕉花多糖溶液的羥基自由基清除能力。
1.2.3.4 金屬離子對多糖抗氧化穩定性的影響 參考宋姍姍等[31]的方法并略作改動,分別用濃度為2、4、6、8、10、12 mmol/L 的NaCl、KCl、CuCl2和FeCl3溶液配制香蕉花多糖溶液(質量濃度0.1 mg/mL),室溫避光放置2 h 后,測定香蕉花多糖溶液的羥基自由基清除能力。
1.2.3.5 常用食品配料對多糖抗氧化穩定性的影響參考趙廣河等[30]的方法,分別用蔗糖溶液(質量濃度0%、1%、2%、3%、4%和5%)、葡萄糖溶液(質量濃度0%、1%、2%、3%、4%和5%)、檸檬酸溶液(質量濃度0%、0.1%、0.2%、0.3%、0.4%和0.5%)和苯甲酸鈉溶液(質量濃度0%、0.005%、0.010%、0.015%、0.020%和0.025%)配制香蕉花多糖溶液(質量濃度0.1 mg/mL),室溫避光放置2 h 后,測定香蕉花多糖溶液的羥基自由基清除能力。
1.2.3.6 滅菌方式對多糖抗氧化穩定性的影響 參考趙廣河等[30]的方法并略作改動,分別用煮沸滅菌(100 ℃條件下加熱10 min)、巴氏滅菌(70 ℃條件下加熱30 min)、微波滅菌(微波功率2.4 W/g 條件下處理10 min)、高壓滅菌(121 ℃、0.11 MPa 條件下加熱15 min)等滅菌方式處理質量濃度0.1 mg/mL 的香蕉花多糖溶液,測定香蕉花多糖溶液的羥基自由基清除能力。
1.3 數據處理
每組做3 次重復實驗,結果以“平均值±標準偏差(Mean±SD)”表示。采用IBM SPSS Statistics 26軟件進行數據的統計分析,通過單因素方差分析(ANOVE)和Duncan 多重比較確定顯著性差異(P<0.05)。采用GraphPad Prism 9.0 進行繪圖。
2 結果與分析
2.1 香蕉花多糖得率與組成成分的分析
首先,根據公式(1)計算出香蕉花多糖的得率為14.56%±1.33%。以標準品溶液的質量濃度為橫坐標、吸光度值為縱坐標分別繪制總糖、糖醛酸、蛋白質、總多酚、總黃酮等含量指標的標準曲線。葡萄糖標準曲線回歸方程及相關系數為y=0.0084x-0.0063(R2=0.9994),半乳糖醛酸標準曲線回歸方程及相關系數為y=0.0066x-0.0319(R2=0.9993),牛血清白蛋白標準曲線回歸方程及相關系數為y=0.0067x+0.0912(R2=0.9993),沒食子酸標準曲線回歸方程及相關系數為y=0.001x+0.0495(R2=0.9993)以及蘆丁標準回歸方程及相關系數為y=0.0036x+0.0131(R2=0.9991)。結果顯示,采用熱水提醇沉法從脫色香蕉花粉末中獲得的提取物主要成分是多糖類(總糖含量超過50%),其中糖醛酸含量287.88 mg/g、蛋白質含量53.46 mg/g。此外,香蕉花多糖中含有少量的酚類、黃酮類等色素成分(見表1)。

表1 香蕉花多糖得率和組成成分分析Table 1 Extraction yield and chemical composition of banana flower polysaccharide
2.2 香蕉花多糖抗氧化活性分析
香蕉花多糖的總抗氧化能力結果如圖1a 所示,香蕉花多糖和VC對Fe3+均有一定的還原力,且隨著溶液質量濃度的增加而呈現上升趨勢。當質量濃度大于0.1 mg/mL 時,香蕉花多糖的T-AOC 顯著高于VC,尤其是當多糖溶液質量濃度為1.0 mg/mL時,其T-AOC 達到(0.56±0.02) μmol/mL。香蕉花多糖的DPPH 自由基清除能力結果如圖1b 所示,香蕉花多糖與VC均具有一定的DPPH 自由基清除能力。在0.1~0.6 mg/mL 質量濃度內,香蕉花多糖的DPPH 自由基清除能力與其濃度呈正相關性,當質量濃度大于0.6 mg/mL 后,其清除能力趨于穩定;而當VC的質量濃度為0.1 mg/mL 時,其對DPPH 自由基的清除率超過90%。香蕉花多糖和VC的DPPH 自由基清除能力的IC50值見表2,結果顯示VC的DPPH自由基清除能力(IC50=0.05±0.01 mg/mL)顯著高于香蕉花多糖(IC50=0.11±0.02 mg/mL)。當溶液質量濃度為1.0 mg/mL 時,香蕉花多糖對DPPH 自由基的清除率為79.24%±1.78%。

圖1 香蕉花多糖的抗氧化能力Fig.1 Antioxidant properties of banana flower polysaccharide
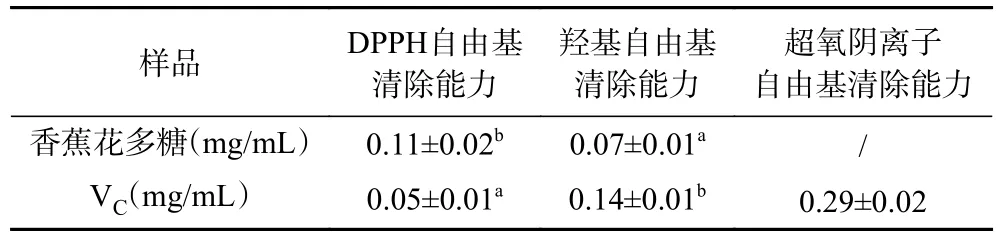
表2 香蕉花多糖自由基清除能力的IC50 值Table 2 IC50 values of free radical scavenging activities in banana flower polysaccharide
香蕉花多糖的羥基自由基清除能力結果如圖1c所示,香蕉花多糖與VC均具有一定的羥基自由基清除能力,且隨著溶液質量濃度的增加而呈現上升趨勢。香蕉花多糖羥基自由基清除能力的IC50值為(0.07±0.01)mg/mL,這顯著低于VC羥基自由基清除能力的IC50值(P<0.05)(見表2)。當香蕉花多糖質量濃度為0.4 mg/mL 時,其羥基自由基清除能力達到90.86%±1.34%。香蕉花多糖的超氧陰離子自由基清除能力結果如圖1d 所示,香蕉花多糖與VC對超氧陰離子自由基均有一定的抑制作用,且隨著溶液質量濃度的增加而呈現上升趨勢。然而,與DPPH、羥基等自由基清除能力相比,香蕉花多糖對超氧陰離子自由基的清除能力較弱,且顯著低于VC的清除能力。當香蕉花多糖質量濃度為10 mg/mL 時,其超氧陰離子自由基的清除能力僅為28.89%±2.05%。
2.3 香蕉花多糖抗氧化穩定性的分析
2.3.1 光照對多糖抗氧化穩定性的影響 光照對香蕉花多糖抗氧化活性的影響見圖2。整體來看,光照對香蕉花多糖的抗氧化穩定性有較大的影響,隨著光照時間的增加,香蕉花多糖的羥基自由基清除能力快速降低。自然光和日光燈2 種光照方式對香蕉花多糖的羥基自由基清除能力的影響趨勢較為相似。在0~6 d 時,多糖的羥基自由基清除能力下降速度較快,放置在自然光和日光燈條件下的多糖溶液,其羥基自由基清除能力降低超過90%;而光照6 d 以后,香蕉花多糖對羥基自由基的清除能力接近于0%。在避光條件下,隨著時間的增加,香蕉花多糖的抗氧化活性下降速度相對緩慢,第10 d 時,香蕉花多糖的羥基自由基清除能力保持在20.78%±0.68%,顯著高于光照條件下的多糖溶液(P<0.05)。因此,對含有香蕉花多糖的產品建議避光包裝,若加工生產過程較長,亦建議盡量做到避光。
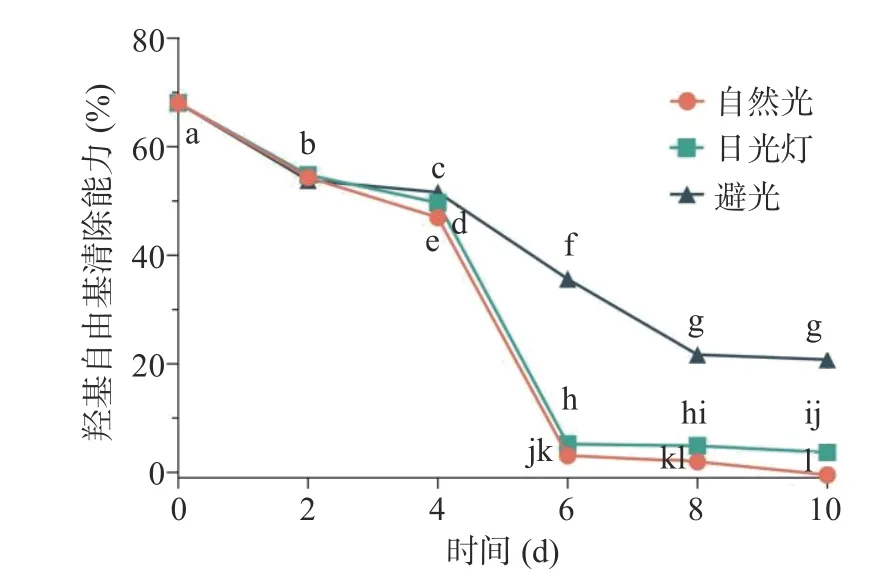
圖2 光照對香蕉花多糖抗氧化活性的影響Fig.2 Effect of light on the antioxidant activity of banana flower polysaccharide
2.3.2 pH 對多糖抗氧化穩定性的影響 pH 對香蕉花多糖抗氧化活性的影響見圖3。整體來看,當pH在3~8 范圍時,香蕉花多糖的抗氧化活性呈現先降低后升高的趨勢。當pH<6 時,香蕉花多糖的羥基自由基清除能力降低。當pH 在6~8 范圍內,香蕉花多糖的羥基自由基清除能力緩慢增加。這可能是由于在強酸條件下,酚類、黃酮類等色素成分與多糖之間易形成交聯結構,協同提高多糖溶液的整體抗氧化活性;而隨著pH 增加,香蕉花多糖中色素成分會發生不同程度的降解[32],香蕉花多糖溶液的抗氧化活性隨之降低。另一方面,香蕉花多糖中含有一定量的蛋白質,蛋白質-多糖的相互作用也易受pH 的影響[33],推測當pH≤4 或>6 時,溶液中易形成具有強抗氧化活性的蛋白質-多糖復合物,故香蕉花多糖溶液的抗氧化活性隨之增強。由此看出,在強酸性及堿性條件下,香蕉花多糖溶液的抗氧化活性比較穩定。

圖3 pH 對香蕉花多糖抗氧化活性的影響Fig.3 Effect of pH on the antioxidant activity of banana flower polysaccharide
2.3.3 溫度對多糖抗氧化穩定性的影響 溫度對香蕉花多糖抗氧化活性的影響見圖4。在溫度40~100 ℃的條件下,隨著加熱時間的延長,香蕉花多糖的抗氧化活性變化是先降低后升高并逐漸平緩。由圖4 可知,在溫度40~100 ℃、加熱時間1 h 內的條件下,香蕉花多糖溶液對羥基自由基的清除能力迅速下降。隨著加熱時間的進一步延長,在溫度40~80 ℃的條件下,香蕉花多糖溶液的羥基自由基清除能力緩慢回升。當加熱時間超過2 h 時,所有溫度條件下的香蕉花多糖溶液的抗氧化活性變化趨于穩定。特別是,當溫度60~80 ℃、加熱時間2~3.5 h 的條件下,香蕉花多糖的抗氧化活性相對較高。這可能是由于在加熱初期,香蕉花多糖溶液中的部分多糖和色素類成分被降解,溶液的抗氧化活性隨之降低;另一方面推測,隨著環境溫度和加熱時間增加,香蕉花多糖溶液中蛋白質-多糖的互作也受到影響,進而使得溶液的抗氧化能力產生波動。
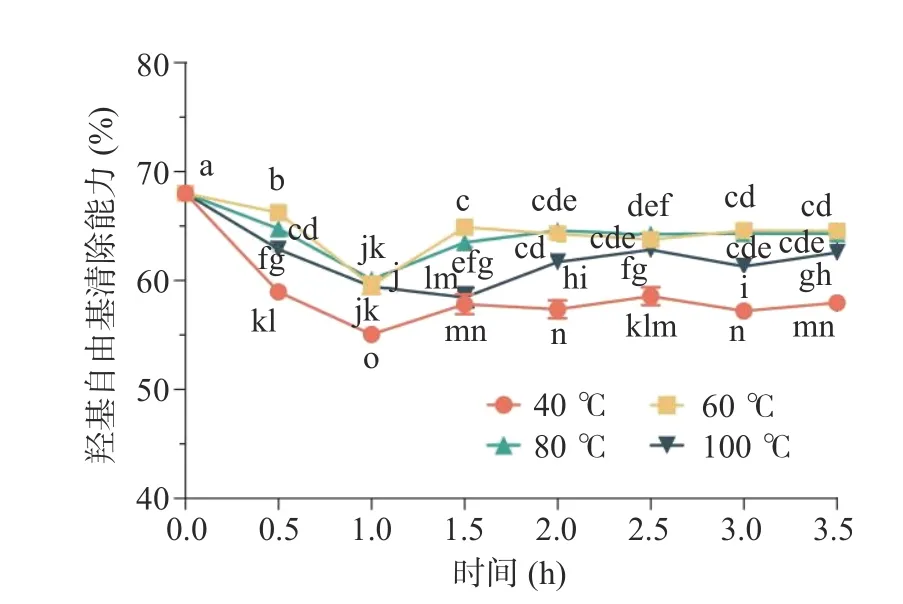
圖4 溫度對香蕉花多糖抗氧化活性的影響Fig.4 Effect of processing temperature on the antioxidant activity of banana flower polysaccharide
2.3.4 金屬離子對多糖抗氧化穩定性的影響 金屬離子對香蕉花多糖抗氧化活性的影響見圖5。由圖可知,在不同質量濃度的K+溶液處理下,香蕉花多糖的羥基自由基清除能力有一定程度的波動,尤其是當K+溶液質量濃度超過10 mmol/L 時,香蕉花多糖對羥基自由基的清除能力下降。在Cu2+、Fe3+溶液中,香蕉花多糖的羥基自由基清除能力隨著金屬離子濃度的增加而顯著降低。此外,當金屬離子溶液質量濃度達到12 mmol/L 時,與Fe3+溶液相比,Cu2+溶液會加速降低香蕉花多糖的抗氧化活性。而相較于K+、Cu2+和Fe3+三種金屬離子溶液,在不同質量濃度的Na+溶液處理下,香蕉花多糖的羥基自由基清除能力相對穩定,這與桃金娘果實、太行菊、敗醬草多糖的抗氧化穩定特性一致[28,30,34]。這可能是由于香蕉花多糖與這些金屬離子結合,形成部分復合物,使得多糖含量降低,進而不利于香蕉花多糖的抗氧化穩定性[35];亦或是香蕉花多糖與不同金屬離子之間的配位能力、配位方式等差異所造成了絡合物空間結構的不同[36],如Fe3+被還原成Fe2+、Cu2+被還原成Cu+,因而導致多糖抗氧化能力的變化。
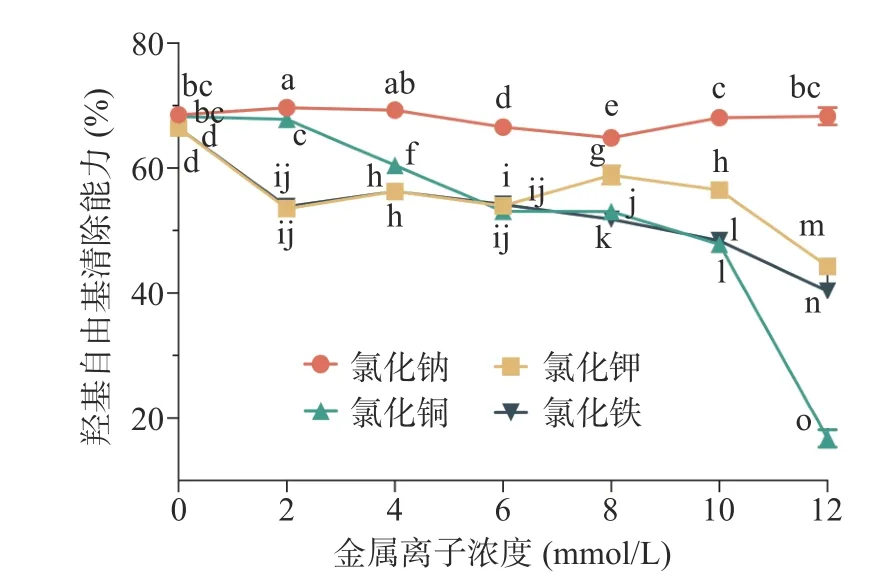
圖5 金屬離子對香蕉花多糖抗氧化活性的影響Fig.5 Effect of metal ions on the antioxidant activity of banana flower polysaccharide
2.3.5 常用食品配料對多糖抗氧化穩定性的影響常用食品配料對香蕉花多糖抗氧化活性的影響見圖6,常見食品配料蔗糖、葡萄糖、檸檬酸以及苯甲酸鈉對香蕉花多糖的抗氧化活性有顯著的影響。加入甜味劑(蔗糖和葡萄糖)后,香蕉花多糖的羥基自由基清除能力顯著降低(圖6a、6b 所示);而加入酸性添加劑(檸檬酸)和堿性添加劑(苯甲酸鈉)后,香蕉花多糖的羥基自由基清除能力顯著提高(圖6c、6d 所示)。這可能是由于在高濃度的H+或OH-條件下,香蕉花多糖的結構仍能保持穩定;亦或是在酸堿性介質的干預下,香蕉花多糖得失電子的能力增強,進而提高其氧化還原能力。因此,在制作香蕉花加工產品中,盡量避免蔗糖、葡萄糖的食品添加劑的使用,可以考慮使用代糖或不添加傳統甜味劑。
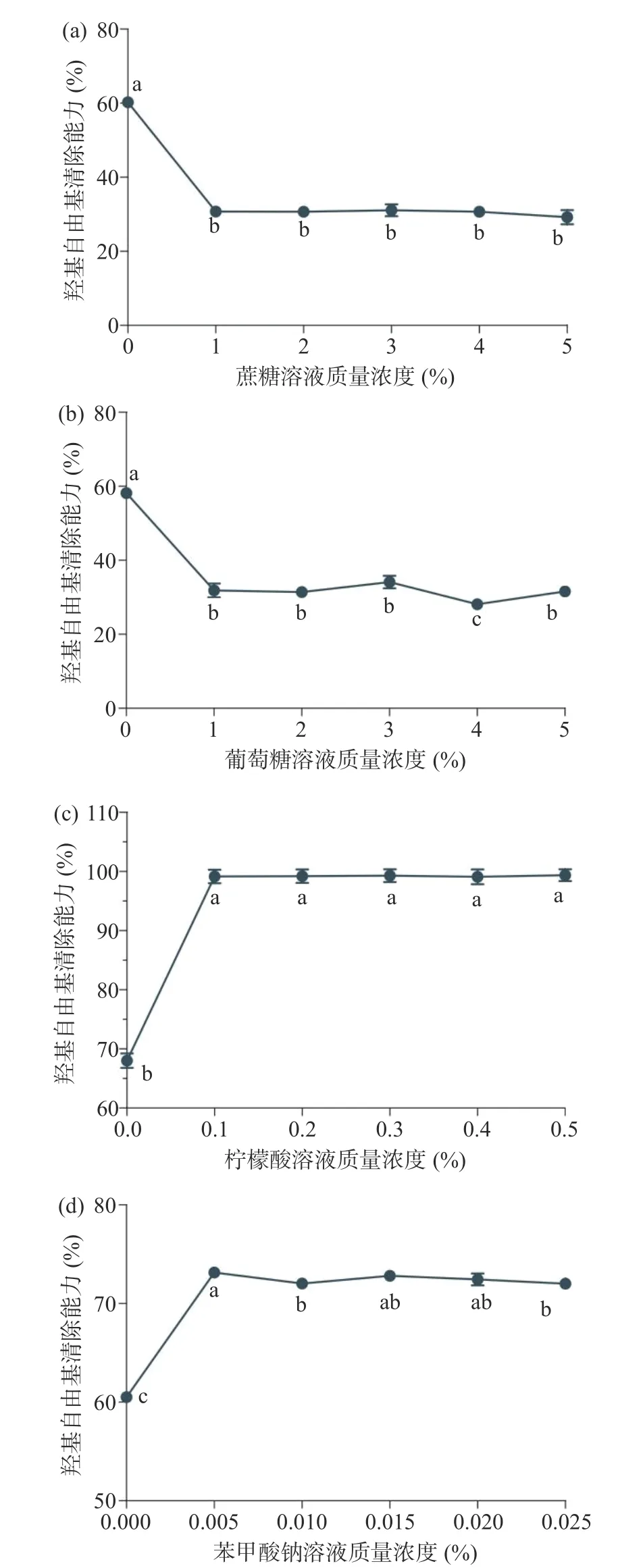
圖6 常用食品配料對香蕉花多糖抗氧化活性的影響Fig.6 Effect of common food ingredients on the antioxidant activity of banana flower polysaccharide
2.3.6 滅菌方式對多糖抗氧化穩定性的影響 滅菌方式對香蕉花多糖抗氧化活性的影響見圖7。煮沸殺菌、巴氏殺菌、微波殺菌以及高壓殺菌對香蕉花多糖的抗氧化活性有不同程度的影響,其中高壓殺菌對香蕉花多糖的羥基自由基清除能力的影響相對較小。因此,對香蕉花加工產品進行滅菌時可優先選擇高壓殺菌。
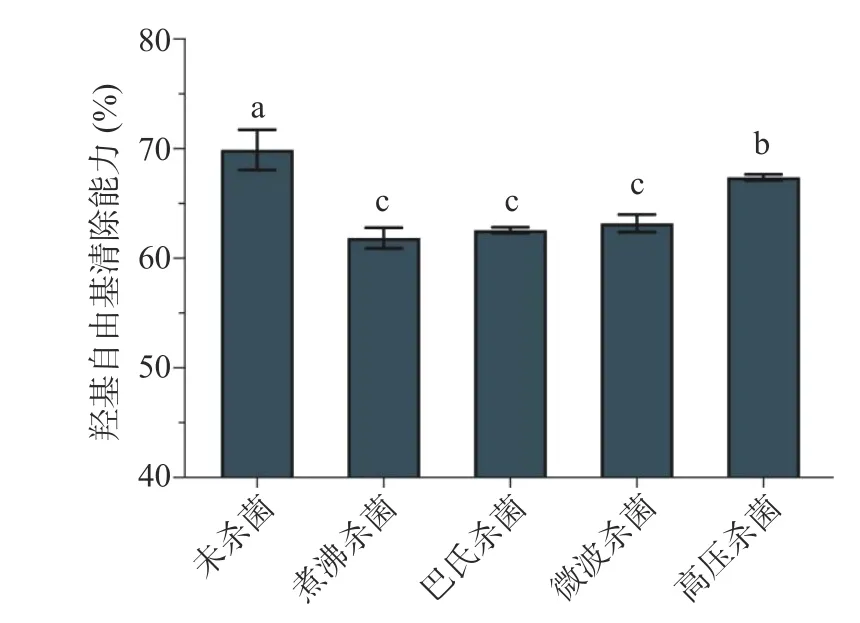
圖7 滅菌方式對香蕉花多糖抗氧化活性的影響Fig.7 Effect of sterilization methods on the antioxidant activity of banana flower polysaccharide
3 結論
以香蕉花多糖為研究對象,對其化學組成成分、抗氧化活性及穩定性進行了分析。研究結論指出,香蕉花多糖具有較好的還原力以及對DPPH、羥基自由基有較強的抑制能力,且隨著質量濃度的增加,香蕉花多糖的抗氧化活性增加。然而,香蕉花多糖的抗氧化活性易受到食品加工條件的影響,尤其是長期光照、金屬鐵離子和銅離子、食品配料蔗糖和葡萄糖等條件會顯著影響其穩定性,在香蕉花的加工貯藏中應避免與此類條件或物質直接接觸。后續研究將采用氧化應激細胞模型和動物模型,對香蕉花多糖的抗氧化能力系統性深入研究與分析,以進一步促進香蕉花多糖作為天然抗氧化劑應用于食品加工業。
? The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).

