黃色短桿菌中L-異亮氨酸同位素豐度及分布的分析方法研究
趙雅夢(mèng),范若寧,雷 雯*
(1.上海化工研究院有限公司,上海 200062;2.上海市穩(wěn)定同位素檢測(cè)及應(yīng)用研發(fā)專業(yè)技術(shù)服務(wù)平臺(tái),上海 200062)
利用同位素標(biāo)記技術(shù)將化合物中普通原子替換為同位素核素所合成的穩(wěn)定同位素標(biāo)記化合物,結(jié)合質(zhì)譜技術(shù),已在蛋白質(zhì)組學(xué)、代謝組學(xué)、生物靶標(biāo)發(fā)現(xiàn)、臨床診斷等生命科學(xué)研究中發(fā)揮重要作用[1-4]。13C、15N標(biāo)記賴氨酸、精氨酸等是細(xì)胞培養(yǎng)中氨基酸的穩(wěn)定同位素標(biāo)記技術(shù)(SILAC)中必備的關(guān)鍵試劑[5-6],也是代謝流量分析中的常用示蹤劑[7-8]。微生物發(fā)酵法是同位素標(biāo)記氨基酸的主要合成方法,將培養(yǎng)基中的營(yíng)養(yǎng)組分替換為穩(wěn)定同位素標(biāo)記化合物,經(jīng)微生物發(fā)酵、提純等即可得到同位素標(biāo)記氨基酸[9-10]。同位素豐度是穩(wěn)定同位素標(biāo)記氨基酸產(chǎn)品的重要參數(shù)之一,決定了批次產(chǎn)品的質(zhì)量水平,也是穩(wěn)定同位素標(biāo)記氨基酸在蛋白質(zhì)定量、代謝流等下游應(yīng)用研究中的重要考察指標(biāo)。高豐度穩(wěn)定同位素標(biāo)記氨基酸產(chǎn)品的應(yīng)用需求大,對(duì)試劑質(zhì)量要求也較高。
目前,氣體同位素質(zhì)譜法和有機(jī)質(zhì)譜法是同位素豐度分析的兩種重要方法,前者通過(guò)高溫燃燒等方式將C、N元素轉(zhuǎn)化為CO2和N2,適用于檢測(cè)純度較高的同位素試劑[11]。后者則是基于化合物同位素質(zhì)量數(shù)的差異完成豐度計(jì)算,如上海化工研究院開(kāi)發(fā)的基于“質(zhì)量簇”的有機(jī)質(zhì)譜同位素豐度[12-13]。近年來(lái),高分辨質(zhì)譜儀因具有超高分辨率、高靈敏度等特點(diǎn)成為同位素豐度和分布分析的主流工具。研究人員利用高分辨質(zhì)譜儀建立了針對(duì)氘標(biāo)記化合物[14]、13C標(biāo)記葡萄糖[15]等的同位素分布及豐度檢測(cè)方法,可實(shí)現(xiàn)復(fù)雜樣本中化合物的豐度計(jì)算,生產(chǎn)過(guò)程的實(shí)時(shí)監(jiān)控,以及有效的降低成本等明顯優(yōu)勢(shì)。
本研究基于同位素標(biāo)記技術(shù),通過(guò)色譜、質(zhì)譜條件的優(yōu)化及對(duì)樣品濃度、質(zhì)譜掃描次數(shù)等影響因素的考察,建立了一種穩(wěn)定、準(zhǔn)確的氨基酸同位素豐度計(jì)算方法,實(shí)現(xiàn)了L-異亮氨酸產(chǎn)生菌黃色短桿菌發(fā)酵液中氨基酸同位素豐度及分布分析,可為發(fā)酵反應(yīng)條件優(yōu)化、細(xì)菌代謝機(jī)理研究等提供數(shù)據(jù)支持。
1 實(shí)驗(yàn)部分
1.1 儀器與試劑
Orbitrap Exploris 120高分辨液相色譜-質(zhì)譜聯(lián)用儀(美國(guó)Thermo Fisher 科技有限公司);MAT 271 型氣體同位素質(zhì)譜儀(美國(guó) Finnigan 質(zhì)譜公司);XPE105DR 電子天平儀(瑞士Mettler Toledo 集團(tuán));Vortex-5渦旋儀(中國(guó)其林貝爾儀器制造有限公司);Merck-Milipore SimolicityTM超純水系統(tǒng)(德國(guó)Merck公司)。
葡萄糖-13C6(純度為99%,美國(guó)劍橋?qū)嶒?yàn)室);L-谷氨酸-15N、L-異亮氨酸-15N、L-亮氨酸-15N、L-賴氨酸-15N、L-苯丙氨酸-15N、L-脯氨酸-15N、L-蘇氨酸-15N、L-纈氨酸-15N(純度均>99%,上海化工研究院有限公司);甲醇、甲酸、乙腈(ACN)(色譜純,美國(guó)Thermo Fisher科技有限公司)。
1.2 標(biāo)準(zhǔn)溶液的配制
準(zhǔn)確稱取1.0 mg 氨基酸樣品,加入1 mL 50%甲醇水溶液,渦旋30 s 充分混勻,配成質(zhì)量濃度為1.0 mg/mL 的儲(chǔ)備液。準(zhǔn)確移取適量?jī)?chǔ)備液,以50%甲醇水溶液稀釋成0.1、0.2、0.5、0.8、1、2 μg/mL的工作標(biāo)準(zhǔn)溶液。儲(chǔ)備液和工作標(biāo)準(zhǔn)溶液均保存于4 ℃。
1.3 實(shí)驗(yàn)條件
1.3.1 色譜條件色譜柱:Hypersil Gold Vanquish 色譜柱(100 mm × 2.1 mm,1.9 μm);流動(dòng)相:流動(dòng)相A 為超純水,流動(dòng)相B 為含0.1%甲酸的甲醇溶液;洗脫條件:90% B 等度洗脫5 min;流速:0.3 mL/min;進(jìn)樣量:1 μL。
1.3.2 質(zhì)譜條件離子源:ESI;電噴霧電壓(Ion sray voltage):3 200 V;鞘氣(Sheath gas):20 arb(~2.68 L/min);輔助氣(Aux gas):15 arb(~14.03 L/min);離子傳輸管溫度:320 ℃;掃描模式:全掃描(Full scan)模式下正離子掃描;分辨率:12 000;掃描質(zhì)荷比范圍:70~500m/z。
1.4 細(xì)菌培養(yǎng)
L-異亮氨酸產(chǎn)生菌菌種為黃色短桿菌(Brevibacterium flavum),發(fā)酵培養(yǎng)基組分為:12 g/L 葡萄糖,3 g/L(NH4)2SO4,0.5 g/L 玉米漿,0.1 g/L K2HPO4,0.025 g/L MgSO4,0.02 g/L FeSO4,0.02 g/L MnSO4,0.01 g/L VB1,0.01 g/L 生物素,pH 7.2。菌種活化、培養(yǎng)及分離純度等過(guò)程參照文獻(xiàn)進(jìn)行[10]。L-異亮氨酸-15N 發(fā)酵生產(chǎn)時(shí),將(NH4)2SO4替換為(15NH4)2SO4;13C同位素示蹤研究時(shí),將發(fā)酵培養(yǎng)基組分中的葡萄糖換為20%葡萄糖 -13C6和80%葡萄糖。
2 結(jié)果與討論
2.1 液相色譜-質(zhì)譜條件的優(yōu)化
色譜柱是液相色譜的核心,由于本文只針對(duì)L-異亮氨酸進(jìn)行分析,且采用的是液相色譜-質(zhì)譜聯(lián)用方法,因此選擇高穩(wěn)定性和重現(xiàn)性的C18色譜柱進(jìn)行分析。分別以乙腈-水、甲醇-水作為流動(dòng)相考察了L-異亮氨酸-15N 的保留及色譜峰形情況。由圖1 可知,以乙腈-水為流動(dòng)相時(shí),樣品在0.8 min 出峰,且在1 min 左右有雜峰出現(xiàn)。而更換流動(dòng)相為甲醇后,由于甲醇洗脫能力弱于乙腈,保留時(shí)間略有延后,但峰形顯著變好,因此選擇甲醇-水流動(dòng)相體系。在甲醇中加入0.1%甲酸時(shí),信號(hào)響應(yīng)有所提高,這可能是因?yàn)樗嵝詶l件促進(jìn)了氨基酸的電離。因此最佳流動(dòng)相條件選擇以水為A 相,含0.1%甲酸的甲醇為B相。
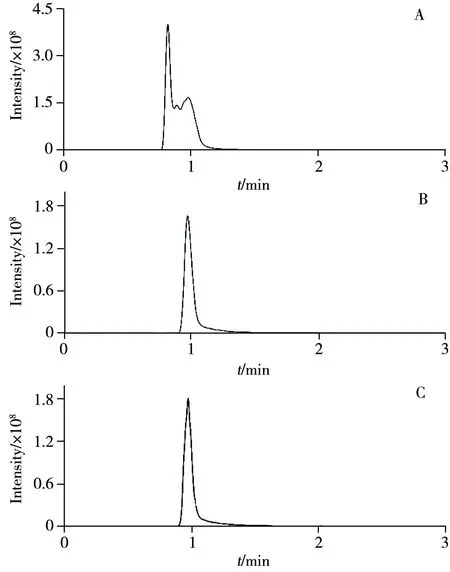
圖1 不同流動(dòng)相條件下L-異亮氨酸-15N的提取離子流圖Fig.1 Extracted ion chromatograms(EIC) of L-isoleucine-15N under different mobile phase conditions
為保證待測(cè)物具有良好的質(zhì)譜響應(yīng),對(duì)離子化模式和噴霧電壓、鞘氣及輔助氣等離子源參數(shù)進(jìn)行優(yōu)化。L-異亮氨酸含有羧基和氨基官能團(tuán),在正、負(fù)離子模式下均出峰且信號(hào)響應(yīng)較好,本文參照文獻(xiàn)選擇正離子模式進(jìn)行實(shí)驗(yàn)[16]。電離電壓等離子源參數(shù)優(yōu)化可有效提高待測(cè)物的信號(hào)響應(yīng)和檢測(cè)靈敏度。研究顯示,噴霧電壓的提高可增強(qiáng)L-異亮氨酸-15N 的質(zhì)譜響應(yīng)信號(hào),但過(guò)高電壓可能會(huì)發(fā)生源內(nèi)裂解而影響同位素豐度的計(jì)算,因此選擇3 200 V 為最佳噴霧電壓。進(jìn)一步考察鞘氣和輔助氣的影響,結(jié)果顯示鞘氣和輔助氣分別為20 arb(~2.68 L/min)和15 arb(~14.03 L/min)時(shí),待測(cè)物的響應(yīng)信號(hào)最佳。
2.2 同位素豐度計(jì)算的影響因素
當(dāng)同位素標(biāo)記化合物的相對(duì)同位素偏差大于儀器質(zhì)量偏差時(shí),可直接參照行業(yè)標(biāo)準(zhǔn)進(jìn)行同位素豐度計(jì)算[17],如13C、D 標(biāo)記的化合物均可根據(jù)LC-HRMS 的質(zhì)譜圖進(jìn)行豐度計(jì)算。以L-異亮氨酸-15N 為例,計(jì)算得到L-異亮氨酸-15N的同位素偏差為45 ppm,遠(yuǎn)大于儀器質(zhì)量偏差(5 ppm),因此可直接根據(jù)質(zhì)譜峰強(qiáng)度進(jìn)行豐度計(jì)算。
2.2.1 樣品濃度的影響當(dāng)L-異亮氨酸-15N濃度過(guò)低時(shí),存在背景干擾大、部分同位素標(biāo)記形式低于閾值而無(wú)法檢出等情況;然而樣品濃度過(guò)高時(shí)可能會(huì)導(dǎo)致質(zhì)譜殘留而影響后續(xù)使用。本實(shí)驗(yàn)考察了不同濃度(0.05、0.1、0.2、0.5、1、2、5、10 μg/mL)L-異亮氨酸-15N 標(biāo)準(zhǔn)溶液對(duì)實(shí)驗(yàn)結(jié)果的影響。結(jié)果顯示,當(dāng)樣品濃度較低時(shí),測(cè)得的豐度較低且偏差較大。隨著樣品濃度的提高,同位素豐度逐漸提高,在1 μg/mL及以上濃度時(shí)趨于穩(wěn)定(見(jiàn)圖2)。因此后續(xù)采用1 μg/mL樣品濃度進(jìn)行實(shí)驗(yàn)。
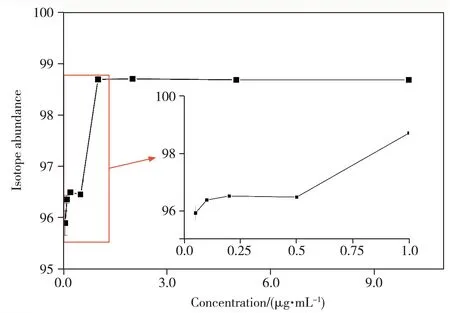
圖2 不同濃度下L-異亮氨酸-15N的同位素豐度計(jì)算結(jié)果Fig.2 Isotopic abundances of L-isoleucine-15N at different concentrations
2.2.2 同位素豐度計(jì)算依據(jù)同位素豐度是依據(jù)質(zhì)譜圖中不同標(biāo)記形式化合物的信號(hào)響應(yīng)進(jìn)行計(jì)算[13-18],目前多以質(zhì)譜峰強(qiáng)度和峰面積進(jìn)行計(jì)算[19]。考察了這兩種計(jì)算形式下同一樣品的同位素豐度,結(jié)果顯示根據(jù)峰面積計(jì)算得到的同位素豐度為98.66%,相對(duì)標(biāo)準(zhǔn)偏差(RSD)為0.03%;根據(jù)峰強(qiáng)度計(jì)算得到的同位素豐度為98.67%,相對(duì)標(biāo)準(zhǔn)偏差為0.04%。二者基本一致,說(shuō)明對(duì)于高豐度同位素標(biāo)記化合物,采用峰面積或峰強(qiáng)度均可得到較為準(zhǔn)確的計(jì)算結(jié)果。但由于采用峰強(qiáng)度計(jì)算時(shí)只需對(duì)一定數(shù)量質(zhì)譜圖進(jìn)行疊加,使用峰面積時(shí)需對(duì)不同形式的峰面積進(jìn)行積分,相對(duì)復(fù)雜。因此后續(xù)以峰強(qiáng)度進(jìn)行豐度計(jì)算。
2.3 不同檢測(cè)方法對(duì)比
氣體同位素質(zhì)譜法是同位素豐度測(cè)定的常用方法,也是同位素試劑質(zhì)量控制的重要手段之一。本文以L-谷氨酸-15N、L-賴氨酸-15N 等多種15N 標(biāo)記氨基酸為例,對(duì)比了氣體同位素質(zhì)譜法(GIMS)與LCHRMS兩種方法計(jì)算結(jié)果的差異。如表1所示,兩種計(jì)算方法得到的同位素豐度值差值均在0.6%以內(nèi),LC-HRMS 計(jì)算得到的豐度值普遍高于GIMS 的結(jié)果,這可能是由于兩種檢測(cè)方法原理不同所致。與GIMS 法相比,LC-HRMS 法所需樣品量少,且無(wú)需氣體轉(zhuǎn)化等前處理,操作簡(jiǎn)便,實(shí)驗(yàn)時(shí)間短,有望成為一種高通量、準(zhǔn)確的穩(wěn)定同位素試劑質(zhì)量控制方法。
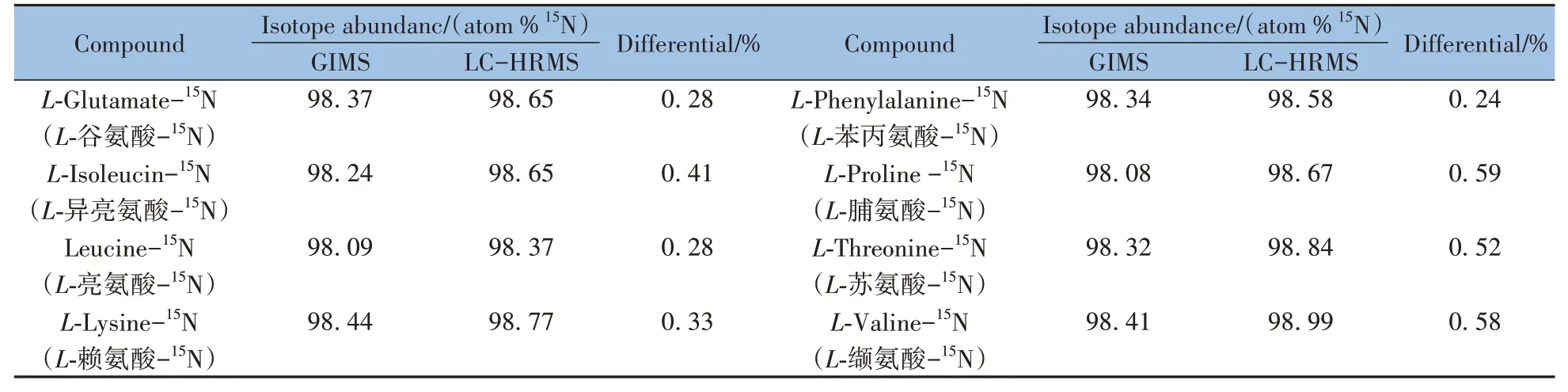
表1 GIMS及LC-HRMS的氨基酸15N同位素豐度測(cè)定結(jié)果對(duì)比Table 1 Comparison of 15N isotope abundance measurements between GIMS and LC-HRMS in isotope labeled amino acid
2.4 方法應(yīng)用
生物發(fā)酵法是國(guó)內(nèi)制備15N 標(biāo)記氨基酸的主要方法,采用GIMS 進(jìn)行豐度分析時(shí),需要得到氨基酸純品后再進(jìn)行分析,若試劑產(chǎn)品質(zhì)量不合格則需重新進(jìn)行培養(yǎng)、純化等步驟。而基于LC-HRMS 的豐度分析方法簡(jiǎn)便快捷,雜質(zhì)干擾小,可直接對(duì)菌液進(jìn)行分析。以L-異亮氨酸-15N 產(chǎn)生菌黃色短桿菌菌液為例,在發(fā)酵過(guò)程中,可能存在賴氨酸等雜質(zhì)干擾,如圖3 所示,盡管菌液成分復(fù)雜,但L-異亮氨酸-15N的提取離子流圖信號(hào)響應(yīng)很高,經(jīng)計(jì)算得到15N同位素豐度為98.58%,相對(duì)標(biāo)準(zhǔn)偏差為0.03%。
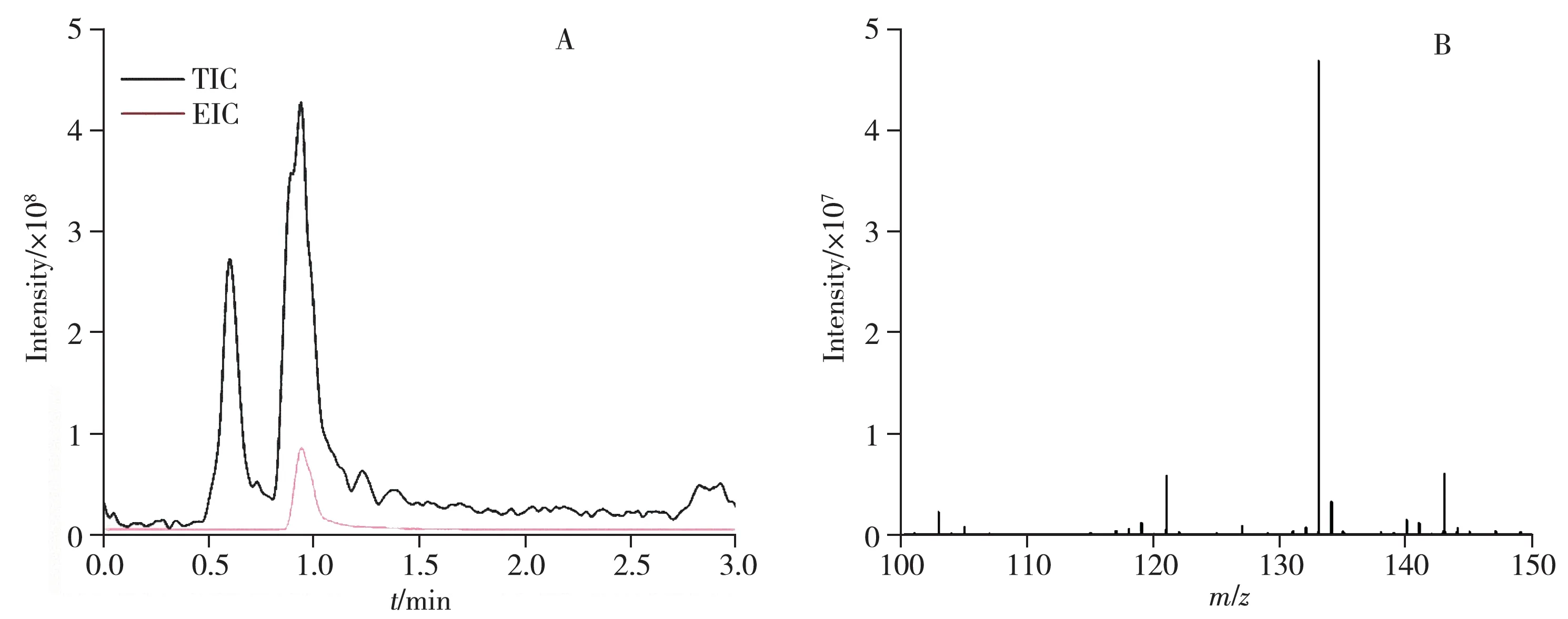
圖3 L-異亮氨酸-15N產(chǎn)生菌黃色短桿菌菌液的離子流圖(A)和質(zhì)譜圖(B)Fig.3 EIC chromatograms(A) and MS spectra(B) of L-isoleucine-15N producing bacteriophage of Brebvibacterium flavum
將該方法進(jìn)一步用于13C6-葡萄糖示蹤的黃色短桿菌中同位素分布及豐度分析,在4~72 h 等不同時(shí)間點(diǎn)取樣(見(jiàn)表2)。結(jié)果顯示,隨著示蹤時(shí)間的增加,L-異亮氨酸-15N 的同位素豐度逐漸升高,48 h后基本達(dá)到平衡,同位素豐度值約為19 atom %13C,與培養(yǎng)基中同位素試劑的添加比例一致,同位素分布如圖4 所示。除同位素豐度計(jì)算外,基于本方法得到的同位素分布也可為代謝流分析、細(xì)菌代謝機(jī)理闡明等研究提供基礎(chǔ)。

表2 不同示蹤時(shí)間下13C標(biāo)記異亮氨酸的同位素豐度Table 2 Isotope abundance of 13C6-isoleucine within different tracing time
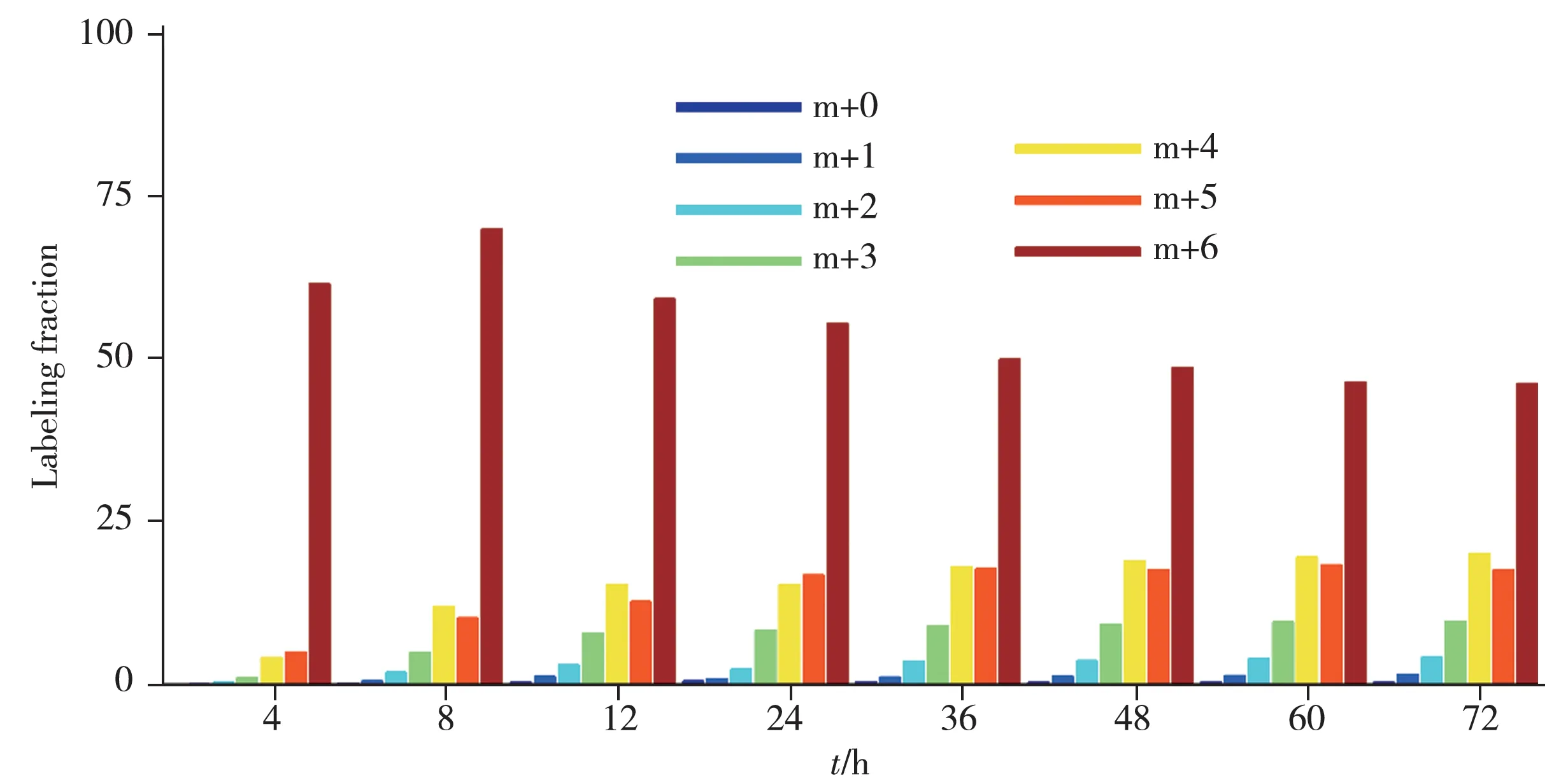
圖4 不同示蹤時(shí)間下13C標(biāo)記異亮氨酸的質(zhì)量分布圖Fig.4 Isotope abundance of 13C labeled isoleucine within different tracing time
3 結(jié) 論
本研究建立了一種可用于L-異亮氨酸同位素分布及豐度分析的LC-HRMS 檢測(cè)方法。方法準(zhǔn)確可靠,穩(wěn)定性良好,且所需樣品量少,操作簡(jiǎn)便,尤其適用復(fù)雜生物樣品如細(xì)菌發(fā)酵液中L-異亮氨酸同位素豐度與分布的快速檢測(cè),可為工程菌株設(shè)計(jì)、培養(yǎng)體系篩選等科學(xué)研究提供支持,提高穩(wěn)定同位素標(biāo)記氨基酸產(chǎn)品的產(chǎn)量,助力生命科學(xué)和生物醫(yī)藥領(lǐng)域的發(fā)展。
- 分析測(cè)試學(xué)報(bào)的其它文章
- 《分析測(cè)試學(xué)報(bào)》第七屆編委會(huì)成員
- 基于電感耦合等離子體質(zhì)譜的大氣細(xì)顆粒物的多維表征研究進(jìn)展
- 化工制藥從業(yè)人員倫理學(xué)相關(guān)問(wèn)題研究
——評(píng)《制藥從業(yè)人員倫理學(xué)》 - 化工產(chǎn)業(yè)經(jīng)濟(jì)發(fā)展產(chǎn)業(yè)鏈及相關(guān)風(fēng)險(xiǎn)管理問(wèn)題研究
——評(píng)《化工產(chǎn)業(yè)鏈與風(fēng)險(xiǎn)管理》 - 不同含水量砂巖的中紅外光譜特征與預(yù)測(cè)模型研究
- 近紅外光譜法快速檢測(cè)何首烏炮制過(guò)程中多糖含量的研究

