A型塞內卡病毒序列元件與蛋白功能研究進展
南福龍,孟海藍,李紫薇,,沙 洲,尼 博,劉拂曉
(1. 青島農業(yè)大學動物醫(yī)學院,山東 青島 266109;2. 中國動物衛(wèi)生與流行病學中心,山東 青島 266032)
2007年在加拿大發(fā)現(xiàn)了一種可引起豬水皰性疾病的新發(fā)病毒[1]。該病毒最初被命名為塞內卡谷病毒,現(xiàn)重命名為A型塞內卡病毒(Senecavirus A,SVA)。隨后,美國、巴西等多個國家相繼發(fā)現(xiàn)該病毒感染的病例[2]。SVA多感染育肥豬和新生仔豬,無明顯季節(jié)性,臨床癥狀為病豬口鼻部、蹄部和黏膜處出現(xiàn)水皰樣病變,后期發(fā)生潰瘍甚至糜爛[2];病豬出現(xiàn)厭食、發(fā)熱和嘔吐等癥狀,與口蹄疫及其他水皰病癥狀十分相似;感染SVA的新生仔豬死亡率高達70%,部分痊愈仔豬生長發(fā)育不良,給我國乃至世界養(yǎng)豬業(yè)造成了較大的經濟損失。我國于2015年首次發(fā)現(xiàn)SVA感染病例[3],其傳播十分迅速。自2015年以來,我國湖北、黑龍江等多個省市均成功分離到SVA毒株[2]。2019年,Liu等[4]從廣東省分離出4株SVA,經重組分析表明,SVA發(fā)生重組變異,具有遺傳多樣性。SVA較高的變異性和毒株的多樣性是其難以防控的主要原因,目前SVA感染尚沒有針對性的防治方案和有效的商品化疫苗,給我國養(yǎng)豬業(yè)帶來較大的挑戰(zhàn)。因此,本文對 SVA 的基因組結構和功能以及SVA結構蛋白和非結構蛋白的相關研究進展進行了總結,旨在為進一步研究SVA致病機制、建立新的防控方法提供參考。
1 病原學
SVA屬于小RNA病毒科(Picornaviridae)、塞內卡病毒屬(Senecavirus),且是該屬唯一的成員[2]。早在2008年就有研究表明,SVA結構與其他小RNA病毒科成員相似[5]。SVA病毒粒子為二十面體對稱的球形顆粒(圖1),直徑大約為27 nm,無囊膜[2]。SVA含有4種結構蛋白,基因組為單股正鏈、不分節(jié)段的RNA,全長約7 300 nt,無5′ 帽子結構,但具有3′ 多聚A尾。基因組包含約668 nt的5′ 非編碼區(qū)(Untranslated region,UTR),1個多聚蛋白開放閱讀框(Open reading frame,ORF)和長約68 nt的3′ UTR。
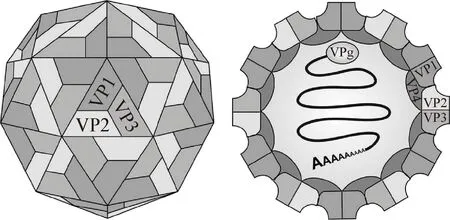
圖1 SVA病毒粒子結構示意圖[2]
2 SVA基因組序列元件
2.1 編碼區(qū)序列 SVA多聚蛋白ORF長度為6 546 nt,可編碼2 181個氨基酸。如圖2所示,該ORF由L序列和中間體P1、P2、P3區(qū)組成。P1區(qū)可分為VP1、VP2、VP3和VP4 四個結構基因,P2區(qū)分為2A、2B和2C三種非結構基因,P3區(qū)分為3A、3B、3C和3D四種非結構基因。SVA基因組與其他小RNA病毒相似,都具有典型的“L-4-3-4”布局[2]。
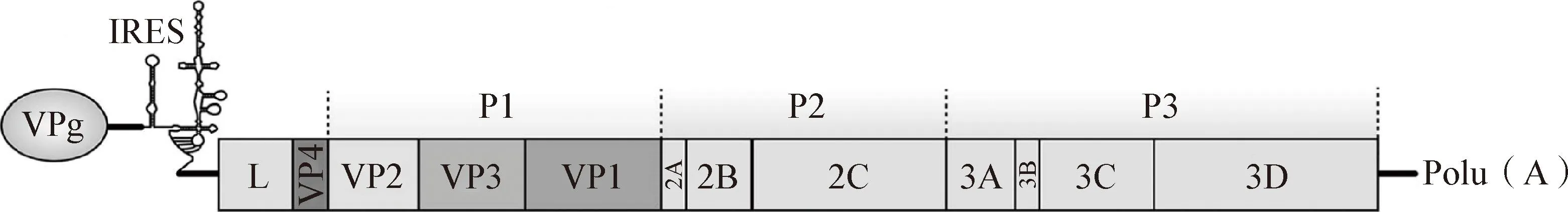
圖2 SVA基因組示意圖[2]
2.2 5′ UTR序列 SVA基因組的5′ 末端與病毒連接蛋白(Viral genome-linked protein,VPg)共價相連。如圖3所示,SVA 5′ UTR包含1個重要的內部核糖體進入位點(Internal ribosome entry site,IRES)[6],在病毒增殖過程中,該結構可通過與起始因子結合參與病毒RNA的翻譯。小RNA病毒的

圖3 SVA IRES示意圖[6]
IRES區(qū)域含有多個復雜的二級結構,其中在起始密碼子AUG上游的假結(Pseudoknot,PK)結構中,假結頸部I(Pseudoknot stem I,PKS-I)形成基序的完整性影響著核糖體40S亞基的結合,而假結頸部II(PKS-II)形成基序的突變,使IRES在核糖體P位點定位起始密碼子的能力減弱[7]。SVA IRES區(qū)域可以招募核糖體,使病毒以不依賴于5′ 帽子結構的方式啟動蛋白翻譯[8],因此IRES對SVA啟動蛋白翻譯至關重要。
Willcocks等[9]研究表明,SVA 5′ UTR下游假結的PKS-II兩個相鄰位點突變(CC→GG),將嚴重降低IRES活性。然而,Liu等[10]通過微型基因組轉染方法,證明了該結構的任何點突變都不會對IRES啟動蛋白表達的活性產生顯著影響;同時借助反向遺傳技術,證明了假結受到破壞的IRES也不會對SVA反基因組復制產生干擾,但會導致重組SVA拯救失敗。由此得出一種假說,即假結的破壞可能使SVA基因組的衣殼化信號受到抑制。Liu等[6]還證明,SVA能夠完全耐受PKS-Ia和非配對間隔序列的突變,相比而言,PKS-Ib可能是SVA拯救所必需的保守序列 。
SVA含有1個丙型肝炎病毒(Hepatitis C virus,HCV)樣IRES[11],主要包括2個區(qū)域(Domain,D),即DII和DIII,后者包括DIIIa、DIIIb、DIIIc、DIIId1、DIIId2、DIIIe和DIIIf,這是8種不同的莖環(huán)結構。Liu等[12]構建了8個各含有1個莖環(huán)突變的SVA cDNA克隆,結果顯示,這些突變的cDNA克隆都不能單獨拯救出具有復制能力的SVA,表明SVA IRES中每個假定的結構域對于病毒復制都是必不可少的,但在成對轉染8個cDNA克隆的28個組合中,成功復活出4個野生型SVA,說明2個復制缺陷型不同的SVA在胞內發(fā)生了RNA重組,即SVA基因組之間存在重組現(xiàn)象,除此之外,該研究還提出了“選擇性復制(Copy-choice)”的病毒重組模型。
SVA IRES假結與AUG之間有一段13 nt序列,Liu等[13]將SVA cDNA克隆的13 nt序列進行了逐一敲除,試圖拯救核苷酸缺陷型重組病毒,結果表明,SVA的13 nt序列最多容忍5個核苷酸的缺失,即便如此,由于RNA病毒的不保真特性,只有1 nt和2 nt缺失型SVA可以穩(wěn)定傳代,其他3株拯救的病毒在13 nt序列處皆有核苷酸突變或增加。該研究揭示了1、2和3 nt缺失型SVA的復制特性,并證明當13 nt序列缺失2個核苷酸時,已經對病毒的生長造成影響。該研究最終提出假想模型,即SVA IRES-AUG距離影響病毒起始密碼子在核糖體中的準確定位。
SVA的翻譯起始于IRES近端的起始密碼子,而起始密碼子通過直接定位在核糖體亞基上啟動翻譯。Wang等[14]研究發(fā)現(xiàn),從含有ATG側翼為3個核苷酸倍數(shù)的外源序列的cDNA克隆中可拯救出具有復制能力的重組SVA,不是3的倍數(shù)的外源序列則導致病毒拯救失敗,可能是IRES近端的人工AUG取代真正的AUG,進而引導多聚蛋白翻譯,最終致使病毒拯救失敗。
小RNA病毒5′ UTR通常有1個二級結構不同的功能結構域,其對病毒的復制至關重要。Meng等[15]通過網絡服務器對SVA 5′ UTR進行分析,建立了其RNA的二級結構,并利用反向遺傳技術對其進行基因修飾,以拯救重組病毒,結果發(fā)現(xiàn)大部分基序都不能忍受額外的基因修飾,說明該結構可能是SVA合成RNA等機制的重要順式作用元件;同時該研究還發(fā)現(xiàn),SVA可以修復其5′ 末端的核苷酸缺陷,其自我修復的極限是5個連續(xù)的核苷酸。
2.3 3′ UTR序列 SVA的3′ UTR高度結構化,下游連接多聚A尾結構,長度較短。多聚A尾可以避免病毒在細胞中被核酶降解,并且對病毒的感染起著非常關鍵的作用。結構分析表明,腸道病毒的3′ UTR吻環(huán)結構具有1個同軸螺旋結構域,該螺旋結構域與其他各個結構域形成復制原點的整體結構,啟動負鏈RNA的合成,若將相關基序突變,則會擾亂吻環(huán)間的相互作用,從而抑制腸道病毒合成RNA[16]。SVA 3′ UTR具有2種高級RNA結構:吻環(huán)和H型假結,但這2種結構不能在3′ UTR共存。Liu等[17]利用反向遺傳技術對SVA 3′ UTR中的吻環(huán)或假結基序進行一個或多個點突變,結果表明,若在3′ UTR中存在假定的吻環(huán)結構,其對于SVA的復制是非必要的;若存在假結結構,其突變將對SVA的復制產生“致命”影響。
3 SVA蛋白
3.1 結構蛋白 SVA的結構蛋白,也稱為衣殼蛋白,由VP1、VP2、VP3和VP4 四種蛋白組成,對應的基因分布見圖2,結構蛋白的功能見表1。4種結構蛋白主要參與病毒粒子的包裝,結構蛋白是SVA主要的保護性抗原,存在中和表位,可刺激機體產生中和抗體,常作為血清學檢測方法和疫苗研發(fā)的靶蛋白;此外,結構蛋白還可以與細胞受體結合,介導病毒進入細胞,使病毒對某些有神經內分泌特征的腫瘤細胞產生選擇性細胞毒性[18]。

表1 SVA結構蛋白的功能
VP1、VP2和VP3蛋白分布在病毒顆粒的最外層,其中,VP1蛋白具有最強的免疫原性,可用于病毒血清學鑒定[5,18]。此外,VP1蛋白含有潛在的B細胞表位和T細胞表位,且高抗原指數(shù)的21GELAAP26完全暴露在VP1蛋白表面,可能是B細胞重要的線性表位[19]。Zhao等[20]通過SVA的VP1蛋白對其遺傳進化進行分析,鑒定出4個核苷酸突變(A65T、N94S、A114P和S229G),并假設其與當前我國發(fā)現(xiàn)的SVA致病性的改變有關。研究表明,SVA的非結構蛋白參與細胞自噬,并利用自噬機制促進病毒感染[21]。但最近的一項研究表明,SVA的結構蛋白VP1同樣參與激活信號通路以誘導自噬[22]。
VP2蛋白與血清中的抗體具有較高的結合反應性[23]。有研究評估了豬對SVA感染的細胞免疫反應,發(fā)現(xiàn)相比于VP1和VP3蛋白,VP2蛋白可引起更高的T細胞反應,表明VP2蛋白含有免疫顯性T細胞表位[24]。炭疽毒素受體1(Anthrax toxin receptor 1,ANXTR1)是SVA的高親和力細胞受體,可與衣殼表面的關鍵殘基相互作用,研究發(fā)現(xiàn),大部分ANXTR1分布于VP2蛋白表面[25]。
VP3蛋白可以在SVA感染的早期階段誘導中和抗體的產生[24]。VP3蛋白表面具有線性表位,但迄今為止只報道過其B細胞表位[26]。研究表明,VP3蛋白還可與其他蛋白協(xié)同作用以參與細胞自噬[22,27]。
VP4蛋白位于蛋白質衣殼內部,在4種結構蛋白中相對保守。小RNA病毒科的一些成員在感染期間會形成天然的空顆粒,但由于VP0蛋白無法正確切割或VP4蛋白可能與衣殼解離等原因,這些空顆粒穩(wěn)定性較差。相反,SVA VP4蛋白的終端特異性β鏈部分附著在VP2蛋白上穩(wěn)定其結構,并裂解VP0蛋白產生VP2和VP4蛋白,進而組裝成穩(wěn)定的前體衣殼,表明SVA前體衣殼可作為病毒樣顆粒或癌癥靶向藥物遞送的工具[8]。SVA是一種無囊膜病毒,其感染細胞不依賴于膜融合,而是通過其他機制將其基因組運送到細胞中,VP4蛋白在此過程中起著主要作用。現(xiàn)已證明,同屬小RNA病毒科的人鼻病毒,其小豆蔻酰化衣殼蛋白VP4從病毒中釋放出來并與細胞膜相互作用,導致細胞膜上形成孔隙,提高了細胞膜的通透性,進而將病毒RNA基因組遞送到細胞質中以啟動病毒復制[28]。
3.2 非結構蛋白 SVA的非結構蛋白有L蛋白、2A、2B、2C、3A、3B、3C和3D 八種,對應的基因分布見圖2。非結構蛋白比結構蛋白更保守,不與病毒粒子結合,主要參與病毒復制、基因表達調控和與宿主之間的相互作用[5],不同非結構蛋白的功能見表2。
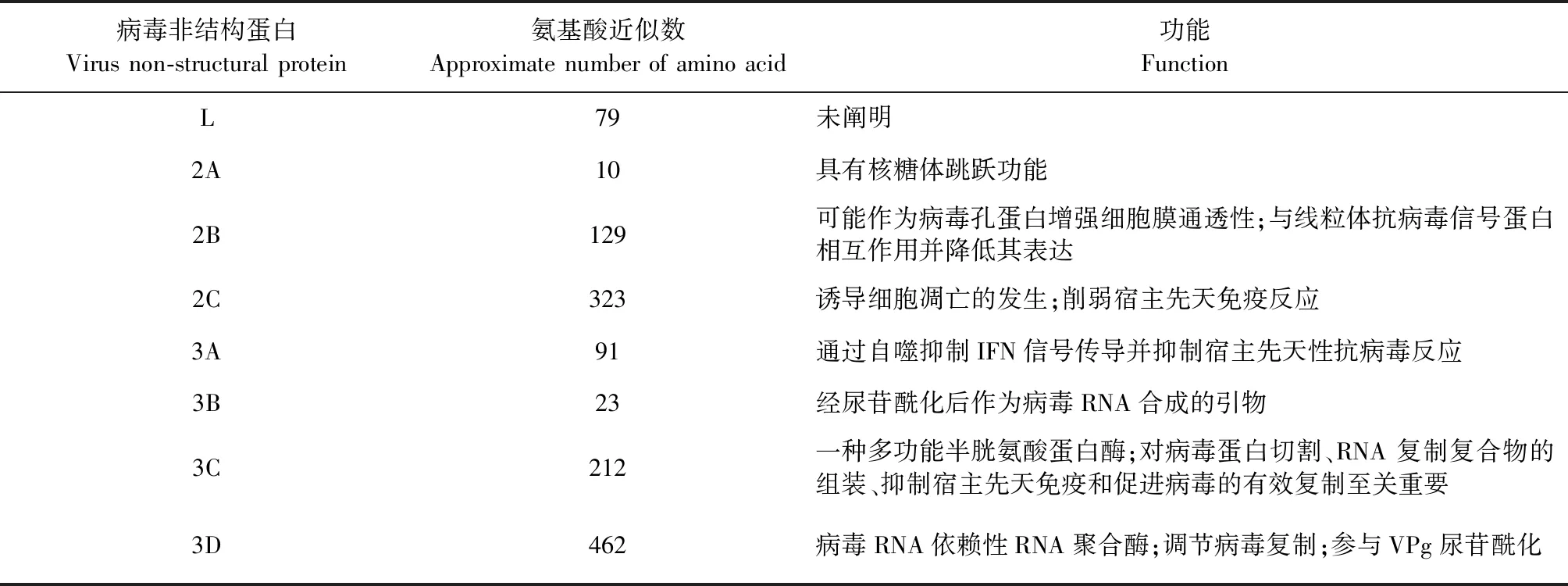
表2 SVA非結構蛋白的功能
L蛋白是小RNA病毒最先表達的蛋白。在口蹄疫病毒和心病毒等小RNA病毒中,L蛋白被證明是具有特殊“鋅指”構象的木瓜蛋白酶樣半胱氨酸蛋白酶,主要參與抑制宿主細胞蛋白質的合成,切割真核起始因子,調節(jié)宿主細胞中病毒的轉錄和翻譯等過程[29-30]。SVA L蛋白的不同之處在于其缺乏蛋白水解活性所需的催化殘基,且沒有“鋅指”構象或酪氨酸磷酸化基序,表明其功能可能與口蹄疫病毒和心病毒不同,確切功能仍需進一步研究[5]。
SVA 2A蛋白是只有9個氨基酸的短肽,其末端存在NPG/P保守基序,具有核糖體跳躍功能,即多肽合成的中斷發(fā)生在P1-2A和2BC-P3之間。若2A蛋白附著在VP1蛋白的羧基末端或與VP1蛋白分離,可能會導致多聚蛋白合成中斷,但尚未有研究證明2A蛋白是否附著在VP1蛋白的羧基末端或與VP1蛋白分離[5]。
小RNA病毒2B蛋白具有在細胞感染過程中增強細胞膜通透性的能力,SVA 2B蛋白的一級結構與其他已知的小RNA病毒的一級結構不同,但其二級結構與其他小RNA病毒2B蛋白的二級結構非常相似,因此推測SVA 2B蛋白可作為病毒孔蛋白,在增強細胞膜通透性方面發(fā)揮重要作用。除此之外,2B蛋白不切割線粒體抗病毒信號蛋白(Mitochondrial antiviral signaling protein,MAVS),也不誘導細胞凋亡,但可與MAVS相互作用以降低MAVS的表達,導致I型干擾素的表達量降低[31]。
2C蛋白是最保守的病毒非結構蛋白之一,在病毒生命周期和免疫逃逸中起著不可或缺的作用[32]。2C蛋白可以靶向定位于線粒體,使細胞色素C釋放到細胞質中,從而在一系列信號級聯(lián)反應中激活半胱天冬酶-9和半胱天冬酶-3以誘導細胞凋亡的發(fā)生[33]。2C蛋白還可以借助半胱天冬酶介導的蛋白降解,靶向作用于視黃酸誘導基因Ⅰ(Retinoic acid-inducible gene-I,RIG-I),并阻斷干擾素誘導基因56(Interferon-stimulated gene 56,ISG56)和干擾素β(Interferon-β,IFN-β)的轉錄以削弱宿主先天免疫反應[34]。
小RNA病毒的3A蛋白高度分化,在不同屬的小RNA病毒復制周期中發(fā)揮不同的功能[35]。關于SVA 3A蛋白的確切功能尚不清楚,但最近有研究表明,口蹄疫病毒的3A蛋白可以通過自噬抑制IFN信號傳導并抑制宿主先天性抗病毒反應[36]。
SVA 3B區(qū)域編碼一種VPg蛋白,其經尿苷酰化后可作為病毒RNA合成的引物[37]。先前的研究證實,小RNA病毒基因組的ORF中存在順式作用復制元件(cis-acting replication element,cre),而口蹄疫病毒的cre位于5′ UTR[38]。cre是一種莖環(huán)結構,在環(huán)結構靠近5′末端的那一半環(huán)序列中具有保守的 AAACA(或 AAACG)基序,AAACA基序可作為將U殘基添加到VPg的模板,從而產生VPg-pUpU,其將作為小RNA病毒合成RNA的引物[39]。Meng等[40]研究發(fā)現(xiàn),SVA的VP2 ORF中存在1個含有AAACA的莖環(huán),且結構上與腦心肌炎病毒的cre高度相似,通過試驗證明此莖環(huán)在功能上與其他小RNA病毒的cre相似。
3C蛋白是一種多功能半胱氨酸蛋白酶,含有半胱氨酸-組氨酸-天冬氨酸催化三聯(lián)體,其與蛋白酶和RNA結合活性相關的結構是保守的,有助于病毒多聚蛋白的切割和SVA復制過程中RNA復制復合物的組裝[41]。此外,SVA 3C蛋白對抑制宿主先天免疫至關重要,可調節(jié)宿主不同的信號通路和細胞死亡形式[33,42],抑制先天免疫信號級聯(lián)反應[34]和宿主翻譯機制[43]等多種途徑,進而促進病毒的復制。
3D蛋白相對保守,可以與3A、3B和3C蛋白相互作用,調節(jié)病毒復制和尿苷酰化。3D蛋白本質是病毒的RNA依賴性RNA聚合酶(RNA-dependent RNA polymerase,RdRp),在病毒復制和mRNA合成中發(fā)揮重要作用[44]。RdRp的保真性較差,缺乏校對活性,使得病毒在復制過程中較易發(fā)生突變和重組,這反而有助于SVA快速適應不斷變化的環(huán)境[45]。功能上,3D蛋白與VPg結合形成3Dpol-VPg復合物,促使VPg 尿苷酰化形成VPg-pUpU,隨后作為觸發(fā)全長基因組或反義基因組合成的引物[46]。
4 小結與展望
位于SVA 5′ UTR的IRES和順式作用元件對病毒啟動蛋白翻譯和基因組復制至關重要,3′ UTR中的多聚A尾對病毒感染起著關鍵作用,且其中存在的二級結構對病毒的復制有“致命”影響。SVA蛋白在病毒增殖過程中的功能不同,結構蛋白除了形成病毒衣殼和保護病毒基因組免受惡劣環(huán)境的影響外,對粘附和侵襲宿主細胞也是必不可少的;非結構蛋白參與調節(jié)病毒復制,并通過不同途徑誘導細胞死亡,抑制宿主的免疫應答,還可與其他蛋白協(xié)同調控信號通路。識別和理解SVA蛋白及其基因組元件的功能對研究病毒的復制、免疫逃避和致病性的分子機制十分必要,可為進一步了解SVA基因組結構和蛋白功能與病毒感染和發(fā)病機制的關系提供理論依據(jù)。
目前,對SVA蛋白及其基因組元件的功能有了初步了解,但仍有許多蛋白的功能仍需進一步闡明,例如:(1)系統(tǒng)分析SVA蛋白與宿主細胞之間的相互作用網絡以發(fā)現(xiàn)新的信號通路;(2)研究結構蛋白在病毒組裝和釋放中的作用并揭示它們與細胞膜和囊泡運輸系統(tǒng)的相互作用;(3)解析非結構蛋白的晶體結構,特別是2C和3D蛋白,其關鍵催化基序的鑒定有助于闡明非結構蛋白參與病毒復制和轉錄的機制;(4)鑒定SVA的其他受體,已知SVA具有多種組織嗜性,但除了ANTXR1之外,病毒進入細胞的其他受體尚未明確,鑒定SVA感染的靶細胞和受體對于理解其多組織嗜性至關重要。這些機制的闡明將為SVA抗病毒制劑的開發(fā)提供理論支持。

