線粒體調控腫瘤免疫的研究進展
李 靜,徐平龍,陳莎莎
1. 溫州大學生命與環境科學學院 浙江省水環境與海洋生物資源保護重點實驗室,浙江 溫州 325035
2. 浙江大學生命科學研究院,浙江 杭州 310058
3. 浙江大學生命系統穩態與保護教育部重點實驗室 浙江省癌癥分子細胞生物學重點實驗室,浙江 杭州 310058
4. 浙江大學杭州國際科創中心智能醫藥研究所,浙江 杭州 311200
5. 浙江大學癌癥研究院,浙江 杭州 310058
線粒體是由原核生物α-變形菌進化而來的存在于大多數真核細胞中的一種功能多樣的細胞器,由線粒體外膜和內膜、線粒體膜間隙、線粒體內膜嵴以及線粒體基質五種不同結構組成[1-2]。線粒體是動物細胞除細胞核外唯一具有DNA 的細胞器,mtDNA 是一個環狀DNA,能編碼氧化磷酸化復合物形成所需的13 種蛋白質、22 種轉運RNA 和2 種線粒體RNA 翻譯所需的核糖體RNA[3-4]。作為細胞能量代謝和生物合成的中心,線粒體通過氧化磷酸化過程產生ATP 以維持細胞內能量穩態[2],同時代謝中間產物則是生物合成途徑的重要參與者[2,5]。此外,線粒體通過釋放mtDNA、mtROS 和代謝產物等參與調節包括細胞能量代謝、細胞命運決定和免疫反應在內的多種細胞生物學過程。因此,越來越多的研究表明線粒體功能障礙與包括自身免疫性疾病在內的多種疾病發生有關[6-8],而且功能異常的線粒體是細胞惡性轉化的驅動力[9-10]。
腫瘤細胞通過重編程相關代謝途徑來適應不斷增加的能量和生物合成需求。在腫瘤微環境中,腫瘤發展驅動的營養耗竭和代謝副產物過度產生,通過調控腫瘤浸潤免疫細胞的代謝重編程及相關信號活化控制不同類型免疫細胞極化,誘導代謝失常介導的抗腫瘤免疫應答缺失,幫助建立免疫抑制的腫瘤微環境。線粒體作為細胞內具有多種生物學功能且高度變化的細胞器[11-12],在調節代謝和激活免疫細胞方面具有關鍵調控作用[13]。研究顯示,腫瘤微環境中包括腫瘤細胞和免疫細胞在內的多種細胞的線粒體功能異常是癌癥發生、發展和轉移的重要原因[14-15]。
本文圍繞線粒體與抗腫瘤免疫應答之間的關系,探討線粒體與免疫細胞活化,線粒體重要組分mtDNA和mtROS在腫瘤發生發展、免疫抑制的腫瘤微環境生成和腫瘤免疫逃逸中的重要調控作用,旨在深入了解線粒體在腫瘤發生發展過程中的核心作用,以期為開發靶向線粒體的抗腫瘤免疫治療策略提供依據。
1 線粒體調控免疫細胞活化、增殖和分化
不同種類和不同表型的免疫細胞具有特定的代謝需求,其活化狀態受到多條信號通路調控。線粒體動力學和能量代謝途徑變化在免疫細胞活化、增殖和分化過程中發揮至關重要的作用[14]。
線粒體調控T淋巴細胞的活化、增殖和分化。初始T 細胞的線粒體形態多為碎片化和圓球狀,氧化磷酸化和脂肪酸氧化是維持其靜止狀態下能量需求的主要途徑[16]。而當T 淋巴細胞被激活時,有氧糖酵解和脂肪酸合成相關信號活性顯著增加,從而維持其增殖和分化能力并促進其發揮相應的生物學功能[17];同時線粒體在T 細胞受體簇下方聚集[18],活化的T 細胞受體通過上調鈣調磷酸酶活性活化動力學相關蛋白1[19-20],并誘導線粒體進一步分裂和線粒體內膜嵴松弛,線粒體數增加和內膜嵴松弛可通過控制糖酵解相關信號在效應T 細胞活化中發揮重要調控作用[21]。此外,線粒體在T 細胞信號轉導和細胞命運決定過程中同樣發揮重要作用。T淋巴細胞活化過程中,線粒體在T 淋巴細胞和抗原提呈細胞形成的免疫突觸中積累[18],T 細胞受體活化刺激線粒體生成活性氧和ATP,在維持鈣離子穩態和調控其下游相關信號活化中至關重要[18,22]。而當活化的T 細胞向記憶T 細胞或調節性T 細胞發展時,線粒體則從分裂狀態逐漸融合形成長管狀結構,線粒體內膜嵴變得緊密,隨后細胞代謝狀態轉向脂肪酸氧化和氧化磷酸化,以維持細胞表型、存活和功能轉變[21,23-25]。在腫瘤組織中,腫瘤細胞對腫瘤微環境中葡萄糖和其他營養物質的潛在競爭則會抑制免疫細胞的代謝和功能[26-27]。在腫瘤微環境中,腫瘤浸潤性T 細胞長期處于高度氧化應激狀態,由于葡萄糖和氧氣缺乏環境介導的代謝不足[28-31]和Akt1-PGC1α 信號介導的線粒體功能和質量持續損傷[32],其細胞增殖能力、生物膜結構完整性和相關信號通路活化水平受到嚴重影響,T 淋巴細胞抗腫瘤免疫效應和相關細胞因子產生遭到嚴重破壞[30],最終引發免疫抑制和腫瘤免疫逃逸。
線粒體調控NK細胞活化。NK細胞是天然的細胞毒性淋巴細胞,其細胞活性與葡萄糖代謝水平顯著相關。當葡萄糖水平升高時,NK細胞活性顯著增強[33]。活化的NK細胞糖酵解能力、基礎氧化磷酸化速率和最大呼吸能力均顯著增加[33];而當其向記憶階段過渡時,線粒體自噬相關蛋白BNIP3-BNIP3L 通過誘導線粒體自噬去除損傷線粒體并減少活性氧的生成,促進記憶性NK細胞的形成[34]。研究顯示,在低氧腫瘤微環境中,腫瘤浸潤NK細胞的線粒體形態相較于正常NK細胞呈現出顯著的碎片化分裂狀態[35],NK細胞活性和腫瘤殺傷能力明顯降低并喪失腫瘤免疫監視能力[35]。
線粒體參與巨噬細胞極化。線粒體在巨噬細胞極化過程中同樣起關鍵作用。巨噬細胞主要可以分為兩個亞型,由脂多糖/γ 干擾素激活的M1 型促炎巨噬細胞和由IL-4 激活的M2 型抗炎巨噬細胞,其中巨噬細胞向M1 型極化時,細胞內代謝反應從氧化磷酸化轉為有氧糖酵解,細胞內活性氧水平升高[36],且在這一過程中線粒體分裂增加。而當細胞向M2 型極化時,細胞內氧化磷酸化和脂肪酸氧化水平顯著增高,且線粒體呈現出融合變長狀態[37-38]。
綜上,從氧化磷酸化到糖酵解的代謝轉變和線粒體形態的動態變化會導致免疫細胞極性和表型的改變,從而影響免疫細胞的生物學效應。因此,深入研究線粒體動力學和代謝在抗腫瘤免疫中的作用,對于調控抗腫瘤免疫和研發抗腫瘤藥物具有重要的推動作用。
2 線粒體DNA在抗腫瘤免疫中的作用
線粒體基因組突變是癌癥突變基因組的重要組成部分[39],mtDNA 功能障礙和基因突變與癌癥的發生密切相關。線粒體基因拷貝數異常、基因異常表達和mtDNA 表觀遺傳學修飾改變經常通過調控細胞代謝、活性氧生成和細胞間相互作用等方式影響癌癥的發生和惡性轉化[40],且mtDNA 基因突變類型、位置和異質性水平能賦予癌細胞不同程度的競爭優勢[39-40]。值得注意的是,mtDNA 作為細胞內常見的DAMP,其斷裂和釋放也是線粒體功能障礙介導機體炎癥發生的關鍵因素[41-42]。線粒體功能障礙介導的mtDNA泄露已被證明在衰老相關的慢性炎癥中發揮重要作用[43]。
維持線粒體穩態對于細胞的能量代謝、命運決定等具有重要意義。在漫長的進化過程中,生物體形成了一套包括線粒體動力學、生物合成、蛋白質穩態和線粒體自噬在內的完整的線粒體質量控制系統,用于維持線粒體結構和功能的完整性[12,44]。功能障礙線粒體通過MDV,將線粒體成分擠入細胞外囊泡,對細胞器穩態具有重要的調控作用[45]。在此過程中,氧化的mtDNA 通過MDV 進入內體-溶酶體途徑,并通過外泌體進入細胞外空間,觸發多種炎癥和抗炎調節途徑,從而引發相關免疫反應[46]。
2.1 線粒體DNA 介導天然免疫信號活化調控抗腫瘤免疫
盡管多項研究表明mtDNA 在天然免疫活化中的重要性,但目前對于mtDNA 從線粒體基質到細胞質的易位機制尚不明確。2014年的兩項獨立研究顯示,mtDNA 在線粒體凋亡過程中釋放[47-48],后續研究進一步表明凋亡相關的線粒體外膜通透化在mtDNA 釋放中具有重要調控作用[41-42]。此外,用于代謝物和離子運輸的電壓依賴性陰離子通道能夠在線粒體外膜形成寡聚體,短mtDNA 片段從這些寡聚體進入細胞質并觸發Ⅰ型干擾素信號[49];細胞應激介導線粒體膜通透性轉換孔形成參與短mtDNA 片段釋放[50-51]。mtDNA 釋放到細胞質中后能夠被cGAS、TLR9 和NLRP3 等模式識別受體識別,從而活化下游相關炎癥信號通路。在腫瘤微環境中,mtDNA 的細胞外泄露主要由外泌體、微泡和凋亡小體組成的細胞外囊泡所介導,mtDNA 能夠通過直接接觸或者MDV 進入細胞外囊泡,隨后由囊泡運輸進入細胞外空間,在細胞死亡過程中,mtDNA 能夠通過機械性損傷介導的細胞膜破裂被動釋放到細胞外[52]。盡管許多報道表明含有mtDNA 的細胞外囊泡是影響代謝和促進腫瘤生長的關鍵成分[46,53-57],但MDV調控mtDNA轉運的具體機制仍不明確。
當mtDNA 完整性、復制和損傷修復異常導致mtDNA 泄露時,細胞質定位的DNA 識別受體cGAS 能迅速識別mtDNA 并誘導第二信使2′3′-cGAMP 生成,隨后2′3′-cGAMP 通過激活內質網定位的接頭蛋白STING 介導下游Ⅰ型干擾素信號通路和相關炎癥反應活化[41]。近年來的研究顯示,cGAS-STING 信號活化在抗腫瘤免疫中具有重要的調節作用。在許多類型的癌癥中,腫瘤T 細胞浸潤與總體預后呈正相關[58],腫瘤特異性的適應性免疫應答包括細胞毒性T 細胞(CD8+T細胞)激活都依賴于抗原提呈細胞的Ⅰ型干擾素信號,而cGAS-STING 信號是介導Ⅰ型干擾素信號活化的重要通路[59]。使用小分子藥物激活cGAS-STING 信號能夠通過觸發相關天然免疫信號,激活包括樹突狀細胞、巨噬細胞、NK 細胞、CD4+和CD8+T細胞在內的多種免疫細胞,導致體內多種腫瘤明顯變小甚至完全消失[60-62]。研究表明,在包括結腸癌和黑色素瘤在內的多種小鼠皮下成瘤模型中,通過瘤內注射2′3′-cGAMP 激活STING 可刺激活化CD8+T 細胞的腫瘤浸潤,并促進腫瘤清除[63-66]。總的來說,STING 依賴的干擾素調節因子3的活化通過連接天然免疫和適應性免疫在CD8+T 細胞介導的抗腫瘤應答中起重要作用。然而,已有報道也表明在某些細胞類型中,STING 激活可能具有促進腫瘤的作用[67]。癌細胞通過抑制下游Ⅰ型干擾素和經典NF-κB 信號活化,促進STING 依賴的非經典NF-κB 信號,增強腫瘤細胞轉移能力,如染色體不穩定性通過活化STING 依賴的非經典NF-κB 信號,促進腫瘤細胞上皮-間充質轉化、細胞侵襲和轉移[68];乳腺癌和肺癌腦轉移模型中,腫瘤細胞通過腫瘤細胞-星形膠質細胞間隙連接通道將2′3′-cGAMP傳遞給星形膠質細胞并激活其STING 信號,促進炎癥細胞因子產生,隨后活化腦轉移癌細胞中的信號轉導及轉錄激活蛋白1 和NF-κB 信號,從而支持腫瘤細胞生長和化療耐藥[69]。
TLR9 通過識別mtDNA 的CpG 結構域并活化下游MAPK 和NF-κB 信號,促進相關炎癥反應發生[70-71]。值得注意的是,泄露到細胞外的mtDNA還可以通過激活臨近免疫細胞的TLR9 和cGASSTING 信號參與包括巨噬細胞、樹突狀細胞和T淋巴細胞在內的多種免疫細胞的極化和功能調控[42,72]。NLRP3 作為細胞質內的多組分蛋白復合體,能夠識別泄漏到細胞質中的mtDNA 并活化下游caspase-1,促進IL-1 和IL-18 前體剪切活化,招募巨噬細胞、中性粒細胞和T 淋巴細胞參與相關免疫反應[73-78],但同時NLRP3和caspase的活化也能夠進一步介導線粒體損傷并促進mtDNA泄露[79-80]。
在腫瘤誘導的線粒體應激過程中,mtDNA 會釋放到細胞質和細胞外空間并介導多個天然免疫信號活化,這個過程對腫瘤的發生發展具有重要推動作用。如在原發性肝細胞肝癌中,動力學相關蛋白1過表達介導的線粒體功能障礙可通過釋放mtDNA 活化TLR9-NF-κB 信號,增強腫瘤細胞趨化因子配體2 的分泌,從而促進TAM 的招募和極化,推動癌癥發展[81]。在食管鱗狀細胞癌中,動力學相關蛋白1 過表達誘導線粒體功能障礙和細胞質mtDNA 應激,隨后通過激活cGASSTING 信號誘導細胞自噬,推動癌癥發展進程[82]。值得注意的是,活性氧應激能夠誘導含有mtDNA 和PD-L1 的細胞外囊泡生成來調節腫瘤組織周圍的微環境[55,57],細胞外囊泡隨后通過促進巨噬細胞分泌干擾素和IL-6 來抑制腫瘤微環境中的T 細胞免疫。最近的報道表明,多種癌癥患者的外泌體PD-L1 水平升高,且與mtDNA 和γ 干擾素的產生呈正相關[55,83]。總的來說,目前多篇報道表明含有mtDNA 的細胞外囊泡是影響代謝和促進腫瘤生長的關鍵成分,依賴于MDV的線粒體質量控制系統對于細胞的生存和炎癥特性非常重要[56]。因此,通過對MDV 生物發生途徑的內容物選擇性攝取,及其調節線粒體穩態的機制研究將為尋找腫瘤治療新手段提供一個新角度。
2.2 線粒體DNA 介導的免疫原性細胞死亡增強宿主抗腫瘤免疫響應
生理條件下,caspase 依賴的細胞凋亡是一個免疫沉默的過程[84]。caspase 通過阻斷瀕死細胞產生和分泌相關炎性細胞因子,抑制DAMP 介導的相關免疫信號[41,85],避免鄰近細胞不必要的免疫激活。如在細胞凋亡過程中,線粒體外膜通透化的形成能夠誘導細胞自噬并通過內體溶酶體途徑清除受損線粒體,從而減弱mtDNA 介導的免疫信號響應[86]。然而,在某些病理條件下,caspase 依賴的mtDNA 釋放或自噬抑制可能將這種免疫沉默的細胞死亡形式轉化為免疫原性細胞死亡。最近的研究顯示,自噬信號缺失的小鼠在放射治療后,其乳腺癌細胞中由Ⅰ型干擾素介導的炎癥反應顯著增強,導致這一反應發生的原因并非細胞核DNA 損傷,而是mtDNA 泄露[87]。在caspase缺乏的情況下,線粒體外膜通透化通過激活mtDNA-STING 信號發揮強大的抗腫瘤作用[88]。其他研究也報道通過藥物抑制caspase 活性聯合細胞毒性治療可增強宿主的抗腫瘤免疫反應[89-91]。這些發現表明在細胞凋亡過程中,通過調控caspase和細胞自噬活性推動由mtDNA-干擾素信號介導的免疫原性細胞死亡是極具潛力的抗腫瘤治療方式。
3 線粒體活性氧在腫瘤免疫逃逸中的關鍵調控作用
細胞氧化應激是指細胞由于遭受有害刺激或發生劇烈的代謝改變,細胞內高活性分子如活性氧自由基產生過多,氧化與抗氧化系統失衡,從而導致細胞損傷的過程[56]。線粒體是細胞內最主要的活性氧生成細胞器,通過有氧呼吸中的電子傳遞鏈和氧化磷酸化過程產生活性氧[92]。生理條件下,低水平的活性氧作為細胞信號轉導的重要調控分子,參與調控基因表達、細胞增殖、分化和應激反應等多種細胞生命活動,但細胞內活性氧水平過高則會造成核質和線粒體DNA、蛋白質和脂質的氧化損傷,并最終導致細胞損傷。因此,保持細胞內活性氧生成和消耗的動態平衡對于維持細胞穩態和機體健康具有重要意義[93]。
相較于正常細胞,腫瘤細胞往往攜帶更多活性氧,包括促癌基因激活、腫瘤抑制功能喪失、線粒體活性改變和組織炎癥在內的多個促腫瘤事件均會導致活性氧過量生成,而活性氧介導的氧化應激反應又會進一步推動炎癥、纖維化和腫瘤等疾病的病理進程[93-95]。活性氧作為腫瘤發生的重要媒介,在腫瘤細胞增殖、遷移和侵襲,以及血管生成、炎癥和免疫逃逸等不同方面均有重要調控作用,幫助腫瘤細胞適應嚴峻的生存環境,且其介導的炎癥反應還可以改變腫瘤微環境中免疫細胞組成,影響微環境的免疫抑制性[93]。需要注意的是,活性氧在腫瘤的發生發展過程中是一把雙刃劍,化療和放療可能通過刺激腫瘤細胞內活性氧大量生成,誘導腫瘤細胞死亡并增加抗腫瘤治療的敏感性[15,56,96]。
3.1 活性氧促進腫瘤免疫抑制微環境形成
目前研究普遍認為腫瘤微環境是一種慢性炎癥環境,活性氧在炎癥性微環境形成中起著核心調控作用[97],并最終推動癌癥的發生發展。如腫瘤細胞可通過誘導炎癥細胞因子分泌,穩定缺氧誘導因子-1α,激活AMPK 信號,促進NADPH產生等途徑來適應高活性氧環境,避免細胞死亡,促進腫瘤轉移和血管生成[93,98]。活性氧可以通過誘導MAPK 信號活化,調控IL-1β、IL-6 和腫瘤壞死因子α 等NF-κB 介導的炎癥因子的分泌[99-101],調控腫瘤細胞炎癥反應。活性氧還參與調控腫瘤微環境中決定癌癥進展的相關免疫細胞活化狀態,高水平活性氧通過抑制微環境中浸潤性T細胞表面的T細胞受體-抗原肽-MHC復合物形成,抑制T淋巴細胞活化,致使腫瘤細胞逃避免疫系統攻擊,從而促進癌癥進展[102]。研究還發現腫瘤細胞和微環境中的免疫抑制細胞協同作用誘導mtROS 產生,幫助腫瘤組織建立免疫耐受[103-107]。
線粒體質量控制系統中的AAA 蛋白酶Lon與多種蛋白相互作用誘導活性氧生成,通過介導NF-κB 信號軸活化增強下游相關信號的活性,推動腫瘤發生發展[108-113]。在腫瘤中高表達的缺氧誘導因子-1α 通過誘導Lon 表達促進mtROS 的產生[108];Lon 通過與吡咯啉-5-羧酸還原酶1 相互作用上調mtROS 生成,從而活化mtROS-NF-κB 信號軸誘導腫瘤細胞釋放IL-6、γ 干擾素、TGF-β 和血管內皮生長因子等細胞因子,調控腫瘤細胞炎癥反應和增殖潛能,最終推動腫瘤組織建立免疫抑制的腫瘤微環境[110]。最近的一項研究表明,順鉑治療過程中,mtROS 通過促進Lon 蛋白表達活化鈉離子/鈣離子通道蛋白NCLX 調控細胞內鈣離子水平,抑制腫瘤細胞凋亡,增加腫瘤細胞在活性氧脅迫下的順鉑抗性[114]。
3.2 線粒體活性氧對腫瘤微環境中免疫細胞活化的影響
為避免高水平活性氧對免疫細胞的有害影響,機體內存在一套嚴密的調控機制以保持免疫細胞活性和活性氧水平之間的微妙平衡[115]。在NK 細胞和T 淋巴細胞中精確控制活性氧水平可以防止其對其他淋巴細胞造成損傷。有研究表明,在腫瘤微環境中,IL-15 誘導NK 細胞通過硫氧還蛋白系統獲得抗氧化應激的能力,并有利于保護腫瘤微環境內其他淋巴細胞免受活性氧的侵害[116]。抗腫瘤免疫過程中,活化的T 淋巴細胞和NK 細胞通過增加活性氧生成募集中性粒細胞和巨噬細胞,最終達到殺傷腫瘤細胞的目的[117],而另一方面,升高的活性氧又可以通過缺氧誘導因子1α[107]等多種途徑促進免疫抑制細胞如骨髓源性抑制細胞、TAM 和調節性T 細胞的轉化[56,93],支持腫瘤細胞的生長,例如腫瘤相關成纖維細胞通過增加周圍單核細胞的氧化應激,促進其向骨髓源性抑制細胞轉化,從而抑制CD8+T細胞的增殖[118-119],促進腫瘤進展。因此,了解惡性腫瘤中活性氧與免疫細胞活化之間的復雜性是探索活性氧靶向癌癥治療潛力的關鍵。
作為信號中間體,活性氧生成和消耗的平衡在T 細胞活化、促進T 細胞抗原特異性增殖和細胞凋亡等方面均具有重要調控作用[120-121]。適度的活性氧水平對于T淋巴細胞的正常活化和分化至關重要,但高水平活性氧則通過上調凋亡相關因子Fas 和下調抗凋亡蛋白Bcl-2 表達促進T 細胞凋亡[122]。此外,細胞外活性氧還能通過改變抗原提呈細胞中抗原肽的免疫原性影響T細胞的激活[123]。免疫原性細胞死亡過程中,細胞內包括ATP、內質網鈣調蛋白和高遷移率族蛋白B1在內的多種DAMP 泄露到細胞外空間,隨后這些DAMP通過與樹突狀細胞上的受體相互作用激活樹突狀細胞,并最終引發T 淋巴細胞的抗腫瘤免疫反應[124],靶向清除腫瘤細胞外活性氧可以增加T 淋巴細胞的腫瘤浸潤,恢復免疫原性細胞死亡誘導的T 細胞抗腫瘤免疫[125]。此外,調節性T 細胞中還原性谷胱甘肽缺乏會引發絲氨酸代謝異常,轉錄調控因子Foxp3表達下調,最終導致調節性T 細胞的免疫抑制功能減弱[126]。這些研究表明,活性氧水平和持續生成能力在免疫原性細胞死亡發生及其是否引發有效的抗腫瘤免疫中具有關鍵作用[127-128]。
長期以來,活性氧都被認為是線粒體的有害代謝物[129],但近年來研究表明mtROS 是防止過度免疫反應所必需的信號分子,特別是在調控巨噬細胞的免疫響應方面具有關鍵作用[130]。正常情況下,活性氧在不同條件下通過調控相關信號通路影響巨噬細胞極化[93,131]。此外,活性氧在極化的巨噬細胞中同樣也具有重要的調控作用,如M1 型巨噬細胞通過Nox2 信號產生活性氧激活NF-κB 信號,增強細胞吞噬作用[132],但高水平的活性氧對巨噬細胞有害[133]。而在腫瘤發生過程中,巨噬細胞又可以成為腫瘤微環境中占比較多的維持腫瘤組織免疫穩態的免疫細胞群。腫瘤細胞通過分泌腫瘤源性因子重塑腫瘤外周和遠端微環境,這些因子可以刺激微環境中定植和循環的單核細胞和巨噬細胞活化,并加速腫瘤進展[56]。盡管TAM 可以展現出促炎M1 型和抗炎M2 型兩種極化形式,但隨著研究的進展,目前普遍共識均傾向于認為TAM 表現出與M2型巨噬細胞相似的功能,通過分泌多種細胞因子、趨化因子和蛋白酶促進腫瘤生長、轉移、血管生成和免疫抑制[134-136]。已有研究發現,線粒體Lon 在M2型巨噬細胞中表達上調[110],暗示在腫瘤發生過程中,巨噬細胞可能存在多個信號通過調控Lon 表達來誘導mtROS產生,在TAM分化過程中發揮重要作用。
由單核細胞分化而來的樹突狀細胞具有抗原提呈和活化T 細胞的能力,在啟動和控制免疫反應中同樣具有重要的作用[137]。樹突狀細胞的成熟過程受到不同類型刺激的調控,當未成熟的樹突狀細胞受到促炎性細胞因子IL-6 或者TLR配體脂多糖的刺激時,其會轉變為可表達CD80、CD86 和IL-6 的成熟樹突狀細胞,并啟動效應T細胞應答信號[138]。而當樹突狀細胞受到調節因子IL-10、TGF-β、維生素D3 和皮質類固醇刺激時,則會轉變成表達IL-10、吲哚胺2,3-二氧酶和PD-L1 的耐受性樹突狀細胞,又稱為調節性樹突狀細胞,最終導致效應T 細胞的分化受損或調節性T 細胞活化[138]。腫瘤微環境通過誘導調節性樹突狀細胞和骨髓源性抑制細胞分化,促進免疫抑制性微環境的形成[139-141]。此外腫瘤細胞和TAM 分泌的TGF-β 和IL-10 還可以抑制樹突狀細胞介導的抗原提呈和適應性免疫反應[142-144]。越來越多的研究表明,腫瘤微環境中活性氧的濃度在調控免疫細胞的細胞毒性或免疫抑制作用中具有重要作用[145-148]。長期暴露在活性氧微環境中會導致機體處于慢性炎癥狀態[146],而不同的炎癥環境決定了樹突狀細胞和T淋巴細胞之間的抗原交叉提呈能力[149],因此不同的活性氧應激水平可能導致不同功能類型的樹突狀細胞活化[149]。此前的研究表明,T 淋巴細胞和樹突狀細胞在抗原提呈過程中均表現出細胞內活性氧的升高[150]。然而,也有研究顯示在老化的樹突狀細胞中,活性氧的濃度升高會阻礙樹突狀細胞的抗原交叉提呈和促炎能力,從而破壞樹突狀細胞的腫瘤殺傷作用[151]。
4 結 語
線粒體通過生成大量ATP 為細胞生命活動提供充足能量,同時在生物大分子合成代謝、細胞信號轉導、免疫細胞活化、細胞命運決定等多個方面具有重要的調控功能。本文通過探究線粒體代謝和生物合成、線粒體重要信號調控組分mtDNA 和mtROS 與腫瘤微環境以及免疫系統之間復雜的相互作用(圖1),旨在從線粒體與腫瘤免疫的角度為開發新的抗腫瘤免疫療法提供思路。
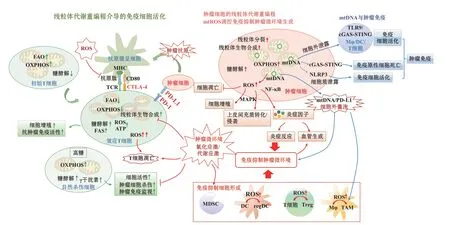
圖1 線粒體調控腫瘤免疫的經典途徑Figure 1 Schematic diagram of typical modes of mitochondria-related tumor immunity
線粒體能量代謝和生物合成在免疫細胞的活化過程中發揮關鍵調控作用,而腫瘤細胞競爭性消耗葡萄糖和腫瘤缺氧微環境則會通過介導線粒體損傷和活性氧大量生成,導致免疫細胞長期處于代謝不足和高氧化應激環境,破壞免疫細胞的活化及其腫瘤免疫監視功能,從而獲得腫瘤免疫逃逸功能。因此,將代謝療法和免疫檢查點結合,通過改善免疫細胞能量代謝,減少免疫細胞線粒體功能障礙和mtROS 的產生,從而增加效應T 細胞存活和記憶T 細胞產生,減少腫瘤微環境中可用總能量,是目前控制腫瘤生長的一種新策略[15]。此外,通過嵌合抗原受體T 細胞的體外mtDNA 編輯來促進線粒體生物合成和氧化磷酸化,從而彌補機體抗腫瘤免疫過程中腫瘤浸潤的效應T細胞的進行性損失,增加免疫細胞的抗腫瘤免疫能力;通過放療方式促進線粒體功能障礙和活性氧爆發,從而引起腫瘤細胞的凋亡級聯反應,也將是重要的抗腫瘤免疫研究和臨床實踐方向[15]。
mtDNA 損傷、突變和細胞質泄露可導致多種疾病,是癌癥發生發展的關鍵因素。細胞發生自身損傷時,細胞質mtDNA 是誘導天然免疫信號活化的重要信號分子。在生理條件下,mtDNA 以類核結構的形式存在于線粒體基質中,當細胞發生損傷時,線粒體形成線粒體外膜通透化或線粒體膜通透性轉換孔,介導mtDNA 進入細胞質并活化包括NLRP3、TLR9 和cGAS-STING 在內的多個天然免疫信號,引發細胞炎癥反應,并導致細胞死亡。值得注意的是,在正常情況下,細胞凋亡是免疫沉默的,而在某些條件下,如通過藥物抑制caspase 活性時,mtDNA 介導的炎癥反應顯著增強,推動免疫原性細胞死亡發生,顯著增強了宿主的抗腫瘤免疫反應。靶向mtDNA 已成為一種很有前途的癌癥治療策略,mtDNA 損傷后的應答機制對于mtDNA 靶向藥物的開發、療效預測和潛在耐藥分析至關重要。
盡管線粒體在癌癥和免疫系統之間復雜的相互作用中起核心調控作用,通過靶向線粒體調節免疫系統來調整宿主的抗腫瘤免疫能力的治療策略是目前基礎和臨床研究的重要方向,但這些研究目前仍處于早期階段。如何在不同細胞亞群活化過程中調控線粒體活性和生物學功能,如何將能量平衡向免疫細胞轉移,在抑制腫瘤細胞代謝的同時促進免疫細胞線粒體功能障礙和代謝不足的修復,這些都是目前值得深入探索的研究方向,也將成為改善臨床患者抗腫瘤療效的重要環節。
志謝研究得到國家自然科學基金(82001668,32370759)支持
AcknowledgementsThis work was supported by the National Natural Science Foundation of China (82001668,32370759)
利益沖突所有作者均聲明不存在利益沖突
Conflict of InterestsThe authors declare that there is no conflict of interests
?The author(s) 2024. This is an open access article under the CC BY-NC-ND 4.0 License (https://creativecommons.org/licenses/by-nc-nd/4.0/)

