口蹄疫病毒O型全自動磁微粒CLIA抗體定量檢測方法的建立
包艷芳,蔣韜,,何莉,呂律,李濤善,李昕,孫燕燕,楊光,魏婷,潘曉樂,林密,
口蹄疫病毒O型全自動磁微粒CLIA抗體定量檢測方法的建立

1蘭州獸研生物科技有限公司,蘭州 730046;2中國農業科學院蘭州獸醫研究所/動物疫病防控全國重點實驗室/國家口蹄疫參考實驗室,蘭州 730046
【背景】口蹄疫(foot and mouth disease, FMD)是由口蹄疫病毒引起的一種急性、熱性、烈性傳染病,疫苗接種是預防臨床口蹄疫的有效措施。免疫抗體水平監測則是評估疫苗免疫效果、制定免疫程序的重要依據,是免疫工作和疫情防控必不可少的關鍵環節,因此建立高效、快速、全自動的抗體檢測方法具有重要意義。【目的】基于磁微粒(micromagnetic particles,MMPs)化學發光免疫分析技術(CLIA),建立一種新型 、全自動、可定量的口蹄疫病毒O型抗體檢測方法,為口蹄疫免疫監測和疫情防控提供技術支撐。【方法】使用納米材料磁微粒為固相載體和分離載體包被捕獲抗體,用堿性磷酸酶(alkaline phosphatase,ALP)標記檢測抗體,經過條件優化建立了一種新型磁微粒CLIA檢測方法(magnetic particle chemiluminescence immunoassay, MP-CLIA)。本方法首先加入磁微粒-兔抗偶聯物 (magnetic particle-polyclonal antibodies, MPs-pAbs)、待測樣本、口蹄疫病毒O型抗原,37℃孵育;再加入適量酶標抗體(ALP-pAbs),37℃孵育;最后加入化學發光底物AMPPD,檢測相對發光強度(relative light unit,RLU)。研究通過檢測標準品擬合標準曲線,并應用受試者工作特征曲線(receiver operating characteristic,ROC)確定檢測方法的判定標準;利用質控樣本進行方法學評價,同時檢測田間樣本,并和液相阻斷ELISA(LPB-ELISA)比對,驗證臨床檢測效果。【結果】優化后最佳反應條件為磁微粒濃度0.25 mg·mL-1、口蹄疫病毒O型抗原1﹕1 000稀釋、酶標抗體1﹕2 000稀釋、加樣量20 μL。整個檢測過程均在全自動化學發光免疫分析儀中完成,反應時間20 min,在抗體含量0—1 280 U(效價0—1﹕2 048)范圍內標準曲線2>0.99,可進行定量檢測。該方法敏感性為94.66%;特異性為97.10%,檢測口蹄疫A型、Asia I型血清型特異性為97.14%,與塞內卡病毒(SVV)、豬繁殖與呼吸綜合征病毒(PPRSV)、牛流行熱病毒(BEFV)、豬圓環病毒2型(PCV2)、羊痘病毒(QRFV)、小反芻獸疫病毒(PPRV)抗體陽性血清無交叉反應;重復檢測變異系數 CV值<10%;田間樣本檢測結果與LPB-ELISA符合率為94.69%,定量結果相關系數2為0.8473,<0.0001,相關性顯著。【結論】建立的MP-CLIA方法耗時短、操作簡便,配套國產全自動化學發光儀,可進行全自動化檢測,是一種新型、高效的口蹄疫病毒O型抗體定量檢測方法,本方法對應的試劑盒已經完成中試生產和臨床檢測試驗,在全國不同區域試用效果較好,具有較高的臨床應用價值。
磁微粒化學發光免疫分析法;口蹄疫;磁微粒;全自動化
0 引言
【研究意義】口蹄疫(foot and mouth disease, FMD)是由口蹄疫病毒引起偶蹄動物的一種急性、熱性、烈性傳染病,在牛、豬、綿羊、山羊等家畜中感染最為普遍,造成重大經濟損失和社會政治負面影響[1-2]。疫苗接種是預防口蹄疫疫情傳播的有效策略[3-4]。免疫抗體水平監測則是評估疫苗免疫效果、制定免疫程序的重要依據,是口蹄疫防控必不可少的關鍵環節,因而建立一種高效、快速、全自動的抗體檢測方法可以為口蹄疫疫病防控提供強有力地技術支撐。【前人研究進展】1977年HALMANN等[5]通過化學發光技術和免疫分析技術聯用對少量微生物進行鑒定和定量,從而建立了化學發光免疫分析(chemiluminescence immunoassay,CLIA)技術,同年,ARAKAWA等[6]用魯米諾-過氧化物酶化學發光反應進行皮質醇酶免疫測定。經過幾十年的發展,CLIA技術現在已經廣泛應用于環境監測、臨床診斷,藥物分析、生命科學等領域[7-11]。在動物疫病檢測方面也有許多研究和報道,如1995年VIDZIUNAITé等[12]建立的檢測布病和兔土拉菌病的CLIA方法,2014年ZHOU等[13]使用金納米材料為載體,建立了檢測豬細小病毒抗體的CLIA方法,YANG等[14]結合磁微粒化學發光和PCR,建立了檢測偽狂犬病毒的方法;口蹄疫方面, LIU等[15-16]分別在2017年、2018年建立了檢測非結構蛋白2C和3ABC抗體的CLIA方法和基于3A-3B重組表位的CLIA檢測方法,能有效區分FMDV感染和免疫抗體, LIU等[17]于2021年利用多表位重組蛋白建立了間接CLIA方法,用于檢測豬血清的FMDV-O型抗體,孫雨等[18-19]建立了口蹄疫病毒O型/A型抗體CLIA檢測方法,可以檢測血清樣本中的VP1蛋白抗體。由于在敏感性、特異性、檢測效率上明顯優于ELISA[8],CLIA已經用于動物疫病臨床檢測中,歐盟已經將CLIA方法作為牛海綿狀腦病(BSE)的快速檢測手段之一[20]。【本研究切入點】近年來,納米粒子在化學發光免疫技術方面表現出較好的應用效果[21-25],其中磁性納米材料制備簡單、成本低、易清洗分離,通過共價鍵連接抗原/抗體不易脫落[26]。以磁性納米顆粒為固相包被和分離載體建立的磁微粒CLIA技術,使得免疫反應在幾乎全液相的狀態下進行,具有快速、高通量、全自動化、操作簡單方便等特點[27-29],此方法克服了傳統ELISA和板式CLIA方法使用聚乙烯化學發光板作為反應載體,包被抗原/抗體濃度有限和免疫反應表面積小導致的檢測的靈敏度低、檢測范圍窄的缺點[30]。2023年SHI等人使用此方法建立了非洲豬瘟抗體檢測的方法,并證明此方法檢測P30蛋白具有高敏感性和特異性,其穩定性好,保存期長,檢測效果好[31]。到目前為止,此方法在FMDV抗體檢測中還未見報道。【擬解決的關鍵問題】本研究使用磁微粒作為固相載體偶聯抗口蹄疫O型兔抗,以堿性磷酸酶(Alkaline phosphatase,ALP)標記抗口蹄疫O型豚鼠抗,滅活O/Mya-98全病毒為檢測抗原,3-(2-螺旋金剛烷)-4-甲氧基-4-(3-磷氧酰)-苯基-1,2-二氧環乙烷(AMPPD)為發光底物,旨在建立一種新型口蹄疫病毒O型全自動磁微粒CLIA抗體定量檢測方法,同時配套全自動化學發光免疫分析儀,克服ELISA、板式CLIA等檢測方法重復性差、操作繁瑣等缺點,實現對FMDV-O型抗體的定量、快速、自動化檢測。
1 材料與方法
試驗于2019年11月至2021年5月在中國農業科學院蘭州獸醫研究所、蘭州獸研生物科技有限公司完成。
1.1 毒種、抗體、血清樣本
口蹄疫O/Mya-98全病毒滅活抗原由中農威特生物科技有限公司提供;兔抗口蹄疫病毒O型純化抗體、豚鼠抗口蹄疫病毒O型純化抗體、口蹄疫病毒O型抗體標準血清,均為蘭州獸研生物科技有限公司實驗室制備、保存。
口蹄疫病毒O型免疫血清樣本131份,口蹄疫病毒A型免疫血清樣本18份, 口蹄疫病毒亞洲Ι型免疫血清樣本17份,健康未免疫血清樣本34份,共200份樣本如表1所示。塞內卡病毒(SVV)抗體陽性血清3份,豬繁殖與呼吸綜合征病毒(PPRSV)、牛流行熱病毒(BEFV)、豬圓環病毒2型(PCV2)、羊痘病毒(QRFV)、小反芻獸疫病毒(PPRV)抗體陽性血清各3份,均蘭州獸醫研究所動物疫病防控全國重點實驗室收集保存。
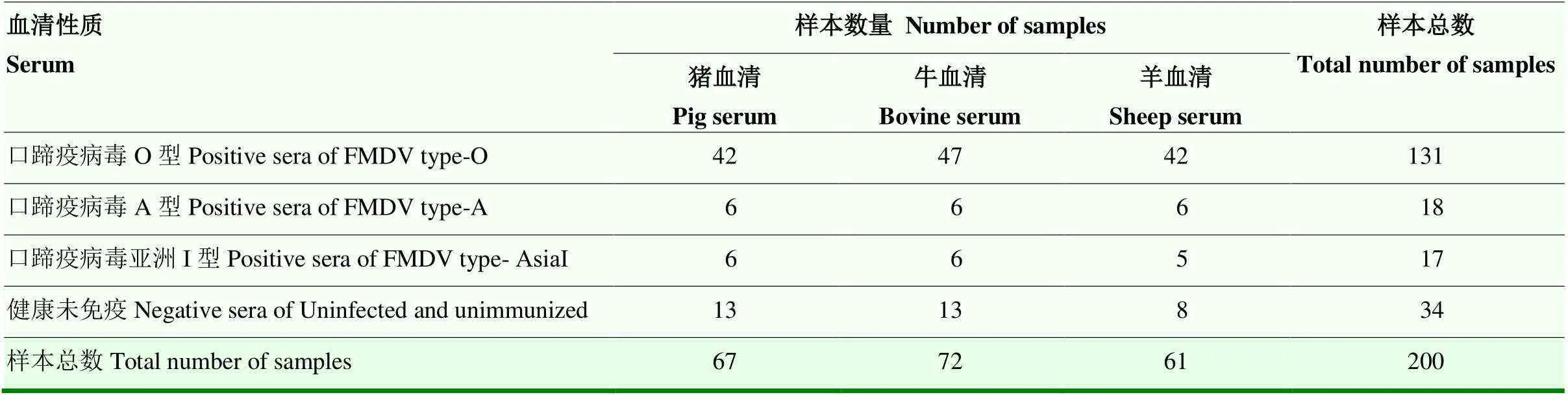
表1 200份血清及背景
1.2 主要試劑和儀器
磁性微粒購自JSR集團MBL公司,堿性磷酸酶(alkaline phosphatase,ALP)、AMPPD均購自sigma公司。口蹄疫病毒O型液相阻斷ELISA抗體檢測試劑盒,蘭州獸研生物科技有限公司提供。
LYC100T全自動化學發免疫分析儀由蘭州獸研生物科技有限公司提供;SEPMAG? A200 mL生物磁性分離器購自sepmag公司,X718-1 XK01血液混勻儀購自江蘇新康醫療器械有限公司,GHP-9270恒溫培養箱購自上海-恒科學儀器有限公司,超速離心機購自Thermo Fisher公司。
1.3 口蹄疫病毒O型檢測抗原的制備
使用PEG6000和NaCl沉淀滅活抗原,進行差速、超速離心,棄上清。用0.1 mol·L-1Tris-HCl緩沖液懸浮沉淀至原體積的1/10,加入2倍三氯乙烯去酯,用原體積1/100的0.01 mol·L-1PBS緩沖液重懸沉淀,分裝后置-20℃以下保存備用。
1.4 磁性微粒(MMPs)偶聯抗口蹄疫O型兔抗
取20 mg MMPs,用生物磁性分離器吸附1 min,棄去溶液后使用2 ml 0.1 mol·L-1MES(pH5.0)重新懸浮,如此反復清洗4次后,加入NHS(10 mg·mL-1)和EDC(10 mg·mL-1)各200 μL進行MPs活化,常溫混勻反應30 min。之后用2 mL0.1 mol·L-1MES(pH5.0)清洗MPs 4次,加入抗口蹄疫病毒O型純化兔抗200 μg,室溫震蕩偶聯3 h后,加入200 μL10% BSA室溫震蕩3 h,制備成磁微粒-多抗偶聯物(magnetic particle-polyclonal antibodies, MPs-pAbs)。最后,用PBST清洗3次,用80 mL保存液分散,4℃儲存備用。
1.5 堿性磷酸酶(ALP)標記口蹄疫O型豚鼠抗體
使用高碘酸鈉(NaIO4)法進行活化標記,整個反應均在4—8℃下進行。首先,NaIO4和ALP反應1 h后,加入等體積乙二醇(1%),還原過量NaIO4,完成ALP的活化。然后,將抗FMDV-O豚鼠抗體與和活化的ALP混合,置于pH9.6,濃度 0.5 mol·L-1的CBS中透析過夜,制備成堿性磷酸酶標記抗體(alkaline phosphatase -polyclonal antibodies ALP- pAbs)。最后,在上述混合液中加入50%甘油的PBS,-20℃及以下保存備用。
1.6 口蹄疫抗體含量的定義和標準品制備
取經病毒中和試驗(VNT)檢測結果為1﹕16的O型口蹄疫抗體血清樣品,定義該抗體含量為10個活性單位,即10 U,則標準品(效價1﹕2 048的血清)抗體含量為1 280 U。用新生牛血清分別倍比稀釋標準品,制備抗體含量分別為1 280 U(1﹕2 048)、640U(1﹕1 024)、320U(1﹕512)、160U(1﹕256)、80U(1﹕128)、40U(1﹕64)、20(1﹕32)、10(1﹕16)、5U(1﹕8)的標準品,-20℃及以下保存備用。
1.7 口蹄疫病毒O型磁微粒CLIA抗體檢測方法的初步建立
方法原理及建立過程如圖1所示,將抗口蹄疫兔抗和磁微粒偶聯制備成磁微粒-兔抗偶聯物(MPs-pAbs),堿性磷酸酶標記豚鼠抗體制備成酶標抗體。檢測時,首先將待測樣本、口蹄疫病毒O型抗原和適量磁微粒-兔抗偶聯物(MPs-pAbs)混合,37℃孵育10 min;用磁力板吸附磁珠1 min,棄去反應液,加清洗液重懸磁珠后再進行吸附清洗,如此重復4次后棄去清洗液,加入適量酶標抗體(ALP-pAbs),混勻磁珠,37 ℃孵育10 min;重復清洗4次后加入100 μL化學發光底物AMPPD,混勻磁珠,37℃孵育3 min,檢測相對發光強度(relative light unit,RLU),計算抗體含量,初步建立口蹄疫病毒O型磁微粒CLIA(magnetic particle chemiluminescence immunoassay,MP-CLIA)抗體檢測方法。
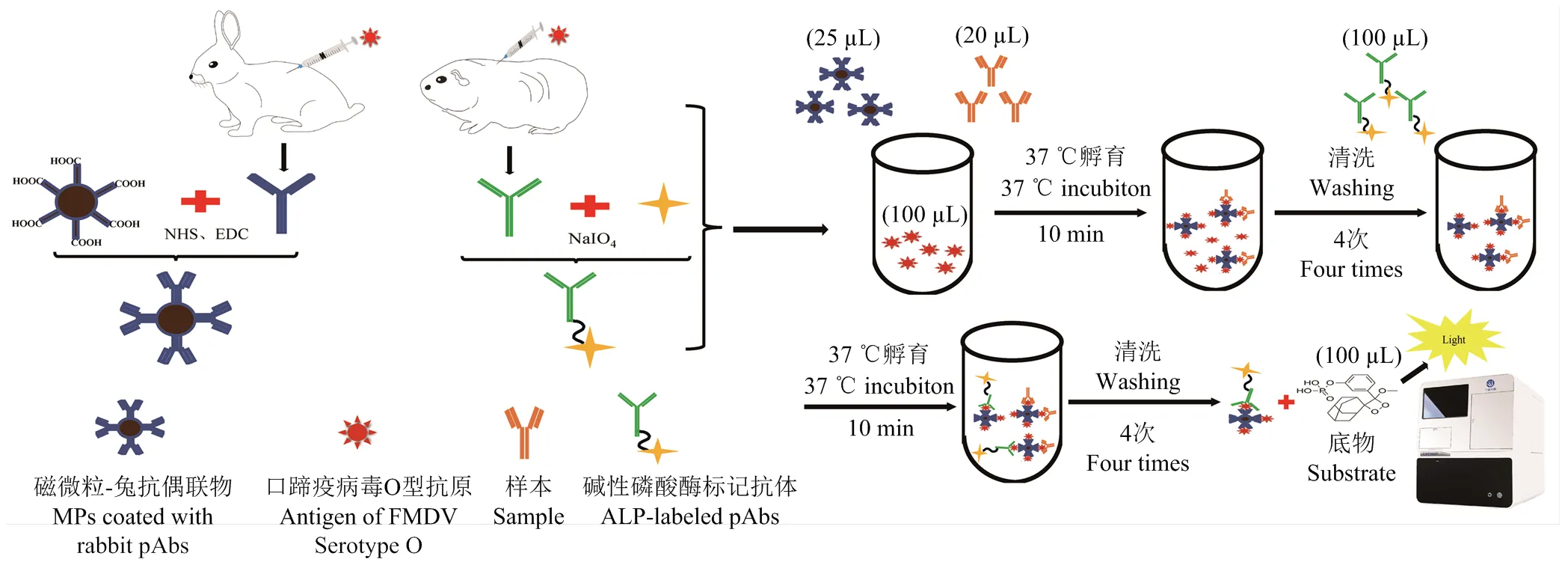
圖1 口蹄疫病毒O型磁微粒CLIA抗體定量檢測方法原理及檢測過程示意圖
1.8 口蹄疫病毒O型抗原、MPs-pAbs、ALP-pAbs反應濃度的優化
按1﹕500、1﹕1 000、1﹕2 000、1﹕4 000、1﹕8 000比例依次稀釋口蹄疫病毒O型抗原,以MPs濃度0.1、0.25、0.5、1 mg·mL-1分別稀釋MPs-pAbs,按1﹕500、1﹕1 000、1﹕2 000、1﹕4 000、1﹕8 000比例依次稀釋ALP-pAbs,保存備用;以標準品為待檢血清,檢測在使用不同濃度抗原、不同濃度的MPs-pAbs和ALP-pAbs條件下的發光值,以抗體含量為X值,RLU為Y值擬合標準曲線;以陰陽性對照為待檢血清,檢測后計算陰陽性血清發光強度比值(luminescence intensity ratio,LIR)N/P值,檢測步驟同1.7。通過比較標準曲線2值,和N/P值,確定口蹄疫病毒O型抗原、MPs-pAbs、ALP-pAbs最佳反應濃度。
1.9 反應時間、加樣量優化
選擇加樣量分別為5、10、15、20、30 μL;待測樣本、口蹄疫病毒O型抗原和適量磁微粒-兔抗偶聯物(MPs-pAbs)混合,37℃分別孵育5、10、15、20 min;加入酶標抗體后37℃分別孵育5、10、15、20 min,同1.8檢測標準品和陰陽性對照血清,擬合標準曲線,計算N/P值,通過比較標準曲線R2值,和N/P值,確定最佳反應時間和加樣量。
1.10 CLIA方法的Cut-off值和判定標準
使用優化后的MP-CLIA方法檢測標準品,擬合標準曲線,并檢測200份背景清楚的田間樣本,通過ROC曲線和交互式點狀圖進行分析,以Youden index值為指標確定CLIA方法的最佳Cut-off值,并作為該方法檢測口蹄疫O型病毒抗體陰陽性的判定標準。
1.11 CLIA方法的敏感性、特異性
分析200份樣本中131份FMDV-O抗體陽性樣本檢出率,計算該方法的敏感性;分析69份陰性血清檢測結果,計算該方法的特異性,并通過其中34份型特異性血清的檢測結果,考察該方法的型特異性。另外,通過檢測SVV、PPRSV、BEFV、PCV2、QRFV、PPRV的抗體陽性血清21份,檢驗該方法對不同病原抗體是否有交叉反應。
1.12 CLIA方法的重復性
根據農業農村部第638號公告《獸用診斷制品試驗研究技術指導原則》,選擇2份陰性、1份弱陽性、1份強陽性共4份血清,抗體含量從低到高,每個樣本進行20次重復性檢測,計算結果平均值(Mean)、標準差(SD)和變異系數CV%,通過比較變異系數大小,考察CLIA方法的檢測重復性和穩定性,其中CV%=(SD/Mean)×100。
1.13 CLIA方法對臨床樣本的檢測
用建立的CLIA方法和OIE推薦的口蹄疫病毒O型液相阻斷ELISA抗體檢測方法(LPB-ELISA)分別檢測320份田間樣本的抗體含量和效價,并對結果進行比對和分析,比較兩種方法陰陽性判定的符合率,并通過相關性分析,比較定量檢測結果的相關性,從而比較兩種方法的檢測差異,評估磁微粒CLIA方法對臨床樣本的檢測準確性。
1.14 統計學處理
采用GraphPad Prism做方法優化數據分析,Medcalc軟件做ROC曲線分析,Origin85做相關性分析,計量比較采用t檢驗,以<0.05為差異有統計學意義。
2 結果
2.1 磁微粒CLIA方法的優化
2.1.1 偶聯抗體的磁微粒濃度優化 偶聯抗體過程中磁微粒(MPs)并沒有丟失,以MPs濃度0.1、0.25、0.5、1 mg·mL-1計算,分別稀釋偶聯抗體的磁微粒用于檢測標準血清,結果如圖2-a所示,磁微粒濃度為0.25mg·mL-1時,標準曲線2為0.9987,陰陽性樣本發光強度比(luminescence intensity ratio,LIR)N/P值為6.27,檢測結果最優。
2.1.2 口蹄疫病毒O型抗原、堿性磷酸酶(ALP)標記抗體稀釋度優化 口蹄疫病毒O型抗原和堿性磷酸酶(ALP)標記抗體分別按1﹕500、1﹕1 000、1﹕2 000、1﹕4 000、1﹕8 000稀釋,均使用100 μL檢測標準血清,結果如圖2-b所示,口蹄疫病毒O型抗原1﹕1 000稀釋、酶標抗體1﹕2 000稀釋時,N/P為20.36,檢測結果最佳。
2.1.3 反應時間、加樣量優化 待測樣本、口蹄疫病毒O型抗原和適量磁微粒-兔抗偶聯物(MPs-pAbs)混合,37℃分別孵育5、10、15、20 min;加入酶標抗體后37℃分別孵育5、10、15、20 min,進行組合優化,如圖2-c所示,隨著反應時間增長,N/P先增大后降低,兩步反應最佳反應時間均為10 min,此時N/P為20.03。選擇加樣量分別為5、10、15、20、30 μL,圖2-d為加樣量優化結果,樣本加入20 μL時檢測結果最好,此時N/P為23.98,標準曲線2為0.9981。
a:磁微粒-捕獲抗體偶聯物使用濃度優化;b:口蹄疫病毒O型抗原、ALP標記抗體稀釋度優化;c:反應時間優化;d:加樣量優化
a: Optimization of the concentration of magnetic particles coated with capture antibodies; b: Dilution optimization of FMDV-O antigen and ALP-labeled pAbs; c: Optimization of the reaction time; d: Optimization of volume of sample
圖2 口蹄疫病毒O型磁微粒CLIA抗體定量檢測方優化
Fig. 2 Optimization of the MPs-based CLIA method for quantitative detection of of Foot and Mouth Disease Virus Serotype O
2.2 CLIA方法的Cut-off值和判定標準
2.2.1 標準血清及抗體含量 病毒中和試驗結果1﹕16定義為10個活性單位,即10U,以效價(1﹕)為橫坐標,活性含量(U)為,其對應關系為=0.0625(圖3),則標準血清抗體含量分別為5U(1﹕8),10(1﹕16),20(1﹕32),40U(1﹕64),80U(1﹕128),160U(1﹕256),320U(1﹕512),640U(1﹕1 024),1 280U (1﹕2 048)。
2.2.2 CLIA方法的Cut-off值和判定標準 按照優化后的CLIA方法檢測標準血清,制作四參數標準曲線如圖4所示,2為0.9994,相關性較好。檢測背景清楚的200田間份血清,使用ROC曲線進行統計分析,結果如圖5所示,本方法的最佳Cut-off值為70.74U(效價為1﹕113.18),此時AUC值為0.975,<0.0001,Youden指數為0.9176,證明CLIA方法具有很好的檢測效果。判定標準定為:當檢測結果≥70.74U判定為口蹄疫病毒O型抗體陽性,<70.74U時判為口蹄疫病毒O型抗體陰性。
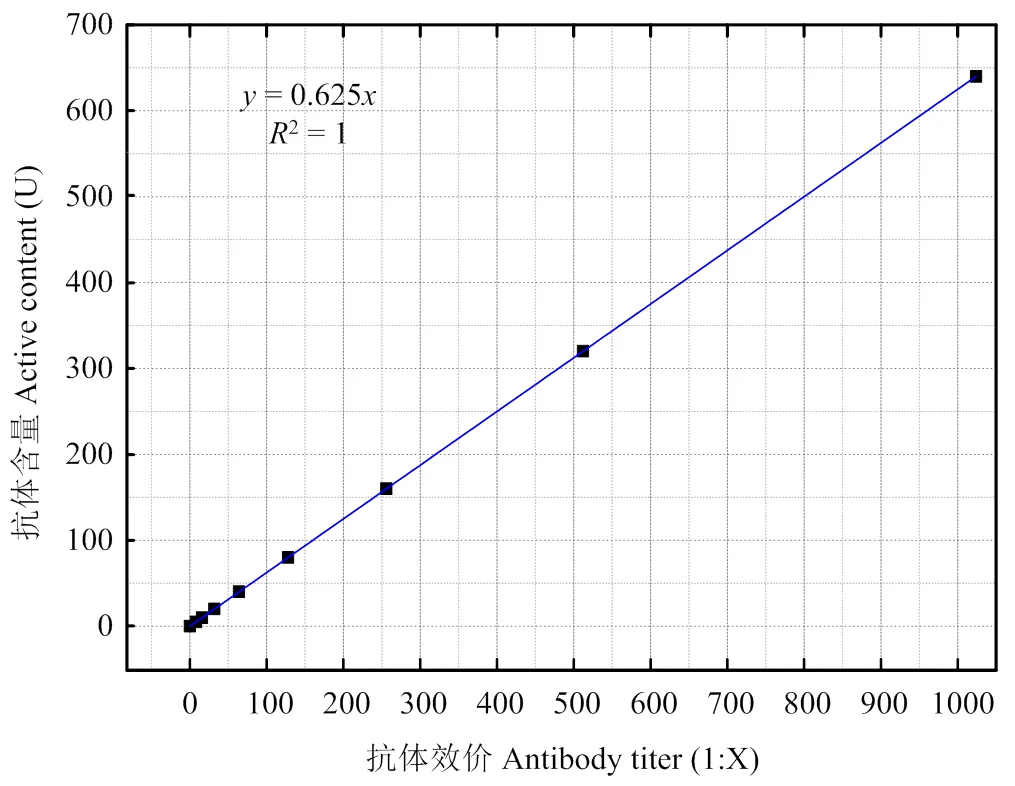
圖3 抗體效價和活性含量對應關系
2.3 CLIA方法的特異性和敏感性
200份樣本檢測結果如圖6所示,其中131份陽性樣本,CLIA方法檢出124份,敏感性為94.66%;69份陰性樣本,檢出陰性67份,特異性為97.10%。特異性樣本具體檢測結果如圖7所示,共計檢測陰性血清69份,其中35份型特異性樣本(A型18份,亞洲Ι型17份)中,34份檢測結果為陰性,型特異性為97.14%;檢測SVV、PPRSV、BEFV、PCV2、QRFV、PPRV的抗體陽性血清21份,結果均為陰性,特異性為100%;其他陰性樣本13份,檢測特異性為97.06%。

圖4 CLIA方法的標準曲線
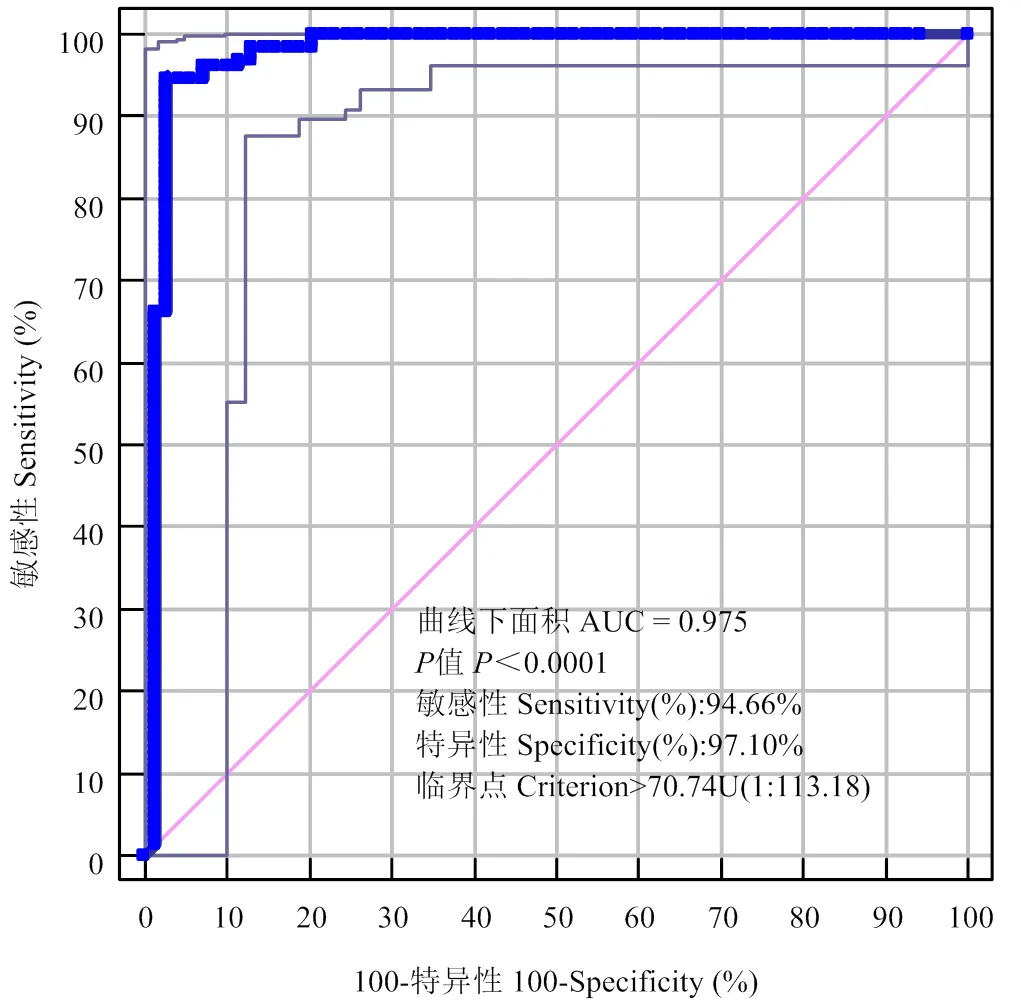
曲線上每一點代表不同的敏感性和特異性
Each point on the graph represents the sensitivity and specificity at a particular threshold
圖5 ROC曲線
Fig. 5 Determination of the Cut-off value for MPs-based CLIA(a) Receiver operating characteristic curve

0為陰性,1為背景陽性圖
0 represents negative sera and 1 represents the positive sera
圖6 200份血清檢測結果
Fig. 6 The result of 200 sample

圖7 特異性檢測
2.4 CLIA檢測方法重復性
檢測4份抗體含量從低到高的血清樣本,每個樣本檢測20次,重復性檢測結果如表2所示,4個樣本變異系數CV%值分別是8.20%、4.14%、3.56%、1.59%,均小于10%,說明CLIA抗體檢測方法重復性較好。
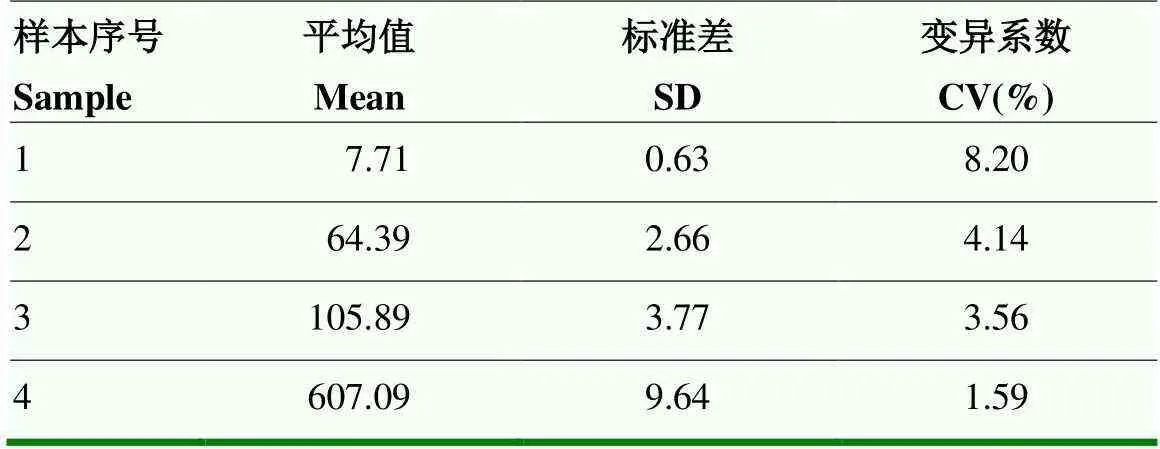
表2 重復性試驗
2.5 CLIA方法對臨床樣本的檢測
用建立的CLIA方法和LPB-ELISA方法分別檢測320份田間樣本,并對結果進行比對和相關性分析,檢測結果如表3所示,在該批臨床比對試驗中,建立的CLIA方法檢出陽性182份,陰性138份,和LPB-ELISA方法陰性符合率為96.90%,陽性符合率為93.19%,總符合率為94.69%;定量結果相關性如圖8所示,2為0.8473,<0.0001,說明兩種方法檢測結果相關性較好。該批臨床試驗樣本根據田間免疫背景進行收集,CLIA方法和LPB-ELISA方法陽性檢出率分別為56.88%、59.69%,陰性檢出率分別為43.13%、40.31%,陰陽性比例滿足比對試驗要求,比對結果顯示,建立的CLIA方法檢測結果可靠,可用于口蹄疫病毒O型抗體的定量檢測。

表3 320份田間樣本檢測
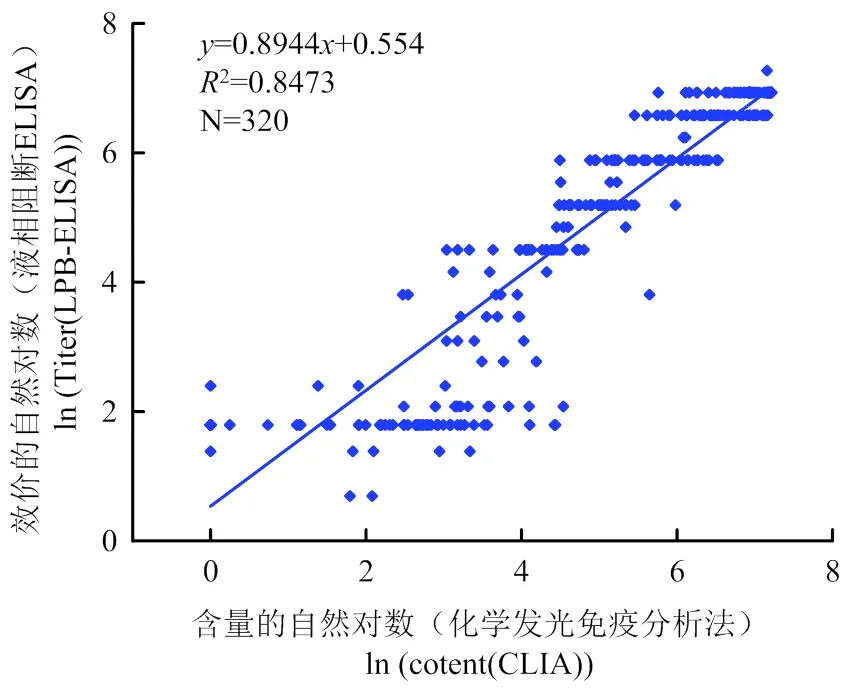
圖8 T-CLIA和ELISA方法檢測相關性分析
3 討論
3.1 磁微粒CLIA方法檢測速度快、檢測重復性好
本研究使用磁微粒為反應載體,通過系統性優化,建立了一種口蹄疫病毒O型抗體檢測方法,并使用針對動物疫病診斷定制的專用化學發光免疫分析儀進行全自動化檢測。本方法使用樣本20 μL,總反應時間為20 min,配套全自動化學發光免疫分析儀,檢測通量達到300測試/h,使用CLIA方法對4份不同抗體含量的樣本進行重復性檢測,檢測結果變異系數均小于10%,實現了FMDV-O抗體高重復性、自動化、快速檢測。
3.2 磁微粒CLIA方法可實現口蹄疫抗體定量檢測
按照農業農村部《國家動物疫病強制免疫指導意見(2022—2025年)》,我國目前采取對所有牛、羊、駱駝、鹿進行O型和A型口蹄疫免疫,對全國所有豬進行O型口蹄疫免疫。推進口蹄疫防控效果進入更高階段,關鍵在診斷檢測技術和疫苗[4],隨著Asia Ι型和A型趨于控制,對O型進行免疫和免疫監測將是主要的措施之一。同時,隨著集約化養殖和降本增效的推行,按照免疫抗體含量制定免疫計劃勢在必行。傳統的ELISA和板式CLIA需要4—1 024倍比稀釋樣本,若要檢測1﹕1 024以內的滴度,每個酶標板只能檢測10份血清,因此定量檢測工作量大、操作繁瑣。本研究參考VNT試驗及判定對抗體的活性單位(U)進行了定義,通過檢測標準品血清建立標準曲線,其檢測范圍在5—1 280U(效價1﹕8—1﹕2 048)內,標準曲線2≥0.99,實現了口蹄疫O型抗體單管定量檢測,為定量檢測口蹄疫病毒抗體提供了一種新思路。
3.3 磁微粒CLIA方法使用國產設備進行全自動化檢測
磁微粒CLIA方法具有靈敏度高、檢測范圍寬、自動化高等優勢,在人醫體外診斷領域發展迅速,但是因為技術門檻較高,化學發光免疫分析儀器被少數進口廠家壟斷,試劑和儀器使用成本昂貴,使得此方法在檢測量較少的動物疫病診斷行業發展緩慢,技術更新換代落后。本研究根據動物疫病診斷的特點定制國產全自動化學發光免疫分析儀(LYC100T、LYC200T),檢測時無需對每個樣本進行梯度稀釋和人工加樣、洗滌、計算結果,從加樣、檢測到打印報告全程在全自動化學發光免疫分析儀上進行,實現了口蹄疫病毒O型抗體的全自動化檢測。
3.4 磁微粒CLIA方法的應用
本研究配套國產全自動化學發光免疫分析,通過系統優化試驗,使得檢測效果達到了應有要求,已經在全國不同區域進行試用,試用反饋效果較好,具有較高的臨床應用價值。在后續的臨床檢測和使用中,研究人員將探索定量結果和免疫保護的關系,以期為臨床免疫方案的制定提供技術支撐。
4 結論
建立了一種磁微粒口蹄疫病毒O型CLIA抗體檢測方法,可通過國產化動物疫病診斷專用化學發光免疫分析儀進行全自動檢測,其特異性好、敏感度高,避免多次稀釋樣本和繁瑣的手動操作,可在20 min內實現口蹄疫病毒O型抗體的定量、高通量檢測,為口蹄疫病毒抗體定量檢測提供了一種新思路和新方法,具有良好的臨床應用潛力。
[1] CLEMMONS E A, ALFSON K J, DUTTON J W 3rd. Transboundary animal diseases, an overview of 17 diseases with potential for global spread and serious consequences. Animals, 2021, 11(7): 2039.
[2] 何繼軍, 靳野, 馬維民, 楊亞民, 呂律, 鄭海學, 楊帆, 曹偉軍, 郭建宏, 李彥敏, 劉在新, 劉湘濤. 外來口蹄疫流行毒株跟蹤分析與防控. 中國動物檢疫, 2018, 35(11): 52-55, 61.
HE J J, JIN Y, MA W M, YANG Y M, Lü L, ZHENG H X, YANG F, CAO W J, GUO J H, LI Y M, LIU Z X, LIU X T. Tracking analysis and control strategies for exotic FMD epidemic strains. China Animal Health Inspection, 2018, 35(11): 52-55, 61. (in Chinese)
[3] DIAZ-SAN SEGUNDO F, MEDINA G N, STENFELDT C, ARZT J, DE LOS SANTOS T. Foot-and-mouth disease vaccines. Veterinary Microbiology, 2017, 206: 102-112.
[4] 劉在新. 全球口蹄疫防控技術及病原特性研究概觀. 中國農業科學, 2015, 48(17): 3547-3564.
LIU Z X. Progress and prospect of the technologies to control foot-and-mouth disease and its pathogen characteristics worldwide. Scientia Agricultura Sinica, 2015, 48(17): 3547-3564. (in Chinese)
[5] HALMANN M, VELAN B, SERY T. Rapid identification and quantitation of small numbers of microorganisms by a chemiluminescent immunoreaction. Applied and Environmental Microbiology, 1977, 34(5): 473-477.
[6] ARAKAWA H, MAEDA M, TSUJI A. Enzyme immunoassay of cortisol by chemiluminescence reaction of luminol-peroxidase. Bunseki Kagaku, 1977, 26(5): 322-327.
[7] PIRES N M M, DONG T. Measurement of salivary cortisol by a chemiluminescent organic-based immunosensor. Bio-Medical Materials and Engineering, 2014, 24(1): 15-20.
[8] AZIM M A U, HASAN M, ANSARI I H, NASREEN F. Chemiluminescence immunoassay: basic mechanism and applications. Bangladesh Journal of Nuclear Medicine, 2018, 18(2): 171-178.
[9] ZHANG C S, SU Y, LIANG Y, LAI W, JIANG J, WU H Y, MAO X Y, ZHENG L, ZHANG R Y. Chemiluminescence and its biomedical applications. Nanophotonics in Biomedical Engineering. Singapore: Springer Singapore, 2020: 143-195.
[10] ZHANG B, LI H Z, LI Y, FU X L, DU D L. A sensitive chemiluminescence immunoassay based on immunomagnetic beads for quantitative detection of Zearalenone. European Food Research and Technology, 2021, 247(9): 2171-2181.
[11] LIU R P, WANG C, JIANG Q, ZHANG W, YUE Z, LIU G H. Magnetic-particle-based, ultrasensitive chemiluminescence enzyme immunoassay for free prostate-specific antigen. Analytica Chimica Acta, 2013, 801: 91-96.
[12] VIDZIUNAITé R, MIKULSKIS P, KULYS J. Chemiluminescent immunoassay (CLIA) for the detection of brucellosis and tularaemia antigens. Journal of Bioluminescence and Chemiluminescence, 1995, 10(4): 199-203.
[13] ZHOU Y, ZHOU T, ZHOU R, HU Y G. Chemiluminescence immunoassay for the rapid and sensitive detection of antibody against porcine parvovirus by using horseradish peroxidase/detection antibody- coated gold nanoparticles as nanoprobes. Luminescence, 2014, 29(4): 338-343.
[14] YANG H W, GUO Y F, LI S, LAN G Q, JIANG Q Y, YANG X R, FAN J, ALI Z, TANG Y J, MOU X B, LIU H N, ALI A SHAH M, JIN S, JIANG H S, LI Z Y. Magnetic beads-based chemiluminescent assay for ultrasensitive detection of pseudorabies virus. Journal of Nanoscience and Nanotechnology, 2014, 14(5): 3337-3342.
[15] LIU Z Z, SHAO J J, ZHAO F R, ZHOU G Q, GAO S D, LIU W, LV J L, LI X M, LI Y F, CHANG H Y, ZHANG Y G. Chemiluminescence immunoassay for the detection of antibodies against the 2C and 3ABC nonstructural proteins induced by infecting pigs with foot-and-mouth disease virus. Clinical and Vaccine Immunology, 2017, 24(8): e00153-e00117.
[16] LIU Z Z, ZHAO F R, GAO S D, SHAO J J, ZHANG Y G, CHANG H Y. Development of a chemiluminescence immunoassay using recombinant non-structural epitope-based proteins to accurately differentiate foot- and-mouth disease virus-infected and vaccinated bovines. Transboundary and Emerging Diseases, 2018, 65(2): 338-344.
[17] LIU W, SHAO J J, ZHANG G L, CHANG Y Y, GE S D, SUN Y, GAO Z, CHANG H Y. Development of an indirect chemiluminescence immunoassay using a multiepitope recombinant protein to specifically detect antibodies against foot-and-mouth disease virus serotype O in swine. Journal of Clinical Microbiology, 2021, 59(3): e02464-e02420.
[18] 孫雨, 宋曉暉, 肖穎, 王睿男, 李秀梅, 任雪建, 李雪剛, 魏巍, 楊林, 王傳彬. O型口蹄疫病毒抗體化學發光免疫分析檢測方法的建立. 中國草食動物科學, 2020, 40(3): 47-52.
SUN Y, SONG X H, XIAO Y, WANG R N, LI X M, REN X J, LI X G, WEI W, YANG L, WANG C B. Establishment of chemiluminescent immunoassay for detection of type O FMDV virus antibody. China Herbivore Science, 2020, 40(3): 47-52. (in Chinese)
[19] 孫雨, 宋曉暉, 王睿男, 李秀梅, 肖穎, 任雪建, 李曉霞, 魏巍, 楊林, 王傳彬. A型口蹄疫病毒抗體化學發光免疫分析檢測方法的建立. 動物醫學進展, 2020, 41(8): 29-36.
SUN Y, SONG X H, WANG R N, LI X M, XIAO Y, REN X J, LI X X, WEI W, YANG L, WANG C B. Establishment of chemiluminescent immunoassay for detection of type A FMDV antibody. Progress in Veterinary Medicine, 2020, 41(8): 29-36. (in Chinese)
[20] 趙協, 安利民, 高沙沙, 張玉, 喬飛. 化學發光免疫分析技術在動物疫病檢測中的應用. 中國動物檢疫, 2020, 37(8): 82-87.
ZHAO X, AN L M, GAO S S, ZHANG Y, QIAO F. Application of chemiluminescence immunoassay in detection of animal diseases. China Animal Health Inspection, 2020, 37(8): 82-87. (in Chinese)
[21] WANG C, WU J, ZONG C, XU J, JU H X. Chemiluminescent immunoassay and its applications. Chinese Journal of Analytical Chemistry, 2012, 40(1): 3-10.
[22] LIU Z Z, ZHAO F R, GAO S D, SHAO J J, CHANG H Y. The applications of gold nanoparticle-initialed chemiluminescence in biomedical detection. Nanoscale Research Letters, 2016, 11(1): 460.
[23] WANG Y, DZAKAH E E, KANG Y, CAI Y X, WU P D, TANG B, LI R, HE X W. A sensitive and rapid chemiluminescence immunoassay for point-of-care testing (POCT) of copeptin in serum based on high-affinity monoclonal antibodies via cytokine-assisted immunization. International Journal of Nanomedicine, 2019, 14: 4293-4307.
[24] HUANG E Q, HUANG D Z, WANG Y, CAI D Y, LUO Y Z, ZHONG Z M, LIU D Y. Active droplet-array microfluidics-based chemiluminescence immunoassay for point-of-care detection of procalcitonin. Biosensors and Bioelectronics, 2022, 195: 113684.
[25] ROSI N L, MIRKIN C A. Nanostructures in biodiagnostics. Chemical Reviews, 2005, 105(4): 1547-1562.
[26] XIE G, ZHU M, LIU Z J, ZHANG B, SHI M J, WANG S. Development and evaluation of the magnetic particle-based chemiluminescence immunoassay for rapid and quantitative detection of Aflatoxin B1 in foodstuff. Food and Agricultural Immunology, 2018, 29(1): 564-576.
[27] LIU X Y, WAN X H, LU S, ZHANG L J, YU S H, LU X X. Evaluation of a magnetic particles-based chemiluminescence enzyme immunoassay for Golgi protein 73 in human serum. Clinica Chimica Acta; International Journal of Clinical Chemistry, 2015, 445: 54-59.
[28] BASILICATA P, PIERI M, SIMONELLI A, FAILLACE D, NIOLA M, GRAZIANO V. Application of a chemiluminescence immunoassay system and GC/MS for toxicological investigations on skeletonized human remains. Forensic Science International, 2019, 300: 120-124.
[29] NAKANO Y, KURANO M, MORITA Y, SHIMURA T, YOKOYAMA R, QIAN C G, XIA F Z, HE F, KISHI Y, OKADA J, YOSHIKAWA N, NAGURA Y, OKAZAKI H, MORIYA K, SETO Y, KODAMA T, YATOMI Y. Time course of the sensitivity and specificity of anti- SARS-CoV-2 IgM and IgG antibodies for symptomatic COVID-19 in Japan. Scientific Reports, 2021, 11(1): 2776.
[30] FU H J, YUAN L P, SHEN Y D, LIU Y X, LIU B, ZHANG S W, XIE Z X, LEI H T, SUN Y M, XU Z L. A full-automated magnetic particle-based chemiluminescence immunoassay for rapid detection of cortisol in milk. Analytica Chimica Acta, 2018, 1035: 129-135.
[31] SHI Z W, CAO L Y, LUO J C, ZHOU G J, ZUO Q S, LIU X T, HU Y H, TIAN H, ZHENG H X. A chemiluminescent magnetic microparticle immunoassay for the detection of antibody against African swine fever virus. Applied Microbiology and Biotechnology, 2023, 107(11): 3779-3788.
Development of a Full-Automated Magnetic Particle ChemiluminescenceImmunoassay Assay for Quantitative Detection of Antibodies Against Foot and Mouth Disease Virus Serotype O

1Lanzhou Shouyan Biotechnology Co.,Ltd, Lanzhou 730046;2Key Laboratory of Veterinary Etiological Biology/National Foot-and Mouth Disease Reference Laboratory/Lanzhou Veterinary Research Institute, Chinese Academy of Agricultural Sciences, Lanzhou 730046
【Background】Foot-and-mouth disease (FMD) is an acute, febrile and virulent infectious disease caused by foot-and-mouth disease virus (FMDV), and vaccination is an effective measure to prevent the spread of FMD. The level of immune antibody monitoring is an important basis of evaluating the effectiveness of vaccine immunization, and developing immunization procedures. It is an indispensable step in the prevention and control of FMD. Therefore, to establish an efficient, rapid and fully automated antibody detection method is of great significance. 【Objective】The aim of this study was to establish a novel, fully-automatic and quantitative antibody detection method for FMD virus type O based on the chemiluminescence immunoassay (CLIA) technology of magnetic particles (MMPs), in order to provide the technical support for the immunization monitoring of FMD and epidemic prevention and control.【Method】In this study, the magnetic nanoparticles were used for solid-phase carriers and separation carriers to encapsulate the captured antibody, the detection antibodies was labelled by using alkaline phosphatase (ALP), and AMPPD was used for the luminescent substrate. Finally, a new magnetic particle Chemiluminescence CLIA method (MP-CLIA) was established after optimization of conditions. In this method, firstly, the magnetic particle-polyclonal antibodies (MPs-pAbs), the samples to be tested, and the antigen of FMDV type O were added to a reaction system and incubated at 37℃, then the appropriate amount of enzyme-labeled antibodies (ALP-pAbs) was added and incubated at 37 ℃, finally, the chemiluminescence substrate AMPPD was added to detect the relative light unit (RLU). In this study, a standard curve was fitted by testing the standards, and thereceiver operating characteristic (ROC) curve was applied to determine the determination criteria of the assay. the quality control samples were utilized for methodological evaluation, and the field samples were also tested and compared with the liquid phase blocking ELISA (LPB-ELISA) to validate the assay results. 【Result】The optimized reaction conditions were 0.25 mg·mL-1of magnetic particles, 1:1 000 dilution of FMD O antigen, 1:2 000 dilution of enzyme-labeled antibody, and 20 μL of spiked sample volume. The entire detection process was completed in a fully automated chemiluminescence immunoassay analysis apparatus, with a reaction time of 20 min, The quantitative detection could be conducted within the range of antibody content of 0-1 280 U (potency of 0-1:2 048), and the standard curve2>0.99. The sensitivity of assay was 94.66%, the specificity was 97.10%, and there was no cross reactivity with the antibodies of six different pathogens which include SVV, PPRSV, BEFV, PCV2, QRFV, and PPRV. The repeatability of the assay showed the coefficient of variation less than 10%. The detection of field samples demonstrated the accordance rate was 94.69% between CLIA and LPB-ELISA, and the result of quantitative detection showed a correlation (2=0.8473,<0.0001) during two method. 【Conclusion】 The established MP-CLIA method was time-consuming, easy to operate, and could be fully automated by matching with the domestic automatic chemiluminescence instrument, which was a new and highly efficient method for the quantitative detection of antibody to FMD virus type O, and had a high value for clinical application.
magnetic particle chemiluminescence immunoassay (MP-CLIA); foot and mouth disease (FMD); micromagnetic particles; fully-automated

2023-07-10;
2023-11-03
中央引導地方科技發展資金項目(23ZYQA295)
包艷芳,E-mail:13919159893@163.com。通信作者林密,E-mail:linmi@caas.cn
(責任編輯 林鑒非)

