CD4+T細胞亞型及其相關炎性因子在NE-FE-COPD患者中的表達及意義*
楊春曉,葉 婷,余維巍△
(華中科技大學同濟醫學院附屬同濟醫院:1.老年醫學科;2.臨床營養科,武漢430030)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是以肺部氣流受限為主要表現的慢性不可逆呼吸系統疾病[1]。頻繁急性加重(frequent exacerbator,FE)型是COPD中最常見的表型之一,患者生活質量較差,社會經濟負擔重[2]。按主要致炎細胞不同,可將其分為中性粒細胞優勢型頻繁急性加重型(NE-FE-COPD)和嗜酸性粒細胞優勢型頻繁急性加重型(Eos-FE-COPD)[3-4]。Eos-FE-COPD患者激素治療效果較好[5-6]。NE-FE-COPD患者誘導痰及支氣管肺泡灌洗液(bronchoalvoelarlavagefluid,BALF)的中性粒細胞所占比例明顯增加,氣道及全身炎性因子表達升高,對激素治療不敏感且患者臨床治療效果較差[7-8],急需進一步了解其發病機制以尋求新的治療手段。
CD4+T細胞是參與COPD發生、發展的主要免疫細胞之一[9]。連續刺激的T細胞歸巢受體及共刺激分子CD28表達降低,從而形成CD4+CD28nullT細胞,是一種代表細胞免疫功能老化的表型。CD4+CD28nullT細胞受刺激后重復增殖,生成大量炎性因子如白細胞介素(interleukin,IL)-1β、γ-干擾素(interferon-γ,IFN-γ)、腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α),伴隨細胞毒性分子穿孔素和顆粒酶B的蛋白表達升高,形成COPD炎癥微環境[9]。本研究旨在通過研究CD4+T細胞亞型及相關炎性因子在不同表型COPD患者中的表達,探討其作用機制。
1 資料與方法
1.1 一般資料
選取2019年3月至2021年3月于本院接受治療的COPD患者為研究對象,收集受試者的詳細臨床病史,采用標準肺功能檢測方法對其進行綜合肺功能測試。根據慢性阻塞性肺疾病全球倡議(global initiative for chronic obstructive lung disease,GOLD)2021的診斷標準,按病史將COPD患者分為FE-COPD組(n=28)和非頻繁急性加重型組(IE-COPD組,n=11)。FE-COPD組為每年至少要經歷2次或以上急性加重,需補充抗生素和/或全身性類固醇治療或住院治療,且每次急性加重在前次疾病治療穩定后至少4周再出現;未達到上述要求患者納入IE-COPD組。依據誘導痰嗜酸性粒細胞、中性粒細胞的比例,以及IL-1β、IL-4、IL-5、TNF-α水平,將FE型再分為嗜酸性粒細胞優勢組(Eos-FE-COPD組,n=13)與中性粒細胞優勢組(NE-FE-COPD組,n=15)[7-8],鑒于IE型患者病情穩定,GOLD多年來治療建議沒有變化,故本文不再做細胞亞型分組。COPD納入標準:(1)40~80歲;(2)吸煙史>10包/年;(3)第1秒用力呼氣容積占預測值百分比(FEV1/pred%)和用力肺活量(FVC)的比值≤70%;(4)入組前至少4周無急性發作。排除標準:(1)其他呼吸系統疾病,如發作性氣胸、肺栓塞、哮喘、肺纖維化及中心型肺癌等;(2)其他慢性疾病,如心功能不全、類風濕性關節炎、慢性結腸炎等;(3)既往3個月內中風、短暫性腦缺血發作、急性冠狀動脈綜合征等;(4)哺乳期、妊娠期或計劃妊娠;(5)過去12個月內有肺切除手術史,或其他可能影響肺功能檢查結果的手術史;(6)未治愈的惡性腫瘤及酗酒、藥物成癮;(7)有精神病史、智力問題等不能配合本研究的相關檢查;(8)不能糾正的出血傾向、多發肺大皰、一般狀況極差不能耐受支氣管鏡檢查。對照組(CTRL組,n=9)為肺功能正常及吸煙史>10包/年者。本研究獲得醫院倫理委員會批準(2019PS342K),患者及家屬簽署知情同意書。各組受試者臨床基線資料見表1。

表1 各組受試者的臨床基線資料比較
1.2 方法
1.2.1標本采集
入組24 h內用100 mL生理鹽水對所有受試者行支氣管鏡肺泡灌洗術,負壓回收量>40%定義為回收成功,Ficoll密度梯度離心及貼壁法原代分離BALF的單核細胞。
1.2.2流式細胞術檢測CD4+T細胞亞群表達
應用流式細胞儀(美國BD公司,FACSCantoTMⅡ)檢測患者BALF標本CD4+CD28+T細胞、CD4+CD28nullT細胞占比,分析CD4+T細胞亞群比例和不同表型COPD的相關性。實驗方法和步驟:(1)細胞懸液采用熒光素異硫氰酸酯(FITC)標記的抗CD4和/或電子偶合染料(ECD)標記的抗CD28染色30 min;(2)細胞清洗后取單細胞懸液(1~2)×105個細胞于10 mL PBS中,置于流式細胞儀,分別對CD4+CD28nullT細胞及總CD4+T細胞的數量進行檢測。CD4+CD28nullT細胞占比=CD4+CD28nullT細胞數/總CD4+T細胞數×100%。
1.2.3ELISA檢測炎性因子水平
采用ELISA檢測BALF中IL-1β、IL-2、IL-6、IL-8和TNF-α水平,試劑盒購自武漢云克隆科技有限公司,操作步驟按照說明書執行。
1.2.4細胞共培養
向熒光示蹤分子CFSE所標記的人氣道上皮細胞(hAECs)分別添加CD4+CD28nullT細胞和CD4+CD28+T細胞,分為CD4+CD28+T細胞+hAECs組(Control組)和CD4+CD28nullT細胞+hAECs組(co-culture組),共培養72 h后采樣。
1.2.5免疫熒光染色
CD4+CD28nullT細胞和CD4+CD28+T細胞對上皮細胞刺激72 h,甲醇-丙酮混合液(50∶50)將上皮細胞固定,0.3%(體積分數)Triton X-100通透,5%(質量分數)脫脂奶粉密封。部分細胞用Alexa Fluor 488 標記anti-occludin抗體(1∶100,美國Invitrogen公司)直接染色,部分細胞用anti-ZO-1抗體(1∶200,美國Invitrogen公司)孵育過夜后,加入Alexa 488標記的二抗。DAPI復染封片后在激光共聚焦顯微鏡(日本Olympus公司,IX81)下進行觀察。
1.2.6Western blot檢測ZO-1、occludin蛋白表達水平
提取細胞,添加蛋白裂解液及蛋白酶抑制劑使細胞完全裂解,放入冰上靜置30 min析出組織或細胞碎片,12 000 r/min 4 ℃離心30 min,取上清液,BCA法定量蛋白,將含β-巰基乙醇緩沖液以1∶3的量加入蛋白上清液內,在100 ℃水浴鍋內加熱變性5 min。制備10%十二烷基硫酸鈉-聚丙烯酰胺分離膠和濃縮膠,添加6 μL蛋白樣品和蛋白marker電泳分離蛋白條帶。當電泳完成時,在300 mA恒流中進行轉模,在常溫下將脫脂牛奶密封2 h,TBST洗膜3次,每次5 min。加入稀釋后的一抗ZO-1(1∶1 000)、occludin-1(1∶1 000)、GAPDH(1∶1 000),于4 ℃搖床孵育過夜。TBST溶液洗滌3次,每次5 min,放入HRP標記山羊抗兔二抗(1∶5 000)常溫振蕩1 h后,再將TBST溶液洗滌3次,每次5 min。最后將ECL發光液均勻滴加到凝膠成像儀上,曝光拍照。利用ImageJ軟件實現蛋白的灰度掃描及相對定量分析,每個樣品試驗重復3次。
1.2.7RT-qPCR檢測ZO-1、occludin mRNA表達水平
使用TRIzol提取劑(美國Invitrogen公司)提取細胞并分離總RNA。使用相同數量的RNA和Roche第一鏈cDNA合成試劑盒(美國Roche公司)進行cDNA合成;采用Bio-Rad CFX96 熒光定量PCR儀,SYBR Green PCR Master Mix進行RT-qPCR檢測;管家基因GAPDH歸一化mRNA的相對水平。引物序列:ZO-1正向引物為5′-AGC GAA AAC CCG AAA CTG ATG-3′,反向引物為5′-TGA TAC TGA GTT GCC TTC ACC CT-3′;occludin正向引物為5′-ATA ATG GGA GTG AAC CCG ACG-3′,反向引物為5′-CCA CGA TAA TCA TGA ACC CCA-3′;GAPDH正向引物為5′-TCA ACG ACC ACT TTG TCA AGC TCA-3′,反向引物為5′-GCT GGT GGT CCA GGG GTC TTA CT-3′。
1.3 統計學處理
2 結 果
2.1 各組CD4+CD28nullT細胞占比情況
與CTRL組比較,IE-COPD組CD4+CD28nullT細胞占比明顯升高(P<0.05);Eos-FE-COPD組、NE-FE-COPD組CD4+CD28nullT細胞占比較IE-COPD組明顯升高(P<0.05);NE-FE-COPD組CD4+CD28nullT細胞占比較Eos-FE-COPD組明顯升高(P<0.05),見圖1。

a:P<0.05,與CTRL組比較;b:P<0.05,與IE-COPD組比較;c:P<0.05,與Eos-FE-COPD組比較。
2.2 各組炎性因子水平比較
與CTRL組、IE-COPD組比較,Eos-FE-COPD組、NE-FE-COPD組IL-1β水平明顯升高(P<0.05);NE-FE-COPD組IL-1β水平高于Eos-FE-COPD組(P<0.05)。與CTRL組比較,Eos-FE-COPD組IL-2水平升高,IE-COPD組、Eos-FE-COPD組、NE-FE-COPD組IL-6水平升高,NE-FE-COPD組IL-8水平升高,Eos-FE-COPD組、NE-FE-COPD組TNF-α水平升高,差異有統計學意義(P<0.05),見表2。
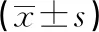
表2 不同表型COPD的炎性因子水平比較
2.3 CD4+CD28nullT細胞占比及炎性因子水平與肺功能、急性加重頻率的相關性分析
CD4+CD28nullT細胞占比、IL-1β水平與肺功能呈負相關(P<0.05),與急性加重頻率呈正相關(P<0.05);IL-2、IL-6、IL-8、TNF-α水平與肺功能和急性加重頻率無相關性(P>0.05),見表3、4。

表3 各指標與肺功能的相關性分析

表4 各指標與COPD急性加重頻率的相關性分析
2.4 CD4+CD28nullT細胞對hAECs的影響
與Control組比較,co-culture組hAECs緊密連接受損,ZO-1和occludin mRNA及蛋白表達水平降低,差異有統計學意義(P<0.05),見圖2。
3 討 論
COPD是一種異質性疾病[10],最常見的表型有慢性支氣管炎、肺氣腫、FE及哮喘-COPD重疊綜合征等[11]。有研究顯示,與IE-COPD比較,FE-COPD患者體重指數、血清蛋白水平偏低,圣喬治呼吸問卷評分偏高,氣流受限嚴重,殘氣量/肺總通氣量比值和肺氣腫指數偏高[12],患者生活質量差,社會經濟負擔重,因此FE在COPD表型中值得特別關注[2]。對于不同表型COPD發病機制的認識不足,是導致目前治療手段仍匱乏的根本原因。
炎癥細胞及炎性因子“交互作用”一直是COPD研究的重點。以往研究發現:NE-FE-COPD患者血清、肺組織、痰及BALF中IL-1α、IL-1β mRNA及蛋白表達水平高于健康人[13-15]。IL-1β水平的升高與FE-COPD患者NOD樣受體蛋白3(NOD-like receptor protein 3,NLRP3)炎癥小體激活,以及中性粒細胞的活性密切相關[16]。IL-1β水平的高低有助于鑒別COPD表型,IL-1β與COPD急性加重頻率、中性粒細胞和C反應蛋白(CRP)呈正相關[17],提示IL-1β可以預測COPD患者的系統炎癥水平,與后續的頻發急性加重相關。氣道分泌物中的中性粒細胞增多和IL-1β水平升高是NE-FE-COPD患者的標志性特征[18]。本研究也發現COPD患者BALF中IL-1β水平升高,且NE-FE-COPD組中IL-1β水平高于Eos-FE-COPD組和IE-COPD組,進一步驗證了IL-1β與NE-FE-COPD相關。盡管大量臨床及動物研究證實IL-1β在COPD中的重要作用,但目前并未有基于IL-1β的臨床治療方法,但基于IL-1β的藥物研發并未停止,最具代表性的臨床藥物研究是人源單克隆IL-1R抗體MEDI8968在COPD中的Ⅱ期臨床試驗[19]。該試驗組織了324例受試者參與雙盲安慰劑對照,研究結果顯示:MEDI8968暫不能減少中重度非特異性COPD患者急性加重的頻率和改善患者肺功能。但是以上臨床試驗剔除規模不充分這一因素后進一步分析表明:(1)COPD作為一種異質性疾病,其病理過程異常復雜,有必要按照不同表型分組并制訂有針對性的研究方案。MEDI8968能明顯降低中性粒細胞、CRP和纖維蛋白原水平,并能幫助改善FE患者的肺功能,主要表現在血常規中性粒細胞增高的患者中,故中性粒細胞基線水平較高者服用IL-1R抗體MEDI8968可使患者受益。MEDI8968初始試驗中沒有將COPD患者按照血常規中的細胞類型進行分組研究,這可能是IL-1R抗體無效的一個原因。(2)MEDI8968對IL-1β、IL-1α有聯合阻斷作用,而后者對COPD亦有一定影響,采用以IL-1β或者IL-1α為靶標的特異性拮抗劑進行輔助治療或許更能理清IL-1β、IL-1α在COPD中的不同作用機制。(3)臨床治療時不能判斷MEDI8968是否在肺組織內達到了適宜的血藥濃度也會成為限制臨床療效的一個關鍵因素。因此有必要對IL-1β在不同表型COPD中的作用機制做進一步深入研究,以尋找更適宜的NE-FE-COPD生物學標志物并開發相應的靶向治療方法,從而達到精準醫療的目的。
本研究發現與CTRL組、IE-COPD組、Eos-FE-COPD組比較,NE-FE-COPD組BALF中CD4+CD28nullT細胞占比較高。同時,將CD4+CD28nullT細胞和hAECs共培養72 h后,hAECs緊密連接受到嚴重損傷,說明CD4+CD28nullT細胞可能通過引起氣道上皮細胞的損傷而參與NE-FE-COPD病理生理過程。CD4+CD28nullT細胞是否通過促進hAECs中IL-1β水平而影響上皮細胞緊密連接尚需要進一步研究。
綜上所述,NE-FE-COPD患者BALF中CD4+CD28nullT細胞占比較高,CD4+CD28nullT細胞可能通過促進氣道上皮細胞的損傷導致NE-FE-COPD病理進展加快。

