卵巢癌順鉑耐藥轉錄組學分析和拮抗劑篩選的研究*
王曉曉,杜佳慧,李莉蓉 ,郭偉強,劉松柏△
(1.蘇州衛生職業技術學院蘇州檢驗醫學生物技術重點實驗室,江蘇蘇州 215009;2.蘇州科技大學,江蘇蘇州 215009)
卵巢癌是女性生殖系統常見的惡性腫瘤之一[1],在所有婦科惡性腫瘤中,卵巢癌的發病率僅次于宮頸癌和子宮內膜癌,但死亡率居第1位[2]。由于早期卵巢癌患者沒有或只有很少的特定癥狀,同時缺乏有效的篩查方法,70%以上的卵巢癌患者在晚期(Ⅲ、Ⅳ期)才被診斷出來[3-4]。手術聯合化療是目前治療卵巢癌的主要方法,但由于耐藥和復發率較高,導致患者的生存率很低,2007—2013年Ⅲ、Ⅳ期卵巢癌患者的5年生存率分別為42%和26%[5-6]。因此,研究卵巢癌新的替代治療策略勢在必行。
鉑類化療藥是臨床上最常用的化療藥物,共分為3代。順鉑(DDP)作為第一代鉑類化療藥,它可以用于多種癌癥的治療,如睪丸癌、卵巢癌、膀胱癌、肺癌、宮頸癌、頭頸部癌癥、胃癌等[7-9]。DDP主要通過與DNA合成DNA-鉑加合物誘導DNA損傷反應來殺死腫瘤細胞[7]。以DDP為基礎的化療在卵巢癌的早期治療中效果很好,然而耐藥是卵巢癌化療中最常見的現象之一[8-9]。針對DDP耐藥,目前臨床多應用DDP聯合其他化療藥物治療,成功降低了藥物毒性和腫瘤的耐藥性。臨床研究表明,在DDP治療各種腫瘤的基礎上加入5-氟尿嘧啶、紫杉醇、吉西他濱、阿霉素等都可獲得良好的療效并減少不良反應[10-12],但仍需要更多的研究來提高抗癌活性,降低毒性和交叉耐藥性或改善藥理特性。因此,了解卵巢癌DDP耐藥的發生機制及尋找拮抗DDP耐藥的新療法或新藥物成為卵巢癌治療研究的熱點和重點之一。
轉錄組是特定細胞在某一功能狀態下所能轉錄出來的所有RNA的總和,包括編碼的mRNA和非編碼RNA。轉錄組測序是基于Illumina測序平臺,研究特定組織或細胞在某個時期轉錄出來的所有mRNA,轉錄組研究是基因功能及結構研究的基礎和出發點,通過新一代高通量測序,能夠全面快速地獲得某一物種特定組織或器官在某一狀態下的幾乎所有轉錄本序列信息,已廣泛應用于基礎研究、臨床診斷和藥物研發等領域。有研究表明,細胞外基質(ECM)不僅在調節細胞黏附、形態和運動方面發揮關鍵作用,而且還介導腫瘤的發生、進展和轉移擴散[13],“ECM-受體相互作用通路”“PI3K/Akt信號通路”和“細胞黏附分子(CAMs)”通路與細胞行為相關,并可能在調節細胞遷移和死亡中發揮核心作用,且在這幾條通路中的整合素亞基基因家族(ITG)在腫瘤進展和癌癥治療中發揮重要作用[14-15]。本研究旨在探討卵巢癌DDP耐藥的分子機制,并尋找克服卵巢癌耐藥的新策略及DDP耐藥的新方向,現報道如下。
1 材料與方法
1.1 材料
卵巢癌細胞系A2780購自北納生物科技公司;1640培養基購自美國Gibco公司;胎牛血清購自德國SERANA公司;胰酶和雙抗均購自美國Hyclone公司;質粒提取試劑盒購自天根生化科技(北京)有限公司;逆轉錄和實時熒光定量PCR(qPCR)試劑盒購自日本Takara公司;引物由金斯瑞生物科技股份有限公司合成;單克隆抗體購自英國Abcam公司;山羊抗小鼠及山羊抗兔抗體購自上海碧云天生物有限公司;OTS964、CPT、AZD7648、雷公藤內酯醇(TPL)及奧拉帕尼等小分子抑制劑購自上海陶術生物科技有限公司。
1.2 方法
1.2.1細胞培養及耐藥細胞構建
用不同濃度的DDP刺激A2780,在培養箱中培養48 h后換不含藥培養基繼續培養,待達到對數生長期后重復劑量誘導,誘導劑量為0.2~64.0 μg/mL,最終獲得DDP耐藥細胞A2780-DDP,誘導成功后,需在培養基中添加1.0 μg/mL的DDP以維持其耐藥性。A2780和A2780-DDP均使用含有10%胎牛血清、100 U/mL青霉素和100 μg/mL鏈霉素的1640培養基,并在37 ℃,5% CO2培養箱中培養。
1.2.2CCK-8細胞活力檢測
細胞增殖能力及藥物敏感性使用CCK-8試劑進行檢測,將A2780和A2780-DDP按照5 000/孔的密度接種到96孔板中,24 h后在培養基中加入不同濃度的DDP,72 h后每孔加入10 μL CCK-8試劑,2 h后使用酶標儀檢測450 nm處吸光度,繪制細胞生長抑制曲線,并計算半抑制濃度(IC50)值。按上述方法將細胞接種到96孔板中,使用CCK-8試劑分別檢測0、24、48、72、96 h的細胞活力,并繪制細胞增殖曲線。
1.2.3細胞劃痕實驗
細胞遷移能力通過劃痕實驗進行驗證,分別將A2780和A2780-DDP按照1.0×107個每孔的密度接種到6孔板中,培養至細胞密度80%,用200 μL的移液器吸頭做劃痕,磷酸鹽緩沖液清洗細胞并拍照;24 h后再次拍照,測量劃痕的距離,與0 h進行比較,驗證細胞的遷移能力。
1.2.4細胞遷移和侵襲能力檢測
使用Transwell小室(Costar)檢測細胞遷移和侵襲能力,胰酶消化細胞,800 r/min離心3 min后用磷酸鹽緩沖液洗1遍,再次離心后,用無血清培養基重懸,吹散混勻并計數,將細胞密度稀釋至50萬/mL;在24孔Transwell板中加入500 μL含10%血清的正常培養基,放入小室,加入200 μL無血清培養基稀釋好的細胞懸液。24 h后取出小室,吸去上層培養液并用棉簽輕輕擦拭除去上層細胞,加入磷酸鹽緩沖液洗1遍,加入時注意不要碰到膜。然后用0.1%的結晶紫染色液染色10 min,吸棄染色液,磷酸鹽緩沖液清洗3次,用鑷子小心揭下膜,吸干殘留液體并晾干后轉移至載玻片上,用中性樹膠封片,顯微鏡拍照并計數,比較細胞遷移和侵襲能力。
1.2.5RNA-Seq分析
分別收集A2780和A2780-DDP進行了轉錄組學測序,將A2780作為對照對象,A2780-DDP作為實驗對象,各重復3次。對測序結果原始圖像數據利用軟件Bcl2fastq(v2.17.1.14)進行圖像堿基識別和初步質量分析后得到原始測序數據。對測序數據進行參考序列比對分析,可變剪切分析,新轉錄本預測及SNV和InDel分析,并通過Htseq軟件計算基因表達水平,該軟件采用RSEM軟件計算基因表達水平,衡量基因表達水平的標準為FPKM值,通過所有基因的FPKM的分布圖及盒形圖對不同實驗條件下的基因表達水平進行比較。對檢測的結果按照差異顯著性標準進行篩選,即差異基因表達變化2倍以上且q值[錯誤發現率(FDR)/校正后的P值(Padj)]統計基因顯著性差異表達上下調情況。最后,通過差異基因GO富集分析和KEGG富集分析對差異表達基因進行聚類分析。
1.2.6qPCR
根據高通量測序結果,篩選出6個預測有表達差異的基因,利用Primer premier5.0軟件進行引物設計,并經上海生工生物工程技術服務有限公司進行合成。采用SYBR GreenⅠ法進行qPCR,驗證轉錄組測序結果的準確性。以逆轉錄產物cDNA為模板,嚴格按照羅氏qPCR試劑盒說明書進行實驗操作。每個模板設置3個重復,每個基因設置3個陰性對照,總反應體系為20 μL,反應條件是95 ℃,15 s;57 ℃,30 s;72 ℃,30 s;40個循環。
1.2.7Western blot
從標本中提取蛋白質并用BCA蛋白試劑盒測定蛋白濃度,然后通過十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳分離蛋白并轉移至聚偏二氟乙烯(PVDF)膜上,再用5%的脫脂奶粉封閉,一抗孵育4 ℃過夜,用PBST洗滌膜3次,并與辣根過氧化物酶標記的二抗在室溫下孵育1 h。然后將PVDF膜在PBST中再次洗滌并使用增強化學發光試劑盒顯影,顯影結果用ImageJ軟件進行條帶定量分析。
1.3 統計學處理
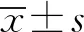
2 結 果
2.1 A2780-DDP細胞株的構建
通過藥物濃度遞增的方法成功構建了耐藥細胞株A2780-DDP。CCK-8結果發現,隨著DDP濃度的增加,A2780的生長受到抑制,而A2780-DDP則表現出明顯的耐藥性,且使用實時細胞分析儀器檢測發現A2780和A2780-DDP的細胞增殖無差異,見圖1。

A:CCK-8檢測細胞耐藥性;B:RTCA方法檢測A2780和A2780-DDP細胞增殖及耐藥性差異。
2.2 耐藥細胞遷移和侵襲能力提高
細胞劃痕和Transwell實驗結果顯示,與A2780比較,A2780-DDP的細胞遷移和侵襲能力明顯提高,見圖2。

A:Transwell實驗檢測細胞侵襲能力,結晶紫染色觀察;B:劃痕實驗檢測細胞遷移能力,100×;a:P<0.05。
2.3 ITGB7/Akt通路在耐藥細胞中存在著高表達和高活性
通過差異基因表達分析,選取了IGF1R、PIK3CG、PDGFRA 3個表達降低的基因及PDGFC、ITGB7、ITGA8 3個表達升高的基因進一步分析驗證。通過設計合成定量PCR引物(表1),qPCR結果與RNA-Seq分析結果一致,A2780-DDP的ITGB7表達水平明顯高于A2780;Western blot結果顯示,與A2780比較,A2780-DDP的p-Akt蛋白表達水平升高,見圖3。

表1 定量PCR引物序列

A:qPCR檢測相關基因的表達水平;B:Western blot檢測Akt和p-Akt蛋白的表達。
2.4 TPL等小分子藥物可以有效拮抗DDP耐藥
為找尋潛在DDP拮抗劑,通過文獻查閱及CCK-8驗證,發現TPL、奧拉帕尼等抑制劑對A2780-DDP具有較好的抑制效果,其中TPL的拮抗效果尤為明顯,A2780-DDP的IC50約為0.17 μmol/L,與A2780差異明顯,具有繼續研究的價值,見圖4。

A:5-氟尿嘧啶對細胞活力的影響;B:OTS964對細胞活力的影響;C:CPT對細胞活力的影響;D:AZD7648對細胞活力的影響;E:TPL對細胞活力的影響;F:奧拉帕尼對細胞活力的影響。
3 討 論
DDP耐藥是卵巢癌化學治療中的常見阻礙之一,嚴重影響患者的治療效果。因此,深入討論卵巢癌DDP耐藥的產生機制和關鍵因素,具有重要意義和價值。本研究基于轉錄組學方法,首次發現ITGB7/Akt通路在DDP耐藥中存在高表達、高活性,并篩選出TPL等潛在的DDP耐藥拮抗劑。
ITGB7/Akt在腫瘤的發生、發展等多個過程中發揮調控作用。ITGB7是整合素超家族的成員,主要與細胞黏附功能相關。整合素家族是ECM分子(如膠原蛋白Ⅳ)中的主要細胞表面受體。細胞膜上的整合素受體與ECM相互作用,傳遞信號以控制細胞生長、代謝、遷移、增殖、分化和其他行為和功能[10]。據報道,整合素的失調與癌癥的發生和進展密切相關,可以用作癌癥治療的靶點[11-12]。整合素亞基基因(ITG)包含一系列α(ITGA1、ITGA10、ITGA11、ITGA2、ITGA2B、ITGA3、ITGA4、ITGA5、ITGA6、ITGA7、ITGA8、ITGA9、ITGAD、ITGAE、ITGAL、ITGAM、ITGAV和ITGAX)和β(ITGB1、ITGB1BP1、ITGB1BP2、ITGB2、ITGB3、ITGB3BP、ITGB4、ITGB5、ITGB6、ITGB7、ITGB8和ITGBL1)基因。有研究表明,一些ITG基因與表觀遺傳變化相關,并在腫瘤進展和腫瘤治療中發揮重要作用[16-19]。ITGB7在各種癌癥中廣泛表達,如胃癌和結腸癌,且可以通過維持抗腫瘤免疫來抑制結直腸癌發病[20]。
Akt是細胞中一個經典的信號通路,在細胞生存當中發揮著重要作用,在原發性乳腺癌中發現Akt信號通路被激活[21-23]。已經發現抑制Akt可能導致卵巢癌細胞生長停滯,這表明Akt在卵巢腫瘤的發展中發揮了作用[23-24]。本研究的Western blot結果證實,ITGB7的蛋白水平和p-Akt水平在DDP耐藥細胞中明顯提高,這表明ITGB7和Akt可能是DDP耐藥發生的關鍵因素和可能的檢測標志物,更為后續基于ITGB7/Akt通路的DDP耐藥拮抗劑的開發和臨床研究提供了重要數據支持。
針對DDP耐藥,目前臨床多應用DDP聯合藥物治療成功地降低了藥物毒性和腫瘤的耐藥性。臨床研究表明,在DDP治療各種腫瘤的基礎上加入5-氟尿嘧啶、紫杉醇、吉西他濱、阿霉素等都可獲得良好的療效或減少不良反應[25],需要更多的研究來提高抗癌活性,降低毒性和交叉耐藥性或改善藥理特性。為此,本研究基于CCK-8檢測,篩選發現TPL、奧拉帕尼等對DDP耐藥具有較好的抑制效果,但其拮抗機制仍有待進一步分析。
綜上所述,本研究通過構建DDP耐藥卵巢癌細胞株探討了耐藥后細胞轉錄組學的差異,并進行小分子藥物篩選,為尋找DDP耐藥的發生機制及治療耐藥的新方法。

