自身免疫疾病應用腫瘤壞死因子-α抑制劑后并發結核病33例臨床特征分析
譚毅剛 鄺浩斌 傅紅梅 李春燕 趙小冰 薛麗京
廣州市胸科醫院(廣州 510095)
隨著因自身免疫疾病應用生物制劑腫瘤壞死因子-α(Tumor necrosis factor-alpha (TNF-α))抑制劑治療免疫性疾病患者越來越普及,并發結核病患者近年逐漸多見,據相關報道[1]應用TNF-α 抑制劑后患者與一般人群相比,其結核病發病率增加18 倍,顯著增加了該人群中結核病的發病率。SARTORI 等[2]納入全球52項研究,發現接受TNF-α抑制劑治療風濕病患者的結核病發病率為9.62/1 000,與北美洲與歐洲相比,南美洲和亞洲的結核病發病率更高,分別為11.75/1 000 和13.47/1 000,非洲南非地區的發病率也達到12.4/1 000[3]。此類患者發病的臨床特征及診治過程多以個案報道為主,少見總結性分析報道,為進一步探討自身免疫疾病應用TNF-α 抑制劑后并發結核病患者的臨床特征,本文對廣州市胸科醫院2019 年1 月至2023 年3 月收治的33 例自身免疫疾病應用TNF-α抑制劑后發生結核病患者的臨床資料進行了回顧性分析及總結。
1 資料與方法
1.1 研究對象2019 年1 月至2023 年3 月廣州市胸科醫院收治的自身免疫疾病患者應用TNF-α抑制劑后發生結核病33 例,其中男25 例,女8 例,年齡12 ~ 58歲,青中年患者32例,中位年齡32歲。33 例患者發生結核病前應用TNF-α 抑制劑時間在3個月到80個月之間,基礎疾病強直性脊柱炎24例,銀屑病3 例,類風濕性關節炎3 例,眼葡萄膜炎、白塞氏病、克羅恩病各1 例。使用的生物制劑阿達木單抗26 例、英夫利西單抗2 例、依那西普單抗2 例、培塞利珠單抗3 例;所有患者均沒有合并糖尿病、腫瘤、器官移植等疾病。
1.2 診斷標準原發病均診斷明確并經過生物制劑(TNF-α抑制劑)治療。所有患者均為初治結核病患者,既往均無結核病治療史,無結核潛伏感染進行預防性治療史、影像學檢查無陳舊性肺結核病灶。
結核病診斷:通過收集患者分泌物(痰液、支氣管灌洗液、膿液)進行涂片找到抗酸桿菌,或培養有分枝桿菌生長、對培養陽性菌株進行菌型鑒定確診為結核分枝桿菌復合群,或分泌物結核分枝桿菌核酸檢測(TB-RNA)、結核分枝桿菌利福平耐藥基因檢測(Gene Xpert MTB/RIF)陽性;菌陰結核病人結合結核菌素皮膚試驗(tuberculosis skin test,TST)陽性、血干擾素-γ 釋放試驗(IFN-γrelease assays, IGRAs)檢測陽性、病灶排除其他疾病、結合胸部X 線攝影、CT、B 超等影像學檢查或氣管鏡檢查符合結核病表現,所有診斷均符合中國結核病預防控制工作技術規范(2020 版)診斷標準[4]及中華人民共和國衛生行業標準WS288-2017 結核病診斷標準[5]。
1.3 研究方法采用回顧性分析方法,收集患者的一般資料,包括性別、年齡、基礎疾病及治療情況、臨床癥狀、實驗室檢查、影像學表現、病理學特征、治療與轉歸等。其中,患者的轉歸情況根據重復住院及門診復診治療至療程結束獲得。
1.4 統計學方法應用SPSS 25.0 軟件對結果進行分析,計量資料采用全距和四分位數表示。
2 結果
2.1 臨床特點33 例患者常見臨床表現有咳嗽、咯痰、發熱、氣促、胸悶、胸痛等癥狀。見表1。

表1 患者主要臨床癥狀(n = 33)Tab.1 Main clinical symptoms of patients例
33 例患者中結核菌侵及肺部32 例,支氣管15 例,縱隔、肺門淋巴結11 例,胸膜7 例,脾6 例,腦膜5 例,頸淋巴結3 例,肝、腸、腹膜各2 例,腋窩淋巴結、泌尿系、喉、左鎖骨上窩淋巴結各1 例。32 例肺結核患者雙側肺部均有病灶28 例,其中雙側全肺(右上中下+左上下肺葉)均有病灶21 例(21/33);左側肺部病灶2 例;右側肺病灶2 例。6 例出現肺空洞病灶。結核菌肺內組織(氣管支氣管、縱隔肺門淋巴結、胸膜)播散19 例(19/33),肺外結核18 例(18/33);肺結核伴肺內組織或肺外結核26 例(26/33),肺結核伴肺內組織及肺外結核14 例(14/33),具體病例見表2。

表2 結核病灶的解剖學部位(n = 33)Tab.2 Anatomical sites of tuberculosis foci (n = 33)
2.2 實驗室檢查結果33 例患者檢測分泌物涂片抗酸桿菌陽性16例(16/33),培養結核分枝桿菌生長19例(19/33),Gene Xpert MTB/RIF陽性21例(21/33),TB-RNA陽性24例(24/33)。血常規白細胞正常30例(30/33);血白蛋白正常22例(22/33)。血IGRA檢測及血CD4+、CD8+、CD3+T淋巴細胞計數結果見表3。

表3 患者結核潛伏感染與臨床細胞亞群檢測情況(n = 33)Tab.3 Detection of latent tuberculosis infection and clinical cell subsets in patients 例
2.3 影像學及氣管鏡下表現、病理特征33 例患者均進行胸部影像學(X 線、CT)檢查,肺部病變以粟粒結節或滲出、斑片狀病灶為主,未見增殖條索影及鈣化灶,雙側全肺均有病灶21 例,其中8 例為雙肺粟粒性改變;11 例肺門、縱隔淋巴結腫大。33 例患者中有26 例完成氣管鏡檢查:大致正常支氣管4 例;支氣管輕度炎癥7 例;15 例患者支氣管鏡檢查見支氣管黏膜充血腫脹伴干酪樣壞死物,診斷為支氣管結核,占26 例氣管鏡檢查的57.7%(15/26),7 例為支氣管結核淋巴結瘺型(縱隔、肺門淋巴結結核壞死物破潰進入支氣管腔內形成支氣管淋巴結瘺),需反復多次行氣管鏡下壞死物清除治療。壞死物病理結果示病灶組織呈局灶上皮鱗狀化生,固有層內見小灶凝固性壞死、增生的類上皮細胞聚集,伴肉芽組織增生,多量淋巴細胞、少量中性粒細胞及嗜酸性粒細胞浸潤,病變符合慢性肉芽腫性炎;鏡下顯示類上皮細胞排列松散,形成不良,見多量組織細胞,未見典型肉芽腫結節形成,未見多核巨細胞。見圖1。
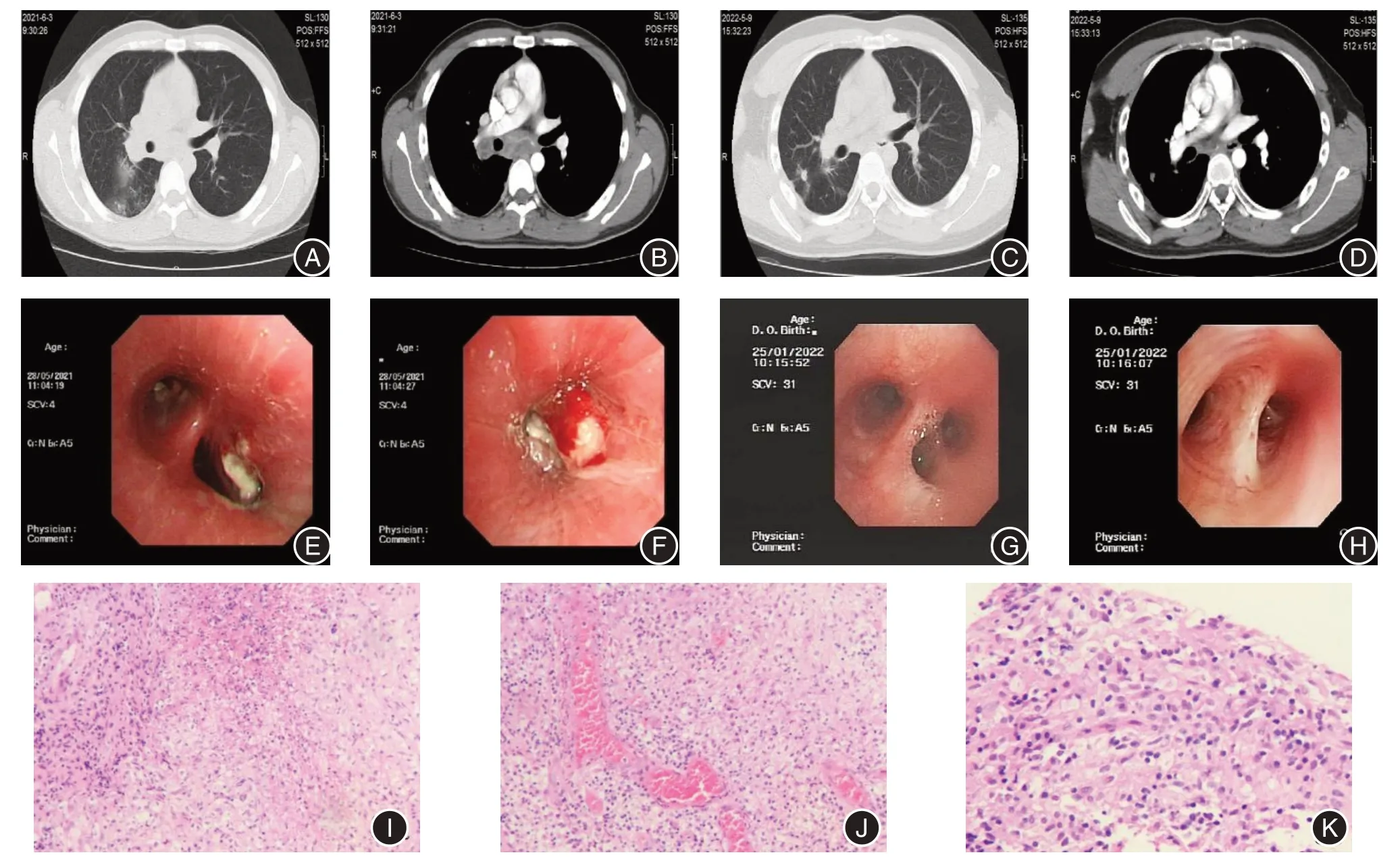
圖1 縱隔、肺門淋巴結結核影像學、氣管鏡及病理學特征Fig.1 Imaging, tracheoscopy and pathological features of mediastinal and hilar lymph node tuberculosis
2.4 治療及轉歸33 例患者經確診后均停用生物制劑,肺結核治療按中國結核病預防控制工作技術規范(2020 版)診斷標準[4]給予2HRZE/10HRE規則抗結核治療(H:異煙肼;R:利福平;Z:吡嗪酰胺;E:乙胺丁醇),合并肺外結核者以肺外結核最長療程進行治療,定期進行細菌學及影像學復查,以完成治療療程后根據分泌物檢測結核分枝桿菌及TB-RNA 陰性、病灶縮小穩定或完全吸收為治愈標準停藥。15 例合并支氣管結核者在規則抗結核治療同時,配合給予異煙肼、阿米卡星霧化吸入治療;對氣管、支氣管內壞死組織定期進行氣管鏡下壞死物清除術治療,本研究組氣管鏡治療次數視支氣管、縱隔、肺門淋巴結結核壞死物清除干凈及病灶愈合時間而定,患者氣管鏡治療次數3 ~15 次之間,平均氣管鏡治療次數為7 次/人。部分患者需多次住院治療及延長抗結核治療療程。經綜合治療,本組患者治療后多轉歸良好,治愈30例,好轉鞏固治療中2 例,1 例因合并重癥肺炎伴呼吸衰竭死亡。見表4。

表4 患者治療總體情況(n = 33)Tab.4 Overall treatment of patients
3 討論
風濕性疾病作為一類常見的自身免疫病,其免疫功能出現紊亂,包括腫瘤壞死因子-α(TNF-α)等多種細胞因子參與炎癥介質產生、炎癥細胞浸潤、趨化及炎癥活性物質釋放等病理生理過程起重要作用,其中TNF-α 作為一種具有多效性細胞因子被認為是參與免疫疾病炎癥反應的主要調節因子、并作為病理發展的關鍵因素[6];風濕性疾病在使用傳統的改善病情抗風濕藥(DMARDs)及(或)糖皮質激素、免疫抑制劑等藥物治療效果欠佳時,通常會應用生物制劑或小分子靶向藥物等進行治療[7]。本研究組患者患有強直性脊柱炎、類風濕性關節炎、銀屑病、白塞氏病、克羅恩病、眼葡萄膜炎等風濕性疾病,應用到的生物制劑為TNF-α 抑制劑,其種類有英夫利昔單抗(人鼠嵌合單克隆抗體)、阿達木單抗(人源性單克隆抗體)、依那西普單抗(重組人腫瘤壞死因子-抗體融合蛋白)、培塞利珠單抗(無Fc片段人源化抗TNF-α單克隆抗體)等4 種藥物[6,8-9];上述藥物可阻隔TNF-α及其受體相互作用的信號通路、阻止炎性因子聚集而改善病情[6],但其應用往往會導致患者自身免疫功能異常,可能會增加嚴重的細菌或病毒感染、腫瘤、結核病等疾病的發生率[10]。
結核分枝桿菌(MTB)入侵人體后,人體免疫系統產生由包括單核細胞、巨噬細胞、自然殺傷細胞(NK 細胞)、自然殺傷T細胞(NKT 細胞)、樹突狀細胞及γδT 細胞等進行的固有免疫應答和由T細胞、B細胞執行的適應性免疫應答以清除MTB;其中主要由活化巨噬細胞、T 淋巴細胞和自然殺傷細胞產生的腫瘤壞死因子α(TNF-α)及T 淋巴細胞分泌的γ-干擾素(INF-γ)、白介素(IL)-2 等細胞因子共同發揮抗結核作用[11-13],在TNF-α 的招募下上述細胞因子參與吞噬結核分枝桿菌后的巨噬細胞轉化為具有殺菌作用的特殊組織細胞及抑菌功能的過程,TNF-α 在巨噬細胞活化與肉芽腫形成并維持肉芽腫的完整性結構起到關鍵作用[14-15],肉芽腫的形成對阻礙結核分枝桿菌的播散有重要作用,當TNF-α 缺乏時形成不良的肉芽腫伴壞死,導致結核分枝桿菌廣泛播散[16]。
本研究組患者以中青年人群為主,應用TNF-α抑制劑后發生結核病時癥狀以咳嗽、咯痰、發熱為多見,臨床表現缺乏特異性。實驗室檢查血CD4+T淋巴細胞結果正常率69.70%(23/33),血γ-干擾素釋放試驗(IGRAs)陽性率81.82%(27/33),與使用免疫抑制劑后并發肺結核患者血T 細胞斑點試驗檢測陽性率85.28%[17]相近,顯示本組患者在應用生物制劑后并發結核病時出現免疫功能下降。本組患者感染結核分枝桿菌后主要在肺部發病,肺結核為最多見發病器官(32/33),易播散至雙側全肺、肺內組織及肺外器官,以支氣管、縱隔及肺門淋巴結、脾、腦等多見;本組患者結核分枝桿菌肺內組織(氣管支氣管、縱隔肺門淋巴結、胸膜)播散19 例(19/33),合并肺外結核達54.5%(18/33),與KEANE 等[18]報道的病例中有57%患者合并有肺外結核,近四分之一的患者播散至縱隔、肺門淋巴結發病情況相近,GEN 等[19]報道了一例以縱隔、肺門淋巴結結核為主的病例發病特點,也有多例個案報道應用了TNF-α 抑制劑后易發生血行播散型肺結核及播散到胸膜、腹膜、脾、腦等多器官部位[20-24],提示了應用TNF-α 抑制劑后免疫功能受損、結核分枝桿菌易多器官播散特點。
本組患者胸部CT 檢查肺部病變多以粟粒結節狀血行播散或滲出、斑片狀病灶為主,部分伴有空洞病灶,肺部病灶易肺內播散至雙側全肺;7 例縱隔、肺門淋巴結結核壞死液化破潰進入氣管、支氣管管腔形成壞死物,病理組織顯示病灶呈類上皮細胞排列松散、形成不良,未見典型肉芽腫結節形成及巨核細胞,病理特征與應用英夫利西單抗后繼發粟粒性肺結核死亡病例尸檢病理解剖顯示肺組織中有粟粒性損害部位多為無結構性肉芽組織相近[25],顯示了在本研究組患者T 淋巴細胞多為正常狀態情況下,TNF-α 抑制劑的應用導致肉芽組織結構受到破壞,結核分枝桿菌容易繁殖播散到全身多個器官部位,然是否為單一因素尚待進一步研究[26]。
本研究組患者確診肺結核后均停止使用TNF-α抑制劑并予規則抗結核治療,據報道[27]縱隔淋巴結結核發病率占肺結核患者的8%-10%,本研究組縱隔及肺門淋巴結結核發病占33.3%(11/33),較無應用生物制劑結核病患者為高;7 例縱隔、肺門淋巴結壞死物破潰侵蝕氣管壁進入氣管、支氣管腔內,在全身抗結核治療同時,需反復多次氣管鏡下進行鉗夾抽吸及冷凍治療清除壞死物,直至將破潰進入支氣管管腔的淋巴結壞死物清除干凈、瘺口愈合形成疤痕才考慮治愈,氣管鏡介入治療次數與縱隔、肺門淋巴結結核壞死物容積及是否多發病灶有關,本組患者平均經氣管鏡治療次數為7 次,與張景熙等[27]報道經支氣管治療次數相近,治療后均可獲得滿意效果。
本組患者發病時因TNF-α 受抑制、免疫功能受損,結核分枝桿菌易播散到全身多個器官,部分患者需反復多次住院治療,抗結核治療療程需延長,最長治療時間達32 個月,治療難度較普通結核病患者大,需按相關指南[28]建議患者在擬進行生物制劑治療前應進行結核菌素皮膚試驗(TST)、血γ-干擾素釋放試驗(IGRAs)檢測及胸部影像學檢查,篩查是否有結核潛伏感染或活動性結核病,如存在結核潛伏感染須進行預防性抗結核治療;對于有活動性結核病患者,應規范完成抗結核治療療程后再評估是否合適應用生物制劑。本組患者缺乏應用生物制劑前結核篩查相關資料,故未能判斷患者在應用生物制劑前已存在結核潛伏感染或應用生物制劑后才感染結核發病情況,需完善相關篩查工作。
目前我國仍有眾多活動性肺結核患者,存在風濕疾病患者在應用生物制劑等治療期間受感染結核分枝桿菌發病可能,如出現呼吸道等癥狀,需警惕并發結核病可能,避免漏診或延誤診斷;對于確診的結核病患者,除肺部病灶外,還需注意有無合并肺外器官或部位發病,應盡量完善全身檢查,包括胸部增強CT、氣管鏡等,完善診斷有助于制定合適抗結核診療方案。

