PGAM5在胰腺癌中的表達及其與臨床病理指標的關系
薛 松,胡加海,董祥寧
(安徽醫科大學附屬滁州醫院/滁州市第一人民醫院腫瘤內二科,安徽 滁州 239001)
胰腺癌具有臨床表現隱匿、發展迅速和預后差的特點,總體發病率和死亡率逐年上升。2020 年GLOBOCAN 數據顯示,全球胰腺癌新發病例約49.6萬,新增死亡病例約46.6 萬[1]。胰腺癌的早期癥狀不典型,多數患者確診時已經處于晚期,5 年總生存(overall survival,OS)率不足10%。晚期胰腺癌的治療以化療為主,目前國際公認的一線化療方案包括:白蛋白結合型紫杉醇+吉西他濱、奧沙利鉑+伊立替康+5-氟尿嘧啶/亞葉酸[2]。但化療療效有限且耐藥難以避免,胰腺癌的治療亟需新突破。免疫治療在近年來取得了顯著的進展,但在晚期胰腺癌領域效果甚微[3]。在靶向治療藥物方面,PARP抑制劑、KRAS抑制劑等取得了一定的效果,但限于突變頻率較低,受益患者較少[4]。因此,尋找新的治療靶點對改善晚期胰腺癌患者的預后有重要意義。
磷酸甘油酸變位酶(phosphoglycerate mutase family member,PGAM)是糖酵解和糖異生的重要酶,催化3-磷酸甘油酸轉化為2-磷酸甘油酸[5]。PGAM5是PGAM 家族成員之一,但其催化磷酸組氨酸特征基序的保守性較差,因此缺乏變位酶活性[6]。盡管如此,PGAM5 通過蛋白質-蛋白質相互作用及其特定的Ser/Thr/His蛋白磷酸酶活性參與線粒體動力學和凋亡的調節[7]。cBioPortal 數據庫顯示,PGAM5突變發生在多種腫瘤中,突變位點主要集中在PGAM 結構域。這些突變可能會改變PGAM5 在線粒體動力學和程序性細胞死亡中的作用,并促進腫瘤的發展。PGAM5已被證實在多種惡性腫瘤中過表達[8-10],但目前其在胰腺癌中是否異常表達尚無報告。本研究旨在明確PGAM5 在胰腺癌組織中的表達及其與患者臨床病理指標的關系。
1 材料與方法
1.1 生物信息學數據分析
從UCSC Xena官網(https://xenabrowser.net/datapages/)下載癌癥基因組圖譜(The Cancer Genome Atlas,TCGA)中胰腺癌的RNA-seq 數據和基因型組織表達(Genotype-Tissue Expression,GTEx)中正常組織的RNA-seq 數據。納入研究的TCGA 數據集包含179 個胰腺癌組織樣本和4個癌旁正常組織樣本;GTEx數據集包含167 個正常組織樣本。利用ggplot2 軟件包(V3.3.6)分析PGAM5 mRNA 在胰腺癌組織和正常組織中的表達差異。
1.2 臨床標本收集、PGAM5 蛋白表達檢測及相關分析
1.2.1 標本收集及患者臨床特征收集了2018 年01月—2020年12月于滁州市第一人民醫院就診的胰腺癌患者臨床資料86 例(52 例包含腫瘤組織標本及其對應的癌旁正常組織標本)。其中男性50 例(58.1%),女性36 例(41.9%);年齡<60 歲53 例(61.6%),≥60 歲33 例(38.4%)。根據AJCC 第8 版TNM 分期標準進行分期,其中I~II期28例(32.6%),III~IV期58例(67.4%);腫瘤長徑≤4 cm 者28 例(32.6%),>4 cm 者58 例(67.4%);無淋巴結轉移15 例(17.4%),有淋巴結轉移71 例(82.6%);無遠處轉移60 例(69.8%),有遠處轉移26 例(30.2%)。納入標準:①經病理學檢查診斷為胰腺癌;②有保存良好的組織標本;③有詳細臨床病理資料和隨訪信息。排除標準:合并有其他腫瘤及重要器官功能障礙者。采用門診、電話或網絡通信相結合的方式進行隨訪。所有患者在首次就診后開始隨訪,每月隨訪1 次,隨訪時間截至2023 年07 月31 日,隨訪率100%。生存期(overall survival,OS)為從病理學診斷為胰腺癌到患者死亡或隨訪截止時間。此外,通過手術收集6 對新鮮胰腺癌組織及其癌旁正常組織標本。本研究經安徽醫科大學生物醫學倫理委員會批準(批準文號為83220465)。
1.2.2 主要試劑過氧化氫、PBS緩沖液、TBST緩沖液、牛血清白蛋白均購自國藥集團化學試劑有限公司;DAB 染色液、蘇木素染色液、EDTA 抗原修復液、PMSF 蛋白酶抑制劑、RIPA 裂解液、BCA 蛋白濃度測定試劑盒、PVDF 膜、ECL 化學發光試劑盒、辣根過氧化物酶標記山羊抗兔IgG(H+L)均購自碧云天生物技術有限公司;兔來源PGAM5 抗體和GAPDH 抗體購自武漢三鷹生物技術有限公司。
1.2.3 Western blot6 對新鮮胰腺癌組織及其癌旁正常組織標本采用Western blot 檢測PGAM5 蛋白的表達水平。首先冰浴上取出新鮮胰腺癌組織及其癌旁正常組織,PBS 洗滌并剪碎,加入含PMSF 蛋白酶抑制劑的RIPA 裂解液,冰浴超聲勻漿。冰浴靜置30 min,4 ℃離心20 min,取上清,取少量用BCA法測定蛋白質含量,其余轉入-80 ℃保存備用。50 μg蛋白樣品經SDS-PAGE 凝膠電泳分離后轉移到PVDF膜上,放入含5%脫脂牛奶的TBST 中,室溫封閉2 h。滴加PGAM5 一抗(1∶20 000 倍稀釋),4 ℃輕搖過夜。TBST洗滌后滴加二抗(1∶1 000倍稀釋),室溫輕搖孵育2 h。通過ECL 化學發光試劑檢測免疫反應條帶。
1.2.4 免疫組織化學染色采用免疫組織化學染色(immunohistochemical staining,IHC)檢測胰腺癌組織中PGAM5 蛋白的表達水平。常規石蠟包埋,脫蠟至水,加入EDTA 抗原修復緩沖液,并于微波爐內進行抗原修復。3%過氧化氫溶液去除內源性過氧化物酶,血清封閉20 min 后滴加PGAM5 一抗(1∶200 倍稀釋),4 ℃過夜。PBS 洗滌后滴加二抗(1∶50 倍稀釋),室溫作用50 min。PBS洗滌后進行DAB顯色,蘇木素對比染色。脫水封片,顯微鏡鏡檢,圖像采集分析。
DAB 顯出的陽性表達為棕黃色,蘇木素染細胞核為藍色。結果以陽性細胞百分率和染色強度結合綜合計分。陽性細胞比例評分標準:≤5%為0分,>5%~25%為1 分,>25%~50%為2 分,>50%~75%為3 分,>75%為4 分。染色強度評分標準:無染色為0 分,淡黃色為1分,棕黃色為2分,棕褐色為3分。將兩者分數相乘,評分的中位值(6 分)為界,總分≥6 分判定為高表達,<6分判定為低表達。染色結果由2名病理醫師獨立雙盲判斷。
1.3 統計學方法
生物信息學數據應用R 4.2.1 軟件進行整理和統計學分析,利用Mann-WhitneyU檢驗比較PGAM5 在胰腺癌組織和正常組織中的表達差異。臨床數據應用SPSS 26.0 軟件進行統計學分析,計量資料用表示,計數資料用百分比(%)表示;采用Wilcoxon符號秩檢驗比較PGAM5 在配對樣本間的表達差異;卡方檢驗分析PGAM5 與臨床病理特征的關系;Spearman 相關系數分析二元變量間的相關性;Cox 回歸模型進行單因素或多因素分析。應用GraphPad Prism 9.4.0 軟件繪制Kaplan-Meier 生存曲線。P<0.05 為差異有統計學意義。
2 結 果
2.1 PGAM5在胰腺癌組織中的表達水平
TCGA 和GTEx 數據庫分析表明,胰腺癌組織中PGAM5 mRNA的相對表達量(4.04±0.50)高于正常組織(2.93±0.52),差異具有統計學意義(P<0.01),見圖1。Western blot 檢測結果顯示在6 對新鮮胰腺癌組織中PGAM5蛋白的表達水平明顯高于癌旁正常組織,提示PGAM5蛋白的表達水平在胰腺癌組織中表達上調,見圖2。IHC 檢測結果顯示,PGAM5 蛋白在胰腺癌組織中呈棕黃色顆粒狀,主要在細胞胞漿中表達(圖3A)。IHC半定量分析顯示,52例胰腺癌組織PGAM5蛋白表達的中位評分為6分(5.27±3.31),對應的癌旁正常組織PGAM5 中位評分為2 分(2.65±2.12),差異具有統計學意義(P<0.01),見圖3B。
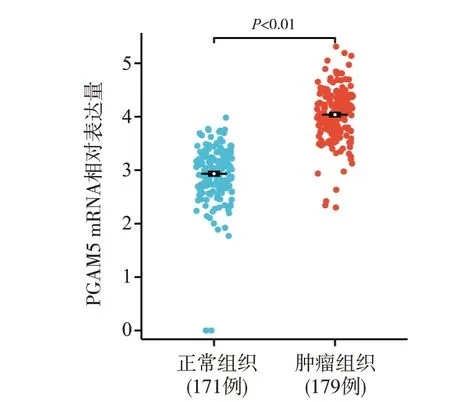
圖1 生物信息學分析PGAM5 mRNA在胰腺癌組織中的表達水平
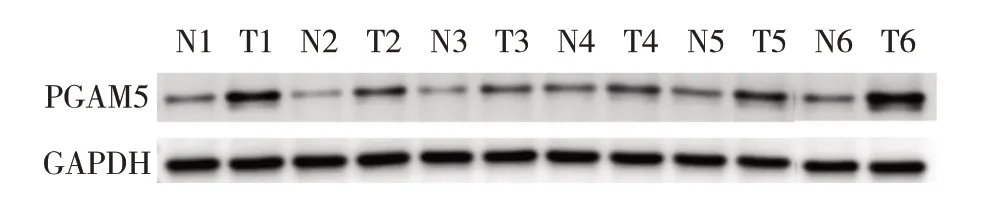
圖2 Western blot 檢測PGAM5蛋白在6對新鮮胰腺癌組織和對應癌旁正常組織中的表達
2.2 PGAM5與胰腺癌患者臨床病理指標的關系
在86例胰腺癌組織中,PGAM5高表達者占53.5%(46/86),PGAM5 低表達占46.5%(40/86),分析其表達水平與胰腺癌患者臨床病理指標的相關性。如表1 所示,PGAM5 的表達水平與胰腺癌患者TNM 分期、腫瘤長徑和遠處轉移有關(均為P<0.01),與年齡、性別和淋巴結轉移無明顯相關(P>0.05)。Spearman 相關分析表明,PGAM5 與TNM 分期、腫瘤長徑、淋巴結轉移和遠處轉移有關,與年齡和性別無明顯相關(P>0.05),見表2。
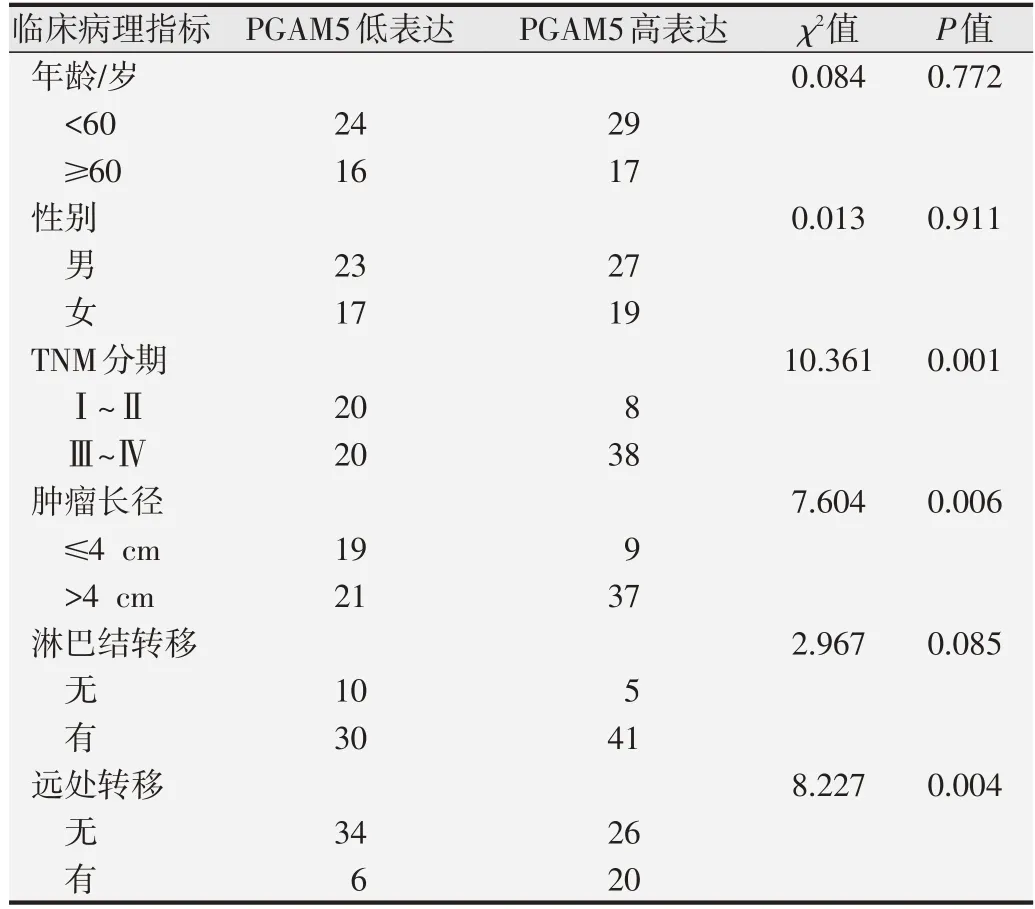
表1 PGAM5表達水平與臨床病理指標之間的關系
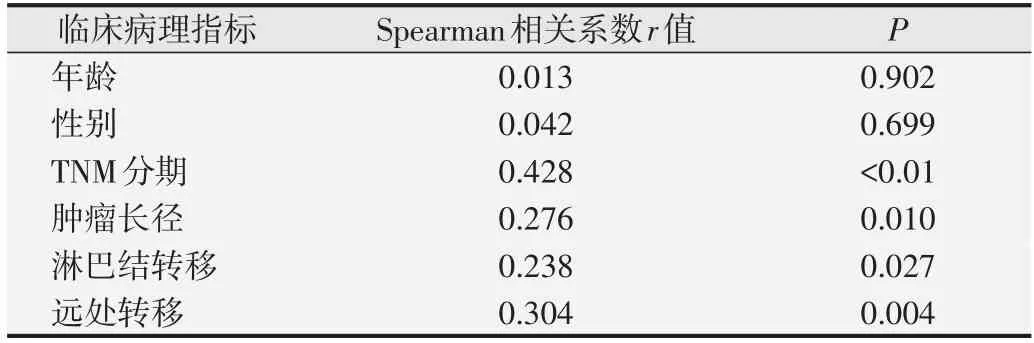
表2 PGAM5表達水平與臨床病理指標的相關性分析
2.3 PGAM5對胰腺癌的生存預后價值
采用Cox 回歸模型分析PGAM5 表達與86 例胰腺癌患者生存預后的相關性。單因素分析提示,PGAM5、TNM分期、淋巴結轉移和遠處轉移均是影響胰腺癌患者預后的危險因素(P<0.01);而年齡、性別、腫瘤長徑與患者預后無關(P>0.05)。將單因素分析中有統計學意義的變量納入多因素分析模型,結果發現,PGAM5蛋白的表達水平是胰腺癌患者生存預后的獨立影響因素[HR=2.101,95%CI(1.210,3.646),P=0.008],見表3。Kaplan-Meier 生存曲線顯示,PGAM5低表達組患者的中位OS為27個月,而PGAM5高表達患者的中位OS 僅為17 個月,差異有統計學意義[HR=2.470,95%CI(1.533,3.980),P<0.01],見圖4。
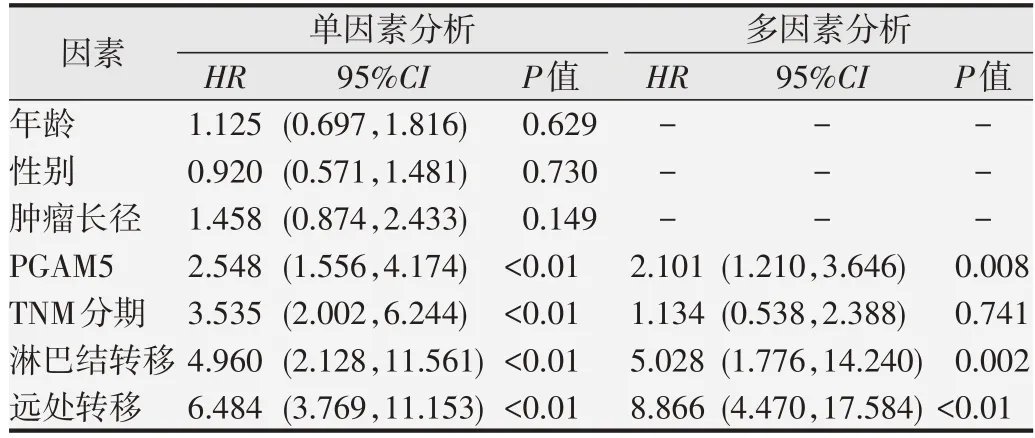
表3 86例胰腺癌患者OS的單因素和多因素分析
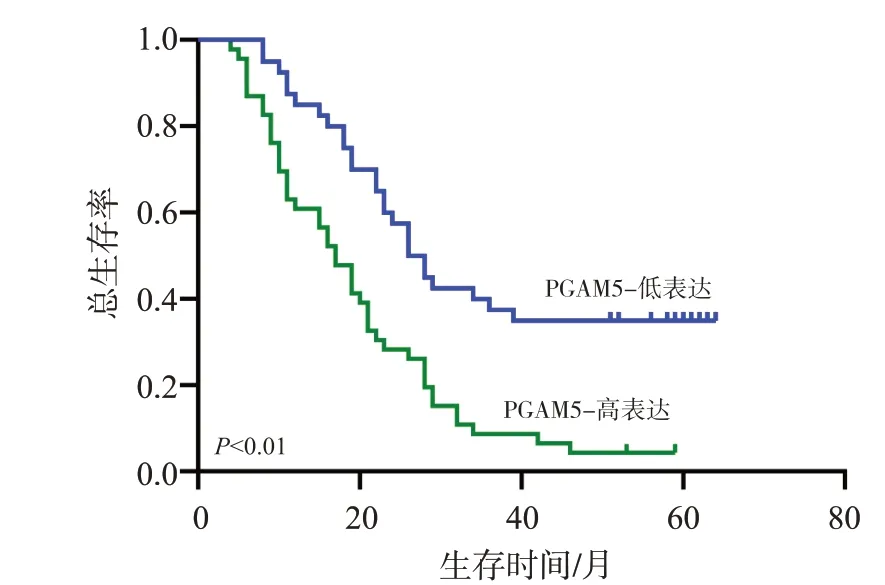
圖4 86例胰腺癌患者的Kaplan-Meier生存曲線
3 討 論
線粒體是細胞增殖過程中平衡氧化應激和細胞死亡的重要細胞器,多項研究證實PGAM5 是線粒體動力學和細胞凋亡的關鍵調節因子[7]。了解細胞如何防御線粒體應激以避免細胞凋亡的過程對于開發有效的疾病治療方法至關重要。在輕度應激下,PGAM5調節線粒體生物發生和線粒體自噬,維持線粒體穩態,促進細胞存活[11]。在嚴重應激下,PGAM5促進線粒體分裂,整合多種死亡信號誘導細胞死亡[12]。已有研究表明,PGAM5的異常表達與人類多種疾病密切相關。與健康人群相比,帕金森病患者血漿中PAMG5 水平明顯升高,且具有較高的敏感性和特異性,PGAM5可能是診斷帕金森病的生物標志物[13]。在免疫反應方面,PGAM5可抑制NDPK-B介導的組氨酸磷酸化,激活K+通道KCa3.1,并負性調節CD4+T細胞[14]。敲除或抑制PGAM5 可通過抑制Drp1 減少心肌細胞壞死,并改善大鼠的心肌缺血再灌注損傷。抑制Ripk3-PGAM5-CypD-mPTP通路可減輕心臟微血管缺血再灌注損傷[15]。
線粒體功能障礙是腫瘤細胞的一個顯著特征。PGAM5的異常表達可導致線粒體超微結構異常和線粒體功能障礙,現已發現與多種腫瘤相關。肝癌組織中PGAM5 的表達高于正常組織,PGAM5 通過與Bcl-xL和Keap1 的相互作用介導肝癌的化療耐藥[8]。Kwong等[9]已證實PGAM5在非小細胞肺癌和癌前組織(鱗狀不典型增生和原位癌)中表達,但在正常上皮中不表達。此外,PGAM5 在胃癌組織中高表達并通過PI3K/AKT信號通路調節胃癌細胞的生長和侵襲[10]。在結直腸癌組織中,PGAM5 和Parkin 蛋白的表達也明顯升高[16]。然而,也有研究報道在人結直腸癌中,PGAM5 和Bcl-xL 的表達低于正常組織,而Keap1 的表達高于正常組織,Keap1介導的PGAM5和Bcl-xL降解可能在結直腸癌中較為活躍[17]。迄今為止,PGAM5在胰腺癌中的表達、與患者臨床病理特征之間關系的研究甚少,值得進一步探索。
本研究通過分析TCGA和GTEx數據庫中胰腺癌和正常組織的RNA-seq 數據,結果顯示PGAM5 在胰腺癌組織中明顯過表達。隨后利用Western blot 和IHC驗證了生物信息學分析結果,Western blot 分析顯示PGAM5 在胰腺癌組織中的表達明顯高于正常組織。IHC 結果顯示,腫瘤組織中PGAM5 的高表達率為53.5%(46/86);相比之下,在癌旁正常組織中的高表達率僅為13.5%(7/52),表明PGAM5 在胰腺癌中的表達水平顯著升高。這些結果表明,PGAM5可作為鑒別胰腺組織良性和惡性的標記物。進一步將PGAM5 的IHC 評分與胰腺癌患者的臨床病理數據進行了關聯分析。相關性分析提示PGAM5 表達水平與TNM 分期、腫瘤長徑、淋巴結轉移和遠處轉移相關,而與年齡、性別無關。多因素分析發現PGAM5、淋巴結轉移和遠處轉移是影響胰腺癌患者生存預后的獨立危險因素(P<0.01)。Kaplan-Merier 生存分析表明,PGAM5 高表達的胰腺癌患者中位OS 僅為17 個月,明顯低于PGAM5 低表達患者中位OS 的27 個月(P<0.01)。這些結果提示,PGAM5可能是判斷胰腺癌患者預后的重要分子標志。
綜上,PGAM5可能是胰腺癌預后判斷的潛在生物學標志物,其表達水平與胰腺癌患者臨床病理特征密切相關,PGAM5 高表達提示預后較差。因此,對于PGAM5高表達的胰腺癌患者,建議強化術后輔助治療方案,如患者一般狀況良好,可考慮奧沙利鉑+伊立替康+5-氟尿嘧啶/亞葉酸三藥方案作為術后輔助化療方案[18]。此外,本研究為回顧性研究,且樣本量較少,可能存在選擇偏倚,需要更加嚴格的大樣本、多中心研究來進一步驗證。對于PGAM5 在胰腺癌發生、發展中的作用機制,還需要進一步的深入研究。

