固固加熱法制備氨氧混合氣及其催化氧化條件的研究
陳寅杰

摘要: 通過對比固固加熱法、液體常溫法制備氨氧混合氣,對比沒有催化劑載體、玻璃纖維載體和泡沫氧化銅載體的催化效果,試圖找到氨催化氧化反應的最佳反應條件,提高演示實驗的成功率。與傳統實驗相比,增加了熱成像儀監控反應進程,使用常見藥品代替危險化學品和昂貴試劑。實驗發現,選用硫酸銨和過碳酸鈉按質量比2:3混合時,氨氧混合氣催化氧化效果最好。
關鍵詞: 氨的催化氧化; 實驗改進; 固固加熱法; 氨氣的還原性
文章編號: 10056629(2024)01009403
中圖分類號: G633.8
文獻標識碼: B
1 問題提出
教育部頒布的《普通高中化學課程標準(2017年版2020年修訂)》中提到:結合真實情境中的應用實例或通過實驗探究,了解氯、氮、硫及其重要化合物的主要性質,認識這些物質在生產中的應用和對生態環境的影響[1]。氨的催化氧化是指氨氣通過催化劑與空氣、氧氣、臭氧等氧化劑進行的氧化反應,無論在工業、農業還是實際教學中都占有非常重要的地位。在工業中,該反應是制取三酸中硝酸的重要一環;在農業中,該反應可以制取硝態氮肥;在教學中,該反應便于學生理解氨氣的還原性,進一步完善氮元素的價類二維圖,從價態角度理解氮及其化合物之間的轉化。不少一線教師對該實驗作了改進與開發,提升了實驗的成功率和實驗效果[2~5]。筆者發現傳統氨的催化氧化實驗裝置復雜,氨氣極易過量,所用藥品涉及危險化學品,且鉑催化劑成本較高,重現性較差,不適宜在課堂演示。
2 實驗設計
2.1 實驗主要儀器與藥品
實驗儀器:試管1支(長20cm,直徑20mm);石英玻璃管1根(長40cm,直徑30mm);紅外熱成像儀FILR ONE Pr 1個(熱像素尺寸12μm,熱分辨率19200像素,熱靈敏度70mK,對象溫度范圍-20℃至400℃)
實驗藥品:氧化銅、三氧化二鉻、二氧化錳、氯化鈣、氧化鈣、增氧片(過碳酸鈉)、碳酸氫銨、氯化銨、硫酸銨、泡沫銅、3%過氧化氫、2mol·L-1氨水
2.2 氨氧混合氣的制取方法的對比
首先,使用過氧化氫和氨水的混合溶液,加入二氧化錳催化過氧化氫分解得到氨氧混合氣,通過控制氨水和過氧化氫的比例,調節氨氧混合氣的比例。
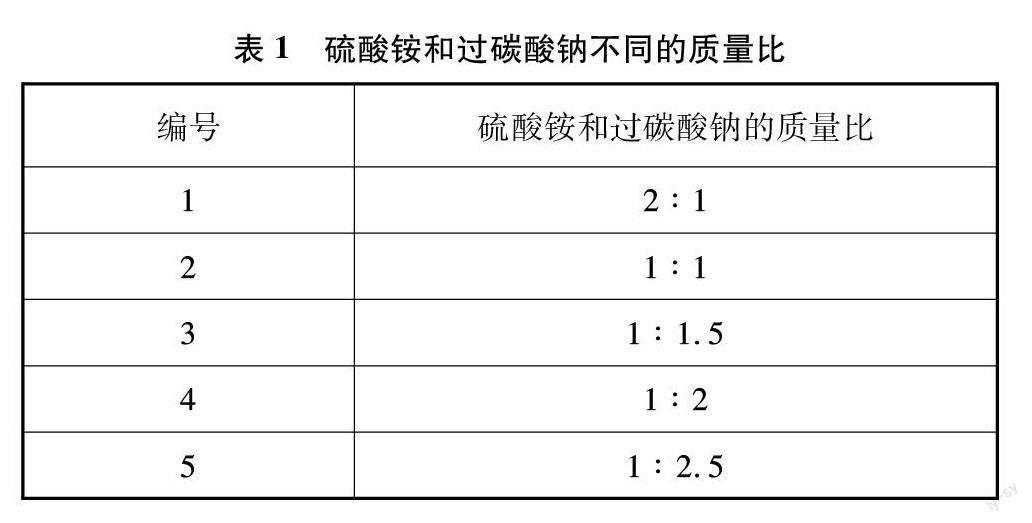
其次,使用銨鹽與過碳酸鈉粉末在二氧化錳以及加熱條件下得到氨氧混合氣,通過控制銨鹽與過碳酸鈉粉末的比例,調節氨氧混合氣的比例。選用硫酸銨和過碳酸鈉制備氨氧混合氣時,兩組分的質量比如表1所示。
使用液體常溫法制取氨氧混合氣的實驗過程中,由于受過氧化氫濃度限制,氧氣濃度較低,導致氨氣大大過量,同時液體常溫法制取過程中水含量較高,極易超過干燥劑的吸水能力,導致石英玻璃管壁上有水滴附著,同時生成大量白煙,無法清晰觀察到紅棕色氣體。測得玻璃管壁上的水滴pH為堿性,初步分析導致出現該現象的原因是氨氣過量,生成的二氧化氮直接與水蒸氣反應生成硝酸,再與過量的氨氣生成硝酸銨。相關反應如下:
4NH3(g)+5O2(g)4NO(g)+6H2O(g)
2NO(g)+O2(g)2NO2(g)
3NO2(g)+H2O(g)2HNO3(l)+NO(g)
NH3(g)+HNO3(g)NH4NO3(s)
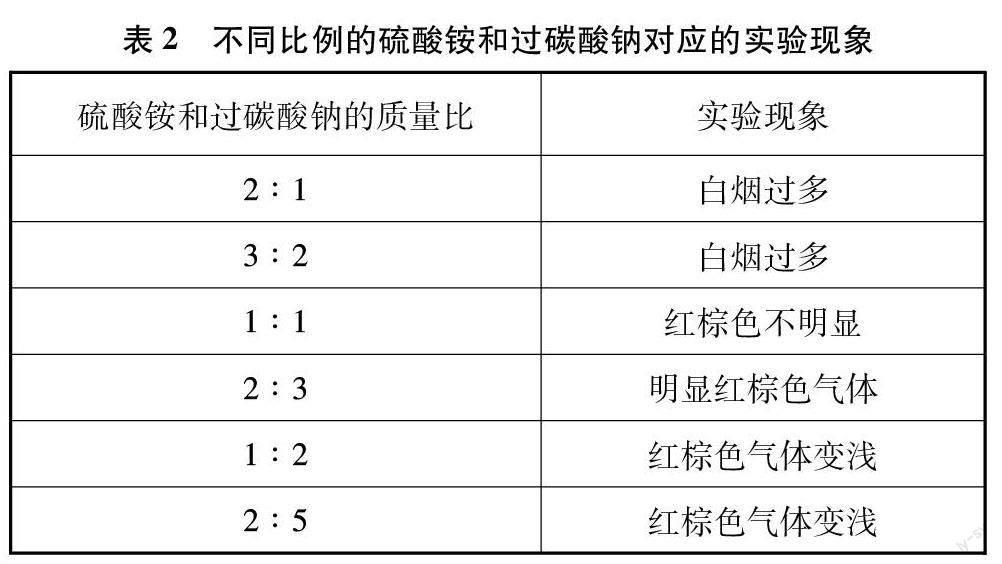
使用固固加熱法制取氨氧混合氣的過程中,發現碳酸氫銨同時受熱分解生成大量的水,依舊在石英玻璃管壁上有水滴附著,實驗現象與液體常溫法相似。而氯化銨的氨含量過高,制得的氨氧混合氣中氨含量也遠高于硫酸銨,同時分解產生氯化氫氣體,可與過碳酸鈉反應生成二氧化碳,引入雜質。因此硫酸銨作為氨的來源是最佳選擇。在加熱過程中,產生白煙,符合預期的實驗現象。硫酸銨與過碳酸鈉的最佳質量比確定為2∶3(見表2)。
2.3 催化劑及其載體的選擇
本實驗選用的催化劑為三氧化二鉻和氧化銅1∶1(質量比)混合物,三氧化二鉻起到主要的催化作用;氧化銅起到防爆作用,提升實驗的安全性。由于該混合物為粉末,因此考慮選用不同種類的催化劑載體作為負載進行實驗。催化劑載體選擇了玻璃纖維與泡沫氧化銅。
泡沫銅是一種在銅基體中均勻分布著大量連通或不連通孔洞的新型多功能材料。而泡沫氧化銅由泡沫銅在空氣中灼燒得到,具有較大的比表面積,可以起到較好的催化劑負載作用。
在表3中的實驗1為空白實驗,直接將三氧化二鉻和氧化銅粉末填充在石英玻璃管中。實驗2首先將三氧化二鉻和氧化銅粉末混合均勻,包裹在玻璃纖維上,再填充在石英玻璃管中。在實驗3中,首先灼燒泡沫銅至黑色,將混合均勻的三氧化二鉻和氧化銅粉末卷在泡沫氧化銅內,再填充在石英玻璃管中。填充催化劑及其載體后,加熱石英玻璃管至紅外熱成像儀中觀察到催化劑全部受熱后,通入氨氧混合氣。
不使用催化劑載體往往會難以把控催化劑的填充程度,填充過松則使得過量氨氣未充分反應就通過催化劑,填充過緊則使得氣體難以通過催化劑而造成容器內壓強增大。經過實驗發現若使用玻璃纖維作為催化劑載體幾乎無法反應,初步分析是由于玻璃纖維的耐熱程度高,保溫效果好,溫度上升緩慢,需要加熱較長時間才能達到催化劑的活性溫度。而使用泡沫氧化銅可達到較高溫度,同時多孔結構可以使得氨氧混合氣與催化劑充分接觸,提高轉化率。因此使用泡沫氧化銅作為催化劑載體實驗效果較好。紅外熱成像儀的使用,便于確定通入氨氧混合氣的時機,若過早通入則催化劑未達到其活性溫度,催化效果較差,若過晚通入則浪費能源。
2.4 干燥劑的選擇
由于該反應生成水,而水又能使得催化劑中毒,降低催化劑的催化活性,因此在反應前后填充干燥劑。本實驗選取了常見的幾種干燥劑——無水氯化鈣、氧化鈣。
當反應前后均使用氯化鈣作干燥劑時,發現反應難以發生,初步分析是由于存在反應CaCl2+8NH3CaCl2·8NH3,氯化鈣不僅吸收水蒸氣還吸收氨氣,因此只能作為反應后的干燥劑,吸收過量氨氣以免生成白煙。當反應前后均使用氧化鈣作干燥劑時,反應后產生少量白煙,初步分析是由于氧化鈣不能吸收氨氣,因此氨氣容易過量。
通過實驗發現反應前用氧化鈣干燥,吸收可能存在的水蒸氣,反應后用氯化鈣干燥,吸收反應生成的水蒸氣以及過量氨氣,紅棕色氣體的現象、催化劑紅熱現象最為明顯。
3 設計特點與結論
通過上述實驗確定氨氧混合氣的制備流程如圖1所示,整個實驗裝置如圖2所示。運用紅外熱成像儀觀察催化劑的受熱情況,更好地控制氨氧混合氣通入的時機。使用氧化鈣-氯化鈣干燥劑組合對混合氣體有選擇性的干燥與除雜作用。使用增氧顆粒作為氧化劑,所用的所有試劑均不屬于危險化學品,提高了實驗的安全性。使用泡沫氧化銅作為催化劑載體,現象更加明顯、重復性更高。全封閉體系安全環保。通過對比干濕兩種方法制備氨氧混合氣,固固加熱法制取時的藥品的種類,催化劑及其載體的種類搭配,并結合數字化儀器進行分析改進。具體研究結論如下:
(1) 藥品使用:選用硫酸銨和過碳酸鈉按質量比2∶3混合時,氨氧混合氣催化氧化效果最好。
(2) 催化劑使用:氧化銅和三氧化二鉻按質量比1∶1混合并加入少量二氧化錳,催化活性較高。使用紅外熱成像儀可以很好地監控反應進程。
(3) 干燥劑使用:反應前使用氧化鈣干燥吸水,反應后使用氯化鈣干燥吸水、吸氨,實驗效果最好。
4 實驗重現性
本實驗的改進前后重現性對比如表4所示,各實驗均重復20次,觀察到紅棕色氣體視為實驗成功。
通過上表數據,發現固固加熱法制備混合氣且在泡沫氧化銅載體的條件下進行反應,實驗成功率和重現性最高。
參考文獻:
[1]中華人民共和國教育部制定. 普通高中化學課程標準(2017年版2020年修訂)[S]. 北京: 人民教育出版社, 2020.
[2]沈美榮. 氨催化氧化后的白霧是什么[J]. 化學教學, 1994,(5): 42.
[3]齊俊林. 氨催化氧化實驗的新設計[J]. 化學教學, 2007,(8): 11.
[4]王屹. 氨氣催化氧化實驗的分析及改進[J]. 化學教學, 2009,(8): 41~42.
[5]鄭雅蘭, 劉麗君. 合成氨實驗組合裝置的設計[J]. 化學教學, 2017,(5): 76~78.

