A族鏈球菌體內(nèi)耐受β-內(nèi)酰胺類藥物的機制研究進(jìn)展
郭孟楊 綜述 姚開虎 審校
(國家兒童醫(yī)學(xué)中心/首都醫(yī)科大學(xué)附屬北京兒童醫(yī)院/北京市兒科研究所微生物研究室/國家呼吸系統(tǒng)疾病臨床醫(yī)學(xué)研究中心/教育部兒科重大疾病研究重點實驗室,北京 100045)
A族鏈球菌(group AStreptococcus,GAS)可導(dǎo)致多種臨床疾病,包括咽炎、猩紅熱、膿皰病、蜂窩織炎在內(nèi)的非侵襲性急性疾病,亦包括壞死性筋膜炎和鏈球菌中毒性休克綜合征等侵襲性疾病。此外,感染GAS 還可引起免疫介導(dǎo)性疾病,如急性風(fēng)濕熱(acute rheumatic fever,ARF)、風(fēng)濕性心臟病、鏈球菌感染后腎小球腎炎等,嚴(yán)重影響人體健康[1]。目前尚無針對GAS 的疫苗投入臨床應(yīng)用,其感染治療主要依靠抗菌藥物[2]。青霉素作為一線藥物治療GAS 疾病已有80 余年,體外試驗還從未確認(rèn)過有對青霉素耐藥的GAS 菌株,指南或共識目前仍推薦使用青霉素等β-內(nèi)酰胺類藥物治療GAS 感染[3-4]。但是,自20 世紀(jì)50 年代開始,便時有青霉素治療GAS感染失敗的報道[5]。關(guān)于GAS 體內(nèi)耐受β-內(nèi)酰胺類藥物的機制至今尚無定論,研究者從不同方面對這一現(xiàn)象產(chǎn)生的原因進(jìn)行了假設(shè)和研究。本文就GAS 體內(nèi)耐受β-內(nèi)酰胺類藥物的現(xiàn)象及可能機制進(jìn)行回顧和總結(jié),以期引起國內(nèi)同行對相關(guān)情況的重視,為臨床用藥和后續(xù)研究提供參考。
1 GAS體內(nèi)耐受β-內(nèi)酰胺類藥物的現(xiàn)象
至今為止,β-內(nèi)酰胺類藥物治療GAS 感染失敗的主要臨床報道見表1。Markowitz 等[6]回顧了1953—1993 年間報道的青霉素治療GAS 所致咽扁桃體炎失敗的情況,經(jīng)咽拭子細(xì)菌培養(yǎng)證實,為期10 d 的口服青霉素治療失敗率為19.1%~21.7%。Gastanaduy 等[7]研究發(fā)現(xiàn),對于GAS 所致咽喉炎患者,依據(jù)細(xì)菌培養(yǎng)結(jié)果,口服或肌注青霉素治療的失敗率為25%左右,且治療失敗組的抗鏈球菌溶血素O 和抗鏈球菌DNA 酶B 的滴度在治療前高于治療成功組,可能該類患者發(fā)病前為GAS 攜帶者,而青霉素對處于增殖活躍期的細(xì)菌清除效果更好,治療失敗(細(xì)菌清除失敗)或許與是否為GAS 攜帶狀態(tài)有關(guān)[12]。當(dāng)GAS 所致咽炎治療不及時或不徹底時,或會引起風(fēng)濕熱、心內(nèi)膜炎、腦膜炎等危及生命健康的嚴(yán)重疾病。有研究發(fā)現(xiàn),GAS 咽部和皮膚感染或攜帶狀態(tài)會增加ARF 的發(fā)病風(fēng)險,但應(yīng)用β-內(nèi)酰胺類、大環(huán)內(nèi)酯類和磺胺類等抗生素并不能降低該風(fēng)險,尚不能確定其是否與藥物不能徹底清除感染或攜帶菌有關(guān)[13]。近幾十年來,時有β-內(nèi)酰胺類藥物治療GAS 感染失敗的相關(guān)報道,雖然各研究中關(guān)于治療失敗的判定標(biāo)準(zhǔn)不一,但用藥后未徹底清除體內(nèi)GAS 的現(xiàn)象基本一致,該現(xiàn)象及其背后的機制值得關(guān)注。
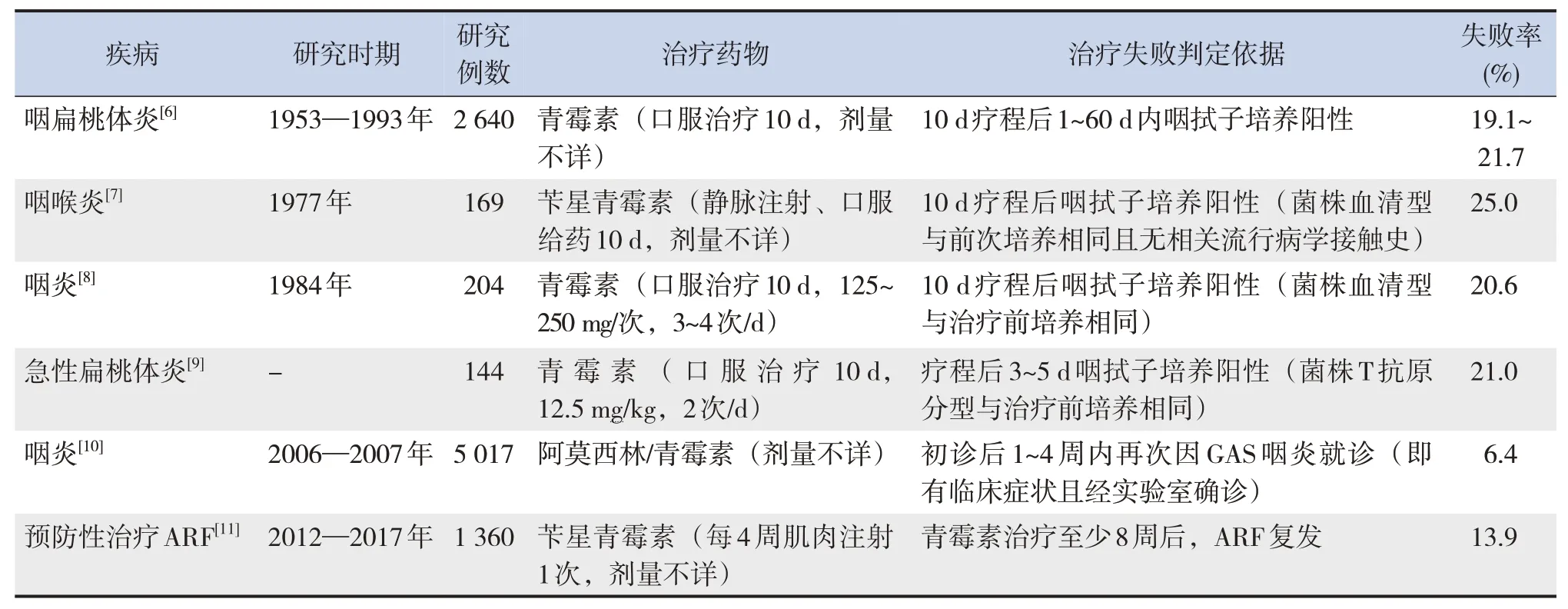
表1 β-內(nèi)酰胺類藥物治療GAS感染失敗的情況
2 GAS體內(nèi)耐受β-內(nèi)酰胺類藥物的機制
關(guān)于β-內(nèi)酰胺類藥物治療GAS 感染/清除體內(nèi)GAS 失敗的原因,研究者提出了不同觀點。總結(jié)既往文獻(xiàn),可從致病菌株的藥物敏感性和其他作用兩個方面進(jìn)行考慮:一是GAS 菌株對β-內(nèi)酰胺類藥物敏感性降低;二是其他微生物與藥物在人體內(nèi)發(fā)生相互作用,或菌株在機體內(nèi)出現(xiàn)不同于體外試驗的其他特性,如持留性(persistence)、產(chǎn)生生物膜的能力等,使得GAS無法被完全清除。
2.1 GAS對青霉素敏感性降低及其機制
已有研究報道了對β-內(nèi)酰胺類藥物敏感性降低的GAS 菌株[14-19]。目前,美國臨床和實驗室標(biāo)準(zhǔn)協(xié)會(Clinical and Laboratory Standards Institute,CLSI)只有GAS 對青霉素敏感的判定界值(MIC≤0.12 μg/mL 為敏感),沒有GAS 對青霉素中介或耐藥的判定界值[20]。與CLSI 不同,歐洲抗菌藥物敏感性試驗委員會(European Committee on Antimicrobial Susceptibility Testing,EUCAST)關(guān) 于GAS 體外藥敏試驗結(jié)果的判讀包括敏感和耐藥而無中介的標(biāo)準(zhǔn),具體標(biāo)準(zhǔn)如下:敏感為MIC≤0.125 μg/mL(腦膜炎)、MIC≤0.25 μg/mL(非腦膜炎);耐藥為MIC>0.125 μg/mL(腦膜炎)、MIC>0.25 μg/mL(非腦膜炎)[21],且有系統(tǒng)綜述表明并未有以此為判定標(biāo)準(zhǔn)的耐藥菌株報道[14]。
尚未見確證的青霉素耐藥GAS 菌株的報告,但青霉素最低抑菌濃度(minimum inhibitory concentration,MIC)升高的GAS 菌株時有出現(xiàn)[14]。Vannice等[15]發(fā)現(xiàn)2株GAS菌株對氨芐青霉素、阿莫西林和頭孢噻肟的MIC值升高,分別為0.25 μg/mL、0.25 μg/mL、0.06 μg/mL,比對照菌株的MIC 值高3~6倍,且其青霉素結(jié)合蛋白2x(penicillin binding protein 2x,PBP2x)發(fā)生了Thr553Lys 氨基酸替換。美國一項多中心研究報道,GAS菌株中PBP2x存在Pro601Leu 氨基酸替換的青霉素MIC 值(0.023~0.032 μg/mL)是野生型GAS 菌株(0.012 μg/mL)的2~3 倍;具有Phe599Tyr 和Gly600Asp 雙氨基酸替換的GAS 菌株青霉素MIC 值(0.023 μg/mL)大于或等于僅具有Gly600Asp氨基酸替換的GAS菌株青霉素MIC 值(0.016 μg/mL),雙氨基酸替換可能對MIC 值的增加具有累積效應(yīng)。以上研究提示PBP2x中某些氨基酸替換導(dǎo)致GAS菌株對β-內(nèi)酰胺類藥物的敏感性降低,且有報道提出該種現(xiàn)象在GAS流行的emm型別中更常見[16]。有研究亦證明,具有停乳鏈球菌似馬亞種(Streptococcus dysgalactiae subspecies equisimilis,SDSE)4 Kb 重組基因片段的PBP2x 嵌合體可導(dǎo)致GAS 在體外試驗中對β-內(nèi)酰胺類藥物敏感性降低,且經(jīng)相同劑量的青霉素治療之后,感染突變菌株的壞死性肌炎小鼠四肢的細(xì)菌載量更高[17]。1995—2016 年冰島一項對1 515株耐紅霉素GAS菌株的研究發(fā)現(xiàn),具有Met593Thr氨基酸替換的GAS菌株青霉素和氨芐青霉素MIC 值(青霉素:0.023 μg/mL,氨芐青霉素:0.032 μg/mL)是野生型GAS 菌株(青霉素:0.012 μg/mL,氨芐青霉素:0016 μg/mL)的2 倍[18]。2015—2021 年美國一項涵蓋侵襲性GAS感染菌株的研究發(fā)現(xiàn),具有PBP2x 中Thr553Lys 氨基酸替換的GAS 菌株,其氨芐青霉素和阿莫西林MIC 值是無此替換菌株的5~10 倍,提示PBP2x 的氨基酸改變與GAS 對β-內(nèi)酰胺類藥物(氨芐青霉素、青霉素G、頭孢噻肟、頭孢西丁和美羅培南等)敏感性降低有關(guān)[19]。
細(xì)菌外排泵亦與耐藥性密切相關(guān),有研究發(fā)現(xiàn),青霉素不敏感GAS 菌株中編碼外排泵相關(guān)的基因表達(dá)上調(diào),但同時與蛋白質(zhì)合成和菌細(xì)胞生長相關(guān)的基因表達(dá)下調(diào),這亦表明GAS 菌株對青霉素產(chǎn)生抗性也需付出一定的生存代價[22]。
實際臨床工作中普遍以CLSI 或EUCAST 規(guī)定的標(biāo)準(zhǔn)判定GAS 菌株是否耐藥/不敏感,而該標(biāo)準(zhǔn)的制定以患者臨床療效為參考,雖然青霉素對于大部分GAS 感染仍有較好療效,且CLSI 無GAS 對青霉素中介或耐藥的判定界值,無法確定“耐藥株”,但近年來不斷有關(guān)于青霉素MIC 值增加的GAS菌株的報道[14-19],MIC值增加提示菌株具有耐藥傾向,需要警惕體外試驗?zāi)退幘甑某霈F(xiàn)。
2.2 接種效應(yīng)
接種效應(yīng)(inoculum effect)指體外試驗中當(dāng)細(xì)菌接種量高于藥敏試驗使用量時,抗菌藥物對其抗菌活性減弱的現(xiàn)象[23]。當(dāng)抗生素殺死細(xì)菌并破壞細(xì)菌細(xì)胞壁時,死亡菌體釋放出能破壞抗生素的酶,從而減少抗生素進(jìn)入仍存活細(xì)菌的濃度,產(chǎn)生接種效應(yīng)。雖然GAS 不產(chǎn)生β-內(nèi)酰胺酶,但近年來研究表明其亦存在對青霉素的接種效應(yīng)。Eagle[5]在20世紀(jì)50年代發(fā)現(xiàn),若給小鼠接種GAS后24 h 內(nèi)給藥或細(xì)菌接種量低于107CFU/mL,則青霉素治療通常有效,若GAS 接種濃度達(dá)到107~108CFU/mL,則細(xì)菌清除效果不佳,認(rèn)為此現(xiàn)象可能與細(xì)菌處于不同生長周期有關(guān)。不同生長周期的GAS 表達(dá)青霉素結(jié)合蛋白(penicillin binding protein,PBP)的量不同,給小鼠接種GAS 24~48 h后,其PBP表達(dá)量明顯低于前24 h,青霉素主要與PBP結(jié)合以達(dá)到抗菌效果,因此青霉素治療GAS失敗或與用藥開始的時間有關(guān)[23]。有研究表明,GAS菌株對青霉素的接種效應(yīng)明顯,即在高細(xì)菌密度和生長平臺期,細(xì)菌對青霉素的敏感性明顯降低[24]。采用中空纖維感染模型(可體外模擬體內(nèi)感染)研究發(fā)現(xiàn),輸注青霉素減少GAS 菌落數(shù)量的幅度與首次接種劑量有關(guān),在青霉素20 mg/q4h 的相同給藥方案下,高劑量接種組的細(xì)菌量減少幅度較小;青霉素連續(xù)輸注24 h后,接種效應(yīng)最為顯著,此后再應(yīng)用青霉素降低細(xì)菌量的作用沒有前24 h用藥作用明顯[24],此現(xiàn)象與不同增殖期GAS 的PBP 表達(dá)量不同的研究結(jié)果一致[23],這些研究突顯了早期治療的必要性。
2.3 共存細(xì)菌的作用
處于同一環(huán)境中的其他細(xì)菌產(chǎn)生β-內(nèi)酰胺酶對GAS 可提供間接保護(hù)作用。有研究發(fā)現(xiàn),應(yīng)用阿莫西林治療GAS 引起的咽扁桃體炎時,在患者咽部檢測到了耐阿莫西林的流感嗜血桿菌,其分泌包裹β-內(nèi)酰胺酶的外膜囊泡對GAS具有保護(hù)作用,在肉湯培養(yǎng)基中分別加入724 μg/mL 和1.2 mg/mL的外膜囊泡蛋白時,GAS阿莫西林MIC值從原來的0.016 μg/mL升至4 μg/mL和16 μg/mL,且用β-內(nèi)酰胺酶抑制劑克拉維酸鹽處理后,該種保護(hù)作用消失[25]。該研究表明感染部位其他菌群分泌的包裹β-內(nèi)酰胺酶的外膜囊泡與β-內(nèi)酰胺類藥物治療GAS感染失敗有關(guān)。
Geyrhofer 等[26]認(rèn)為,菌群存活與菌群死亡率及抗生素清除率均有關(guān)。首先,一部分細(xì)菌因暴露于抗生素而死亡,同時,存活細(xì)菌會產(chǎn)生分解或滅活抗生素的酶,從而降低抗生素濃度,當(dāng)抗生素濃度在所有細(xì)菌被清除前降低到某一不足以殺死細(xì)菌的濃度或以下時,則會有抗性菌群的存活,要有抗性細(xì)菌存活就需達(dá)到最小接種量。產(chǎn)β-內(nèi)酰胺酶共存細(xì)菌要產(chǎn)生GAS 保護(hù)作用也必需達(dá)到一定的接種量,即這些在GAS 感染部位共存的其他菌群數(shù)量與其為GAS提供的保護(hù)作用有關(guān)。
有研究發(fā)現(xiàn),雖然大腸桿菌單獨存在時對氨芐青霉素敏感,但當(dāng)與非耐藥枯草芽孢桿菌共存時,其可免受氨芐青霉素的清除,并對其他細(xì)菌的生長產(chǎn)生抑制作用[27]。該種現(xiàn)象的具體機制尚不明確,GAS 感染患者感染部位的非耐藥共存菌是否會導(dǎo)致其免受β-內(nèi)酰胺類藥物的清除需要進(jìn)一步的調(diào)查研究。
2.4 細(xì)菌持留性及生物膜的形成
細(xì)菌的持留性在抗生素治療失敗中也扮演了重要角色。2018 年,歐洲分子生物學(xué)組織定義了細(xì)菌“持留性”,即細(xì)菌一個細(xì)胞亞群在殺菌性抗生素治療中存活下來,但其并沒有產(chǎn)生耐藥性,且當(dāng)無抗生素時,其恢復(fù)增殖并保持藥物敏感性的特性。抗生素誘導(dǎo)是細(xì)菌產(chǎn)生持留性的觸發(fā)因素之一,誘導(dǎo)產(chǎn)生具有持留性菌群的MIC 值并無改變,但其最低殺菌濃度(minimum bactericidal concentration,MBC)值高于其他菌群。這可以解釋為何青霉素治療對藥物敏感的GAS 感染仍會失敗的情況[28]。有研究表明,GAS 被接種到非生物表面形成高細(xì)菌負(fù)荷的團(tuán)聚狀態(tài)(生物膜樣環(huán)境)時具有形成持留性的能力,并證明此現(xiàn)象與外排泵和菌細(xì)胞自身生長停滯有關(guān)[22]。臨床中嚴(yán)重GAS 感染患者即使接受了正規(guī)青霉素治療,但由于感染部位可達(dá)高細(xì)菌載量形成生物膜樣環(huán)境,產(chǎn)生的持留性細(xì)菌無法被清除,可能會因此導(dǎo)致治療失敗。
生物膜與抗生素不能清除GAS 密切相關(guān)。無癥狀患者口咽部的GAS 攜帶狀態(tài)與生物膜形成相關(guān),皮膚和咽部的GAS 感染部位均可發(fā)現(xiàn)生物膜[29]。不同于MIC及MBC,清除生物膜中的細(xì)菌,藥物需要達(dá)到最低生物膜根除濃度(minimum biofilm eradication concentration value,MBEC)。生物膜可使GAS對青霉素的耐受性提高2 500~5 000倍。有研究發(fā)現(xiàn),應(yīng)用外切糖苷酶去除咽細(xì)胞(pharyngeal cell)的聚糖物質(zhì)后,其表面所形成的GAS生物膜MBEC是未處理咽細(xì)胞表面GAS生物膜的2 倍余,說明聚糖物質(zhì)可降低GAS 生物膜MEBC,增加生物膜中GAS 對青霉素的敏感性[30]。此外,亦有研究證明精氨酸脫亞氨酶(arginine deiminase,ADI)促進(jìn)細(xì)菌生物膜的形成[31]。若能以咽細(xì)胞表面聚糖為基礎(chǔ),研發(fā)具有相似結(jié)構(gòu)或抑制ADI途徑的藥物,將其與青霉素聯(lián)用或可避免治療失敗。
2.5 GAS可內(nèi)化入細(xì)胞
通常將GAS 定義為胞外菌,但它亦會侵入細(xì)胞并在胞內(nèi)持續(xù)存在,以躲避免疫清除和抗生素作用[32]。研究表明,鏈球菌可通過多種機制粘附并內(nèi)化(internalization)入細(xì)胞[33]。青霉素脂溶性較低,對人體細(xì)胞膜的透過率低,不能有效清除胞內(nèi)菌。內(nèi)化入胞的GAS 免受青霉素清除,可引起反復(fù)感染和無癥狀的咽部攜帶狀態(tài)[34]。喹諾酮類抗生素在細(xì)胞內(nèi)與細(xì)胞外濃度的比值,比β-內(nèi)酰胺類抗生素高約8倍,具有較強的組織細(xì)胞滲透性。對GAS 侵入的細(xì)胞應(yīng)用阿莫西林和喹諾酮類藥物拉庫沙星(lascufloxacin,LSFX)后發(fā)現(xiàn),阿莫西林不能減少胞內(nèi)GAS量,而LSFX可有效減少內(nèi)化入宿主細(xì)胞內(nèi)的GAS[35]。近年來,有學(xué)者針對β-內(nèi)酰胺類藥物不能清除胞內(nèi)GAS 的問題進(jìn)行研究,探尋新的GAS感染治療方向。Lu等[36]發(fā)現(xiàn)血管內(nèi)皮生長因子可通過增強內(nèi)皮細(xì)胞中溶酶體活性及促進(jìn)異體吞噬從而有助于胞內(nèi)GAS的清除。
3 結(jié)語
盡管體外試驗中GAS 總是對青霉素等敏感,但GAS 體內(nèi)耐受青霉素等β-內(nèi)酰胺類藥物也已得到確證。GAS 體內(nèi)耐受青霉素等β-內(nèi)酰胺類藥物的機制尚無定論,可能與GAS 菌株的藥物敏感性有關(guān),也可能與機體內(nèi)的其他因素,包括GAS 的接種效應(yīng)、共存菌的作用、GAS 生物膜和細(xì)菌持留性,以及細(xì)菌內(nèi)化入細(xì)胞等。需要注意的是,雖然有青霉素等藥物清除細(xì)菌失敗的情況,但仍然少見,包括青霉素在內(nèi)的β-內(nèi)酰胺類藥物對大部分GAS 感染仍然有效,換用其他藥物不論是從經(jīng)濟(jì)還是療效考慮,均于患者無益[37]。臨床需要持續(xù)對治療失敗的情況保持警惕,并監(jiān)測GAS 分離株體外藥物敏感狀況,為GAS 體內(nèi)耐受β-內(nèi)酰胺類藥物的機制研究提供更多線索和證據(jù),促進(jìn)預(yù)防和治療GAS感染新策略的研發(fā)。
作者貢獻(xiàn)聲明:郭孟楊查閱及整理分析文獻(xiàn)、撰寫文章;姚開虎把握選題、修改文章、經(jīng)費支持。
利益沖突聲明:所有作者聲明不存在利益沖突。

