人工誘導泥鰍雌核發(fā)育的細胞學研究和誘導參數優(yōu)化
鐘汶蓉 陶彬彬* 徐 聞, 譚 娟 羅紅瑞宋焱龍 陳 戟 胡 煒, *
(1.大連海洋大學, 大連 116023; 2.中國科學院水生生物研究所, 淡水生態(tài)與生物技術國家重點實驗室, 湖北洪山實驗室,武漢 430072; 3.中國科學院大學, 北京 100049; 4.懷化學院, 懷化 418000)
雌核發(fā)育(Gynogenesis)是指需要兩性親緣種精子的刺激而促使卵子活化, 導致卵子只依靠雌性原核進行發(fā)育的一種特殊生殖方式[1,2]。人工誘導雌核發(fā)育技術通常指卵子在遺傳滅活的外源精子刺激下, 經染色體加倍過程后完全在母本遺傳信息控制下的發(fā)育[3], 該技術在魚類種質純化和全雌養(yǎng)殖魚類品種培育等方面發(fā)揮了重要作用。通過物理或化學方式進行人工雌核發(fā)育研究, 已獲得多種淡水、海水魚類的雌核發(fā)育后代, 如鯉(Cyprinus carpio)[4]、黃鱔(Monopterus albus)[5]、草魚(Ctenopharyngodon idella)[6]、半滑舌鰨(Cynoglossus semilaevis)[7]和牙鲆(Cynoglossus semilaevis)[8]等。
泥鰍(Misgurnus anguillicaudatus)屬于鯉形目、鰍科、花鰍亞科的泥鰍屬, 對環(huán)境具有極強的適應性, 是廣泛分布于亞洲地區(qū)的重要淡水經濟魚類。泥鰍素有“水中人參”的美譽, 因其肉質細嫩、味道鮮美[9]、營養(yǎng)價值高, 越來越受到消費者的青睞; 近年來, 泥鰍的市場需求量一直維持在較高的水平,2021年我國泥鰍養(yǎng)殖產量達到36.7086萬噸[10], 泥鰍具有生長的性別二態(tài)性, 雌性個體比雄性更大、生長更快[11], 培育全雌泥鰍養(yǎng)殖新品種具有巨大的市場前景。自然水體中存在著二倍體、三倍體、四倍體、五倍體和六倍體[12]等不同倍性的泥鰍, 染色體倍性操作是泥鰍育種的研究重點之一, 如人工誘導泥鰍雌核發(fā)育二倍體[13], 人工誘導四倍體泥鰍雄核發(fā)育二倍體[14], 二倍體泥鰍與四倍體泥鰍雜交[15]等。國內外相關研究一般是通過正交實驗來獲得泥鰍倍性操作的條件[16,17], 缺乏二倍體泥鰍雌核發(fā)育的細胞層面的研究。
本研究通過細胞觀察追蹤減數分裂過程中遺傳物質的變化特征, 獲得人工誘導泥鰍雌核發(fā)育的熱休克參數, 利用該參數成功實現泥鰍雌核發(fā)育的人工誘導, 并進一步通過核型和流式細胞技術對雌核發(fā)育的泥鰍胚胎進行檢測分析, 確定其倍性。本研究旨在建立精準的泥鰍雌核發(fā)育技術提供指導。
1 材料與方法
1.1 親本來源及催產方法
野生性成熟泥鰍(雌30尾及雄6尾)購買自湖南省懷化市集貿市場, 性成熟雄性黃河鯉(Cyprinus carpio)來自中國科學院水生生物所官橋養(yǎng)殖基地。泥鰍在實驗室暫養(yǎng)1周, 水溫26—28℃, 溶氧>5 mg/L, 保證餌料充足。在人工繁殖前1d, 雌泥鰍每尾經腹鰭下注射鯉垂體1 mg, HCG 50 IU, 雄泥鰍劑量減半; 雄鯉每公斤經胸鰭下注射鯉垂體2 mg, HCG 1000 IU。
1.2 異源精子滅活
選一尾雄鯉擠出精液, 按1∶4的比例加入Hanks’ Balanced Salt Solution (C0218, Beyotime)稀釋。加水激活精子, 解剖鏡下觀察精子活力并計時,若雄鯉的精子能快速開始游動且能持續(xù)游動50s以上, 則認為具有足夠的活力。玻璃皿中加入稀釋后的鯉精液1 mL, 厚度約1—2 mm。玻璃皿下墊碎冰降溫, 放于上方帶有紫外燈的搖床上進行精子滅活。照射前10min打開2支平行30 w紫外燈, 照距25 cm。照射10min后每1min鏡檢一次并計時, 若大部分雄鯉的精子遇水后呈“醉漢狀”游動且只能游動20s以下, 則停止照射, 冰上避光保存。
1.3 人工授精及熱休克處理
通過熱休克處理二倍體泥鰍與黃河鯉精子自交/雜交受精卵。擠出雄鰍精液, 用hanks保存液稀釋備用。雌鰍擠出成熟卵子, 12尾雌鰍卵子各分為5份, 3份分別與200 μL泥鰍精子, 200 μL黃河鯉精子, 200 μL滅活黃河鯉精子人工授精, 兩份與200 μL滅活黃河鯉精子人工授精, 混勻后加入少量曝氣水。加水后開始計時, 在第2min30s/3min30s將受精卵置于40—41℃進行熱休克處理刺激, 熱休克持續(xù)2min。獲得以下5種組合: A組(野生型組, 二倍體泥鰍卵×二倍體泥鰍精子)、B組(雜交組, 二倍體泥鰍卵×黃河鯉精子)、C組(未熱休克組, 二倍體泥鰍卵×滅活黃河鯉精子, 不進行熱休克)、D1組(雌核發(fā)育組, 二倍體泥鰍卵×滅活黃河鯉精子, 2min30s進行熱休克)和D2組(雌核發(fā)育組, 二倍體泥鰍卵×滅活黃河鯉精子, 3min30s進行熱休克)。置于24—26℃水溫孵化, 于9h、48h和168h統(tǒng)計受精率、畸形率和存活率, 在25h剝去卵膜進行形態(tài)學觀察, 50h進行形態(tài)學觀察。
1.4 受精細胞學觀察
以A(野生型組)為對照組, 對B(雜交組)、C(未熱休克組)和D2(雌核發(fā)育組)的胚胎發(fā)育早期過程進行熒光受精細胞學觀察。取樣時間分別為人工授精后0、1min、2min、3min、4min、5min、6min、7min、8min、9min和10min, 每時間段取卵20—30個。先室溫下用4%多聚甲醛溶液固定卵24h, 再用4%多聚甲醛4℃固定48h。在體視顯微鏡(SZ61, Olympus)下剝去卵膜, 0.1% Triton X-100溶液37℃金屬浴3min; 用PBS溶液清洗3次, DAPI(C1006, Beyotime) 染色液避光染色30min, 在抗熒光淬滅劑(BMU104-CN, Abbkine)中保存, 保存時間不超過12h。利用活體光切層照顯微鏡(SP8 DLS,Leica)進行觀察并拍照記錄。
1.5 胚胎染色體數目統(tǒng)計
取A(野生型組)、B(雜交組)、C(未熱休克組)和D2(雌核發(fā)育組)四組受精后24h胚胎各20—30個, 撕去卵膜與卵黃, 用0.08%秋水仙素(C804812, Macklin)處理3h, 1%檸檬酸鈉低滲20min,用預冷的卡諾固定液(甲醇∶冰醋酸=3∶1)固定3次,每次20min, 4℃低溫過夜。于1.8 m高處滴片, 酒精燈烤干。選擇中期分裂相用正置熒光顯微鏡(DM4B, Leica)拍照并計數。
1.6 DNA含量測定
以二倍體泥鰍體細胞DNA含量作為對照, 利用微流顆粒成像分析系統(tǒng)(CytoFlex S, Beckman)檢測以下各試驗樣品DNA含量。取父母本泥鰍以及黃河鯉尾靜脈血1 μL, 用200 μL Sysmex-Partec/CyStain?DNA 1step(05-5004, Merck millipore)染液稀釋成一定濃度, 經細胞過濾網過濾后進行測定。取獲得的每組受精后48h胚胎各10尾, 用1 mg/mL膠原酶Ⅳ(C8160, Solarbio) 37℃消化4h后, 用200 μL Sysmex-Partec/CyStain?DNA 1step染色, 經細胞過濾網過濾后進行測定。
1.7 數據處理
采用Excel統(tǒng)計, 數據均表示為平均值±標準差。分析均使用GraphPad Prism 9進行。兩組數據之間的差異通過獨立樣本t檢驗的方法進行檢測。在所有統(tǒng)計學比較中,P<0.05為差異顯著。
2 結果
2.1 泥鰍卵細胞第二次減數分裂細胞學觀察
對四組(野生型組、雜交組、未熱休克組和雌核發(fā)育組)人工授精后的泥鰍受精卵進行共聚焦3D時序成像。如圖1a, 在24—26℃水溫條件下, 單個泥鰍精子通過卵子受精孔進入內部, 促使卵子第二次減數分裂完成, 分裂成卵核以及第二極體。0—3min內, 精子逐漸向卵核靠近, 泥鰍卵內染色體聚攏在一起, 整齊地排列在赤道板上, 卵核與第二極體還未分開; 至5min, 觀察到染色體已經分開為兩份, 向著相反方向移動, 即第二極體已經與卵核分開;8min時, 仍可以觀察到有精子還未與卵核結合的情況; 10min時, 可觀察到第二極體正遠離受精核向外排出。當鯉精子作為異源精子通過受精孔進入卵子, 刺激泥鰍卵完成第二次減數分裂的共聚焦3D時序成像如圖1b, 在3—5min內, 泥鰍卵核第二極體分開, 10min內鯉精核與泥鰍卵核并未融合。當滅活的鯉精子通過受精孔進入卵子, 刺激泥鰍卵完成第二次減數分裂的細胞觀察時序圖如圖1c, 在4—6min內, 泥鰍卵核第二極體分開。當滅活的鯉精子通過受精孔進入卵子, 刺激泥鰍卵完成第二次減數分裂,并在人工授精后3min30s進行2min熱休克, 細胞觀察時序圖如圖1d, 在3—5min內, 泥鰍卵核第二極體分開, 精核在向卵核靠近時, 第二極體并未向外排出,且10min以后, 未觀察到有卵核、第二極體及精核的圖像, 表明此時卵核已經向卵子內部移動。
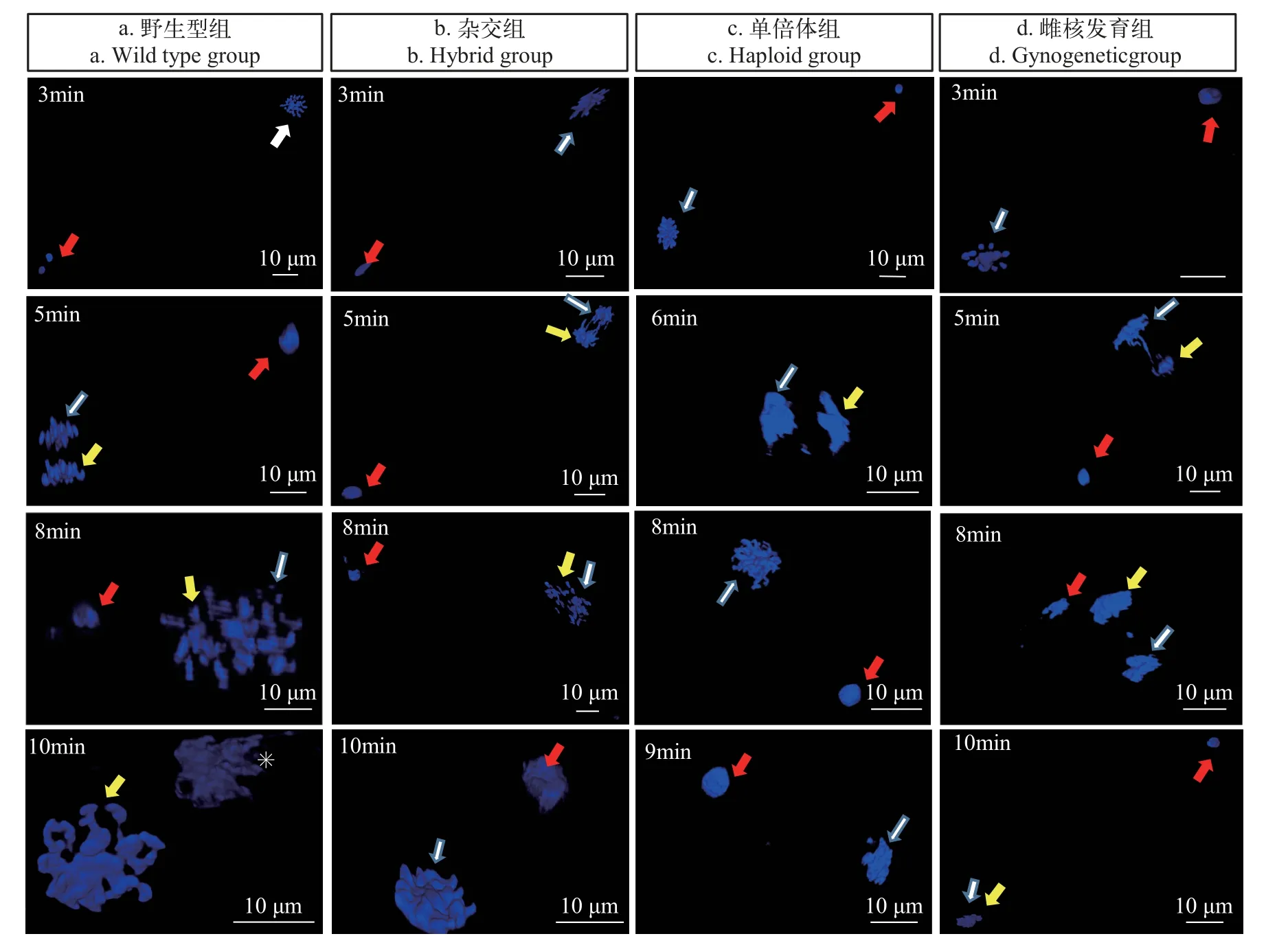
圖1 不同處理組受精卵受精細胞學觀察Fig.1 Fertilization cytology observation of fertilized eggs in different groups
2.2 確定人工誘導泥鰍減數分裂雌核發(fā)育參數
統(tǒng)計野生型、雜交型、單倍體和雌核發(fā)育組胚胎9h、48h和168h后的受精率、畸形率、存活率,各組數據進行兩兩比較的結果如表1。結果顯示野生型組(組A)的受精率和存活率最高、畸形率最低,且與其他組有顯著性差異(P<0.05); 雜交組(組B)與未熱休克組(組C)魚苗全部發(fā)育畸形, 且在開口前(7d內)全部死亡; 對比兩個雌核發(fā)育組(組D1, 在人工授精后2min30s后熱休克; 組D2, 在人工授精后3min30s后熱休克)的數據, 發(fā)現人工授精后3min30s開始熱休克比人工授精后2min30s開始熱休克產生的受精率和存活率更高, 畸形率更低, 但是兩組間無顯著性差異(P>0.05)。

表1 不同處理組胚胎的受精率、畸形率和存活率Tab.1 Fertilization rate, deformity rate, and survival rate of embryos in different groups
人工授精后25h及50h的不同處理組魚苗的形態(tài)觀察如圖2所示。授精后25h野生型組(圖2a) 、授精后50h野生型組(圖2e)與授精后25h雌核發(fā)育組 (圖2d) 、授精后50h雌核發(fā)育組(圖2h)均為發(fā)育正常的魚苗, 而授精后25h雜交組(圖2b) 、授精后50h雜交組(圖2f)與授精后25h未熱休克組 (圖2c) 、授精后50h未熱休克組(圖2g)的魚苗發(fā)育畸形, 出現身體扭曲, 尾部短且彎曲, 水腫, 圍心腔擴大、心血管畸形和黑色素增多等非正常形態(tài)。
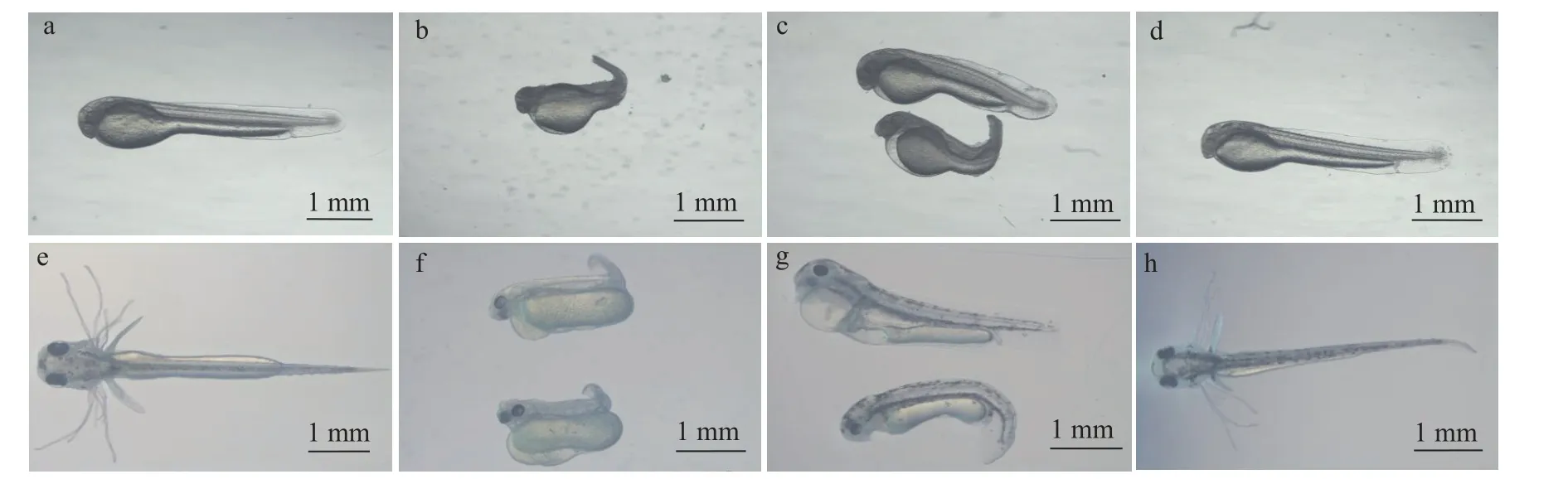
圖2 不同處理組幼魚的形態(tài)觀察Fig.2 Morphological observation of juvenile fish in different groups
2.3 雌核發(fā)育泥鰍的染色體數目分析
通過染色體計數法分析A(野生型組)、B(雜交組)、C(未熱休克組)、E(雌核發(fā)育組)4個處理組的染色體數目。結果表明, 不同處理組有不同頻率的整倍體和非整倍體, 野生型組多為正常二倍體, 染色體數目如圖3a (2n=50), 雜交組染色體數目近三倍體, 如圖3b (n+n=68), 未熱休克組染色體數目為正常單倍體如圖3c (n=25), 雌核發(fā)育組二倍體染色體數目如圖3d (2n=50)。
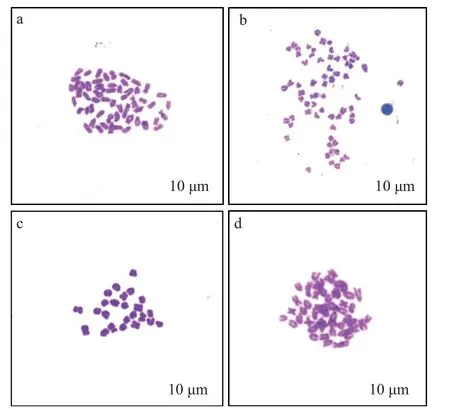
圖3 不同處理組胚胎的中期分裂相染色體Fig.3 The metaphase chromosome of embryos in different groups
二倍率最高的是泥鰍精子與泥鰍卵人工授精的野生型組, 眾數百分比為96.67%(圖4a); 其次是雌核發(fā)育組, 二倍體眾數(2n=50)百分比為64.71%(圖4b); 雜交組出現n+n=75的眾數百分比為0, 均不為25的整倍數(圖4c); 未熱休克組出現單倍體(n=25)的眾數百分比為96.97%(圖4d)。
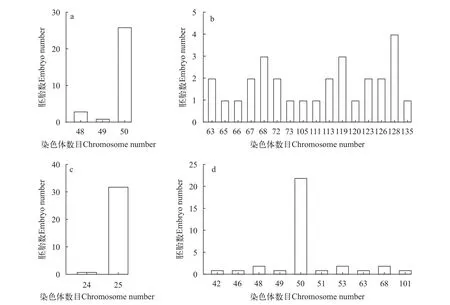
圖4 不同處理組染色體數目分布Fig.4 Distribution frequency of the number of chromosome in embryos of different groups
2.4 雌核發(fā)育泥鰍的相對DNA含量分析
利用流式細胞儀對父母本二倍體泥鰍、黃河鯉、子代野生型組胚胎、雜交組胚胎、未熱休克組胚胎、雌核發(fā)育組胚胎的核DNA相對含量進行測定(圖5)。因為胚胎早期細胞分裂較為旺盛, 所以出現了幾個峰值, 細胞頻率高的是處在有絲分裂G0—G1期的細胞。父本泥鰍(圖5a)、母本泥鰍(圖5b)、黃河鯉(圖5c)的DNA相對含量主要峰值在15—16, 野生型胚胎(圖5d)的DNA相對含量主要峰值在15—16, 雜交組胚胎(圖5e)的DNA相對含量主要在21—22, 單倍體胚胎(圖5f)的DNA相對含量主要峰值在8—9, 雌核發(fā)育胚胎(圖5g)的DNA相對含量主要峰值在15—16。通過比較可以看出, 雜交胚胎細胞的DNA相對含量是二倍體細胞的1.31—1.46倍, 未熱休克胚胎細胞的DNA相對含量是二倍體的0.50—0.56倍, 雌核發(fā)育胚胎細胞的DNA相對含量與二倍體相差不大。上述結果表明, 雜交組胚胎既不是二倍體, 也不是三倍體, 未熱休克胚胎為單倍體, 雌核發(fā)育胚胎為二倍體。
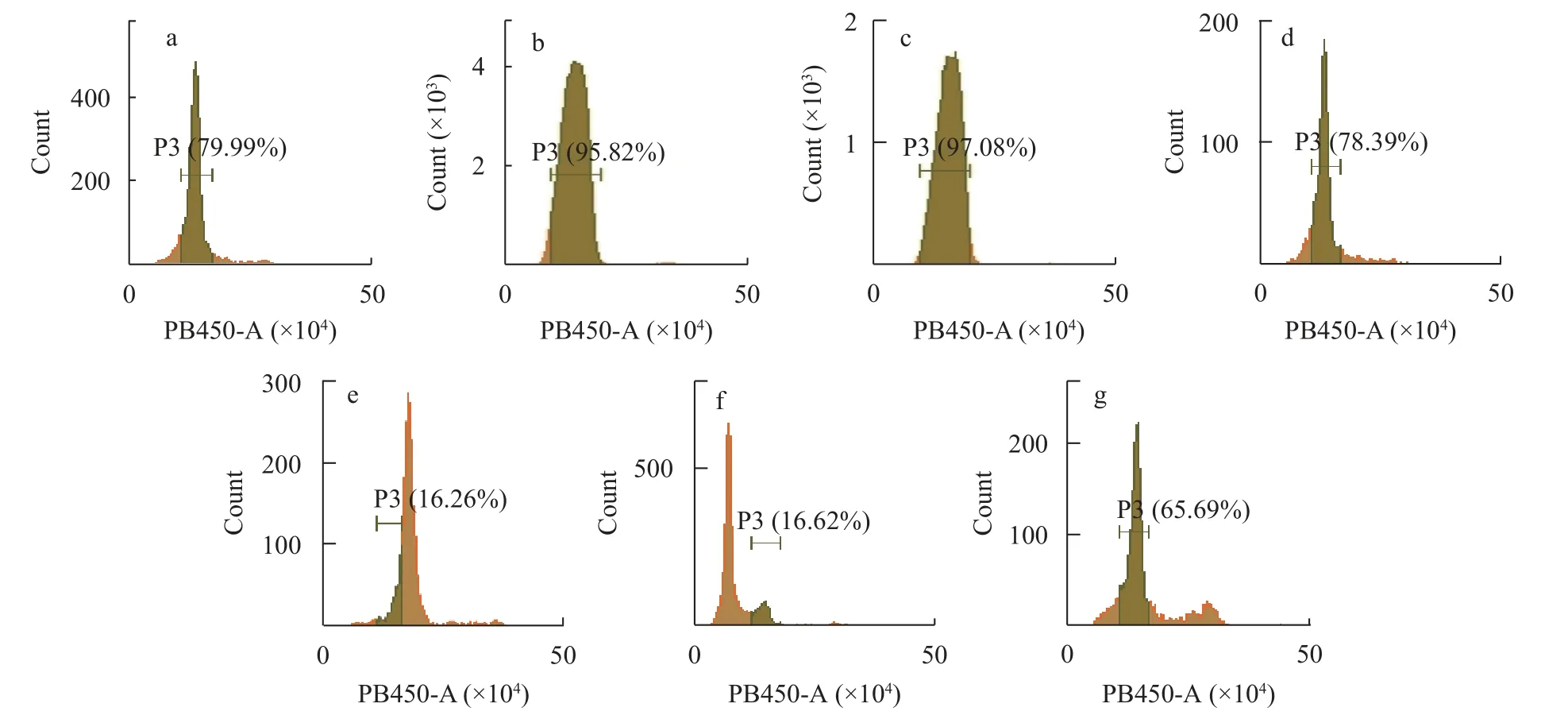
圖5 不同處理組胚胎相對DNA含量Fig.5 Relative DNA contents in embryos of different groups
3 討論
本研究通過共聚焦3D成像分析二倍體泥鰍卵的第二極體與卵核分開的過程, 獲得了熱休克人工誘導二倍體泥鰍雌核發(fā)育的參數。即在水溫24—26℃條件下, 二倍體泥鰍卵子與紫外滅活的黃河鯉精子授精3min30s, 于41℃的熱水中持續(xù)處理2min,常規(guī)孵化。利用該誘導參數, 本研究成功實現了人工誘導泥鰍減數分裂雌核發(fā)育, 并進一步通過分析實驗泥鰍的染色體數目和相對DNA含量, 確定人工誘導的減數分裂雌核發(fā)育胚胎為二倍體。
細胞DNA熒光染色與共聚焦3D成像相結合的技術為研究魚類生殖細胞減數分裂過程提供了新的技術手段, 如Zhang等[18]用了PI (碘化丙啶)紅熒光和DAPI藍熒光, 追蹤了異育銀鯽減數分裂染色體的動力學過程。本研究通過DAPI熒光染色后,采用光切層共聚焦3D顯微成像的方法, 對泥鰍早期胚胎第二次減速分裂中期、第二次減速分裂后期以及精卵融合、第二極體排出的核變化過程進行了時序觀察, 獲得了二倍體泥鰍卵第二極體染色體與卵染色體分離的時間參數, 該方法與已報道的泥鰍受精過程及第二極體排出過程中細胞學觀察法相比有明顯的優(yōu)勢。在為數不多的泥鰍受精細胞學觀察研究中, 胡雨等[19]通過掃描電鏡檢測和石蠟切片觀察, 觀察到二倍體泥鰍的受精后, 精子入卵時受精孔的表面及內部結構變化, 但是步驟較為復雜, 耗時較長。黃松錢等[20]使用了熒光染料DAPI,對誘導三倍體泥鰍受精卵及胚胎早期發(fā)育的遺傳物質進行了追蹤, 但在普通熒光顯微鏡下的圖像可能出現卵表面黏附精子的干擾, 且不易看出卵子與精子空間上的相對位置。本研究通過DAPI染色結合共聚焦3D成像分析, 觀察精子及卵子核移動的3D過程, 可以更為清晰地顯示染色體的高度螺旋狀態(tài),并且排除背景的雜色干擾。研究溫度休克處理對卵子的影響, 可以為建立精準的人工誘導雌核發(fā)育技術提供細胞學的理論依據。
在已報道的人工誘導泥鰍雌核發(fā)育的研究中,初步分析了第二極體形成和溫度休克處理的時間點, 但不同學者的研究結果不同。如胡雨等[19]通過組織觀察, 發(fā)現二倍體泥鰍第二極體形成的時間為授精后6—8min; 黃松錢等觀察到二倍體泥鰍授精后5—10min第二極體已形成且未排出; 趙振山等[21]發(fā)現大鱗副泥鰍卵與泥鰍精子授精后6—9min時雌核膨脹后向卵子內部移動, 提示此時第二極體已經形成; 何進[22]通過正交實驗發(fā)現二倍體泥鰍雌核發(fā)育授精后3min熱休克的處理效果最佳; 林忠喬等[14]發(fā)現四倍體泥鰍雄核發(fā)育授精后5min冷休克的處理效果最佳。以上研究中, 第二極體形成和溫度休克處理時間點的差異可能與卵子狀態(tài)、干法授精及孵化時的水溫、刺激卵子第二次減數分裂的精子來源的不同有關。本研究對比了在24—26℃水溫條件下, 泥鰍卵子分別與泥鰍精子、鯉精子及滅活的鯉精子進行人工授精后第二次減數分裂的細胞學過程, 其中使用滅活鯉精子刺激后的泥鰍卵子分別進行熱休克和未熱休克兩種方式處理。本研究觀察到滅活的鯉精子刺激泥鰍卵第二極體分開的時間是授精后4—6min, 用未滅活的鯉精子刺激分開的時間是授精后3—5min, 而使用滅活的鯉精子刺激后又熱休克, 泥鰍卵子第二極體與卵核分開的時間是授精后3—5min。不同卵子第二極體與卵核分開的時間點略有不同, 這主要受卵子質量的影響。將熱休克的起始時間設置在我們觀察到的第二極體與卵核最早出現分離后的30s, 即授精后3min30s, 并持續(xù)熱休克處理2min。在此過程中, 泥鰍卵的第二極體與卵核逐漸開始分離。在熱休克結束時, 即授精后5min30s, 基本所有的泥鰍第二極體與卵核已經分離, 使得熱休克處理最大程度影響泥鰍第二極體與卵核分開的過程。因此, 本研究將人工誘導泥鰍雌核發(fā)育的熱休克起始時間點優(yōu)化為受精后3min30s, 持續(xù)熱休克處理2min。比較發(fā)現, 泥鰍卵在滅活的鯉精子刺激后, 不進行熱休克處理的卵子, 其第二極體形成時間相較于熱休克處理的卵子稍晚, 精子的種類、精子的滅活和受精卵孵化水溫度的變化是否對泥鰍第二次減數分裂過程的快慢有影響還需要進一步研究。
本研究誘導獲得的雌核發(fā)育胚胎的畸形率為22.24%, 略高于授精3min后持續(xù)60min的冷休克畸形率(14.53%)[23]。但是, 本研究基于泥鰍雌核發(fā)育胚胎的細胞學特征建立的精準的人工誘導雌核發(fā)育技術, 通過熱休克得到的胚胎二倍率達64.71%,高于授精后3min后持續(xù)2min的熱休克(42.79%)、授精后3min后持續(xù)20min的冷休克(38.11%)。而且,本研究利用核型分析和流式細胞技術從染色體和DNA水平鑒定雌核發(fā)育誘導成功率, 相較于孵化率和正常苗率能更準確反映人工誘導泥鰍雌核發(fā)育的二倍化效率。熱休克的持續(xù)時間通常比冷休克更短[24,25], 因此找到泥鰍減數分裂第二極體形成及排出的精確時間對于泥鰍減數分裂雌核發(fā)育的研究具有重要意義。本研究發(fā)現第二極體與卵核分離到第二極體完成排出的時間為授精后5—10min,長于本研究中熱休克的持續(xù)時間2min。那么要對第二極體的排出進行干擾, 相較于在第二極體與卵核分開的早期進行熱休克處理, 在第二極體與卵核分開的中后期對受精卵進行熱休克處理的誘導效果是否會更好, 尚需要在未來的研究中進行分析。
綜上所述, 本研究通過觀察泥鰍第二次減數分裂時期卵染色體與第二極體染色體分離的過程, 基于細胞生物學特征, 優(yōu)化了人工誘導泥鰍減速分裂雌核發(fā)育熱休克的起始時間, 并利用優(yōu)化的誘導參數條件, 成功得到雌核發(fā)育二倍體泥鰍子代。在核物質層面分析泥鰍減速分裂雌核發(fā)育的條件, 為建立精準的人工誘導雌核發(fā)育技術快速獲得全雌的泥鰍新種質提供了可靠的技術支撐。

