Lir@BSA-PMF納米顆粒的制備及其細胞功能驗證
黃清昱,陳奇英,孫晟甲,吳幫衛,林 杉,阿力木江·買買提江
復旦大學附屬華山醫院 心內科,上海 200040
三分之二的糖尿病相關死亡是由動脈粥樣硬化性心血管疾病引起的[1],其危害十分嚴重。利拉魯肽(liraglutide,Lir)是胰高血糖素樣肽-1(glucagon-like peptide 1,GLP-1)的類似物,可通過下調主動脈晚期糖基化終末產物受體(the receptor of advanced glycation endproducts, RAGE)的表達降低動脈粥樣硬化病變程度[2],目前被廣泛用于糖尿病合并心血管疾病患者的治療。但其臨床應用局限為需要頻繁的腸胃外注射。為此,既往研究者合成了一種具有緩釋特性的利拉魯肽抗脂肪口服納米制劑[3]。
細胞膜包被的納米顆粒[cell membrane-coated nanoparticles(NPs),CNPs]被開發為仿生納米藥物遞送系統,可解決合成納米載體的過早清除、毒性和免疫原性問題[4]。有研究表明,血小板與斑塊有較強的親和性,可以靶向動脈粥樣硬化病變部位[5-6]。基于以上發現,本研究制備了一種具有靶向和緩釋雙功能的新型載藥血小板膜仿生納米載體,該材料結構穩定,細胞功能良好。
1 材料與方法
1.1 材料
1.1.1 血小板來源:采集新鮮小鼠全血濃縮血小板,-80 ℃保存。
1.1.2 主要試劑:人胚胎腎細胞系(human embryonic kidney 293T,HEK293T)、牛血清白蛋白(bovine-serum albumin,BSA)、2-嗎啉乙磺酸(2-morpholinoethanesulphonic acid,MES)溶液(Sigma-Aldrich公司);氫氧化鈉、鹽酸、十二烷基硫酸鈉(sodium dodecylsulfate,SDS)和二硫蘇糖醇(DL-dithiothreitol,DTT)(阿拉丁公司);利拉魯肽(MCE公司);利拉魯肽檢測試劑盒(酶聯免疫吸附試驗法)(武漢云克隆科技股份有限公司);細胞和組織裂解液(上海碧云天生物技術有限公司)。
1.2 方法
1.2.1 血小板膜碎片(platelet membrane fragments,PMF)的制備:按照文獻[7]中的方法制備血小板膜碎片。
1.2.2 BSA納米顆粒的制備:1)BSA活化:稱取120 mg BSA,60 mg SDS和4.4 mg DTT,置于5 mL樣品瓶中,加入3 mL超純水,充分溶解,90 ℃油浴,180 r/min,2 h。2)MES緩沖溶液(0.1 mol/L)的配制:0.97 g MES溶于50 mL超純水中,用0.1 mol/L NaOH調節pH值到4.25~4.8。3)BSA空白納米粒的合成:以1 mL體系為例,取25、50和100 μL活化后的BSA溶液(40 mg/mL),加入到24孔板中,然后加入975 μL MES溶液,在37 ℃,800 r/min振蕩合成4 h。合成的納米粒用100 ku的超濾管,4 000 r/min,10 min 洗滌2~3次,4 ℃保存,備用。
1.2.3 Lir@BSA納米粒的形成:以1 mL體系為例,取25 μL活化后的BSA溶液(40 mg/mL),加入24孔板中,然后加入950 μL MES溶液,在震蕩條件下加入25 μL Lir溶液,最后在37 ℃,800 r/min振蕩合成4 h。合成的納米粒用100 ku的超濾管,4 000 r/min,10 min洗滌2~3次,最后用BCA蛋白試劑盒測定BSA蛋白濃度,4 ℃保存。
1.2.4 PMF濃度的測定:用BCA蛋白試劑盒測定BSA蛋白濃度。
1.2.5 Lir@BSA-PMF納米顆粒的制備:配制1 mg/mL Lir@BSA溶液和1 mg/mL PMF溶液,按照體積比為1∶1混合,之后將上述混合液通過0.22 μm聚碳酸酯膜來回擠出20次,沉淀重懸備用。
1.2.6 透射電子顯微鏡(transmission electron microscope,TEM):檢測BSA、Lir@BSA和Lir@BSA-PMF微觀形貌。
1.2.7 動態光散射(dynamic light scattering,DLS):對比載藥和包膜前后納米顆粒的水合動力學直徑和Zeta電位,判斷血小板膜是否包覆在BSA表面。
1.2.8 酶聯免疫吸附試驗法:利用利拉魯肽檢測試劑盒檢測藥物利拉魯肽的包封率、負載率和Lir@BSA-PMF中藥物利拉魯肽的釋放情況,具體方法如下:根據差量法測定負載率和包封率。將合成Lir@BSA-PMF過程中得到的濾液,用利拉魯肽檢測試劑盒(酶聯免疫吸附試驗法)檢測濾液中Lir的含量,通過差量法計算負載率和包封率,公式如下:負載率(%)=(藥總量-濾液中藥含量)/(載體總量+藥總量-濾液中藥含量)×100%。包封率(%)=(藥總量-濾液中藥含量)/藥總量×100%。釋放率:將Lir@BSA-PMF納米顆粒放在磷酸緩沖鹽(phosphate buffer saline,PBS)(pH=7.4)溶液中,37 ℃恒溫箱中靜置24 h,在2、4、6、8、10、12和24 h時間點取出溶液,4 ℃保存。用試劑盒對不同時間點的溶液進行測定,利用累積法計算不同時間點Lir的釋放量。
1.2.9 十二烷基硫酸鈉聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分析蛋白質結構: 為證明修飾的Lir@BSA-PMF具有完整的膜蛋白質,用RIPA裂解物裂解PMF和Lir@BSA-PMF并離心(14 000 r/min,5 min)以獲得提取的膜蛋白質,然后用BCA蛋白質濃度測定試劑盒測定蛋白質濃度。將樣品與上樣緩沖液混合并煮沸5 min。將PMF和Lir@BSA-PMF上樣于15% SDS-PAGE膠(每孔35 μg)中,并在120 V下電泳1.7 h。然后將其用考馬斯亮藍染色60 min,并采集結果。
1.2.10 CCK-8法檢測細胞存活:將BSA、PMF和Lir@BSA-PMF納米溶液與HEK293T細胞在體外共培養,觀察細胞的生存情況。HEK293T細胞在含有10%胎牛血清培養基中培養。取96孔板,每孔接種1×104個細胞,24 h后棄掉培養基,替換為納米材料溶液,同時設置空白組,每組分別3個平行樣品,置于培養箱中孵育24 h。分別在4、8、12、24、48和72 h后棄掉液體,每孔替換上100 μL培養基(含10 μL CCK-8溶液),繼續在37 ℃,5% CO2的細胞培養箱中孵育2 h后,用酶標儀測量各孔在450 nm處吸光度(A450 nm)值。再根據公式:細胞存活率=(實驗組吸光值/空白組吸光值)×100%,計算細胞存活率。
1.2.11 細胞內活性氧的檢測:使用二氯二氫熒光素二乙酸酯(2′7′-dichlorofluorescin diacetate,DCFH-DA)探針檢測HEK293T細胞內ROS水平:將HEK293T細胞以1×104個細胞/孔的密度接種于24孔細胞培養板中,37 ℃,5% CO2的潮濕培養箱中過夜貼壁培養。將HEK293T細胞用1 μg/mL的脂多糖(lipopolysaccharide,LPS)預先處理24 h造模。然后與 BSA、Lir、PMF和Lir@BSA-PMF納米顆粒共孵育48 h,PBS洗滌細胞2次,每孔加入含10 μmol/L DCFH-DA探針的 PBS孵育48 h。通過激光共聚焦顯微鏡觀察細胞的熒光強度。
1.2.12 細胞攝取實驗檢測對納米顆粒攝取能力:將HEK293T細胞(2×105個/孔)接種于24孔板中,與標記的納米顆粒在37 ℃下分別孵育0、2、4、6和8 h。孵育結束后,棄藥液,用PBS清洗2次,加入胰蛋白酶消化細胞,全培養基終止消化,收集細胞。接下來,為進一步研究細胞對Lir @BSA-PMF納米系統的攝取,在預定時間內,用激光共聚焦顯微鏡對HEK293T細胞中FITC標記的NPs進行拍照。并用Imagine J軟件對其熒光值進行半定量計算。
1.3 統計學分析
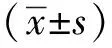
2 結果
2.1 Lir@BSA-PMF仿生納米載體的形貌觀測
BSA、Lir@BSA和Lir@BSA-PMF組均為粒徑大小均一的球狀納米粒子。單獨的BSA納米粒子的尺寸范圍為25~35 nm,而負載了藥物Lir之后,其尺寸范圍在35~50 nm。包裹了血小板膜的納米粒子Lir@BSA-PMF中出現了很多納米碎片,并且Lir@BSA-PMF的納米尺寸范圍為20~35 nm。
2.2 Lir@BSA-PMF仿生納米載體的尺寸檢測
單獨的BSA水合動力學動力直徑為28.2 nm,而負載了藥物之后,Lir@BSA粒徑略微有增加,從28.2 nm增加到32.7 nm,進一步包裹納米血小板膜之后,Lir@BSA-PMF粒徑值為26.2 nm(圖2)。

圖1 BSA、Lir@BSA和Lir@BSA-PMF的透射電鏡顯微鏡照片Fig 1 TEM images of BSA, Lir@BSA and Lir@BSA-PMF

圖2 BSA、Lir@BSA和Lir@BSA-PMF粒徑分布Fig 2 Particle size distribution of BSA, Lir@BSA and Lir@BSA-PMF
2.3 Lir@BSA-PMF仿生納米載體的Zeta電位測定
Lir與BSA納米粒子復合之后,Zeta電位值發生改變,Lir@BSA納米顆粒合成成功。包裹血小板膜之后,Lir@BSA-PMF的Zeta電位值進一步降低,血小板膜碎片成功包覆在Lir@BSA納米顆粒表面,形成Lir@BSA-PMF仿生納米載體(圖3)。

圖3 BSA、Lir、Lir@BSA和Lir@BSA-PMF的Zeta電位Fig 3 Zeta potential of BSA, Lir, Lir@BSA and
2.4 Lir@BSA-PMF仿生納米載體的粒徑穩定性
Lir@BSA-PMF在PBS(pH=7.4)溶液中具有良好的穩定性,48 h內納米粒子粒徑維持在25 nm左右(圖4)。

圖4 Lir@BSA-PMF粒徑穩定性Fig 4 Particle size stability of Lir@BSA-PMF
2.5 Lir@BSA-PMF仿生納米載體的包封率和負載率
測試結果顯示:Lir@BSA-PMF的包封率和負載率分別為85.56%和7.96%。
2.6 Lir@BSA-PMF仿生納米載體的釋放率
Lir@BSA-PMF在PBS(pH=7.4)溶液中,24 h累計釋放率為77.06%(圖5)。

圖5 Lir@BSA-PMF中Lir的釋放效率Fig 5 Release efficiency of the Lir in Lir@BSA-PMF
2.7 Lir@BSA-PMF仿生納米載體中完整膜蛋白質結構的驗證
在PMF和Lir@BSA-PMF組中檢測到相同的蛋白質條帶分布,血小板膜在包覆藥物Lir和BSA納米顆粒之后,仍然保留著相似的膜蛋白質結構分布(圖6)。

圖6 PMF和Lir@BSA-PMF的SDS-PAGE分析Fig 6 SDS-PAGE analysis of PMF and Lir@BSA-PMF
2.8 Lir@BSA-PMF仿生納米載體的生物相容性驗證
BSA、PMF和Lir@BSA-PMF組中加入納米粒子后,各組HEK293T細胞存活率沒有統計學顯著性差異(圖7)。

圖7 CCK-8檢測BSA、PMF and Lir@BSA-PMF HEK293T細胞活力的影響
2.9 Lir@BSA-PMF仿生納米載體對細胞氧化損傷的影響
正常的HEK293T細胞的DCFH-DA熒光強度較低,用1 μg/mL LPS刺激之后,其熒光強度明顯增加,成功構建氧化損傷模型。在體外HEK293T細胞的LPS模型中分別加入BSA、Lir、PMF和Lir@BSA-PMF納米顆粒之后,BSA和PMF組的熒光強度與模型組基本一致,而Lir和Lir@BSA-PMF組的熒光強度逐漸減弱(圖8A)。LPS刺激之后,與正常細胞相比,LPS模型組的熒光值顯著增加(P<0.05),ROS損傷模型構建成功后,在LPS模型細胞中加入Lir和Lir@BSA-PMF納米粒溶液后,與ROS損傷模型組相比,其熒光值顯著性下降(P<0.05)(圖8B)。

LPSa.model group of LPS stimulation; *P<0.05 compared with control; # P<0.05 compared with LPSa; △ P<0.05 compared with PMF.
2.10 Lir@BSA-PMF仿生納米載體的細胞吞噬效果
隨著培養時間的延長,Lir@BSA-PMF納米粒子在細胞中的綠色熒光強度逐漸增多(圖9A)。隨著時間的增加,細胞吞噬量逐漸增加(圖9B)。

圖9 Lir@BSA-PMF納米顆粒的細胞吞噬效果Fig 9 Lir@BSA-PMF Effect of cellular phagocytosis of
3 討論
動脈粥樣硬化是以斑塊和炎癥為特征的動脈血管疾病,高脂血癥、高血壓、炎性反應和氧化應激引起的慢性動脈損傷是導致其發生發展的主要原因[8]。目前該疾病主要的治療方法是藥物治療。GLP-1在2型糖尿病(type 2 diabetes mellitus,T2DM)中具有特殊地位,因為它具有刺激胰島β細胞分泌胰島素的能力[9]。GLP-1受體激動劑是對GLP-1結構進行修飾后獲得,其半衰期進一步延長,外源性給藥后可提高體內活性的GLP-1水平,使其在體內達到有效濃度,從而改善胰島素敏感性,并發揮降低血糖、血壓及體質量的作用[10]。本研究使用的藥物利拉魯肽作為GLP-1受體激動劑,是T2DM治療領域的研究熱點[11]。
近期研究結果顯示將藥物與納米粒子結合起來形成納米載藥,可降低藥物毒性以及增加在特定部位的富集,利于動脈粥樣硬化的治療[12]。本研究使用的BSA納米載體是牛血清中的一種球蛋白,實驗結果顯示BSA、PMF和Lir@BSA-PMF本身對HEK293T細胞均無殺傷能力,Lir@BSA-PMF穩定規則的納米球狀結構可被細胞攝取。相比于單獨的納米顆粒,包裹血小板膜碎片的納米顆粒尺寸有輕微減小,且粒徑分布變寬,這可能與Lir@BSA-PMF的制備過程中來回擠出有關。在來回擠出的過程中納米顆粒形狀變得更加規整,同時也可能會出現部分納米顆粒被擠碎的現象。
藥物遞送過程中的生物屏障可阻止納米藥物載體在患病部位的積累,從而會限制藥物治療時的有效率[13]。另外有研究表明,血小板可通過誘導單核細胞遷移富集到動脈粥樣硬化斑塊上[14]。本研究使用血小板膜片對納米顆粒進行修飾,制備的仿生納米藥物遞送系統是由血小板膜偽裝成的納米顆粒,更加容易在復雜的生物環境中運行[15];納米顆粒表面保留的膜蛋白質結構可延長其在血液中的循環,同時具有靶向斑塊遞送以及受控釋放的特點。本研究結果顯示Lir@BSA-PMF載藥納米仿生載體24 h內可持續緩慢釋放藥物利拉魯肽。
綜上所述,本研究制備的Lir@BSA-PMF載藥納米仿生載體具有良好的生物相容性和抗氧化損傷能力,具備優異的藥物包封率和藥物緩釋效果,同時可被細胞攝取并且保留了血小板膜上的蛋白質。

