紫紺型先天性心臟病患兒瘦素及其受體的表達與低氧誘導因子-1α相關
國 蓉,張 森,袁建輝,李肖玨,周姝含,李守軍,陳燕燕*
中國醫學科學院 北京協和醫學院 阜外醫院 1.內分泌科;2.小兒心臟外科一病區,北京 100037
瘦素(leptin,LEP)是由脂肪細胞分泌,由肥胖基因編碼表達的蛋白質產物,被認為是與能量平衡調節有關的激素[1]。大量研究表明,瘦素的多種生物學作用是通過結合細胞膜上靶瘦素受體(Ob gene receptor,Ob-R),啟動相應信號轉導系統實現的[2-4],但瘦素在心肌能量平衡調節中的作用尚不清楚。而低氧誘導因子-1a(hypoxia-inducible factor 1α,HIF-1α)通過與低氧心肌中存在的特定低氧反應元件(hypoxia response element,HRE)結合來激活靶基因的轉錄[5],對心臟的正常發育、結構重構和功能具有重要作用。
嬰兒體重過輕是先天性心臟病手術的獨立危險因素。雖然既往研究對紫紺型先心病嬰兒的營養和生長狀況進行了調查,但尚未明確其與血清瘦素水平之間的關聯。瘦素及其受體在心肌能量平衡調節中的作用也尚不清楚。
臨床數據檢測到HIF-1α通過與胰腺癌細胞、乳腺癌細胞的HRE結合,直接激活和調控Ob-R的轉錄[6-8],但這并非是腫瘤細胞所特有的。瘦素及其受體參與了低齡低體質量紫紺型先心病的發生發展過程。因此,本研究目的是探討紫紺型先心病患兒瘦素及其受體的表達和HIF-1α的關聯。
1 材料與方法
1.1 材料
1.1.1 患兒:本研究納入了2019年1月至2020年10月在阜外醫院先心病外科接受手術治療的52例6月齡以下的先心病患兒,根據動脈血氧分壓(PaO2)分為紫紺組30例[PaO2<90 mmHg(1 mmHg=0.133kPa),女性12例,男性18例];非紫紺組22例(PaO2≥90 mmHg,女性9例,男性13例)。參與研究者均簽署知情同意書,該研究得到阜外醫院機構倫理委員會的批準和支持。具體分組情況:所有患兒均經臨床評估和實驗室檢查(包括胸部X線、心電圖、超聲心動圖和心導管測壓)確診。無一例患兒伴有發育異常或重度肺動脈高壓(表1)。

表1 紫紺和非紫紺型先心病患兒的年齡、BMI、瘦素水平Table 1 Age, BMI and leptin levels in children with cyanotic and acyanotic groups
1.1.2 動物:SPF級Sprague-Dawley雄性大鼠,4周齡,體質量80~120 g,[北京華阜康生物科技股份有限公司提供,動物合格證號 SCXK(京)2020-0004]。
1.1.3 試劑(盒):人瘦素(LEP)ELISA試劑盒和ECL超敏發光液 (賽默飛世爾科技(中國)有限公司);地高辛和 Trizol(默克化工技術 (上海) 有限公司);水合氯醛 (北京雷根生物技術有限公司);甲醛緩沖液(上海聯邁生物工程有限公司);蘇木精-伊紅染色(北京艾普希隆生物科技有限公司);BCA蛋白質含量檢測試劑盒(北京索萊寶科技有限公司)。
1.2 方法
1.2.1 患兒入組情況:計算患兒入院時BMI值(體質量/身高2),晨起6點至8點采集血液,動脈血氣分析測定PaO2。手術中,在主動脈阻斷后立即從右心室流出道獲取心肌組織。本研究經阜外醫院倫理委員會批準通過,所有患者均簽署知情同意書。
1.2.2 動物的分組及處理:將大鼠分為常氧組、低氧組[置于10% O2(低氧) 艙內維持4周];和地高辛干預組[于低氧第14天至第21天腹腔注射地高辛(2 mg/kg)]。
1.2.3 收集標本,測定右室肥厚指數:模型建立后從股動脈取血樣本(0.5 mL),在血氣分析儀中進行分析。然后打開胸腔后立即取出心臟,并將其解剖成右心室(right ventricle,RV)、左心室+室間隔(left ventricle+ventricular septum,LV+S),通過測定重量以獲得右室肥厚指數(RV/LV+S)。
1.2.4 HE檢測組織學:分離心臟,用3.7%甲醛緩沖液固定,石蠟包埋,連續切片用蘇木精-伊紅(HE)染色。在HE染色切片上,示蹤100~200個心肌細胞核清晰的心肌細胞輪廓。常規光鏡檢查和奧林巴斯圖像分析儀系統用于組織學分析。
1.2.5 RT-qPCR檢測基因表達:取心臟組織80~100 mg,轉移到消毒好研磨缽中,加液氮研磨成粉末,參照 Trizol 法提取細胞總RNA,紫外分光光度法測定RNA的濃度,擴增Ob-R的引物序列,上游為: 5′-CA-GATTCGATATGGCTT AAATGG-3′, 下游為: 5′-GTTAAAAT-TCACAAGGG AGGCA-3′,擴增產物的長為 474 bp。擴增內參照 β-actin 基因的引物序列,上游為 5′-CGTAAAGACCTC-TATGCC AA-3′,下游為 5′-AGCCATGCCAAATGTGTCAT-3′,擴增產物的長度為473 bp。PCR的反應條件為: 94 ℃ 45 s,57 ℃ 45 s,72 ℃ 90 s,共進行35個循環。取PCR產物進行10 g/L瓊脂糖凝膠電泳,紫外照相并行圖像分析。
1.2.6 Western blot檢測蛋白表達:取80~100 mg心臟組織,按照說明書方法提取總蛋白,BCA法檢測蛋白質濃度。加入5×上樣緩沖液,煮沸后經十二烷基硫酸鈉聚丙烯酰胺凝膠電(SDS-PAGE,8%)分離蛋白,轉膜,5%脫脂牛奶封閉,孵育一抗β-actin(1∶5 000)、LEPR(1∶2 000)、HIF1-α(1∶1 000),4 ℃過夜,TBST洗膜3次,二抗常溫孵育1.5 h(1∶10 000),TBST洗膜3次,電化學發光法(ECL)顯色曝光,經Image J軟件處理并分析圖像。
1.2.7 ELISA檢測血清瘦素和VEGF水平:4 ℃、3 000×g,離心20 min,取血清保存在-80 ℃。用ELISA試劑盒測定。
1.3 統計學分析
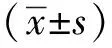
2 結果
2.1 血清瘦素水平與BMI正相關
與非紫紺型相比,紫紺型先心病患兒的BMI水平明顯降低(P<0.001)(表1)。
紫紺組VEGF平均水平高于非紫紺組(P<0.05)。而血清瘦素水平無差異。經BMI校正(瘦素/BMI)的血清瘦素水平在紫紺組高于非紫紺組(P<0.05)。先心病患兒的血清瘦素水平與BMI呈顯著正相關(r=0.335,P=0.018 6)(圖1)。
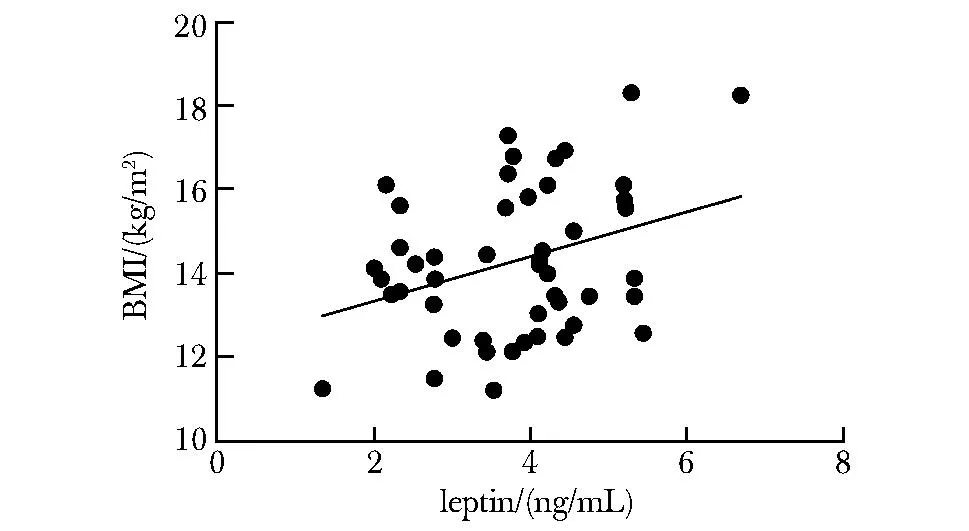
圖1 先心病患兒瘦素水平與BMI呈正相關Fig 1 Correlation between leptin levels and BMI in children with CHD
After 4 weeks of hypoxia (Hyp), HIF-1α and Ob-R were quantitatively detected by Western blot; Ob-R.Ob gene receptor receptor; *P<0.05 compared with the ayanotic group.
2.2 紫紺心肌HIF-1α過表達與低氧促進的Ob-R表達
紫紺組HIF-1α蛋白表達增加。作為陽性對照,HIF-1α過表達后VEGF mRNA表達也明顯增強。隨著HIF-1α蛋白的過表達,Ob-R蛋白及mRNA表達水平也相應增加(圖 2)。
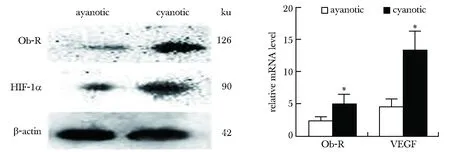
2.3 HIF-1α抑制劑可降低心肌組織Ob-R的表達
低氧組心肌組織Ob-R mRNA表達較常氧組顯著升高, 地高辛組Ob-R mRNA表達水平較低氧組下降。地高辛明顯抑制低氧組HIF-1α的表達。隨著HIF-1α的表達下調后,Ob-R的蛋白水平也明顯低于對照組 (圖3)。抑制Ob-R的表達的同時既增加了紫紺大鼠體質量 (P<0.05)(圖4),又改善了右室心肌重塑程度 (圖5)。
Hypoxic rats were given digoxin (2 mg/kg), and saline was used as a control; after 4 weeks of hypoxia, Ob-R was quantified by Western blot (7 rats in each group);*P<0.05 compared with the normoxia group; Hyp.hypoxia;Ob-R.Ob gene receptor receptor;# P<0.05 compared with the hypoxic group.
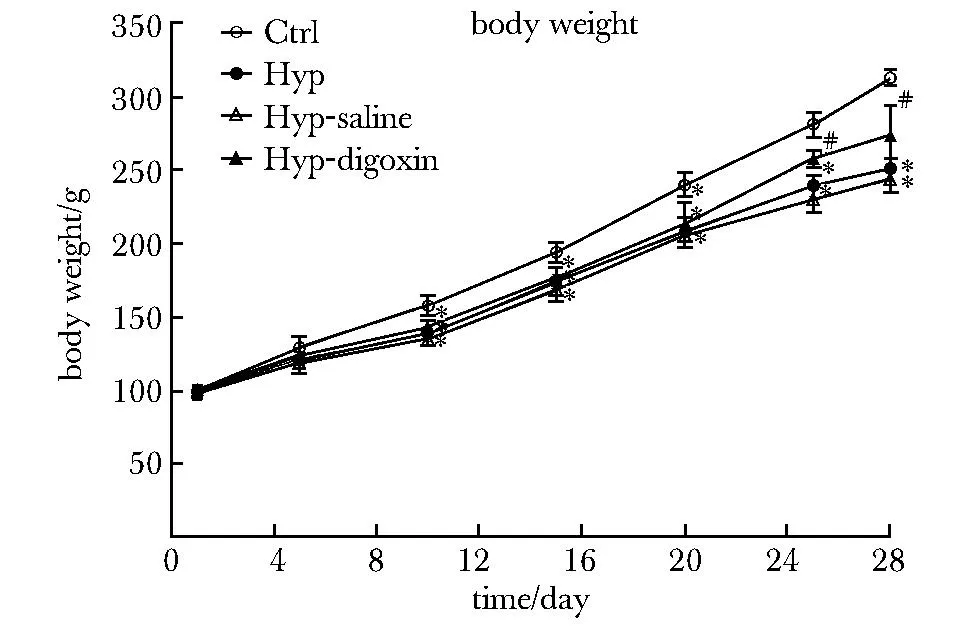
Hypoxic rats had significant body mass loss compared to normoxic rats, but weight loss was improved after hypoxic rats received digoxin.No significant differences were observed between hypoxic and hypoxic controls; Hyp.hypoxia; *P<0.05 compared with the normoxia group; # P<0.05 compared with the hypoxic group.
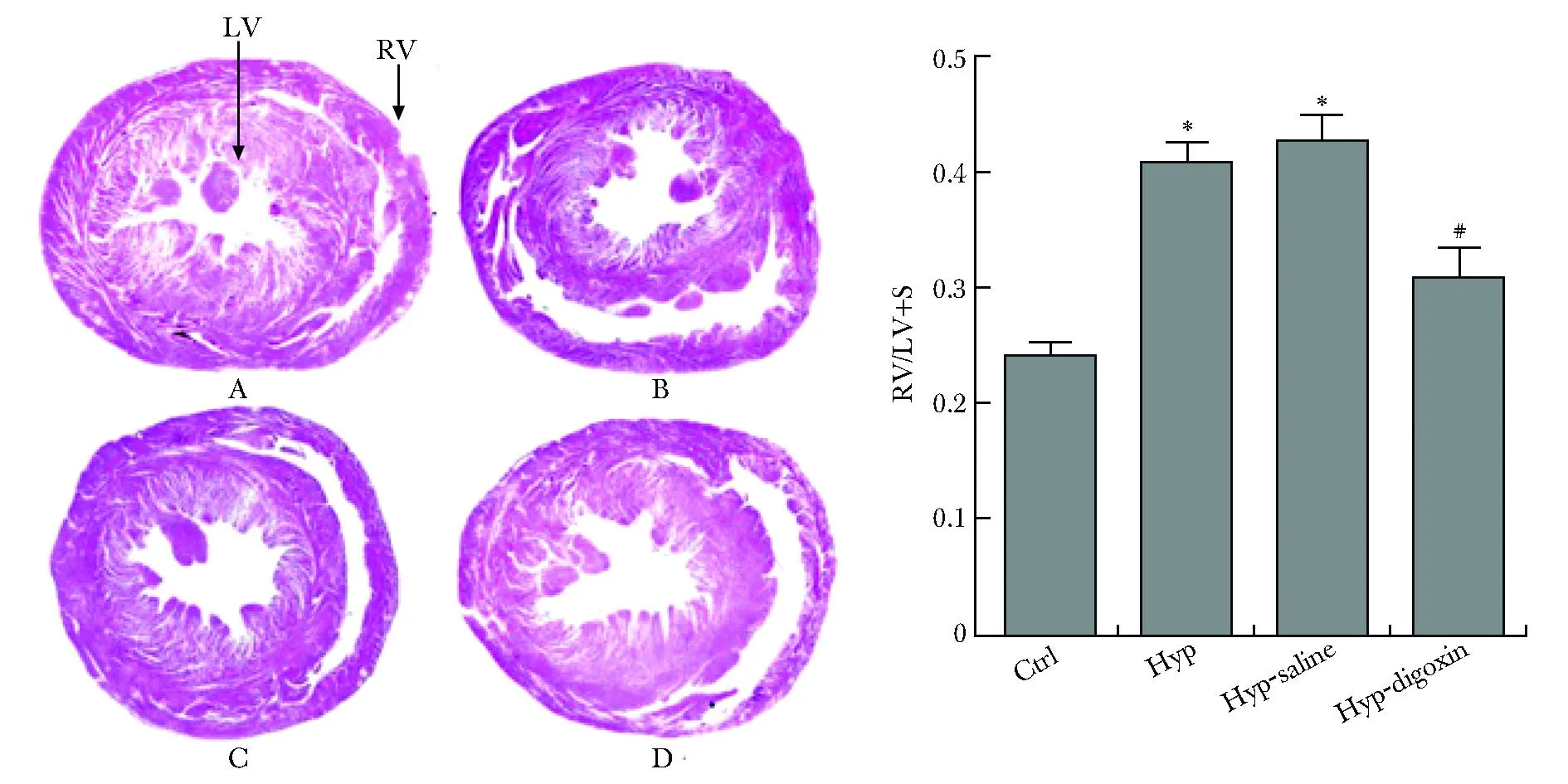
A.Hyp rats in normoxia group; B.hypoxia group; C.Hyp rats in hypoxia control group had obvious right heart enlargement, disordered arrangement of myocardial cells and myocardial fibers, broken, missing, and blank areas; D.while Hyp-digoxin group the arrangement of myocardial cells was more regular, and the morphology of RV was also improved than before; RV/LV+S.weight ratio of right ventricle to left ventricle plus septum ;*P<0.05 compared with the normoxia group; # P<0.05 compared with the hypoxic group.
3 討論
瘦素參與了多種疾病的發病機制[5,9-10],先天性心臟病患兒生長遲緩的原因是多因素的。在紫紺型先天性心臟病中,許多患兒表現出明顯的脂肪減少。在本研究中,紫紺組的體質量、BMI明顯低于非紫紺組,紫紺組和非紫紺組的瘦素濃度相似可能是意想不到的,但經BMI校正過的瘦素水平呈現顯著差異。先心病患兒循環系統中血清瘦素與BMI呈顯著正相關。
由于Ob-R的變化對瘦素刺激的敏感性至關重要[11],Ob/Ob-R軸參與了紫紺型先心病患兒的能量代謝。闡明Ob-R調節機制有助于了解先心病患兒心肌組織能量代謝的情況。在本研究中,Ob-R在心肌組織中的表達與HIF-1α的表達高度相關;低氧導致Ob-R mRNA和蛋白的表達增加。
既往研究通過對Ob-R啟動子區域的篩選,發現位于HIF832/-828區域的3個潛在的HRE是結合HIF-1α和增強Ob-R表達的關鍵元件[12-14]。臨床資料還檢測到瘦素、Ob-R和HIF-1α在乳腺和結腸疾病中的相關性,進一步支持瘦素和Ob-R都是HIF-1α的靶基因,但本研究創新性的證實了在心肌中表達的相關性。紫紺組Ob-R表達顯著增加,證實了Ob/Ob-R軸參與了心肌的能量代謝,其內在機制作用還需進一步研究證實。
地高辛是臨床常用的正性肌力藥物,也是HIF-1α的特異性抑制劑[15]。對于Ob-R高表達的患者,特異性的HIF-1α抑制劑可能有利于改善低齡紫紺型先心病患兒的能量代謝,如果HIF-1α調節Ob-R的表達,HIF-1α的下調可能會削弱這種作用。地高辛動物實驗表明,阻斷HIF-1α的表達可以下調Ob-R的表達,不僅可以改善紫紺大鼠體質量,還可以改善右室重構。
綜上所述, Ob-R在心肌組織中顯著表達,HIF-1α可直接調節Ob-R的表達,Ob/Ob-R系統可能是進一步改善低齡紫紺型先心病患兒預后的新途徑。

