鳥苷酸結合蛋白GBP1和GBP2抑制豬輪狀病毒體外復制
陳姝宇,朱雪蛟,周金柱,陶 然,張雪寒,索朗斯珠,貢 嘎*,李 彬*
(1.西藏農牧學院動物科學學院,林芝 860000;2.江蘇農業科學院 獸醫研究所,南京 210000; 3.獸用生物制品(泰州)國泰技術創新中心,泰州 225300)
輪狀病毒(rotavirus,RV)近年來嚴重危害全球健康,是一種人畜共患病原體。輪狀病毒為呼腸孤病毒科、輪狀病毒屬,是一種分節段的雙鏈核糖核苷酸(dsRNA)病毒,其結構呈二十面對稱體,無囊膜,三層衣殼結構包裹11段dsRNA,分為結構蛋白(VP1~VP4、VP6~VP7)和非結構蛋白(NSP1~NSP5)。輪狀病毒分為10個群(A~J),其中A、B、C及H群在世界各地流行并感染人和多種動物。其中I群來源于犬,J群來源于蝙蝠[1]。目前,人類輪狀病毒A群(rotavirus-A,RVA)有較完整數據,但對豬輪狀病毒(porcine rotavirus,PoRV)的了解有限。PoRV A群造成的危害最為嚴重,也是我國主要高發病原體[2]。G9型RVAs是G型中最常見的,被認為是豬和人類的新興病原體,豬源G9型的所有基因組片段與人類RVAs的基因組片段相似度高,所以豬被認為是人類G9型RVAs的潛在宿主庫[3]。豬輪狀病毒A群是引起幼齡仔豬發生急性胃腸炎的主要病原之一,主要侵害小腸上皮細胞[4],多以糞口途徑傳播,其中小于10~20日齡的仔豬感染后死亡率極高,且該病原經常與其他病原混合感染。雖然有多種檢測輪狀病毒的方式,比如ELISA、PCR等[5-6],但目前尚無治療輪狀病毒的有效藥物,接種疫苗仍是預防輪狀病毒性胃腸炎暴發的重要措施。
鳥苷酸結合蛋白1(guanylate-binding protein-1,GBP1)、鳥苷酸結合蛋白2(guanylate binding protein-2,GBP2)屬于鳥苷酸結合蛋白家族(GBPs),是干擾素(interferon,IFN)誘導的 GTPases 超家族(65~72 ku)成員,GBP1、GBP2能夠被干擾素誘導表達。GBPs家族具有GTPase酶活性結構域,有多篇文獻報道其活性與抗病毒作用相關[7-8],主要作用為抵抗原生動物感染[9-11]、抑制細菌增殖、抗病毒復制、抗腫瘤作用以及促進炎癥反應形成,在抗病原微生物反應中發揮著重要作用。已有多項研究表明,GBP1對豬繁殖與呼吸綜合征病毒(porcine reproductive and respiratory syndrome virus, PRRSV)[12]、豬偽狂犬病病毒(pseudorabies virus, PRV)[13-14]、口蹄疫病毒(foot-and-mouth disease virus, FMDV)[15]、腦淋巴結心肌炎病毒(encephalomyocarditis virus, EMCV)和水皰型口炎病毒(vesicular stomatitis virus, VSV)[16]等多種病毒均有抗病毒作用。然而,GBP1、GBP2 在 PoRV 感染過程中的作用目前還未見研究報道,基于此,探索GBP1、GBP2蛋白的未知功能及對PoRV復制的影響,深層次理解PoRV復制的分子機制,為候選抗病基因提供重要的證據。
1 材料與方法
1.1 病毒、細胞和質粒
PoRV A群G9P[7]型毒株NJ2012,包含11段dsRNA(NCBI序列號MT874983~MT874993)[17]、恒河猴細胞MA104細胞和pCDNA3.1(+)真核表達質粒,均由江蘇省農業科學院獸醫研究所保存。
1.2 試劑
GAPDH小鼠單克隆抗體、GBP1鼠多克隆抗體、GBP2兔多克隆抗體購自Proteintech公司;胎牛血清(四季青FBS)、DMEM培養基購自Gibco公司;2Phanta Master Mix高保真酶/2Phanta Max Master Mix(Dye Plus)、HiScript?II Q RT SuperMix for qPCR/5 HiScript?II Q RT SuperMix for qPCR逆轉錄酶、ChamQ Universal SYBR qPCR Master Mix、2×AceQ qPCR Probe Master Mixa、50×ROX Reference Dye 2b購自Vazyme公司;NSP5熒光定量PCR引物及探針購自生工公司;轉染試劑Lipo3000、T4 DNA Ligase(40000 EU)連接酶、KpnⅠ、BamHⅠ、ApaⅠ和XhoⅠ限制性內切酶購自Thermo Fisher公司;RIPA蛋白裂解液和胰酶購自碧云天公司;大腸桿菌感受態Trans5α購自Transgen公司;泛GTPase酶抑制劑(CID-1067700)購自Selleck公司。
1.3 引物設計與合成
分別根據豬源的GBP1基因(Gene ID: 100151938)、GBP2基因(Gene ID: 100153137),使用Snapgene軟件設計引物,由擎科生物科技有限公司合成。在引物的5′端和3′端添加限制性內切酶位點KpnⅠ、BamHⅠ、ApaⅠ和XhoⅠ。引物序列見表1、siRNA序列見表2。

表1 引物片段序列Table 1 Primer fragment sequences

(續表1 Continued)

表2 siRNA片段Table 2 siRNA fragments
1.4 GBP1和GBP2分段基因的擴增及真核重組質粒的構建
按Vazyme試劑盒說明書提取細胞內的RNA,并反轉錄為cDNA,反轉錄體系:16 μg RNA,4 μL 5 HiScript?II Q RT SuperMix for qPCR,反應條件為50 ℃ 15 min,85 ℃ 5 s。PCR擴增反應體系為:cDNA模板2 μL,2 Phanta Max Master Mix(Dye Plus)12.5 μL,上游引物(10 μmol·L-1)1 μL,下游引物(10 μmol·L-1)1 μL,加ddH2O 補足25 μL。反應程序:95 ℃預變性2 min;95 ℃變性15 s,58 ℃退火15 s,72 ℃延伸2 min;共30個循環;72 ℃再延伸5 min。最后用濃度為1%瓊脂糖凝膠分析擴增產物大小。
將條帶大小正確的GBP1全長、GBP2(47-592 aa)、(131-592 aa)基因片段、GBP1、GBP2的G、M、E、ME截斷體和pCDNA3.1(+)空載體同時使用KpnⅠ、BamHⅠ、ApaⅠ和XhoⅠ雙酶切回收,T4 DNA連接酶過夜連接后,轉化大腸桿菌感受態Trans 5α。次日,挑取單菌落培養提取重組質粒,再酶切鑒定確定條帶大小,并送測序分析序列的正確性。
1.5 PoRV感染對GBP1和GBP2表達影響試驗
將MA104細胞消化后鋪于24孔板,置于37 ℃、5% CO2培養箱中,待細胞長滿單層,將107TCID50·mL-1毒價的PoRV(NJ 2012)病毒液按0.1 MOI接毒量感染細胞,接毒后分別在0、1、6、12和24 h收取細胞,Western blot檢測PoRV病毒和GBP1、GBP2表達情況。同時設置(+)PoRV接毒組和(-)PoRV未接毒組。
1.6 GBP1、GBP2基因的過表達
將MA104細胞消化后鋪于24孔板,置于37 ℃、5% CO2培養箱中,待細胞長滿單層,Lipo3000轉染重組質粒,參照說明書進行正向轉染操作。pCDNA3.1(+)、GBP1全長、GBP2(47-592 aa)、(131-592 aa)、GBP1、GBP2的G、M、E、ME截斷體轉染至MA104細胞后繼續培養。轉染后24 h,按0.1 MOI感染PoRV病毒液,接毒后12 h左右,收取細胞。通過定量PCR和Western blot方法分別檢測PoRV和GBP1、GBP2基因在mRNA和蛋白水平的變化。
1.7 GBP1、GBP2基因的siRNA干擾試驗
前期細胞鋪板、培養和轉染方法同“1.6”所描述,按照轉染試劑說明書進行操作。將轉染重組質粒更換為GBP1、GBP2的siRNA基因片段,對照組由pCDNA3.1(+)空載體更換為公司合成的Negative control(NC)空白對照,序列見表1。轉染后24 h,按0.1 MOI接毒量感染PoRV,接毒后12 h,收取細胞,檢測在mRNA水平上GBP1、GBP2和病毒基因PoRV-NSP5變化和蛋白水平上PoRV-VP6的變化,分析干擾GBP1、GBP2表達對PoRV復制的影響。
1.8 GBPs泛GTPase酶活性區域抑制試驗
前期細胞鋪板、培養、轉染及接毒方法同“1.6”所描述,分成兩組,過表達組操作同“1.6”,抑制組分別在接毒前1 h和接毒后1 h加入泛GTPase酶活性抑制劑,濃度每孔10 μmol。繼續培養,接毒后12 后收取細胞,定量PCR和Western blot分別檢測PoRV和GBP1、GBP2基因在mRNA和蛋白水平的變化。
1.9 Western blot檢測
蛋白樣品的制備:棄掉細胞板中培養基,收取細胞,加PBS重懸,加RIPA裂解液,冰上裂解10 min,加蛋白上樣緩沖液,混勻后金屬浴煮沸10 min,SDS-PAGE分析并進行Western blot鑒定。用半干轉膜法將蛋白轉至硝酸纖維素膜上,5%脫脂奶粉封閉2 h,含0.5%吐溫-20的磷酸鹽緩沖液(PBST)洗膜3次,根據檢測靶標選擇對應抗體,4 ℃過夜孵育,次日PBST洗膜3次,再孵育對應一抗和二抗,繼續室溫孵育60 min,PBST洗滌后,ECL曝光檢測。
1.10 熒光定量PCR檢測
分別使用SYBR Green法和探針法檢測GBP和PoRV基因表達情況,引物序列見表1。GBP1和GBP2基因用SYBR Green法檢測體系和擴增程序。熒光定量體系:ChamQ Universal SYBR qPCR Master Mix 5 μL,qGBP1、qGBP2-F 0.2 μL,qGBP1、qGBP2-R 0.2 μL,模板cDNA 3 μL,ddH2O補足10 μL。熒光定量程序:95 ℃預變性30 s;95 ℃變性10 s,60 ℃延伸30 s,熔解曲線為默認程序。PoRV-NSP5基因用探針法檢測,熒光定量體系為:2×AceQ qPCR Probe Master Mixa10 μL,50×ROX Reference Dye 2b0.4 μL,qNSP5-F 0.4 μL,qNSP5-R 0.4 μL,TaqMan Probe 0.2 μL,Template cDNA 2 μL,ddH2O補足20 μL。熒光定量程序:95 ℃預變性5 min;95 ℃變性 10 s,60 ℃延伸30 s,熔解曲線為默認程序。GBP1、GBP2的qPCR引物序列見表3。

表3 qPCR引物片段序列Table 3 qPCR primer fragment sequences
1.11 病毒毒價檢測
將MA104細胞消化后鋪于24孔板,置于37 ℃、5% CO2培養箱中,待細胞長滿單層,用5 μg·mL-1含胰酶的DMEM培養基稀釋病毒,按照10倍比稀釋,從10-1稀釋到10-10。每孔加入100 μL稀釋好的病毒液,每個稀釋度重復8孔,對照孔加入100 μL 5 μg·mL-1含胰酶的DMEM培養基維持。每日觀察病變并記錄,一般觀察5 d左右。按照Reed-Muench兩氏法計算結果。
1.12 數據統計分析
所有試驗數據均采用統計學分析/試驗數據均利用GraphPad Prism9軟件作圖,通過one-way ANOVA進行統計分析,并通過Tukey’s multiple comparisons test進行組內多重比較,其中,*表示差異較顯著為(P<0.05),**表示差異顯著(P<0.01),***表示差異極顯著(P<0.001),****表示差異極顯著(P<0.000 1)。
2 結 果
2.1 重組質粒的構建
以豬腎細胞反轉錄后的cDNA為模板,成功擴增出全長pCDNA3.1-GBP1-HIS(1 773 bp)、pCDNA3.1(+)-GBP2(47-592 aa)-HIS(1 635 bp)和pCDNA3.1(+)-GBP2(131-592 aa)-HIS(1 383 bp)片段。
以GBP1和GBP2的全長質粒為模板,成功擴增出GBP1的pCDNA3.1-GBP1-G-HIS(840 bp)、pCDNA3.1-GBP1-M-HIS(243 bp)、pCDNA3.1-GBP1-E-HIS(600 bp)、pCDNA3.1-GBP1-ME-HIS(930 bp)和GBP2的pCDNA3.1-GBP2-G-HIS(840 bp)、pCDNA3.1-GBP2-M-HIS(531 bp)、pCDNA3.1-GBP2-E-HIS(279 bp)、pCDNA3.1-GBP2-ME-HIS(933 bp)四段結構域截斷體,瓊脂糖凝膠分析顯示與預期結果一致(圖1 A、C、D)。以上重組質粒經KpnⅠ、BamHⅠ、ApaⅠ和XhoⅠ雙酶切鑒定,可見與預期結果大小一致(圖1 B、E、F),并且測序結果與GenBank 序列一致,沒有突變。

A. GBP1、GBP2基因的PCR擴增[1. GBP1(1 773 bp)全長基因擴增產物;2. GBP2(47aa-592aa)(1 635 bp)基因擴增產物;3. GBP2(131aa-592aa)(1383bp)基因擴增產物];B. pCDNA3.1(+)-GBP1-全長-HIS、pCDNA3.1(+)-GBP2-(47、131-592aa)-HIS重組質粒的酶切驗證;C. GBP1截斷體G、M、E、ME基因的PCR擴增;D. GBP2截斷體G、M、E、ME基因的PCR擴增;E. pCDNA3.1(+)-GBP1-HIS截斷體G、M、E、ME重組質粒的酶切驗證;F. pCDNA3.1(+)-GBP2-HIS截斷體G、M、E、ME重組質粒的酶切驗證;M. DL2000 DNA相對分子質量標準 A. PCR amplification of GBP1 and GBP2 genes, 1. Full-length gene amplification product of GBP1 (1 773 bp), 2. Gene amplification product of GBP2 (47aa-592aa) (1 635 bp), 3. Gene amplification product of GBP2 (131aa-592aa) (1 383 bp); B. Enzymatic verification of pCDNA3.1(+)-GBP1-full-length-HIS, pCDNA3.1(+)-GBP2-(47, 131-592aa)-HIS recombinant plasmids; C. PCR amplification of GBP1 truncated G, M, E, ME genes; D. PCR amplification of GBP2 truncated G, M, E, ME genes; E. Enzymatic validation of pCDNA3.1(+)-GBP1-HIS truncator G, M, E, ME recombinant plasmid; F. Enzymatic validation of pCDNA3.1(+)-GBP2-HIS truncator G, M, E, ME recombinant plasmid; M. DL2000 DNA molecular weight standard圖1 重組質粒構建與驗證Fig.1 Recombinant plasmid construction and validation
2.2 PoRV感染MA104細胞后不同時間GBP1、GBP2蛋白的表達情況
按0.1 MOI接毒量PoRV感染細胞,接毒后6、12、24 h分別收取(+)PoRV接毒組和(-)PoRV未接毒組樣品,通過Western blot和相對熒光定量PCR,結果顯示,接毒后6、12、24 h PoRV-VP6(40 ku)蛋白表達逐漸升高,GBP2(65 ku)蛋白表達逐漸升高,接毒組GBP1(65 ku)蛋白與未接毒組組相比,在6和12 h表達明顯升高(圖2A)。與不同時間對應未接毒組相比較,接毒組的GBP1、GBP2基因mRNA拷貝數均逐漸升高,接毒后6 h,接毒組GBP1、GBP2表達量無明顯變化。接毒后12 h,GBP1基因mRNA拷貝數升高7倍左右,GBP2基因mRNA拷貝數升高5倍左右。接毒后24 h,GBP1、GBP2基因表達量達到最高,GBP1基因mRNA拷貝數升高15倍左右,GBP2基因mRNA拷貝數升高12倍左右(圖2B、2 C)。結果表明,在MA104細胞中,PoRV感染能上調GBP1、GBP2的表達。
2.3 siRNA干擾GBP蛋白表達對PoRV復制的影響
針對GBP1、GBP2基因的特異性siRNA轉染進MA104細胞24 h后,按0.1 MOI感染PoRV,接毒后12 h收取樣品。通過Western blot、定量PCR、毒價測定等方法檢測,結果顯示,與無關干擾NC接毒組相比較,干擾GBP1、GBP2后的接毒組,PoRV-VP6蛋白表達量升高(圖3 A),干擾GBP1、GBP2組的PoRV-NSP5基因mRNA拷貝數均升高至2倍以上(圖3 B)。干擾GBP1組的毒價升高至108TCID50·mL-1,干擾GBP2組的毒價升至接近108TCID50·mL-1(圖3 C)。結果表明,GBP1、GBP2蛋白表達下調后,PoRV復制明顯升高。

A. 蛋白水平上GBP1、GBP2的表達+表示PoRV接毒組;-表示PoRV未接毒組;hpi表示病毒接毒時間;B. mRNA水平上GBP1的表達 ;C.mRNA水平上GBP2的表達;6、12、24 hpi表示PoRV不同時間接毒組;6 h-mock、12 h-mock、24 h-mock表示不同時間未接毒組(差異性分析指同時間接毒組與未接毒組相比較)。***.P<0.001;****.P<0.000 1 A. Expression of GBP1 and GBP2 at the protein level + indicates PoRV attached group; - indicates PoRV unattached group; hpi indicates the time of virus attachment; B. Expression of GBP1 at the mRNA level; C. Expression of GBP2 at the mRNA level; 6 hpi, 12 hpi, 24 hpi indicate PoRV unattached group; 6 h-mock, 12 h-mock, 24 h-mock indicate PoRV unattached group, 12 h-mock, 24 h-mock denote the uninfected group at different times (differential analysis refers to the comparison of the simultaneous indirect poisoning group with the uninfected group).***.P<0.001;****.P<0.000 1圖2 接種病毒后不同時間點GBP1、GBP2蛋白在細胞內的復制水平Fig.2 Replication levels of GBP1 and GBP2 proteins in cells at different time points after virus inoculation

A. PoRV-VP6蛋白水平變化;B. PoRV-NSP5 mRNA表達的變化;C. PoRV毒價的變化。**.P<0.01;****.P<0.000 1 A. Change in PoRV-VP6 protein level; B. Change in PoRV-NSP5 mRNA expression; C. Change of PoRV virulence value. **.P<0.01;****.P<0.000 1圖3 干擾GBP1、GBP2蛋白后PoRV復制水平變化Fig.3 Changes in PoRV replication levels after interference with GBP1 and GBP2 proteins
2.4 過表達GBP1、GBP2蛋白對PoRV復制的影響
將重組質粒pCDNA3.1(+)-GBP1-HIS(1-590 aa、65 ku)和pCDNA3.1(+)-GBP2-HIS(47-592 aa、60 ku)(131-592 aa、55 ku)轉染進MA104細胞24 h后,按0.1 MOI 感染PoRV,接毒后12 h,進行Western blot、定量PCR、毒價測定。結果顯示,與轉染對照質粒的接毒組(Mock組)相比,過表達GBP1、GBP2后PoRV-VP6蛋白表達下降(圖4 A),過表達GBP1接毒組,PoRV-NSP5基因mRNA拷貝數降低60%,過表達GBP2(47-592 aa)PoRV-NSP5基因mRNA拷貝數降低44%、GBP2(131-592 aa)PoRV-NSP5基因mRNA拷貝數降低46%(圖4 B),過表達GBP1接毒組的PoRV毒價降低至104TCID50·mL-1左右,過表達GBP2接毒組PoRV毒價降至105TCID50·mL-1左右(圖4 C)。結果表明,過表達GBP1、GBP2蛋白抑制PoRV的復制。

A. PoRV-VP6蛋白水平變化;B. PoRV-NSP5 mRNA表達的變化;C. PoRV毒價的變化。**.P<0.01;***.P<0.001 A. Change in PoRV-VP6 protein level; B. Change in PoRV-NSP5 mRNA expression; C. Change of PoRV virulence value.**.P<0.01;***.P<0.001圖4 過表達GBP1、GBP2蛋白后PoRV復制水平變化Fig.4 Changes in PoRV replication levels after overexpression of GBP1 and GBP2 proteins
2.5 過表達GBP1、GBP2蛋白對PoRV不同復制時間的影響
初步驗證GBP1、GBP2蛋白對PoRV的抑制作用后,將重組質粒pCDNA3.1(+)-GBP1-HIS和pCDNA3.1(+)-GBP2-HIS(47-592 aa、131-592 aa)轉染進MA104細胞24 h后,以0.1 MOI感染PoRV,并在接毒后0、6、12、24 h 4個時間點分批收樣,進行Western blot、定量PCR檢測。結果顯示,與轉染對照質粒的接毒組(Mock組)相比,接毒0 h,過表達GBP1、GBP2后接毒組的PoRV-VP6蛋白未見明顯條帶,PoRV-NSP5基因表達無明顯差異。接毒后6 h,Mock組的PoRV-VP6蛋白表達未見明顯條帶,過表達GBP1的PoRV-NSP5基因mRNA拷貝數表達下降38%,過表達GBP2(47-592 aa)的PoRV-NSP5基因mRNA拷貝數降低27%、GBP2(131-592 aa)的PoRV-NSP5基因mRNA拷貝數降低24%。接毒后12 h細胞生長狀態最好,過表達GBP1、GBP2后接毒組的PoRV-VP6蛋白的表達均下降、過表達GBP1的PoRV-NSP5基因mRNA拷貝數表達下降51%,過表達GBP2(47-592 aa)的PoRV-NSP5基因mRNA拷貝數降低42%、GBP2(131aa-592aa)的PoRV-NSP5基因mRNA拷貝數降低40%。接毒后24 h,過表達GBP1、GBP2后,PoRV-VP6蛋白的表達下降、過表達GBP1的PoRV-NSP5基因mRNA拷貝數表達下降35%,過表達GBP2(47-592 aa)的PoRV-NSP5基因mRNA拷貝數降低20%、GBP2(131-592 aa)的PoRV-NSP5基因mRNA拷貝數降低29%(圖5A、5 B)。結果表明,過表達GBP1、GBP2在接毒后12 h抑制PoRV的復制效果最明顯,24 h其次,說明GBP1、GBP2在PoRV吸附、入侵等前期階段沒有明顯效果,GBP對病毒基因轉錄水平在6 h開始有明顯抑制作用,而對病毒蛋白在接毒后12、24 h發揮抑制效果。

A.PoRV-VP6蛋白水平變化;B.PoRV-NSP5 mRNA表達的變化(每不同時間組與對應時間Mock組間比較)。*.P<0.05;**.P<0.01 A. Changes in PoRV-VP6 protein levels; B. Changes in PoRV-NSP5 mRNA expression (comparison between each different time group and the corresponding time Mock group).*.P<0.05;**.P<0.01圖5 過表達GBP蛋白不同時間的PoRV復制水平變化Fig.5 Changes in PoRV replication levels at different times of overexpression of GBP protein
2.6 抑制GTPase酶活性對PoRV的影響
利用廣譜GTPase酶抑制劑泛GTPase酶抑制劑(CID-1067700),驗證抑制劑對過表達GBP1、GBP2蛋白后PoRV感染的影響。將重組質粒pCDNA3.1(+)-GBP1-HIS和pCDNA3.1(+)-GBP2-HIS(47-592 aa、131-592 aa)轉染進MA104細胞24 h后,分成酶活性非抑制組(Overexpression)和酶活性抑制組(Inhibition)。根據酶抑制劑推薦接種劑量10 nmol,設置6種劑量梯度。PoRV感染MA104細胞,接毒后12、24 h后兩個時間點收樣。通過CCK8方法、Western blot、定量PCR檢測。結果顯示,抑制劑加入MA104細胞后,6.25 nmol、12 h細胞狀態最好,細胞活力最高,酶抑制劑毒性最小(圖6 A)。Inhibition組加入抑制劑并過表達GBP1、GBP2后接毒,與Mock-Inhibition組比較,GBP1-Inhibitor、GBP2-Inhibitor組PoRV-NSP5基因mRNA拷貝數表達量均上升至1.5倍左右(圖6 B)、PoRV-VP6蛋白表達上升(圖6 C),說明對GBP1、GBP2抑制PoRV復制的效果被解除。Overexpression組過表達GBP1、GBP2后接毒,與Mock組相比較,過表達GBP1、GBP2組PoRV-NSP5基因mRNA拷貝數表達均下降,其中GBP1組下降33%,GBP2組下降46%(圖6 B),PoRV-VP6蛋白表達也下降(圖6 D),GBP1、GBP2抑制PoRV的復制。結果表明,GBP1、GBP2蛋白對PoRV的復制發揮作用需要GTPase活性區域。
2.7 驗證GBP1、GBP2蛋白的不同結構域對PoRV的影響
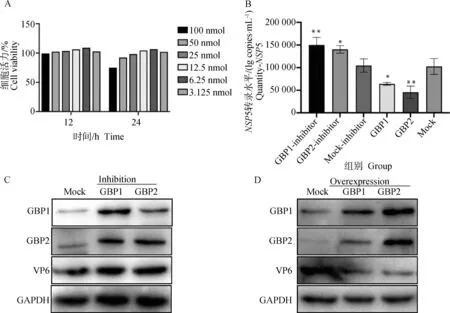
A.細胞活力水平(%);B.PoRV-NSP5 mRNA水平的變化(與Mock組間比較,未標記為無顯著差異);C.Inhibition組PoRV-VP6、GBP1、GBP2蛋白水平變化;D.Overexpression組PoRV-VP6、GBP1、GBP2蛋白水平變化。*.P<0.05;**.P<0.01 A. Cell viability levels (%); B. Changes in PoRV-NSP5 mRNA levels (compared with no significant difference between Mock groups, unlabeled); C. Changes in PoRV-VP6, GBP1, and GBP2 protein levels in the Inhibition group; D. Changes in PoRV-VP6, GBP1, and GBP2 protein in the Overexpression group level changes.*.P<0.05;**.P<0.01圖6 抑制GBP1、GBP2蛋白結構域后PoRV的變化Fig.6 Changes in PoRV after inhibition of the structural domains of GBP1 and GBP2 proteins
根據GBP家族蛋白具有的不同結構區域,N端具有球狀GTPase結構域,具有水解和結合GTP的功能,標為G區域。中間的螺旋部分起連接作用,標為M區域。C端具有GTPase效應器結構域,標為E區域[18]。將全長的GBP1(1-590 aa)、GBP2(1-592 aa)蛋白分別截斷為4段,GBP1-G(1-280 aa)、GBP1-M(280-361 aa)、GBP1-E(361-560 aa)、GBP1-ME(280-560 aa)、GBP2-G(1-280 aa)、GBP2-M(281-464 aa)、GBP2-E(464-557 aa)、GBP2-ME(281-592 aa),驗證對PoRV產生影響作用的區域(圖7 A、7 B)。將重組質粒pCDNA3.1(+)-GBP1-G/M/E/ME-HIS和pCDNA3.1(+)-GBP2--G/M/E/ME-HIS轉染進MA104細胞24 h后,以0.1 MOI 感染PoRV,接毒12 h后收樣。通過Western blot、定量PCR檢測。結果顯示,與轉染對照質粒的接毒組相比,過表達GBP1、GBP2的G區、M區、E區、ME區4段截斷體后,過表達后G區域PoRV-VP6蛋白表達下降最明顯。過表達GBP1截斷體中,M區PoRV-VP6蛋白部分表達下降。過表達GBP2截斷體中,M、E區PoRV-VP6蛋白部分表達下降(圖7 C),過表達G區域的PoRV-NSP5基因mRNA拷貝數表達下降,GBP1-G下降54%,GBP2-G下降50%,其他區域PoRV-NSP5基因表達無明顯差異(圖7 D)。結果表明,GBP1和GBP2的G區域抑制PoRV的復制,說明主要發揮抑制PoRV復制作用的功能區域是G區域。

A、B. GBP1、GBP2截斷體G、M、E、ME區結構域示意圖;C. PoRV-VP6蛋白水平變化;D. PoRV-NSP5 mRNA水平的變化(與Mock組間比較,未標記為無顯著差異,*.P<0.05) A, B. Schematic diagram of the structural domains of the G, M, E, and ME regions of GBP1 and GBP2 truncates; C. Changes in PoRV-VP6 protein levels; D. Changes in PoRV-NSP5 mRNA levels (compared with the Mock group, unlabeled as not significantly different,*.P<0.05)圖7 GBP1、GBP2蛋白的G、M、E、ME區截斷體對PoRV復制的變化Fig.7 Changes in the truncated G, M, E, and ME regions of GBP1 and GBP2 proteins on PoRV replication
3 討 論
PoRV是養殖場最主要的病毒性腹瀉病原之一[19],盡管多種安全有效的PoRV疫苗已在全國范圍廣泛使用,但PoRV仍嚴重危害生豬養殖業的發展。由于對PoRV發病機制和病毒與宿主相互作用的基礎方面了解不足,阻礙了疫苗改進和有效抗病毒治療產品的研發。本試驗室在前期轉錄組學中發現(數據未公開),PoRV感染豬小腸上皮細胞后可顯著上調GBP1、GBP2 基因表達,但與哪個病毒蛋白互作,或者通過哪種信號通路來發揮作用,都尚不明確。
PoRV可以通過DAP參與許多生物過程和信號通路,如代謝過程、免疫系統過程、氨基酸代謝、MHC Ⅰ類肽組裝復合物、Hippo信號通路等,以此對抗細胞的免疫機制[20]。但細胞受到病毒感染時,首先細胞會通過啟動自身的一系列免疫應答反應來阻止病毒的入侵或者抑制病毒的復制,從而維持細胞自身的穩態。GBPs家族被IFN誘導后可以大量表達[21],具有抑制細胞增殖減少病理損傷的作用。GBP1抗豬瘟病毒(classical swine fever virus, CSFV)[7]、甲型流感病毒(influenza A virus, IAV)[22]、偽狂犬病病毒(PRV)都需要GTPase發揮作用。GBP2抗PRRSV、PRV、EMCV、VSV也依賴于GTPase的活性,且GBP2對弓形蟲和沙門菌呈現顯著抑制[9]。本研究發現PoRV感染MA104細胞后,GBP1、GBP2的轉錄水平顯著上調。作者首先通過構建真核重組質粒轉染MA104細胞實現GBP1、GBP2過表達,發現PoRV-VP6蛋白和PoRV-NSP5 mRNA基因均顯著降低,病毒復制一定程度受到抑制。為進一步明確GBP1、GBP2與PoRV關系,設計特異性siRNA感染片段轉染MA104細胞,沉默GBP1、GBP2基因在細胞中的表達,PoRV復制增加。由此可見,GBP1、GBP2基因能夠抑制PoRV復制。通過GTPase酶活性抑制試驗和GBP1、GBP2截斷體過表達試驗發現G區域對PoRV具有抑制復制的效果。說明GBP1、GBP2 共有的N端的G區域GTPase酶功能區為其發揮抗病毒效果所必需,但具體機制尚有待深入研究。
4 結 論
本研究成功構建了GBP1全長、GBP2兩段真核表達質粒、GBP1、GBP2的G、M、E、ME結構域截斷體,并驗證了其能夠成功表達。隨著PoRV在MA104細胞中的復制,GBP1、GBP2的轉錄水平顯著上調。過表達GBP1、GBP2蛋白顯著抑制 PoRV在MA104細胞中的復制。沉默表達GBP1、GBP2蛋白顯著促進PoRV在MA104細胞中的復制。通過抑制GBP1、GBP2的酶活性區域和過表達GBP1、GBP2的G、M、E、ME區截斷體,發現GBP1、GBP2依賴GTPase酶的G區域來抑制PoRV的復制。該研究首次揭示了GBP1、GBP2蛋白能夠發揮抗豬輪狀病毒的作用,為深入研究GBP1、GBP2蛋白開辟了新道路。

