基于TMT技術的牦牛妊娠期血清蛋白質組學分析
姚 穎,周應聰,杜培巖,李一娟,錢文潔,李柳楊,余志鵬,崔 燕, 余四九,2,樊江峰,2*
(1.甘肅農業大學動物醫學院,蘭州 730070;2.甘肅省牛羊胚胎工程技術研究中心,蘭州 730070)
牦牛(Bosgrunniens)是生活在青藏高原上的重要家畜資源,與普通牛相比,牦牛性成熟較晚,通常在3~4歲。牦牛繁殖力較低,平均繁殖率僅為48.61%,半數以上的牦牛兩年一胎或三年兩胎[1-2]。由于惡劣的生存環境和高發的衣原體病,導致牦牛自然流產率較高。2014年胡廣衛等[3]的調查資料表明,在青海省玉樹縣、海晏縣等地區牦牛流產率高達30%以上。較低的繁殖率和較高的流產率是影響牦牛生產效益的重要因素。妊娠是一個極其復雜的過程,要經歷受精卵形成、卵裂、胚泡附植、胚胎和胎盤的發育及妊娠維持等一系列連續的生物學過程[4],大量分子、細胞及信號通路參與到了妊娠過程的調節。妊娠期間,為了滿足胎兒生長發育的需求,母體多個組織器官的新陳代謝活動都發生了顯著的改變,血液中蛋白種類和濃度也發生了相應的變化[5]。同樣,妊娠階段所發生的分子事件也會受到蛋白種類和表達水平的調節。因此,血液蛋白質組分析是在分子水平上探究妊娠調控機制的重要手段。
串聯質譜標簽技術(tandem mass tag, TMT)是通過多個穩定同位素標記,特異性標記多肽的氨基酸基團進行串聯質譜分析,可用于研究不同組織樣品中蛋白質表達水平的差異[6]。相比于其他定量蛋白質組學技術,TMT技術在通量和同位素標記數量上更具有優勢,并且其靈敏度和可重復性較高。蛋白質組學技術的發展及其在動物體中的研究應用,為動物復雜的繁殖生理調控機制的研究提供了新的方法和思路,但目前關于妊娠階段牦牛血液蛋白質表達變化的研究鮮有報道。本研究采用TMT技術檢測不同妊娠階段血清蛋白的表達差異情況,分析差異表達蛋白參與的信號通路和生物學過程,將為進一步探明牦牛妊娠維持的分子機制,開發新的流產防治藥物和技術策略提供一些基礎資料。
1 材料與方法
1.1 血液樣品的采集與分組
在甘南藏族自治州夏河縣牙利吉鄉阿納扎西牦牛養殖合作社內選擇9頭4歲半至6歲齡,健康狀況良好且當年未產犢的自然發情牦牛進行人工授精(artificial insemination, AI),并分別在AI后第30、60及90天,采用頸靜脈采血法采集其飼喂前的血液樣品5 mL·頭-1,室溫3 500 r·min-1離心10 min,獲取上清液收集在1.5 mL的滅菌離心管中,編號,并置于-80 ℃冰箱保存備用。授配母牦牛在AI后第70和90天利用直腸觸診檢查結合B超探查進行妊娠診斷,并依據診斷結果對采集樣品進行回顧性分組,即妊娠第1月組(FP)、妊娠第2月組(SP)及妊娠第3月組(TP)。未妊娠組(NP)血樣采自AI后90天并經妊娠診斷確診為未孕的牦牛個體。每組樣品3個生物學重復,用于蛋白質組學檢測。
1.2 血清蛋白的提取和定量
取200 μL血清樣品置于培養皿中,用PBS洗滌兩次,離心取沉淀后加入1 mL的預冷SDS裂解緩沖液(含10 μL蛋白酶抑制劑、10 μL PMSF),4 ℃玻璃勻漿器上下手動勻漿20次。取勻漿液轉移到1.5 mL預冷的離心管中,冰上放置10 min,4 ℃、16 000 r·min-1離心10 min,取上清液,即為血清總蛋白。使用ProteoMinerTM蛋白富集試劑盒(Bio-Rad)去除血清總蛋白中高豐度的蛋白質,然后使用BCA試劑盒對去除高豐度蛋白的血清蛋白樣品進行蛋白質定量檢測。
1.3 蛋白酶解與TMT標記
取200 μg蛋白溶液于離心管中,使用1.5 mmol·L-1二硫蘇糖醇(DTT)還原二硫鍵,37 ℃反應1 h,冷卻至室溫后加入30 mmol·L-1碘乙酰胺(IAA)避光反應30 min,然后移入超濾管中離心棄去收集液。在超濾管中用賴氨酸蛋白酶(Lys-C)按照酶和蛋白1∶200的比例預消化蛋白質3 h,然后在37 ℃下用胰蛋白酶(Trypsin)按照酶和蛋白1∶100的比例過夜消化。消化后的多肽溶解在適當體積的100 mmol·L-1HEPES(pH 8.0)中,按照TMT試劑盒說明書,使用12-plex TMT試劑進行標記。
1.4 高pH反相分級
將TMT標記的多肽脫鹽干燥后,采用堿性高pH反相高壓液相色譜法進行肽分級。TMT標記的混合多肽在溶液A(5 mmol·L-1NH4OH, 20% ACN, pH=10.0)中溶解,經C18色譜柱分級。分離梯度如表1所示。從5 min 到80 min每1 min收集洗脫物至1.5 mL離心管中,將收集的約60個組分的洗脫物合并為12個組分,真空干燥。

表1 高pH分離梯度表Table 1 High pH separation gradient table
1.5 LC-MS/MS 質譜分析
將樣品溶于液相A液(100% H2O, 0.1% FA)中采用Nano LC系統進行洗脫分離,選擇250 μL·min-1流速,并使用2%~100%液相B液(80% ACN, 0.1% FA)的線性梯度洗脫60 min分離樣品。分離后的樣品進行質譜定量分析,MS條件設置如下,OTMS1分辨率60 000,自動增益控制目標(AGC)為1e6,最大離子注入時間(Max IT)為50 ms;OTMS2分辨率30 000,AGC為5e4,Max IT為200 ms,動態排除參數為6 s。
1.6 數據庫與數據分析
質譜下機原始數據為RAW文件,借助Proteome Discovery 1.4軟件對數據庫GCF_000298355.1_BosGru_v2.0_protein.faa (28 881條蛋白序列)進行搜索。具體搜庫參數如表2所示。
1.7 生物信息學分析
以差異倍數(fold change, FC)≥1.2或≤0.83,且P<0.05為條件對所獲得的蛋白質篩選差異表達蛋白。并對所得的DEPs使用BLASTALL(v2.2.26, evalue設置為1e5)軟件進行GO、KEGG數據庫注釋,分析其生物學功能。利用STRING在線分析軟件(https://string-db.org)對差異蛋白進行蛋白網絡互作分析。

表2 Proteome Discovery搜庫參數Table 2 Proteome Discovery search parameters
2 結 果
2.1 蛋白定量
不同組別的12份血清樣本(FP: 1-3, SP: 1-3, TP: 1-3, NP: 1-3)去除高豐度蛋白前后的定量結果如表3所示。結果顯示,本試驗血清樣本總蛋白的提取及高豐度蛋白的去除成功,可以滿足后續TMT蛋白質組學的試驗要求。

表3 高豐度蛋白去除前后血清蛋白定量結果Table 3 Quantitative results of serum protein before and after high-abundance protein removal
2.2 蛋白質鑒定
樣品經過TMT標記及LC-MS/MS鑒定分析后,以錯誤發現率(false discovery rate, FDR) ≤0.01的條件進行過濾,共獲得3 933個肽段,共鑒定出497個蛋白質。鑒定到的肽段長度分布如圖1所示,所測肽段分布長度主要集中在6~25個氨基酸之間,說明肽段酶解較為充分。將所鑒定的蛋白質的分子量分布進行統計,結果如圖2所示,分子量>100 ku的蛋白最多,其次是分子量在20~30 ku和50~60 ku的蛋白,分子量<10 ku的最少,且主要集中分布在10~60 ku。

圖1 肽段長度分布圖Fig.1 Peptide length distribution chart
2.3 差異表達蛋白的篩選
以差異倍數FC≥1.2或≤0.83,且P<0.05為條件進行篩選,共得到處于妊娠期不同階段及未妊娠期中的牦牛血清差異表達蛋白68個,對各組間差異表達蛋白的分布繪制火山圖,如圖3所示。由圖可知,FP與SP組共有4個DEPs,其中上調4個,下調0個;FP與TP組共有34個DEPs,其中上調17個,下調17個;SP與TP組共有44個DEPs,其中上調17個,下調27個;TP與NP組共有18個DEPs,其中上調10個,下調8個。各組間的部分DEPs信息如表4、5、6、7所示。

圖2 蛋白分子量分布圖Fig.2 Protein molecular weight distribution chart

A、 B、C、D分別表示FP vs. SP、FP vs. TP、SP vs. TP、TP vs. NP組差異蛋白火山圖 A, B, C, and D represent the differential protein volcano maps of FP vs. SP, FP vs. TP, SP vs. TP, and TP vs. NP groups, respectively圖3 牦牛血清差異蛋白火山圖Fig.3 Volcano plot of differential proteins in yak serum

表4 FP vs. SP組牦牛血清差異蛋白信息Table 4 The serum differential proteins information of yak in FP vs. SP group
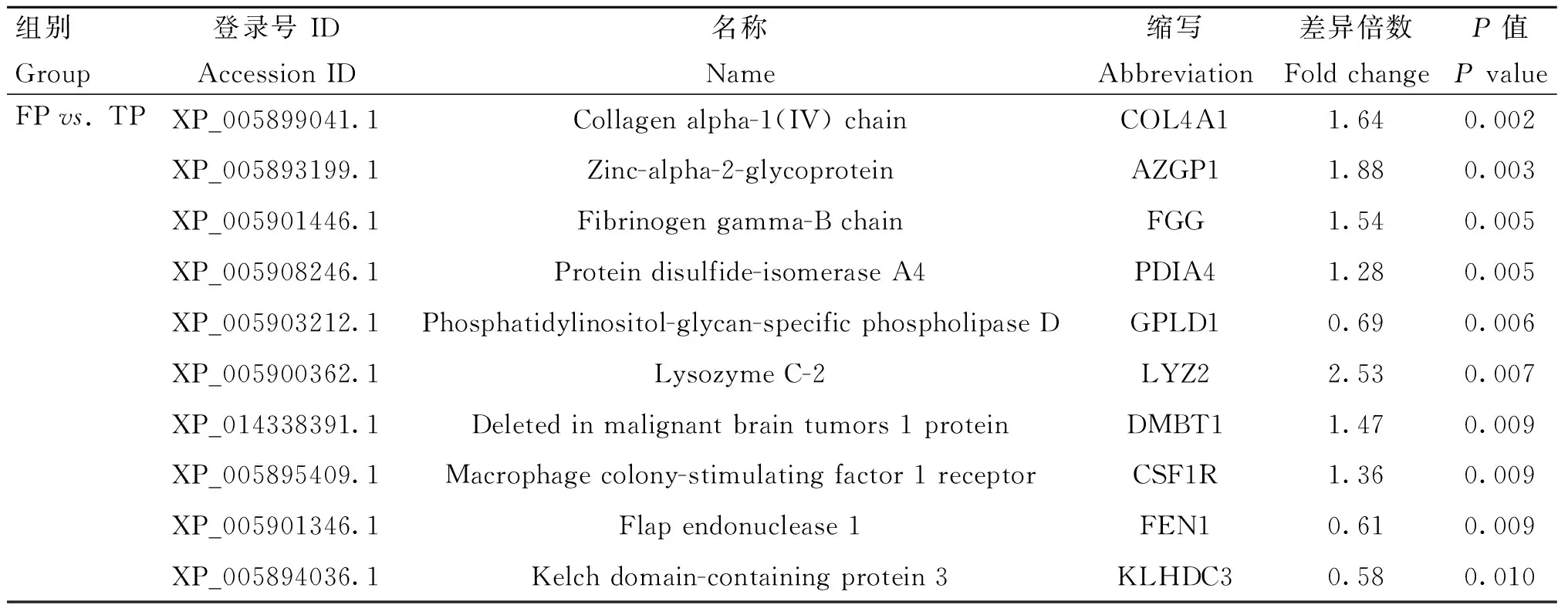
表5 FP vs. TP組部分牦牛血清差異蛋白信息Table 5 The serum differential proteins information of yak in FP vs. TP group
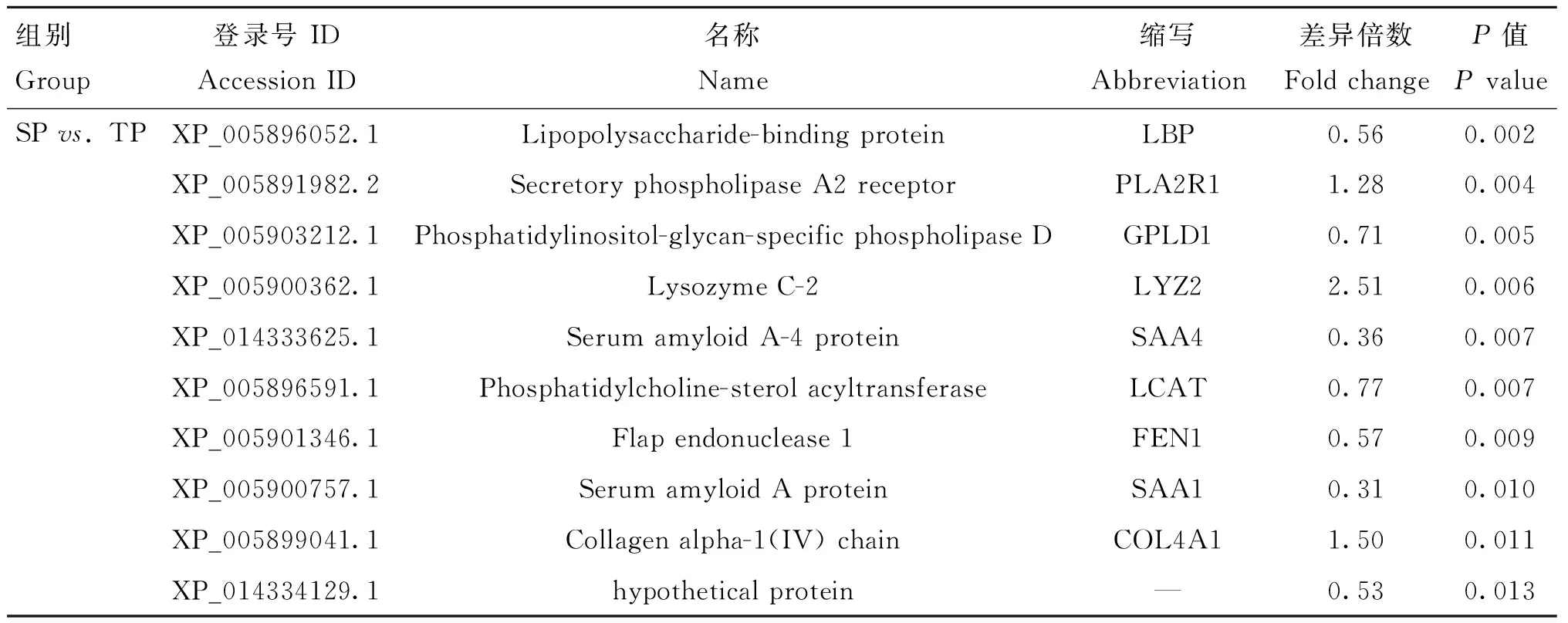
表6 SP vs. TP組部分牦牛血清差異蛋白信息Table 6 The serum differential proteins information of yak in SP vs. TP group
2.4 DEPs的GO富集分析
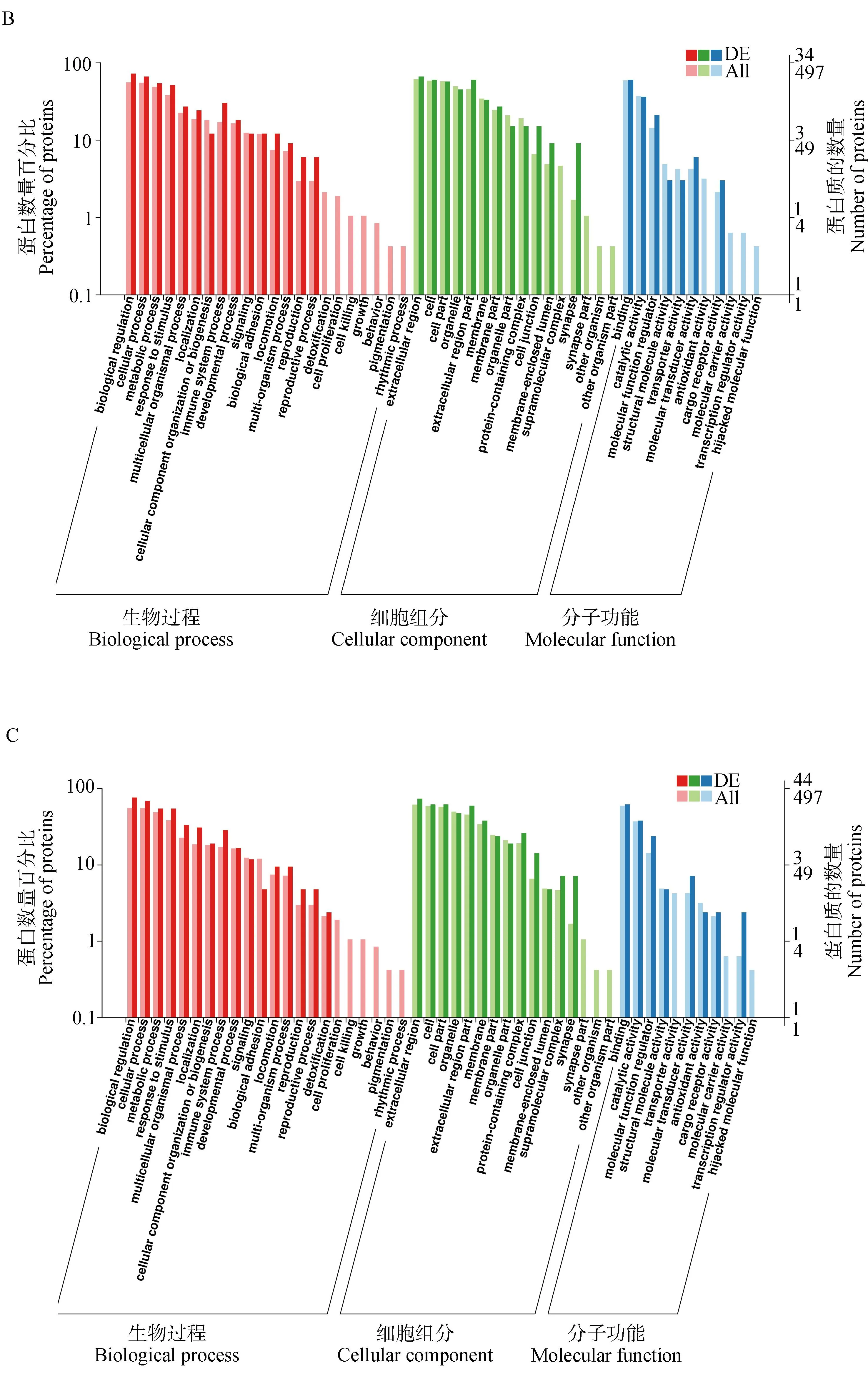
利用BLAST軟件對GO數據庫進行搜索,將FPvs.SP、FPvs.TP、SPvs.TP、TPvs.NP四組對照組中的差異蛋白進行功能注釋,并對各組差異表達蛋白和全部蛋白背景下GO各二級功能條目的蛋白富集情況進行分析,如圖4所示。結果表明,各組差異蛋白的GO功能富集情況基本相似,在生物學過程中主要富集在生物調節、代謝、免疫系統、粘附及發育等過程;在細胞組分中主要富集在細胞外區域、細胞器、蛋白復合體和膜封閉腔等;在分子功能中主要富集在結合、催化活性、分子功能調節、抗氧化活性和轉運活性等方面。

表7 TP vs. NP部分牦牛血清差異蛋白信息Table 7 The serum differential proteins information of yak in TP vs. NP group
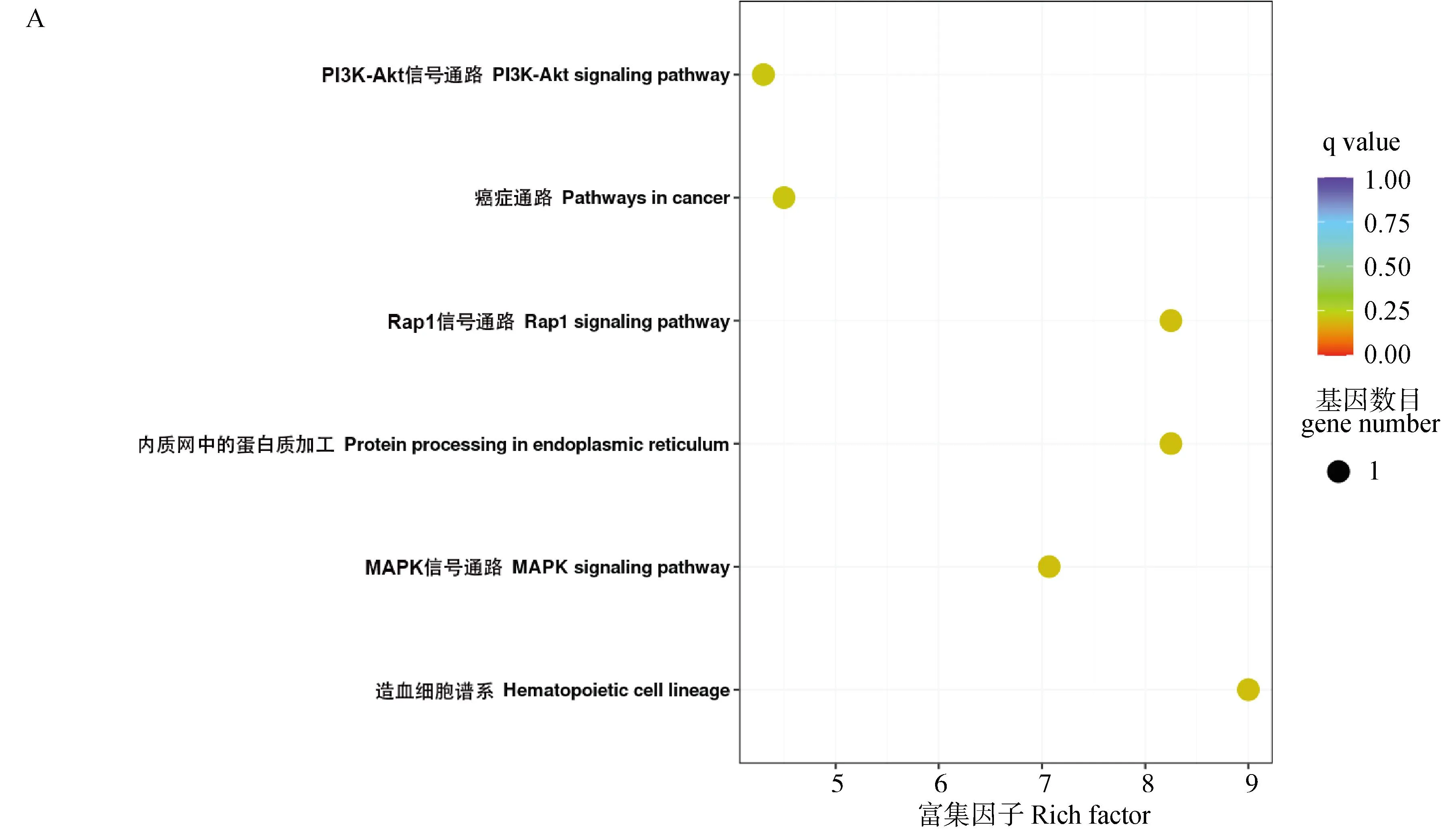
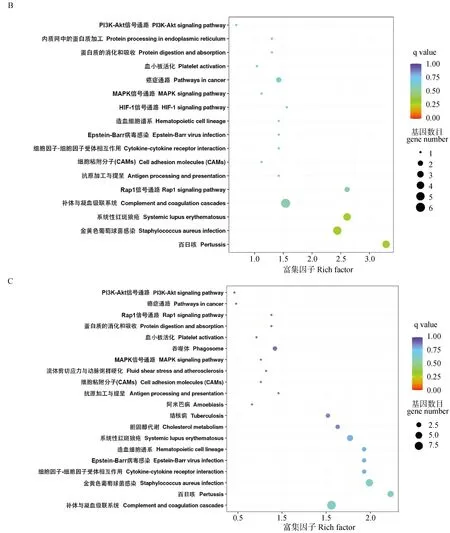
2.5 DEPs的KEGG富集分析
將各組間的KEGG富集分析結果以散點圖的形式可視化,如圖5所示。結果表明,差異表達蛋白在37個通路中被富集,圖中呈現了顯著性Q值最小的前20個通路,且富集因子越大,表示差異表達蛋白在該通路中的富集水平越顯著。結果發現,FPvs.TP、SPvs.TP和TPvs.NP組的差異蛋白主要富集于補體與凝血級聯、細胞粘附分子和金黃色葡萄球菌感染等與炎癥和免疫防御相關的途徑中,FPvs.SP組主要富集在造血細胞譜系通路中。并且在妊娠期(FP、SP、TP)的各組間差異蛋白富集通路中均包含有PI3K-Akt、Rap1、MAPK等信號通路。

(圖4續 Continued)
(圖4續 Continued)
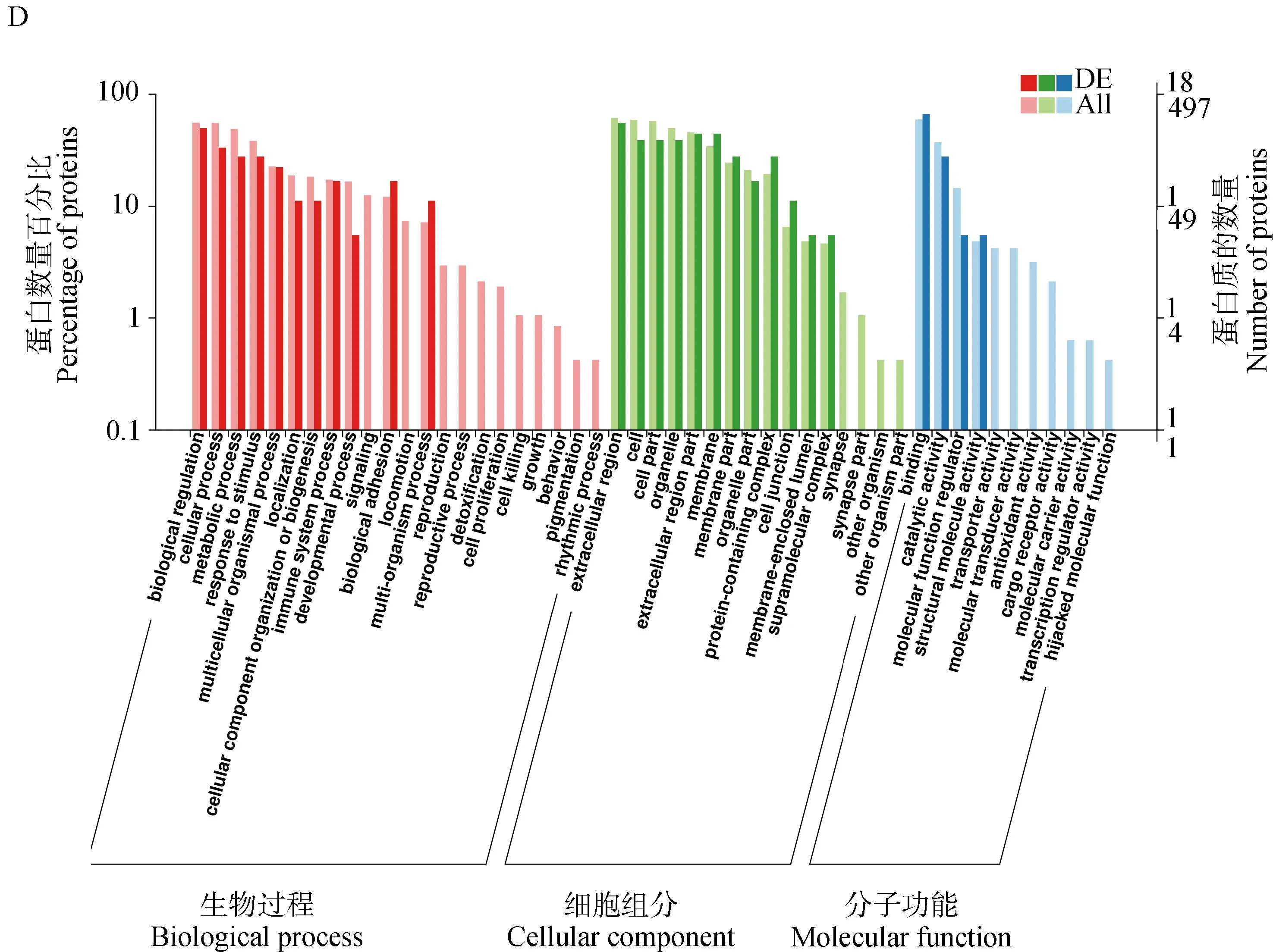
A、 B、C、D分別表示FP vs. SP、FP vs. TP、SP vs. TP、TP vs. NP組差異蛋白GO富集分析 A, B, C, and D represent GO enrichment analysis of differential proteins in FP vs. SP, FP vs. TP, SP vs. TP, TP vs. NP groups, respectively圖4 牦牛血清差異表達蛋白GO富集分析Fig.4 GO enrichment analysis of differentially expressed proteins in yak serum
(圖5續 Continued)
(圖5續 Continued)

A、B、C、D分別表示FP vs. SP、FP vs. TP、SP vs. TP、TP vs. NP組差異蛋白KEGG通路富集分析 A, B, C, and D represent the KEGG pathway enrichment analysis of differential proteins in FP vs. SP, FP vs. TP, SP vs. TP, and TP vs. NP groups, respectively圖5 牦牛血清差異表達蛋白KEGG通路富集散點圖Fig.5 Scatter plot of KEGG pathway enrichment of differentially expressed proteins in yak serum
2.6 與妊娠維持潛在相關DEPs的篩選
對妊娠期和未妊娠期的差異蛋白進行綜合分析,發現有5種蛋白:胰島素樣生長因子結合蛋白2(IGFBP2)、纖維蛋白原γ(FGG)、β-2微球蛋白(B2M)、蛋白二硫化物異構酶A4(PDIA4)、鋅-α-2-糖蛋白1(AZGP1),如表8所示,它們在妊娠期(FP、SP和TP)具有連續的表達差異趨勢,即在妊娠第3月(TP)表達量最高,妊娠第1、2月(FP和SP)表達量降低,并且這些蛋白在妊娠第3月(TP)相對于未妊娠(NP)狀態下調,說明這些蛋白在妊娠第3月(TP)狀態下表達量顯著高于未妊娠狀態。因此這些蛋白可能參與妊娠維持過程,并發揮一定的生物學作用。
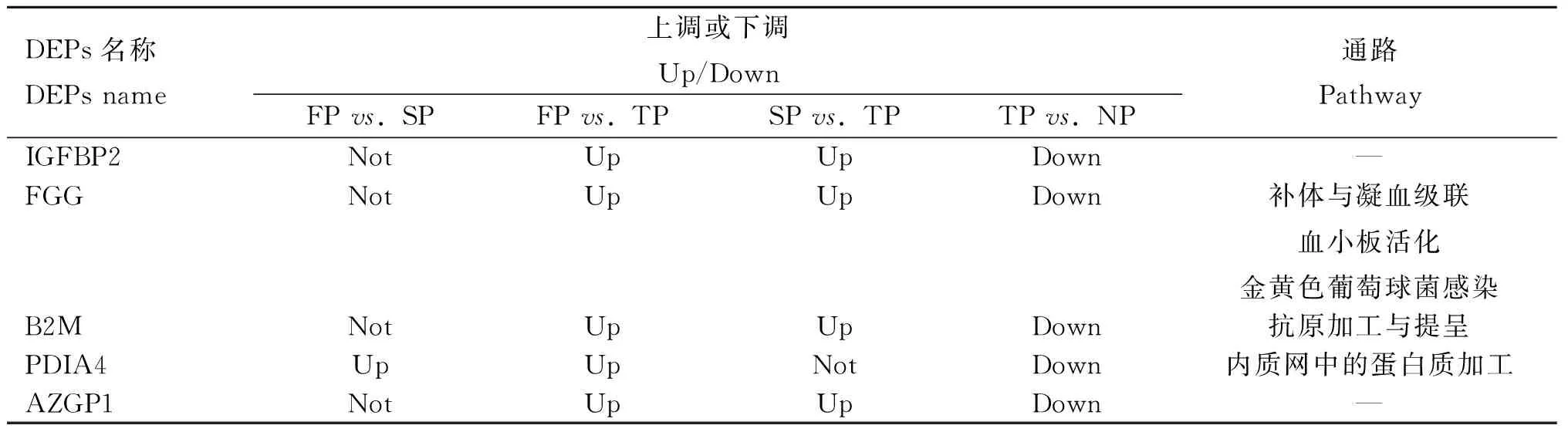
表8 重要DEPs篩選信息Table 8 The screening information for important DEPs
2.7 與妊娠維持潛在相關DEPs的網絡互作分析
利用STRING在線軟件(https://string-db.org)對所篩選的可能與妊娠維持相關的差異蛋白繪制網絡互作(PPI)分析圖,結果如圖6所示。圖中節點代表蛋白質,部分節點內有螺旋結構,表示該蛋白結構已知。部分節點內是空的,則表示該蛋白結構暫時未知。節點之間的連線表示蛋白之間的相互作用,連線越多表示蛋白間的相互作用關系越強。在PPI網絡圖中顯示,篩選出的差異蛋白多數存在互作關系,說明我們所鑒定篩選出的蛋白質在牦牛妊娠期相互作用,進而在維持妊娠中共同發揮作用。
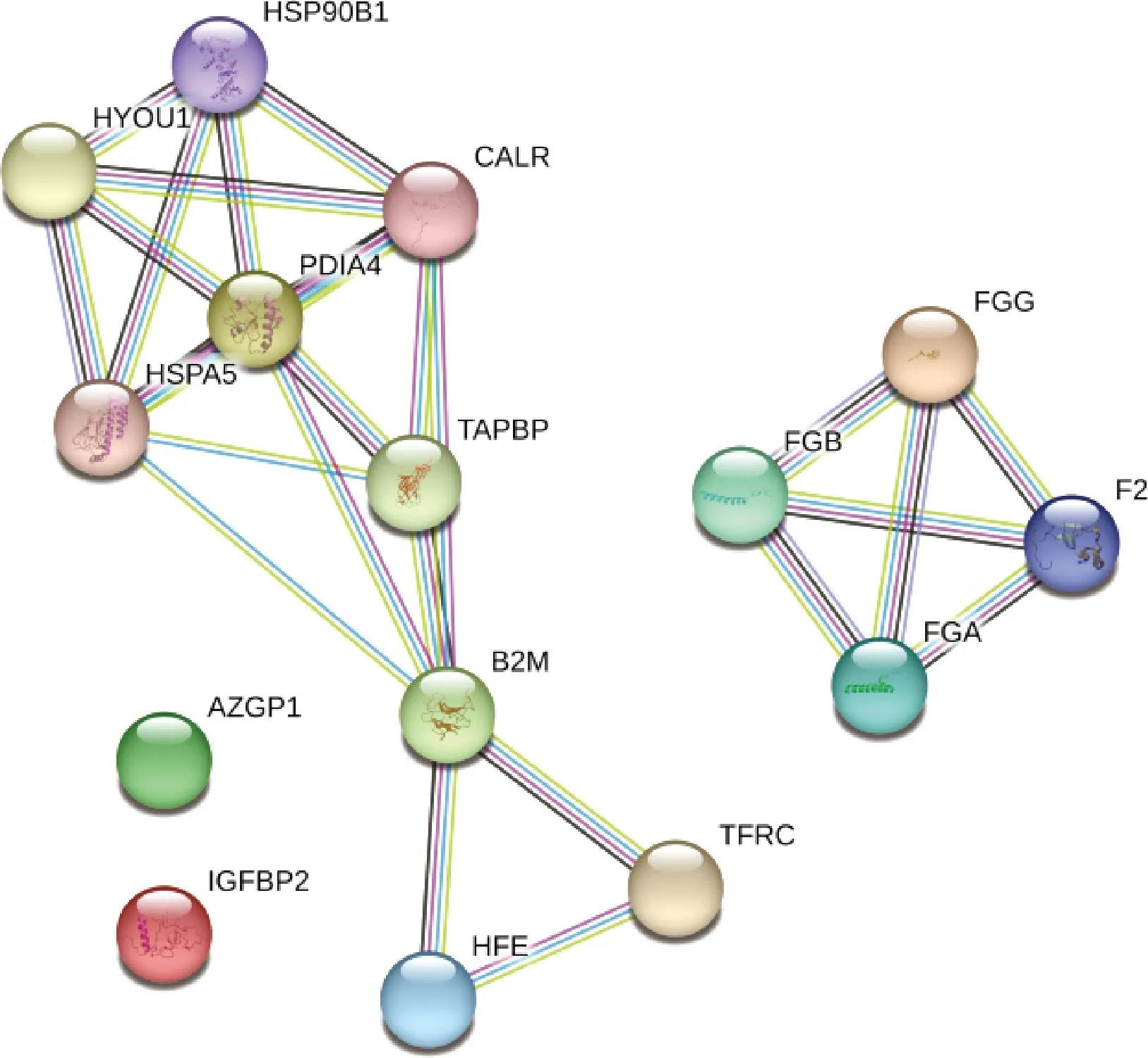
圖6 與妊娠維持潛在相關DEPs的網絡互作分析Fig.6 Network interaction analysis of DEPs potentially related to pregnancy maintenance
3 討 論
哺乳動物妊娠過程的建立和維持涉及到母體多器官和系統細胞生物學、生物化學等多方面的適應性調節。蛋白質是基因表達翻譯的最終產物,蛋白質組學可以對某一時期機體處于特定生理狀態下的所有蛋白質進行組學鑒定和研究,通過蛋白豐度的變化來揭示機體相關生物學過程和功能轉變的分子機制。本研究采用TMT聯合LC-MS/MS技術對處于妊娠第1、2、3月及未妊娠的牦牛血清樣品進行了蛋白質組學分析,結果共檢測到3 933個肽段,定量出497個蛋白質,篩選出68個DEPs。
通過各組間差異表達蛋白的GO功能注釋,發現DEPs主要富集在生物過程中的代謝、免疫、粘附和生物調節,細胞組分中的細胞外區域、細胞器以及分子功能中的結合和催化活性。研究表明,妊娠會引起母體代謝的實質性改變,妊娠的前3個月是合成代謝的狀態,這一階段母體血液內孕激素、雌激素和糖皮質激素等類固醇激素含量升高有利于脂質沉積[7-8]。妊娠早期的合成代謝階段至關重要,因為胎兒的能量需求無法僅通過增加能量攝入來滿足,更依賴于妊娠早期積累的脂肪儲存[9]。并且有研究表明,妊娠期間類固醇激素與滋養細胞的增殖以及妊娠的健康發展密切相關[10],由此說明類固醇代謝與妊娠維持相關,對支持胎兒的生長和發育具有關鍵作用。研究表明,細胞粘附涉及胚胎細胞外基質的構建和胚胎與子宮內膜的附著等生殖過程,并影響滋養細胞的增殖和分化[11],因此細胞粘附過程對妊娠維持有重要意義。妊娠是一個動態的免疫過程,胚胎所攜帶的遺傳物質一半來自母體,另一半來自父體,當胚胎進入母體內并且在子宮內膜上種植時無異于異體植入,會刺激母體免疫系統。免疫系統通過激活補體C途徑和誘導內肽酶對異物做出反應,使得母體處于炎癥增加的狀態[12-13]。同時為了保證胎兒不被母體免疫排斥,許多免疫相關分子會在母胎界面建立免疫耐受,并允許異基因胎兒在滋養層侵入母體組織,進而允許胎兒和胎盤的發育[14-15],因此妊娠期母體免疫調節的動態平衡對于妊娠的建立和維持是至關重要的。
KEGG富集分析表明,妊娠期各組間的差異蛋白主要富集在補體與凝血級聯、金黃色葡萄球菌感染等與炎癥和免疫防御相關的通路以及PI3K-Akt、Rap1、MAPK等信號通路中。妊娠維持、胎盤和胎兒發育以細胞增殖、遷移、分化、轉化和凋亡等細胞過程為特征[16],且這些細胞過程依賴于信號通路的活動。Rap1信號通路涉及多種細胞過程,包括細胞間的相互作用、細胞分子的粘附和增殖以及胎兒發育過程中細胞極性的調節[17]。此外,Rap1信號通路還參與維持上皮和內皮細胞連接的完整性,從而維持胎兒的生存能力[18],因此推測Rap 1通路可能通過調節胎盤和胎兒發育進而維持妊娠的健康發展。MAPK信號通路參與細胞增殖、分化和轉化過程,同時它還參與了胎盤發育期間胚胎和卵黃囊的血管生成[19]。磷脂酰肌醇3激酶/蛋白激酶B(PI3K/Akt)途徑經常在各種細胞中被激活,并促進多種細胞增殖、粘附、遷移、侵襲和血管生成[20-21]。因此推測,MAPK和PI3K-Akt通路可能與妊娠過程中滋養細胞的增殖和胎盤發育中的血管生成有關。金黃色葡萄球菌感染通路是一種與炎癥相關的通路,在人類和動物中的研究表明,妊娠中胎盤涉及滋養細胞侵潤和血管生成過程,它的成功依賴于一定程度的子宮炎癥[22-23],因此低程度的炎癥有益于正常胎盤的生長發育。補體系統在先天免疫和適應性免疫過程中起關鍵作用,其經典通路可以被凋亡細胞激活,正常孕婦的滋養細胞凋亡伴隨著缺血和氧化應激的增加,進而導致滋養細胞碎片脫落進入母體循環[24],這也解釋了為什么在牦牛正常妊娠中大量分子富集在補體及凝血級聯途徑中。本研究提示,DEPs可能通過細胞粘附、免疫調節和代謝等生物過程以及PI3K-Akt、Rap1、MAPK等信號通路,參與調節胎兒組織細胞的增殖和胎盤的生長發育過程,進而在牦牛妊娠維持中發揮關鍵作用,并且當這些生物過程和通路失調時可能會損害胎盤和胎兒的生長發育,甚至導致妊娠失敗。
通過比較發現,IGFBP2、FGG、B2M、PDIA4和AZGP1 在牦牛妊娠期血清中具有連續上調的表達趨勢,并且這些蛋白在妊娠第3月表達量顯著高于未妊娠狀態。因此推測,這些蛋白在牦牛妊娠維持過程中發揮著重要的生物學作用。IGFBP2是一種發育調控因子,具有促進細胞分化、刺激有絲分裂和防止凋亡等功能,能夠與IGF-2相互結合并調節IGF-2對胚胎生長功能的促進作用[25]。高飛[26]研究發現,在人類中IGFBP2表達減少會抑制胎盤滋養細胞的侵襲及增殖,導致子宮肌層螺旋小動脈重鑄障礙,進而誘發早產甚至流產。本研究中,IGFBP2在妊娠期表達上調,意味著其可能通過調控胎盤滋養細胞的侵襲和增殖,參與胎盤植入和發育過程,進而維持妊娠。FGG是纖維蛋白原三條肽鏈(α、β和γ)中的一條,作為纖維蛋白原的結構域發揮功能[27]。正常妊娠時,母體血液中促凝活性顯著增高,凝血效率增加,纖維蛋白原和凝血因子升高,母體纖維蛋白原通過維持止血平衡和穩定胎兒-母體接合處的纖維蛋白層的子宮胎盤附著來支持妊娠[28]。Iwaki等[29]研究發現,敲除FGG基因的小鼠因為子宮內大量異常出血使得胎盤和卵黃囊嚴重受損破裂,導致胎兒死亡,妊娠不能維持至足月。因此,FGG可能通過維持胎盤止血平衡進而在維持牦牛妊娠中發揮重要作用。B2M屬于I類主要組織相容性復合體(MHC)的組成部分,參與抗原的加工與呈遞,在促進免疫細胞的抗原呈遞和母體-胎兒界面的血管生成方面發揮重要作用[30]。在妊娠期間,充分的抗原呈遞可以促進免疫應答進而誘導滋養層侵襲、組織重塑、胚胎發育和胎盤形成[31]。研究表明,人血清中B2M的含量隨著妊娠周期的增加而增加[32],這與本試驗中鑒定出的血清B2M的變化趨勢相一致。PDIA4是蛋白質二硫鍵異構酶家族(PDIs)中的一種內質網蛋白,在維持氧化還原穩態和內質網蛋白質折疊等生物學過程中發揮重要作用[33]。正常妊娠中,隨著胎齡的增加,胎盤滋養層細胞會產生一定程度的內質網應激反應,輕度的應激反應會導致機體產生抗氧化防御等一系列適應性反應[34]。因此推測,PDIA4作為內質網蛋白,可能通過調節胎盤內質網應激,誘導機體產生抗氧化防御,進而起到維持妊娠的作用。AZGP1是一種新型脂質動員因子,具有抗原的加工和呈遞功能,參與細胞粘附、免疫系統調節、炎癥反應和脂質代謝[35-36]。研究發現,在小鼠體內AZGP1可以促進脂聯素表達升高,而脂聯素又被發現可以降低小鼠自然流產的風險,對維持正常妊娠有積極作用[37-38]。由此提示,AZGP1可能通過影響脂聯素的表達直接或間接調節脂質代謝,從而參與牦牛的妊娠維持。
4 結 論
本研究利用TMT技術對不同妊娠階段和未妊娠的牦牛血清進行分析,結果表明牦牛妊娠早期存在著明顯的血清蛋白組的變化。通過對這些DEPs進行篩選與功能分析,發現它們分別富集在代謝、免疫、粘附及PI3K-Akt、Rap1、MAPK等與生殖相關的條目與通路中。這些DEPs在促進細胞粘附與增殖、促進母胎血管生成、維持母體代謝與免疫平衡等過程中起到重要作用,進而維持母體在妊娠期各器官和系統的動態平衡。其中IGFBP2、FGG、B2M、PDIA4、AZGP1的表達在妊娠早期具有連續上調的趨勢,推測其可能通過調節胎盤生長發育、免疫應答和脂質代謝,參與了牦牛的妊娠維持過程。本研究是利用蛋白質組學探索在不同妊娠階段和未妊娠牦牛的差異蛋白的初步試驗,這些結果為進一步探明牦牛維持妊娠過程的調控機制提供了基礎資料。

