基于轉錄組數據挖掘牦牛皺胃發育代謝的關鍵候選基因
劉益麗,唐 嬌,閔 奇,楊 露,王澤寧,胡 蓮,趙 迪,江明鋒*
(1.西南民族大學畜牧獸醫學院,成都 610041;2.西南民族大學青藏高原研究院,成都 610041)
牦牛是長期生活在我國青藏高原上的特有物種,可為牧民提供生產及生活所必需的資源,具有極高的經濟價值。犢牦牛出生后,從液體奶到斷奶采食草料經歷了巨大的生理和代謝變化,消化道系統的結構和功能迅速發育。牦牛皺胃是典型的管狀器官[1],是牦牛的第四個胃,又稱為真胃,剛出生犢牛的消化吸收功能主要依靠皺胃和小腸來完成[2]。新生犢牛皺胃已有一定程度的發育,具有消化吸收能力,攝食液體乳時,經食管溝可直接進入皺胃消化,利用葡萄糖為機體供能[3-4],犢牛出生2~3周內,皺胃是最主要的營養消化場所;成年時期的皺胃主要是對前胃消化的較小食糜進一步消化吸收[5]。由此可見,皺胃在牦牛的整個生長發育過程中發揮著重要的生理功能。
皺胃早期相關研究主要集中在疾病、引發疾病因素、形態及其影響因素[6-8]。近年研究主要在皺胃相關酶[9-10]、微生物及其作用等方面[11-12]。有研究對犢牛皺胃凝乳酶和胃蛋白酶安全性進行了評估,結果表明皺胃凝乳酶和胃蛋白酶可作為食品酶,用于牛奶加工和奶酪生產[10]。周亞楠等[13]研究發現,哺乳期補飼開食料能正向調控牦牛犢牛的皺胃形態與功能發育,進而提高對營養物質的消化利用率。Nazish等[11]從山羊和綿羊皺胃分離出睪酮科單胞菌、威氏假單胞菌和線蟲等,研究3種皺胃真菌對線蟲進行生物防治,3種皺胃真菌培養濾液濃度增加,線蟲的死亡率增加,對線蟲卵孵化具有抑制作用。Kasl等[12]研究發現,含有醋酸鈉的口服電解質溶液可限制降低犢牛皺胃內大腸桿菌的體外生長潛力,可能減少皺胃大腸桿菌過度到腸道,從而減少腹瀉發病率[14-15]。可見皺胃的深入研究對反芻動物的健康發育和相關產品開發具有重要的意義。
對牦牛復胃的轉錄組研究主要集中在瘤胃,網胃、瓣胃和皺胃的相關研究較少。本團隊謝書瓊等[16]前期對牦牛皺胃全長轉錄組進行了測定和初步分析,但基于不同年齡段牦牛皺胃組織的轉錄組分析和功能發育研究鮮見報道。因此,本研究在前期基礎上,以液體乳為主階段(1、20日齡),過渡階段(60日齡),反芻為主階段(15月齡和3歲)共5個年齡段的牦牛皺胃組織為研究對象,進行RNA-Seq高通量測序及功能分析,篩選參與皺胃發育和代謝調控的信號通路及相關基因,為今后闡明牦牛皺胃發育和營養代謝的調控分子機制提供更多的理論依據和重要參考,為皺胃組織相關產品開發提供新思路。
1 材料與方法
1.1 試驗動物與樣品采集
動物樣本采自四川省阿壩藏族羌族自治州紅原縣,牦牛培育采用自然放牧方式,犢牛出生后隨母哺乳,自由采食。本試驗選取5個年齡段,即1日齡、20日齡、60日齡、15月齡與3歲的健康牦牛作為研究對象,每組各3頭。按照以下程序人道地處理牦牛:放血前電休克,昏迷時經頸部放血并快速解剖,用滅菌剪刀取皺胃上皮及皮下組織塊,剪成約1 cm×1 cm×0.5 cm的小塊,用DEPC水沖洗后迅速放入凍存管中,并立即投入液氮中保存。
1.2 皺胃指數測量
準確測量每頭牦牛體重,屠宰后迅速取出完整復胃,將瘤胃、網胃、瓣胃和皺胃相連部位結扎,將4個胃室分開,清空內容物,準確測得4個胃室重量并記錄。皺胃指數為皺胃重(g)/復胃重(g),數據以“均數±標準差(Mean± SD)”表示,使用Microsoft Excel 2007與Origin9.0軟件進行數據采集、記錄、運算與分析。兩組數據間的比較用t檢驗方法,多組數據間的差異分析使用ANOVA檢驗方法。P<0.05表示有顯著性差異,P<0.01表示有極顯著性差異。
1.3 主要試劑及儀器
1.3.1 主要試劑 mirVanaTMmiRNA ISOlation Kit 試劑盒購自Invitrogen公司(AM1561);TruSeq Stranded mRNA Sample Prep Kit購自Illumina公司(RS-122-2101);Agencourt AMPure XP核酸純化試劑盒購自Beckman Coulter公司(A63881);QubitTMRNA HS Assay Kit 購自Thermo公司(Q32852);Qubit dsDNA Assay Kit購自Thermo公司(Q328520);Bioanalyzer 2100 RNA-6000 Nano Kit購自Aglient(5067-1511);Bioanalyzer 2100 DNA-1000 Kit購自Aglient(5067-1504);Super Script II Reverse Transcriptase購自Invitrogen公司(18064014);PrimeScript RT reagent Kit with gDNA Eraser購自TaKaRa公司(RR047B); TB Green Premix Ex TaqTMII (Tli RNaseH Plus) 購自TaKaRa公司(RR820A)。
1.3.2 主要儀器 臺式離心機購自Eppendorf公司(Centrifuge 5418R);PCR 儀購自Bio-rad公司(MyCycler);紫外分光光度計購自Thermo公司(NanoDrop 2000);實時熒光定量PCR儀購自Roche公司(LightCycler 96);凝膠成像分析系統購自天能公司(Tanon 2500);定量儀購自Invitrogen公司(Qubit2.0);磁力架購自Invitrogen公司(Magneticstand-96);Bioanalyzer生物分析儀購自Aglient(2100)。
1.4 RNA提取與 cDNA文庫構建
根據mirVanaTMmiRNA ISOlation Kit試劑盒操作流程提取15個牦牛皺胃組織的總RNA,利用Nanodrop 2000超微量分光光度計檢測總RNA的濃度、純度(OD260 nm/OD280 nm和OD260 nm/OD230 nm比值)和RNA完整值(RNA integrity number,RIN),隨后用1%瓊脂糖凝膠電泳進行檢測,將質檢合格的RNA置于-80 ℃超低溫冰箱中保存備用。使用Illmina? TruSeq Stranded mRNA樣品制備試劑盒構建15個測序樣本的cDNA文庫。主要步驟包括:將樣品總RNA用DNase消化DNA,用Oligo(dT)磁珠富集mRNA;用打斷試劑將mRNA打斷成短片段,以打斷后的mRNA短片段為模板,用六堿基隨機引物合成一鏈cDNA,利用二鏈合成反應體系合成二鏈cDNA并用試劑盒純化雙鏈cDNA;對純化的雙鏈cDNA進行末端修復、加A尾并連接測序接頭,片段大小選擇和PCR擴增;利用Agilent 2100生物分析儀檢測構建文庫的大小、濃度及質量,得到合格cDNA文庫。
1.5 轉錄組測序與質量控制
本試驗中15個樣本的建庫測序及部分數據分析由上海歐易生物醫學科技有限公司完成。基于Illumina二代高通測序平臺(Illumina HiSeq X ten),采用PE150測序方式對文庫進行測序,獲得原始序列數據(raw reads)。為了得到可用于后續分析的高質量reads,使用Trimmomatic軟件[17]進行質控并去除接頭(adaptor),過濾掉低質量堿基及N堿基得到高質量的clean reads,統計clean reads的Q30和GC含量。用 Hisat2[18]將clean reads與牦牛參考基因組(GCF_000298355.1)進行序列比對,通過基因組比對率來評估樣本的情況。
1.6 主成分分析
利用HTSeq-count[19]軟件獲取落到各個樣本中基因的reads 數目,使用cufflinks[20]軟件對蛋白編碼基因的FPKM[21]表達量值定量,用R語言繪制主成分分析(principal component analysis,PCA)二維圖。
1.7 差異表達基因篩選及功能富集分析
利用HTSeq-count[19]軟件獲得比對到每個樣本中蛋白編碼基因的reads數,使用DESeq (2012) R package[22]的函數estimateSizeFactors對數據進行標準化,使用函數nbinomTest計算差異倍數(Fold Change)和差異的顯著性(P-value)。選取P<0.05,log2(Fold Change)>2 的差異表達基因(DEGs)進行GO和KEGG[23]通路富集分析。以1日齡樣本為參照,利用GO Seq分別對20日齡、60日齡、15月齡和3歲齡的牦牛皺胃DEGs進行GO功能注釋,基于GO數據庫功能,按照細胞組分(cellular component,CC),生物過程(biological process,BP)和分子功能(molecular function,MF)將4個年齡段的DEGs進行分類,以P<0.05為標準篩選得到顯著富集的GO條目和KEGG信號通路。
1.8 qRT-PCR驗證
為進一步驗證牦牛皺胃RNA-Seq數據的可靠性,隨機選取5個差異表達基因,利用Primer BLAST設計引物,采用實時熒光定量PCR驗證基因的表達水平。將測序返樣RNA用PrimeScript RT reagent Kit with gDNA Eraser逆轉錄試劑盒反轉錄為cDNA,以GAPDH作為內參基因,利用TB Green? Premix Ex TaqTMII (Tli RNaseH Plus)試劑盒在LightCycler 96 系統上檢測。熒光定量PCR反應體系為20 μL:2×TB Green? Premix Ex TaqTMII 10 μL,上、下游引物(10 μmol·L-1)各0.5 μL,皺胃組織cDNA 2 μL,RNase Free ddH2O 7 μL。PCR 程序: 95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,40個循環;95 ℃ 5 s, 60 ℃ 1 min;重復3次。采用2-△△ct法分析數據,用t-檢驗統計分析相對表達量,數據結果表示為“平均數士標準差(Mean±SD)”,P<0.05為差異顯著。對應的引物序列見表1。

表1 基因及對應引物序列Table 1 Gene and the corresponding primer sequences
2 結 果
2.1 不同年齡段牦牛皺胃重量和指數分析
對牦牛5個年齡段15個樣本的復胃重量和皺胃指數進行分析,如表2所示,在同一年齡段,1日齡皺胃最重,瘤胃次之,皺胃重顯著高于網胃和瓣胃重(P<0.05);20日齡皺胃重顯著高于網胃和瓣胃重(P<0.05),與瘤胃重差異不顯著(P>0.05);60日齡瘤胃重最大,顯著高于皺胃、網胃和瓣胃重(P<0.05);15月齡瘤胃重顯著高于瓣胃(P<0.05),皺胃與網胃重最小,差異不顯著(P>0.05);3歲瘤胃重量最大,顯著高于瓣胃(P<0.05),皺胃重大于網胃重,差異不顯著(P>0.05)。如圖1所示,1日齡、20日齡和60日齡牦牛皺胃重量差異不顯著(P>0.05),15月齡與3歲牦牛的皺胃重顯著增加(P<0.05),皺胃重整體呈現增加趨勢;1日齡、20日齡牦牛的皺胃指數差異不顯著(P>0.05);與1日齡相比,15月齡與3歲牦牛的皺胃指數顯著下降(P<0.05),皺胃指數與皺胃重量變化趨勢相反,整體呈現下降趨勢。

表2 不同年齡段牦牛復胃重量的變化Table 2 Changes of compound stomach weight of yaks at different ages
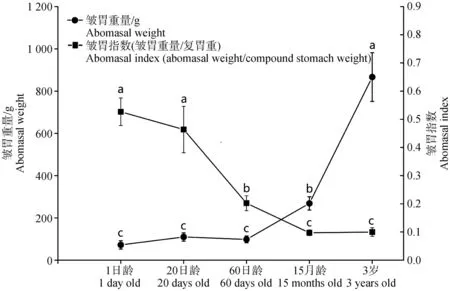
橫坐標表示年齡,N=3/組;左縱坐標表示皺胃重量,右縱坐標表示皺胃指數 The abscissa represents the age, N=3/group, the ordinate on the left side represents the weight of abomasum, and the ordinate on the right side represents the abomasal index圖1 不同年齡組牦牛皺胃重量與指數分析Fig.1 Analysis of weight and index of abomasum in yak at different ages
2.2 不同年齡段牦牛皺胃總RNA質量與測序數據質量控制
15個皺胃組織樣本的總RNA濃度均大于300 ng·μL-1,RIN值大于7.5,OD260 nm/OD280 nm在2.0~2.2之間,28S/18S核糖體RNA條帶清晰,RNA完整性較好,RNA質量檢驗合格,可進一步用于后續試驗分析。利用Agilent 2100生物分析儀檢測cDNA文庫的片段大小與質量符合要求,cDNA文庫有效濃度大于4 nmol·L-1,表明cDNA文庫構建成功。
如表3所示,15個皺胃組織樣本的有參轉錄組測序獲得過濾后的clean reads數目為741.36 M,過濾后得到的測序量106.19 G,有效堿基百分比均在93%以上,Q30均在95%以上,GC含量在50%左右,比對到參考基因組的reads比率均在94%以上,表明15個樣本的測序質量均較高,數據準確可靠,所選參考基因組的組裝滿足后續分析要求。
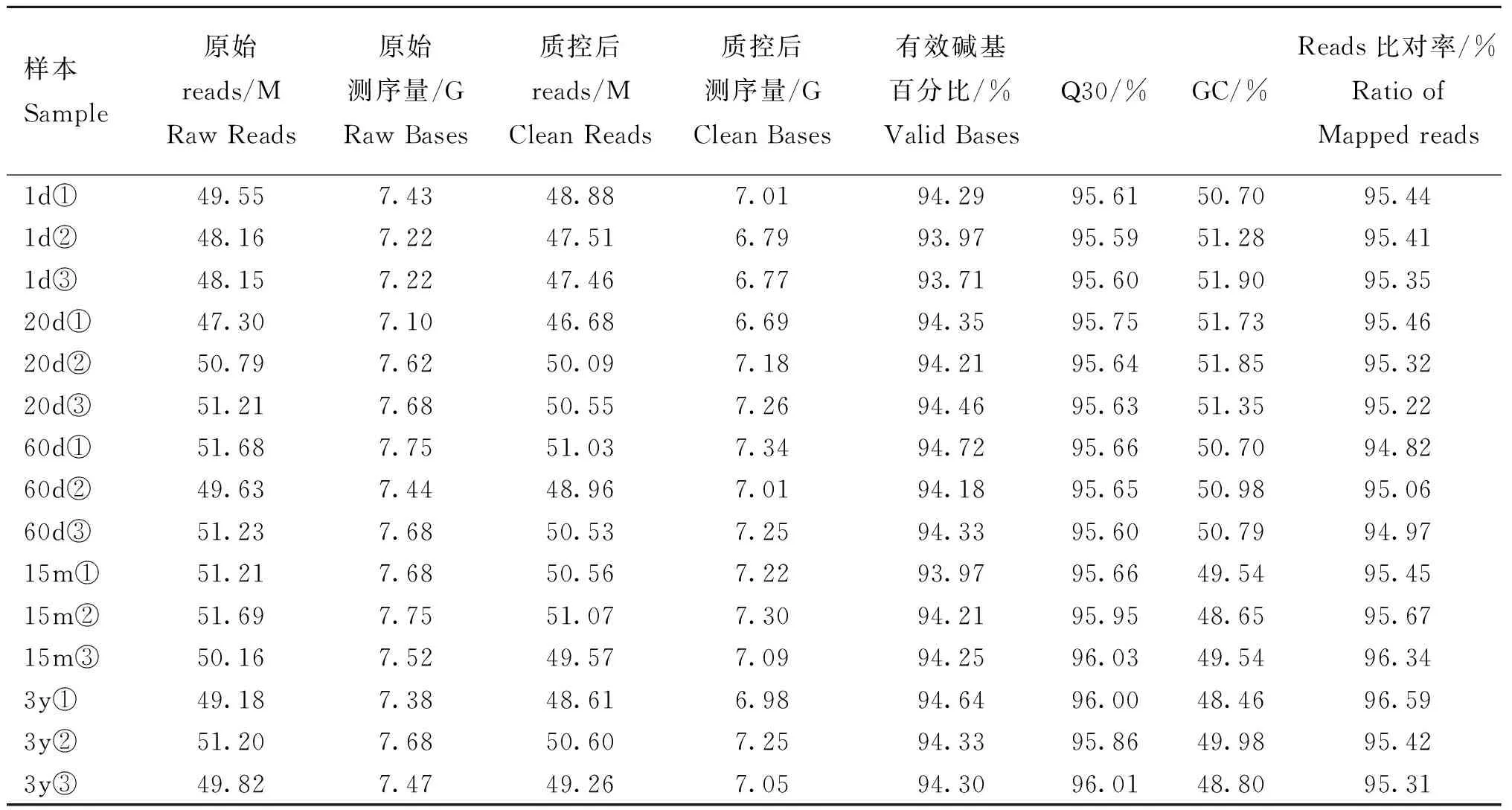
表3 牦牛皺胃組織轉錄組數據質量檢測分析Table 3 Quality analysis of transcriptome sequencing data of abomasum tissues in yak
2.3 不同年齡段牦牛皺胃基因表達水平分析
對不同年齡段牦牛皺胃組織基因表達水平進行分析,5個年齡組間的基因表達水平與基因密度均存在差異。如圖2A所示,1日齡、20日齡和60日齡3個年齡組組間的基因表達水平差異較小,15月齡組的基因表達水平低于其他組,3歲組整體基因表達量高于其他組;如圖2B所示,20日齡組基因密度高于其他組。
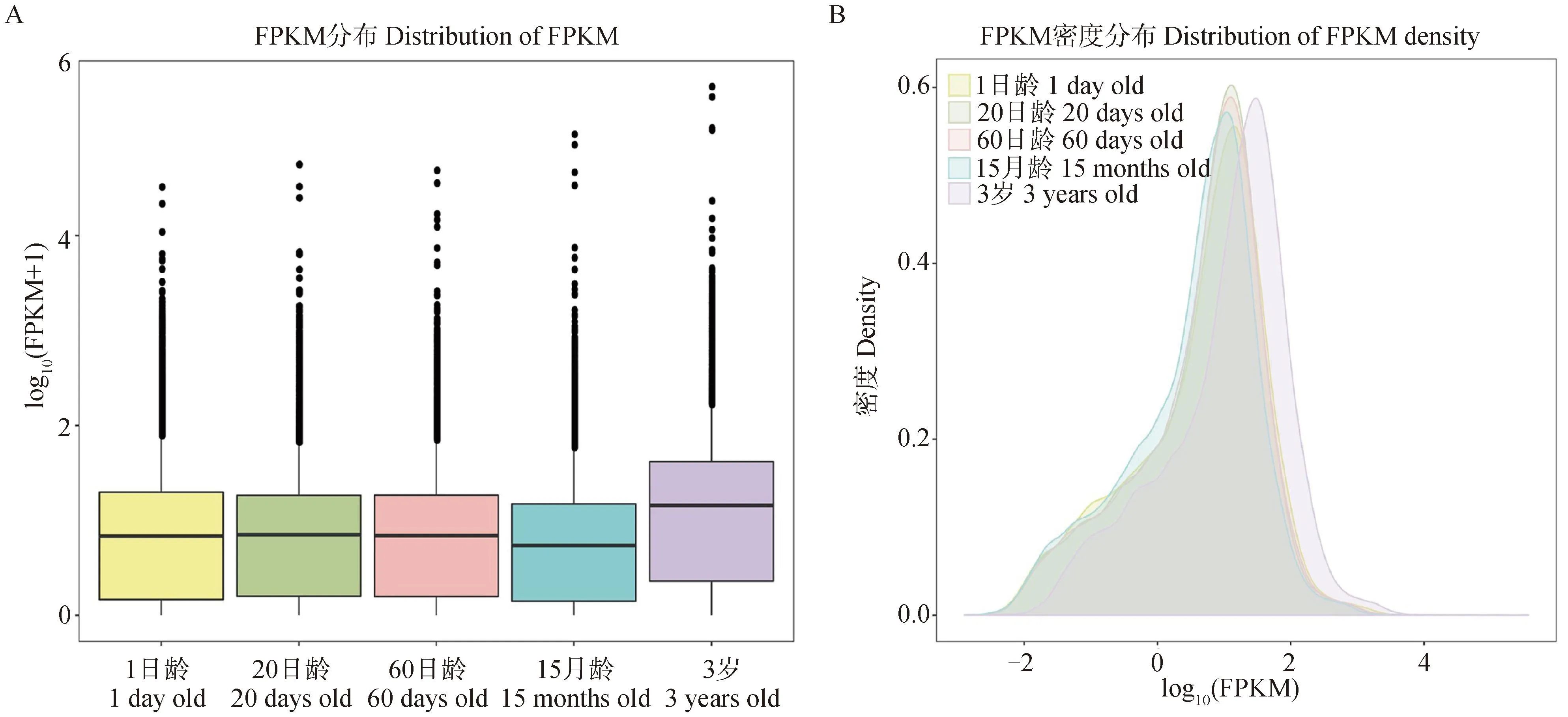
A.不同年齡組牦牛皺胃基因表達水平箱線圖,橫坐標為年齡,縱坐標為log10(FPKM+1),且展示了最大值、上四分位數、中位數、下四分位數和最小值。B.不同年齡組牦牛皺胃基因密度分布圖,橫坐標為log10(FPKM),縱坐標為基因密度 A. Boxplots of gene expression levels in abomasum of yaks at different ages, with the abscissa of age and the ordinate of log10(FPKM+1), showing the maximum, upper quartile, median, lower quartile and minimum values. B. Distribution of abomasal gene density in yaks at different ages, log10(FPKM)in abscissa and gene density in ordinate圖2 不同年齡組牦牛皺胃基因表達水平箱線圖和基因密度分布圖Fig.2 Boxplots of gene expression levels and distribution of gene density in abomasum of yaks at different ages
2.4 不同年齡段牦牛皺胃差異表達基因分析
為進一步探討在5個年齡階段牦牛皺胃組織DEGs的表達模式,本研究采用了兩種比較方法[24],即封閉組 (20日齡vs.1日齡,60日齡vs.1日齡,15月齡vs.1日齡和3歲vs.1日齡),相繼時間組 (20日齡vs.1日齡,60日齡vs.20日齡,15月齡vs.60日齡和3歲vs.15月齡)。如表4所示,以1日齡組為對照,隨年齡增加DEGs逐漸增多,在20日齡、60日齡、15月齡和3歲組中分別鑒定到1 310、1 715、1 931和2 199個DEGs,且4個對比組中上調基因的數量均高于下調基因(表4),其特有DEGs分別為 341、242、395和565個,4個組共有基因565個(圖3A),包括GKN1、CXCL17、SCNN1B、SCNN1G和CCL5等基因。以前一個時間點為對照,20日齡、60日齡、15月齡和3歲組分別鑒定到1 310、861、569和597個DEGs,20日齡vs.1日齡組的DEGs明顯高于其他3個對比組,其特有DEGs分別為 950、419、250和284個,4個組共有基因9個(圖3B),分別是MMP9、CDH26、GSTA3、TMEM61、ADGRG5、LOC102269721、LOC102287938、LOC102276015和LOC102271445。
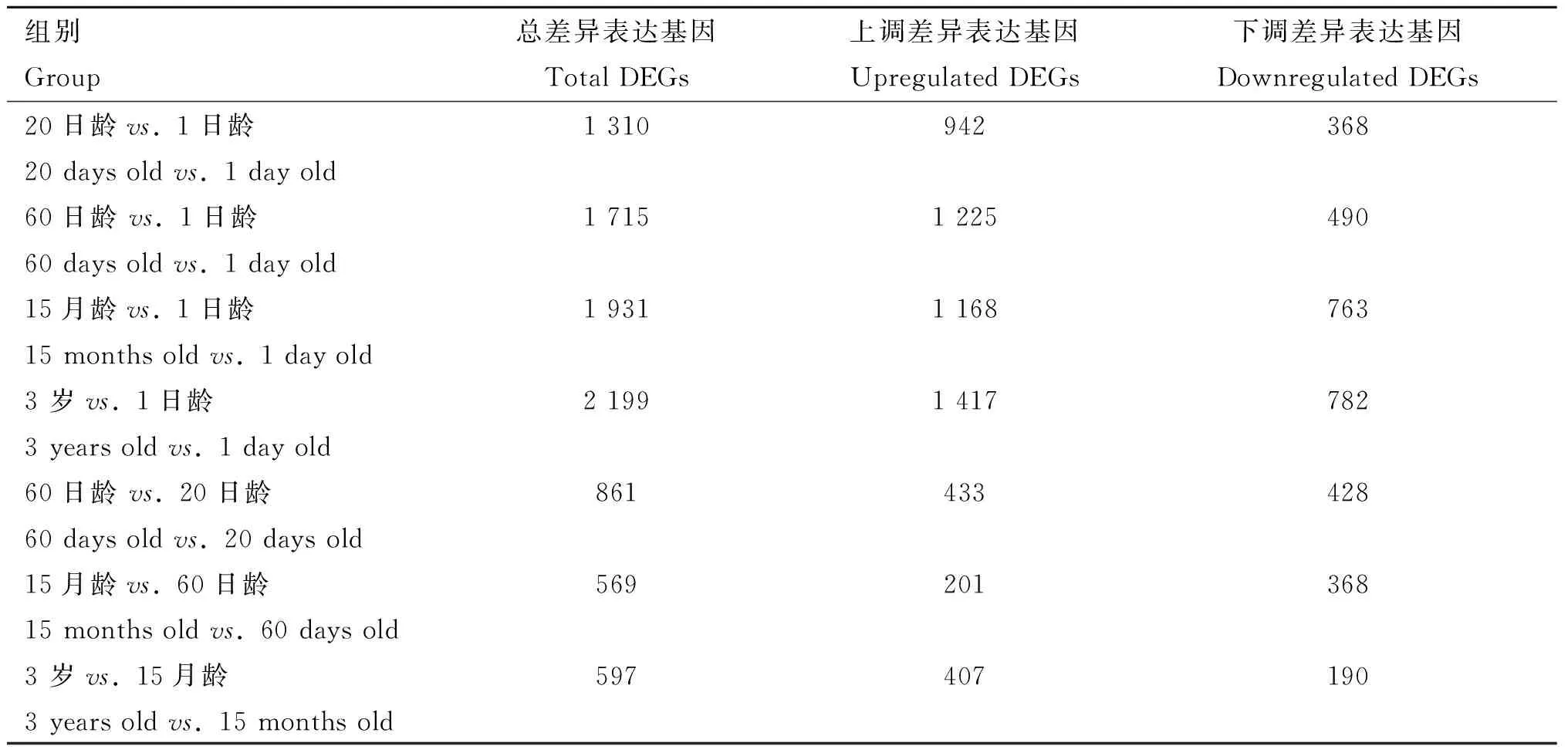
表4 不同年齡段牦牛皺胃組織差異表達基因數目統計Table 4 Statistics of the number of DEGs in abomasum tissues of yaks at different ages
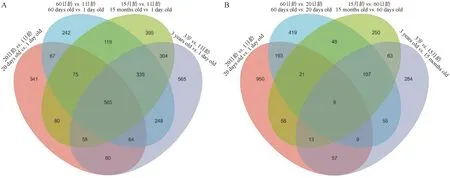
圖3 不同年齡段牦牛皺胃差異表達基因韋恩圖,4個封閉組(A),4個相繼組(B)Fig.3 Venn diagram of DEGs in abmasum in yaks with 4 closed (A) and 4 consecutive (B) groups at different ages
2.5 不同年齡段牦牛皺胃差異表達基因的功能注釋及分類
對封閉組的DEGs進行GO富集分析,在20日齡、60日齡、15月齡和3歲組中分別有1 191、2 578、1 117和2 835條顯著性條目。按P值排序篩選BP、CC和MF三大類的前10條顯著性GO條目。如圖4所示,不同年齡組的前10條顯著性GO條目中有共有的,也有各年齡階段特有的條目。在生物過程中,總共19個條目,共有條目12個,其中20日齡、60日齡、15月齡和3歲組共有3個條目,分別是免疫反應、炎癥反應和適應性免疫反應;20日齡、15月齡和3歲年齡組特有條目分別有1、4和2個,20日齡富集到補體激活的調節顯著性條目,60日齡無特有條目,15月齡分別富集到T細胞受體信號通路、細胞溶質鈣離子濃度的正向調節、Fc-ε受體信號通路等顯著性條目,3歲組是細胞趨化性和干擾素-γ介導的信號通路顯著性條目。在細胞組分中,總共14個條目,共有條目10個,其中20日齡、60日齡、15月齡和3歲組共有5個條目,分別富集于質膜外側、細胞外區、細胞外間隙和質膜等顯著性條目;20日齡、15月齡和3歲組各有1個特有條目,分別富集于膠原三聚體、鈉通道復合物、絲足和含膠原蛋白的細胞外基質顯著性條目。在分子功能中,總共17個條目,共有條目10個,其中20日齡、60日齡、15月齡和3歲4個年齡段共有6個條目,分別富集于抗原結合、C-C趨化因子、C-C趨化因子受體活性、趨化因子結合等顯著性條目;20日齡、60日齡、15月齡和3歲4個年齡段特有條目分別為3、1、2和1個,20日齡組富集到雙鏈RNA結合、免疫球蛋白受體結合等條目,60日齡組富集到乙醇脫氫酶(NADP+)活性條目,15月齡組是甲狀腺激素結合和跨膜信號受體活性條目,3歲組富集到具有拉伸強度的細胞外基質結構成分條目。
2.6 不同年齡段牦牛皺胃差異表達基因KEGG富集分析
對封閉組的差異表達基因分別進行KEGG功能富集分析,在20日齡、60日齡、15月齡和3歲組中分別有100、102、100和111條顯著通路。按P值排序篩選4個年齡組的前30條顯著性KEGG通路(圖5)。結果顯示,每個年齡組前30條顯著通路同樣存在共有的,也有各年齡階段特有的,總共43條通路,共有通路33個,其中20日齡、60日齡、15月齡和3歲4個年齡段共有20個條目,包括吞噬體、同種異體移植排斥反應和細胞因子-細胞因子受體相互作用;20日齡、60日齡、15月齡和3歲4個年齡段特有信號通路分別是4、1、3和4條,如20日齡組富集到白細胞跨內皮遷移通路,15月齡組富集到亞油酸代謝、谷胱甘肽代謝和糖尿病并發癥中的AGE-RAGE信號通路,3歲組富集到ECM受體相互作用、細胞色素P450對外源性物質的代謝、藥物代謝-細胞色素P450等信號通路。
2.7 牦牛皺胃發育和代謝候選基因篩選
本研究以1日齡為對照,篩選20日齡、60日齡、15月齡和3歲組皺胃組織DEGs,根據顯著性高低,分別從4個年齡組前30個DEGs中篩選影響牦牛皺胃發育的相關候選基因,見表5。結果顯示,在20日齡、60日齡、15月齡和3歲的年齡組中均包含共有基因,如KRT20;在20日齡、15月齡和3歲的年齡組中均包含共有基因,如GKN1、CXCL17;在60日齡、15月齡和3歲的年齡組中均包含共有基因,如JCHAIN、SCNN1B、SCNN1G;60日齡和3歲組均包含CCL5、B2M;另外4個組也有一些獨有基因,如20日齡中的GPR34、PTGS2、LAPTM5,60日齡組中的SCNN1B,15月齡組中的IGF2BP3,3歲齡組中的IGF2BP2,這些基因參與牦牛皺胃的不同發育階段,可能是與牦牛皺胃發育相關的重要候選基因。另外,本研究富集到參與皺胃的葡萄糖代謝、葡萄糖轉運、脂肪酸轉運、肽轉運、胃蛋白酶和溶菌酶活性相關的信號通路,分別篩選到12、12、16、4、1和11個候選基因,見表6。其中GANAB、PRKCSH、GBA2、SLC2A1、SLC2A3、SLC2A4、CPT1B、GOT2等是與牦牛皺胃的代謝和營養吸收相關的重要候選基因。

A-C. 4個年齡組DEGs在BP、CC、MF三大類中前10個GO條目。氣泡大小表示DEGs的數量(計數),氣泡顏色表示錯誤發現率(FDR P-value),x軸為-lg(P-value)值,y軸為GO條目 A-C. The top 10 GO terms in molecular function, cellular component and biological process, respectively. The bubble size represents the number (count) of DEGs, the bubble color represents false discovery rate (FDR P-value), the abscissa represents -lg(P-value), and the ordinate displays GO term圖4 差異表達基因GO富集氣泡圖Fig.4 Bubble charts of GO enrichment of differentially expressed genes
2.8 差異表達基因驗證
對隨機選取的5個差異基因進行qRT-PCR驗證,結果如圖6所示,以1日齡為對照,ABAC1基因在20日齡和15月齡上調;ACAT1基因在15月齡上調,但在20日齡、60日齡和3歲組下調;G6PC3、GOT2和SLC38A2基因在20日齡、60日齡、15月齡和3歲組均下調。上述所挑選的差異表達基因的qRT-PCR變化規律與轉錄組測序數據表達規律基本一致,進一步表明測序結果具有可靠性。
3 討 論
皺胃發育與多種因素密切相關,如飼養方式[25]、日糧[5,13]等,對反芻動物的營養物質消化吸收和生長發育具有重要影響。近年來,已有研究對牛[26-28]、羊[5]、駱駝[29]等的皺胃組織進行形態鑒定和生理功能研究,但這些研究主要集中在皺胃組織形態、免疫方面等,對分子水平的功能研究較少。目前關于牦牛皺胃發育的分子機理尚不清楚,需進一步研究,為牦牛的營養調控和健康生長提供理論參考和新思路。本研究中,隨年齡增長牦牛皺胃重整體呈增長趨勢,但20和60日齡的皺胃重差異不顯著,且60日齡有下降趨勢,可能是因為20~60日齡是自然放牧犢牦牛生長發育的一個重要階段,正在經歷由以液體奶為主到以牧草為主的過渡,瘤胃快速增長以適應這一變化,但網胃、瓣胃和皺胃重變化均較小。15月齡和3歲的皺胃重顯著增長,但皺胃指數逐漸下降,提示隨著年齡增加皺胃組織發育更加完善,但功能方面可能會發生一定程度的變化。1日齡牦牛皺胃重在復胃重中占比最大,顯著高于其他3個前胃(P<0.05),可側面反映牦牛皺胃可能成熟比較早,且新生牦牛皺胃在復胃中發揮著重要作用。20日齡至15月齡期間,皺胃重占比相較于前一個年齡均顯著下降(P<0.05),側面反映20日齡后牦牛的能量提供不再完全由皺胃組織主導,而部分由快速發育的瘤胃進行VFA代謝所提供的營養替代,與本實驗室唐嬌等[30]前期對5個年齡段牦牛瘤胃的轉錄組研究結果相呼應。

表5 不同年齡組牦牛皺胃的前30個差異表達基因Table 5 The top 30 differentially expressed genes in abomasum of yaks in different age groups

表6 參與皺胃主要代謝功能的候選通路與基因Table 6 The pathways and genes involved in major metabolic functions of abomasum
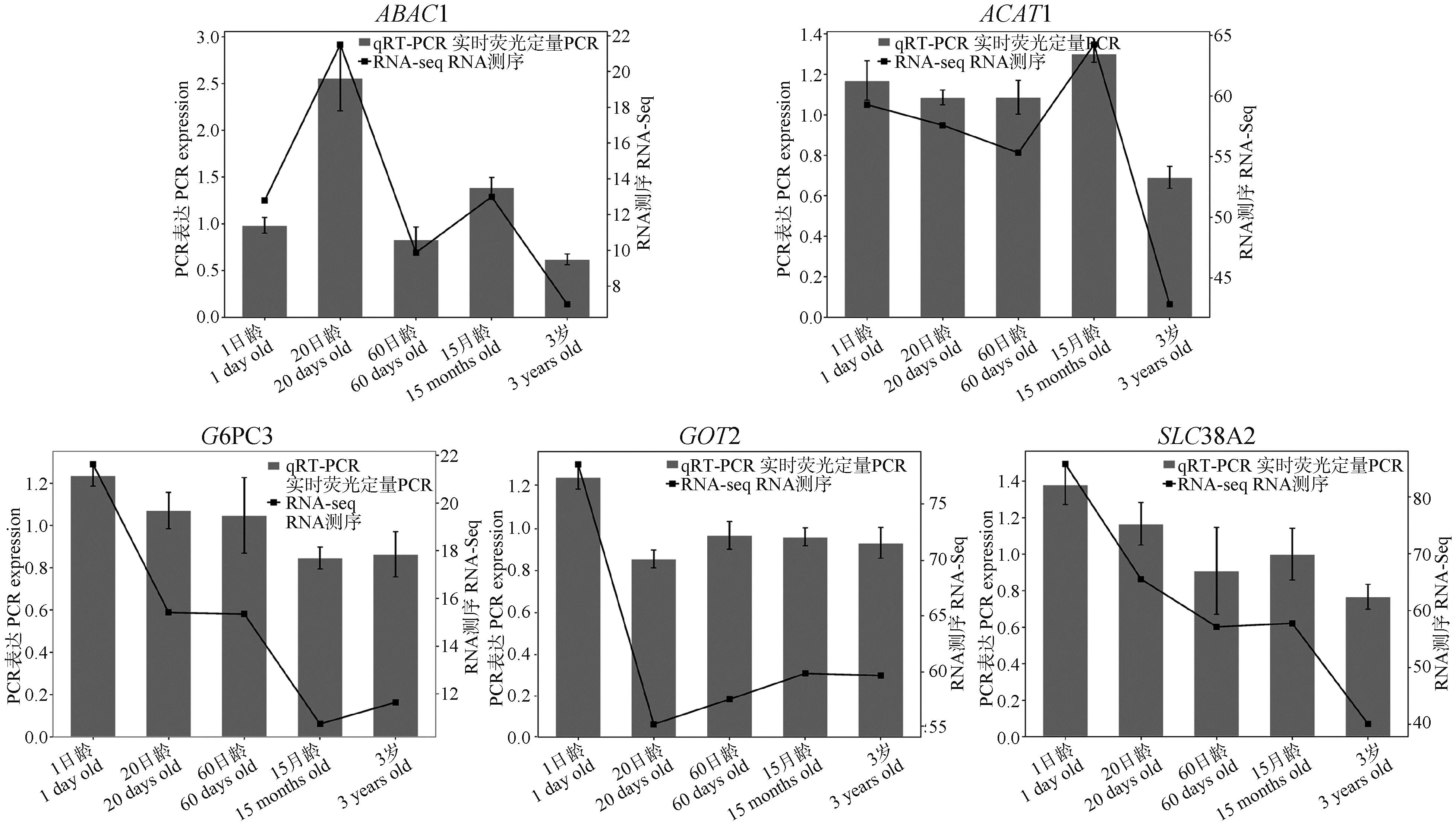
圖6 差異表達基因的實時熒光定量PCR驗證Fig.6 qRT-PCR verification of DEGs
牦牛皺胃胃壁是由漿膜、肌層、黏膜層和黏膜下層構成,其中黏膜又可細分為上皮、固有層和黏膜肌層[31]。研究發現,牦牛皺胃的腺區固有層均分布著大量彌散淋巴細胞和孤立淋巴小結,使其具有比其他反芻動物更強的黏膜免疫功能[1],這可能與其長期生長在高原環境密切相關。KEGG富集分析顯示,與1日齡相比,在20日齡、60日齡、15月齡和3歲4個年齡段的DEGs共同顯著富集到20條信號通路,這些通路多與牦牛皺胃組織發育及免疫調控相關,包括吞噬體、細胞粘附分子、細胞因子-細胞因子受體、趨化因子信號通路、腸道IgA生成通路、Thl和Th2細胞分化、Th17細胞分化信號通路等。研究表明,Th17細胞釋放IL-17A、IL-17F、IL-21、IL-22和IL-9,并通過它們與腸上皮細胞相互作用,從而誘發胃腸道炎癥[32],皺胃與炎癥性腸病之間是否具有聯系、是否可通過皺胃探究牦牛炎癥性腸病的發病機制,以及Th17細胞分化途徑是否與其相關值得進一步研究。20日齡、60日齡、15月齡和3歲4個年齡段特有信號通路分別有4、1、3和4條,20日齡組是白細胞跨內皮遷移通路,15月齡組是亞油酸、谷胱甘肽代謝和糖尿病并發癥中的AGE-RAGE信號通路,3歲組是ECM受體相互作用、細胞色素P450對外源性物質的代謝、藥物代謝-細胞色素P450, 研究發現細胞色素P450外源性物質的代謝途徑和ECM受體相互作用途徑在維持瘤胃上皮完整性和健康中發揮作用[33],可推斷這些代謝通路可能在牦牛皺胃的健康發育過程中發揮著重要作用。
根據差異表達基因的顯著性高低,分別從4個年齡組前30個DEGs中篩選影響牦牛皺胃發育相關的候選基因,其中GKN1、CXCL17、SCNN1B、SCNN1 G、CCL5和IGF2BP3等基因可能與牦牛皺胃發育相關。胃動蛋白1(gastrokine-1,GKN1)是胃動蛋白家族成員之一,該基因能在胃粘膜中特異性表達一種新型自分泌/旁分泌蛋白。研究發現,GKN1具有保護胃竇粘膜,并能促進損傷胃竇粘膜的修復和增殖分化,促進胃粘膜上皮細胞分裂與移動、維持上皮層完整性和抑癌等功能[34-36]。趨化因子17(CXC chemokine ligand 17,CXCL17)是一種與粘膜內環境穩定相關的新型CXC趨化因子,該基因在支氣管和胃部均有表達,且前者表達高于胃部[37-38]。研究發現CXCL17參與胃癌的發生[39],能促進胃癌細胞的增殖[40]。另外,在對幽門螺旋桿菌根除者的胃內菌群特征研究中發現,CXCL7可能影響胃內菌群結構[41],與胃部健康息息相關。鈉通道上皮1亞基β(sodium channel epithelial 1 subunit beta,SCNN1B)位于染色體16p12.2-p12.1,編碼640個氨基酸[42-43]。研究發現,SCNN1B基因能誘導細胞凋亡、阻滯細胞周期、抑制癌細胞侵襲、增殖與遷移和促進細胞粘附,其過表達可抑制胃癌細胞上皮間質轉化[44-45]。鈉通道上皮1亞基γ(sodium channel epithelial 1 subunit gamma,SCNN1G)主要在胃癌細胞中的細胞質和細胞膜中,研究表明SCNN1G能顯著抑制胃癌細胞增殖、侵襲與遷移,該基因的表達與WNT/β-catenin信號通路緊密相關[46]。C-C基序趨化因子配體5(C-C motif chemokine ligand 5,CCL5)是CC亞家族趨化因子基因,具有調節正常T細胞表達和分泌的功能,同時能促進炎性細胞因子的釋放,參與免疫調節和炎癥過程[47];CCL5也能提高活化T細胞的葡萄糖攝取能力和ATP水平[48]。并在瘤胃上皮的基底和棘突層定位到CCL5,在瘤胃內環境穩定中發揮重要作用[30,49]。胰島素樣生長因子II mRNA結合蛋白3(insulin like growth factor 2 mRNA binding protein 3,IGF2BP3)是一種RNA結合蛋白,能參與細胞極化、遷移、增殖和分化等生物過程[50-51]。綜上,GKN1、CXCL17、SCNN1B、SCNN1G、CCL5和IGF2BP3基因可能在牦牛皺胃組織的發育過程中發揮著關鍵調控作用。
牦牛皺胃可消化的營養物質包含葡萄糖、脂質、蛋白質等,本研究富集到參與皺胃的葡萄糖代謝、葡萄糖轉運、脂肪酸轉運、肽轉運、胃蛋白酶和溶菌酶活性相關的信號通路,分別篩選到12、12、16、4、1和11個候選基因。其中GANAB、PRKCSH、GBA2、SLC2A1、SLC2A3、SLC2A4、CPT1B、GOT2、SLC15A1等是與牦牛皺胃代謝和營養吸收相關的重要候選基因。葡萄糖酰神經酰胺酶2(glucosylceramidase beta 2,GBA2)基因編碼一種膽汁酸β-葡萄糖苷酶,可催化膽汁酸3- o -葡萄糖苷作為內源性化合物的水解,在碳水化合物的運輸和代謝中起作用[52]。溶質載體家族2成員1(solute carrier family 2 member 1,SLC2A1)又稱GLUT1,是反芻動物促進葡萄糖攝入的主要轉運蛋白[53]; 溶質載體家族27成員4(solute carrier family 27 member 4,SLC27A4)又稱FATP4,是動物機體調控脂肪酸攝取的重要因子,能促進機體對脂質的吸收[54];溶質載體家族15成員1(solute carrier family 15 member 1,SLC15A1)又稱PepT1,參與小肽的跨膜運轉,可直接促進機體對蛋白質的消化吸收[55]。研究發現,補飼精料更有利于犢牦牛對葡萄糖、脂肪、蛋白質的消化吸收,同時發現牦牛皺胃GLUTI、PepT1和FATP4基因相對表達量均顯著升高[13,56],說明這些基因在牦牛皺胃的營養代謝和吸收過程中扮演著關鍵的角色。目前國內外對于牦牛皺胃營養轉運載體的研究極少,有待進一步探究。
4 結 論
本研究對液體乳為主階段(1、20日齡)、過渡階段(60日齡)、反芻為主階段(15月齡和3歲齡)共5個年齡段的牦牛皺胃組織進行了轉錄組測序,并對復胃相關參數進行測定。在整個發育過程中,瘤胃重的增長最快,其次是瓣胃、網胃和皺胃,且皺胃指數整體呈下降趨勢。GO注釋分析和KEGG富集分析結果表明,差異表達基因多參與免疫反應、吞噬體、細胞因子-細胞因子受體相互作用、ECM受體相互作用、細胞色素P450對外源性物質的代謝、藥物代謝-細胞色素P450等信號通路。這些信號通路有利于牦牛在高原環境中更好促進皺胃細胞的增殖分化,提高免疫力,更有利于皺胃的生長發育。對牦牛皺胃營養代謝通路進一步篩選,得到GANAB、PRKCSH、GBA2、SLC2A1、SLC2A3、SLC2A4、CPT1B、GOT2和SLC15A1等與皺胃營養吸收和代謝相關的重要候選基因。上述這些基因可能參與牦牛皺胃的發育和營養代謝過程,可為進一步理解牦牛皺胃的發育和營養代謝機制提供理論基礎。

