反芻動物瘤胃微生物培養組學研究進展
范定坤,張吉賢,付域澤,馬 濤,畢研亮,張乃鋒
(中國農業科學院飼料研究所 農業農村部飼料生物技術重點實驗室,北京 100081)
微生物廣泛存在于動物消化道內,與宿主形成共生關系,并據此執行基本的生理功能。反芻動物瘤胃微生物相較于其他動物更為復雜多樣,具有纖維分解、脂肪降解、植物蛋白水解、微生物蛋白合成等功能[2]。此外,瘤胃菌群產生的代謝物如揮發性脂肪酸等能夠通過調控宿主基因表達促進瘤胃上皮發育,與宿主生理功能密切相關[3]。然而到目前為止,瘤胃環境中不同細菌占據的生態位仍不明確,細菌多樣性及數量仍然是基于測序算法估測得到的。在現有1 300個瘤胃基因組的基礎上[4],Stewart等[1]通過宏基因組測序增加了4 941個新的宏基因組數據,而且仍有未知的微生物存在于反芻動物瘤胃中。目前,瘤胃中可培養微生物僅有500余株,不足瘤胃微生物總數的10%[4],嚴重阻礙了基于菌株水平對瘤胃微生物菌群結構和功能的研究。培養組學是一種采用多種培養條件,結合高通量測序技術鑒定菌種的培養方法。高通量、并行化的培養組學技術在瘤胃微生物中的應用,為在菌株水平上研究重點菌株功能及其與宿主互作關系提供了新的視角。本文從瘤胃微生物的組成結構出發,系統闡述了培養組學在反芻動物瘤胃微生物培養的應用現狀、挑戰及展望,以期為進一步探索瘤胃微生物多樣性、補充瘤胃菌株資源提供理論基礎和參考依據。
1 反芻動物瘤胃微生物的組成與結構
瘤胃微生物是動物界迄今為止所描述的最多樣化的消化道生態系統之一,其中包括1010~1011CFU·g-1的細菌、108~109CFU·g-1的古菌、105~106個·g-1的原蟲、103~104CFU·g-1的真菌以及未知含量的病毒[1]。在出生后的24 h,反芻幼畜的瘤胃壁開始富集需氧菌和兼性厭氧菌群,并占據主導地位[5]。之后的2周內,瘤胃細菌的種類和豐度發生極大變化,需氧菌和兼性厭氧菌被逐步取代,菌群相對豐度以擬桿菌門升高和變形菌門降低為主要特征,厚壁菌門內部則從鏈球菌屬向普雷沃氏菌屬轉變[6-8]。成年反芻動物瘤胃菌群的構成較為穩定,主要包括厚壁菌門、擬桿菌門以及變形菌門,與其幼齡階段的菌群組成有明顯差異[2]。厚壁菌門和擬桿菌門是瘤胃微生物的優勢菌群,并且在纖維降解中發揮了重要作用[2]。例如,厚壁菌門的黃色瘤胃球菌(Ruminococcusflavefaciens)、白色瘤胃球菌(Ruminococcusalbus)等是重要的纖維素降解菌[9]。除了纖維降解菌,瘤胃微生物優勢菌還包括能夠將植物性蛋白以及非蛋白氮轉化為微生物蛋白供宿主利用的蛋白質降解菌,如Ruminobacteramylophilus、Eubacteriumrumination、Streptococcusbovins、Bacteroideruminicola等[10]。出自Lactobacillus、Streptococcus、Enterococcus和Pediococcus菌屬的乳酸相關菌[10],以及通過氫轉移與其他瘤胃微生物合作維持瘤胃pH穩定的產甲烷菌[3]等在調節宿主消化系統和瘤胃內環境方面起重要作用。某些低豐度菌群在功能上也需要引起重視。纖維桿菌門的產琥珀酸絲狀桿菌(Fibrobactersuccinogenes)僅占細菌多樣性的0.5%,然而在大多數核心微生物組研究中均有報道[11-12]。Fibrobactersuccinogenes以纖維素為底物發酵產生的可溶性糖和琥珀酸鹽能夠促進其他微生物組的代謝,因而被認為是一個關鍵的纖維降解物種[13]。古菌域通常在瘤胃中的占比較小,僅占瘤胃微生物總豐度的1.7%,其中包括Methanosarcina、Methanomicrobium、Methanobrevibacter、Methanobacterium等產甲烷菌[10],但產甲烷菌仍然普遍存在于反芻動物瘤胃中,因此屬于反芻動物核心菌群的一部分[12]。
前人采用傳統的分離培養方法分離獲得了部分瘤胃可培養菌株[14],如RuminococcusflavefaciensWQ-1[15]。Hungate1000庫中保藏有410株瘤胃來源的微生物,覆蓋了82個瘤胃菌屬[3]。此外,包括美國ATCC菌種保藏中心、哥德堡大學CCUG菌株保藏中心、德國DSMZ保藏中心、日本JCM菌株保藏中心、比利時BCCM菌種保藏中心、英國NCTC菌種保藏中心在內的國際菌種保藏中心共保藏了117種瘤胃微生物純培養物[16]。Liu等[17]通過原位培養法分離出包括Pseudomonasstutzeri、Proteuspenneri、Klebsiellapneumoniae等在內的12種28株尿素分解菌,為進一步探索微生物參與瘤胃氮代謝提供有效幫助。de Oliveira等[18]從瘤胃中分離出可產生抗菌肽的鏈球菌,并通過比較基因組學表征了它們的抗菌活性以及與瘤胃環境適應相關的遺傳特征。盡管如此,瘤胃微生物的分離培養尚處于探索階段,能夠純化培養的菌種占比較小,因此需要借助現代培養組學等技術手段加大瘤胃功能菌群分離培養和鑒定的工作力度。
2 培養組學的技術發展概況
培養組學是利用多種培養條件進行細菌培養,并通過MALDI-TOF和16S rRNA鑒定物種的新方法。培養組學具有并行化、可視化、活菌保藏等優勢,同時也有篩選不確定性高、培養條件復雜等缺點,如圖1所示。作為一種研究復雜微生物生態系統的全新方法,培養組學在傳統微生物培養的基礎上開創了新的試驗方法和研究技術,使其具有高度并行和高通量的特點,因而被賦予了“組學”地位。此前,受限于培養條件和培養技術的滯后,大多數微生物的分離培養并未成功,人們普遍認為超過80%的未分類的細菌無法被分離培養,直至Lagier等[19-20]引入培養組學技術,使得細菌物種的分離培養和基因組測序成為可能。Lagier等[21]采用212種不同的培養條件成功從人類腸道獲得1 057種細菌,包括334種已知但未被分離培養的細菌和197個潛在新物種。培養組學微生物分離和培養的技術主要采取了以下兩種方式:1)通過基于液滴的微流體將水相中的游離細胞分裝在油乳液中;2)在物理微孔或微閥的小型陣列中對單個微生物進行基于有限空間的分區。
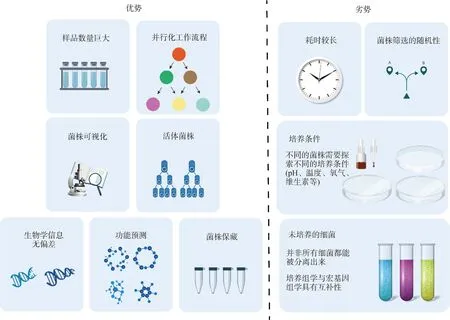
圖1 培養組學的優、缺點Fig.1 The strengths and weaknesses of culturomics
2.1 基于液滴微流體的培養組學技術
基于液滴的微流體依靠的是兩相微通道流體捕捉分散在球形顆粒中的單個細胞或分子,這些顆粒由生物相容性油包裹,由于其在高通量、并行化、標準化和動態過程控制方面的優勢,該技術被視為單細胞微生物分離培養工作流程的關鍵組成部分[22]。然而,細胞的分離過程符合泊松分布,每個微液滴包裹的細胞數量無法準確預知,只有部分微液滴僅包含單細胞,而更多的微液滴是空的或包含兩個及以上數量的細胞[23-24]。目前,提高分離單細胞的概率通常是通過樣品的無限稀釋來實現的。
瘤胃、腸道等厭氧生態環境中存活的微生物在利用微流體分離、培養、分析單個微生物細胞時會面臨額外的挑戰,即樣品處理、生長檢測和微流控分選需要在無氧條件下進行。由于與流式細胞儀或分選裝置耦合的微流控管道難以集成到標準厭氧工作站中,目前已開發了一些厭氧條件下微生物生長監測的替代方法。例如,微流控條紋板(microfluidic streak plate,MSP)將微流控與條紋板技術相結合,微流控產生的液滴由均勻的油阻隔開,并允許手動或自動將其移至培養皿中培養[25]。MSP在好氧和厭氧條件下均能從食木白蟻腸道微生物組中分離出單細胞細菌[26]。最近,MSP單細胞培養被整合到高通量功能篩選工作流程中,如咪唑啉酮降解細菌的定向選擇[27]。
MicDrop將厭氧封裝培養的單個細菌微流體液滴與Illumina MiniSeq測序相結合,實現間接非連續生長監測,進而實現厭氧環境下的微生物培養和鑒定[28]。其原理是將產生的16S rDNA序列變體(sequence variant,SV)在含有相同細菌分類群的微液滴之間共享,通過16S rDNA測序和qPCR數據在SV水平擬合生長曲線,可以在厭氧工作流程之外跟蹤單個物種的生長。MicDrop的高通量培養可以進行功能性篩選,評估在選擇性培養條件下厭氧富集的微生物的生長動力、分類學特性和微液滴中的單菌豐度。Watterson等[29]開發了一種基于液滴的微流控系統,并且集成了顯微檢測,將分離、培養和分選三種基本功能結合在一起,通過設定不同的閾值標準,可以將單個細菌擴繁而成的菌落進行選擇性地收集和傳代,從而進行分類和功能表征。
相較于厭氧培養,有氧的工作條件可以實現空間要求更高的復雜微流控設置,以進行深入的功能篩選。在這方面的創新型進展之一是將生物相容性雙水包油乳化液滴微流控技術(microfluidic double water-in-oil-in-water emulsion droplet technology,MDE)和熒光激活細胞分選(fluorescence-activated cell sorting,FACS)相結合,以研究熒光標記的目標菌株和潛在功能菌株之間單細胞水平的微生物相互作用[30]。Terekhov等[31]通過MDE-FACS將綠色熒光蛋白標記的金黃色葡萄球菌與微生物菌群混懸液共包封,鑒定了具有潛在抗金黃色葡萄球菌生物活性的代謝物。
2.2 基于分區的微列陣培養組學技術
基于分區的培養組學技術的主要優勢是能夠提供更大的微生物培養空間,可以將單細胞擴展到更大體積的高密度微菌落。與微流控相比,從離散的微室中分離選定的微菌落通常更直接。而原位培養概念的引入使得基于分區的微生物培養得以進一步發展。原位培養是通過模擬自然環境,提供微生物生存的化學成分的微生物培養方法。該方法可以最大限度的還原微生物原位生態環境,簡化人工微生物培養條件的探索。原位培養法使用了選擇通過性膜以允許微生物與其原棲息環境進行有限的接觸,納入其必需生長因子的同時實現微生物之間的隔絕,最終富集形成理想的純化菌落。此外,目標微生物產生的生長抑制代謝物可以經選擇性通過屏障結構進行自由擴散,避免了局部聚集導致的培養環境惡化[32]。Liu等[17]使用透析袋作為選擇通過性膜將細菌進行瘤胃液包埋實現原位培養,成功分離出28株含有脲酶基因的細菌。基于原位培養法的原理,Kaeberlein等[33]將擴散室培養引入微生物研究用于培養“不可培養”的微生物,并成功獲得2株菌株。然而,擴散室培養仍無法實現有效的高通量微生物培養,極大限制了其適用性。Nichols等[34]研究并設計了由數百個微室構成的隔離芯片(iChip),可將單個微生物細胞裝入微室實現高通量的特異性富集培養。滑移芯片(slipchip)是兩塊由單細胞微室和流體導管組成的微流控芯片嵌合而成的,可用于消化道厭氧菌的培養[35]。滑移芯片可以物理切割微生物群落,一部分用于16S rRNA測序,另一部分用于目標微生物的保存和擴繁[35]。
除了需要分離培養微生物之外,人們逐漸開始對捕捉單個微生物在傳代過程中的進化產生興趣。單細胞分離延時成像技術(single-cell isolation following timelapse imaging,SIFT)通過多代延時顯微鏡追蹤空間受限活細胞,該技術能夠揭示目標微生物的生理狀況和其對非生物刺激反饋的基本信息[36]。在兩層SIFT微流控芯片中,第一個流動層用于細胞分離,而第二層集成了一系列微流控閥門、流動通道和用于收集芯片外單細胞的光鑷[36]。目前,SIFT僅應用于單個細菌的無損多代成像和追蹤以及分離和擴繁培養,但該技術也可用于高通量分離和篩選動物微生物[36]。
3 培養組學在瘤胃微生物培養中的應用現狀
當前培養組學在瘤胃微生物的研究中應用較少,但已有的研究已經在一定程度上揭示了其在縮小瘤胃菌群物種未知范圍、探知瘤胃微生物功能等方面的巨大潛力。瘤胃微生物基因組學網絡(Rumen Microbial Genomics Network)在全球研究聯盟家畜研究小組(Livestock Research Group of the Global Research Alliance)的支持下成立,并將生成瘤胃微生物基因組目錄Hungate1000作為主要目標以期推動反芻動物的高效生產并減少溫室氣體排放[4]。Hungate1000目錄中的微生物覆蓋9門48科82屬,Seshadri等[4]選擇410株可培養的瘤胃微生物進行基因組測序,并與91株公開的可培養菌株的基因組聯合分析,構建了Hungate1000瘤胃微生物基因組目錄(包括480株細菌和21株古菌)。在瘤胃中占據主導地位的瘤胃厚壁菌門(Firmicutes)和擬桿菌門(Bacteroidetes)貢獻了Hungate1000基因組目錄的大部分,其中Lachnospiraceae家族是最大的單一類群(32.3%);可培養的古菌主要來自Methanobrevibacter屬和Methanomassiliicoccales目[4]。Hungate1000中大多數可培養的微生物來自于牛(70.9%)或羊(17.6%),其余可培養微生物則來自于包括駱駝在內的其他反芻動物。de Oliveira等[18]從牛瘤胃中分離到463株細菌,其中5株細菌含有高度保守的生物合成基因簇,與瘤胃鏈球菌中抗菌肽的產生有關。Liu等[17]通過原位培養法模擬瘤胃環境,從瘤胃微生物菌群中分離出404株細菌,測序后發現28株具有脲酶基因的新物種在能量代謝與氮代謝方面發揮重要作用。然而,仍有已被基因組測序探知的瘤胃微生物尚未被分離培養[4]。Zehavi等[16]研究發現,培養基類型、樣品稀釋度、系統發育等多種因素能夠影響瘤胃微生物的可培養性,其中樣品稀釋能夠顯著降低瘤胃微生物可培養性對相對豐度的依賴。另外,微生物的豐度和系統發育是決定瘤胃微生物可培養性的主要因素[16]。瘤胃微生物與多糖降解、蛋白質的水解與合成、纖維素的降解、瘤胃解毒等功能密切相關,因此基于培養組學的瘤胃微生物純化培養能夠分離某些關鍵功能的標志性菌株,為深入了解瘤胃微生態系統提供新視角[1]。
4 培養組學在瘤胃微生物培養中的挑戰
4.1 營養基質和生長條件的鑒定
反芻動物瘤胃中的古菌和部分細菌難以分離培養的事實早已形成共識。在純化培養瘤胃微生物時,所需的營養基質可用于分離或富集特定菌株。然而,部分瘤胃微生物的培養對生長環境和生長因子(維生素、氨基酸、腐殖酸、無機元素等)要求極為嚴苛,因此在實驗室中探索菌株生長條件具有一定挑戰性。對于難以適應富營養環境的瘤胃微生物,可使用寡營養培養基進行分離培養[32]。此外,一些無機物如金屬化合物、含硫化合物、含氮化合物參與了微生物生理代謝的微生態循環,但由于其濃度低于實驗室檢測極限,也成為了瘤胃微生物培養的重要阻礙。對于部分微生物而言,它們所需的寬泛的底物類別可從基因組序列中推斷出來,但仍然無法精準確定每個底物類別中的所需物質。這種可變性在一定程度上反映了基于底物基質和生長條件分離培養微生物的痛點和難點。
4.2 休眠期微生物的復蘇
瘤胃微生物種群在受到環境脅迫時,部分成員能夠以存活為目的通過表型變異進入休眠[37-38]。雖然目前有大量關于微生物休眠的文獻報道,但人們對其休眠與復蘇的過渡機制仍知之甚少[37]。有研究表明,微生物休眠期的結束可能受到某些信號分子的影響,過程具有隨機性[38]。此外,微生物可能已經進化出不同的機制來調節機體的休眠與復蘇,這也使得瘤胃微生物分離培養變得更加復雜[39]。
4.3 菌群的共生關系
部分微生物群落成員之間通過直接或間接交換必要的生物分子形成種間依賴的共生關系。然而,人工分離培養微生物時往往會忽視這種共生的微生態關系,導致分離培養的目標單菌無法正常生長和存活。產氫細菌(H2-producing bacteria)和氫利用產甲烷菌(H2-consuming methanogens)是典型的共生微生物,Guzman等[40]使用電生物化學系統模擬產甲烷菌在共生培養中的氫氣消耗,成功富集Syntrophomonaszehnderi,但仍不能使其從產甲烷菌中完全分離出來進行單菌純化培養。此外,Diapherotrites、Parvarchaeota、Aenigmarchaeota、Nanohaloarchaeota、Nanoarchaeota(DPANN)古菌和Candidate phyla radiation(CPR)細菌的基因組較小,通常以未分離的小細胞共生體的形式被檢測到,它們主要以共生形式或寄生形式依賴于其他宿主微生物存活[39]。因此,以組合的方式進行微生物分選,可能是突破微生物分離培養瓶頸的契機。
4.4 菌群的競爭關系
在瘤胃復雜的微生物群落中,高豐度微生物對生長環境的廣泛適應性提高了其分離及純化培養的成功率[41]。菌群的競爭性抑制使分離低豐度瘤胃微生物的過程更加復雜。目前常用的分離培養低豐度微生物的方法是利用基因組測序技術預測目標微生物生長的最佳環境,然后對其進行純化培養。然而,即使低豐度微生物被成功分離,在隨后的富集試驗中,它們仍有可能被生長速率更快的其他微生物競爭性地取代,導致培養失敗。近年來,從樣本中分離單個微生物并接種到培養基進行培養已成為分離培養低豐度微生物的有效方法[41-43]。
5 培養組學在瘤胃微生物培養中的展望
培養組學能夠增加已知微生物的種類和數量,填補微生物學未知領域的空白。Zehavi等[16]通過研究培養基類型、樣品稀釋度、系統發育等因素與培養瘤胃微生物之間的關系,發現約23%瘤胃微生物是潛在可培養的且主要來源于低豐度微生物種群。迄今為止,反芻動物瘤胃微生物的多樣性研究尚不充分,培養組學的出現可為未知瘤胃微生物的分離鑒定提供新方法。
培養組學不僅能夠拓展微生物種質資源,而且可以校正特定環境下微生物群的組成結構及菌群豐度。宿主生理健康及疾病與消化道菌群組成的變化密切相關,可通過移植培養組學分離的菌株來調控宿主菌群結構進而發揮重塑菌群穩態的重要作用,以期維護腸道屏障,改善腸道健康。鑒于微生物培養組學在恢復菌群平衡和校正微生物組成的潛在作用,分離培養與疾病相關的關鍵微生物可能會對特定環境下的微生物對話機制提供見解。
抗生素可以廣泛用于由致病菌感染引起的疾病治療,其主要來源是細菌,因此利用培養組學深入挖掘細菌基因庫與參考菌株庫對新型抗生素的發現具有重要作用[44]。研究表明,反芻動物瘤胃中存在部分能夠分泌抗菌肽的功能性菌株,如StreptococcilutetiensisUFV09,StreptococcilutetiensisUFV11,StreptococcilutetiensisUFV58等,分離培養瘤胃細菌可能是開發新型抗菌肽的有效途徑[18]。因此,培養組學提供的廣泛的未知微生物類群和每個物種的多個菌株,可以作為新型抗生素的潛在來源為治療細菌感染性疾病開拓新思路。
6 小 結
培養組學技術在瘤胃微生物分離培養中的應用為擴充瘤胃菌群數據庫、探索瘤胃微生物的組成和功能,以及后續通過調節瘤胃微生物來改善瘤胃健康帶來了新機遇。然而,瘤胃微生物培養組學尚處于起步階段,仍面臨諸多挑戰,包括培養條件嚴苛、生存/競爭關系復雜、休眠復蘇機理不清等,需要進一步研究以突破相關技術瓶頸。未來建議靈活運用并持續優化培養組學技術方案,注重多組學技術的有機結合,豐富瘤胃微生物圖譜、篩選標志菌株及產物,并實現轉化應用。隨著瘤胃微生物與宿主互作研究成為熱點,瘤胃微生物培養組學具有廣闊的應用前景。

