固態(tài)共培養(yǎng)木霉和芽孢桿菌抗煙草黑脛病及其活性成分研究
彭治鑫,趙棟霖,林 偉,高 貴,管志坤,王耀斌,張成省,李 偉
固態(tài)共培養(yǎng)木霉和芽孢桿菌抗煙草黑脛病及其活性成分研究
彭治鑫1,2,趙棟霖2,林 偉3*,高 貴4,管志坤5,王耀斌5,張成省2,李 偉1*
(1.長江大學(xué)生命科學(xué)學(xué)院,湖北 荊州 434000;2.中國農(nóng)業(yè)科學(xué)院煙草研究所,青島 266101;3;福建省煙草公司南平市公司,福建 南平 353000;4.貴州省煙草公司黔西南州公司,貴州 興義 562400;5.山東青島煙草有限公司,青島 266000)
為提高棘孢木霉HG1和枯草芽孢桿菌tpb55共培養(yǎng)菌的生物量和抗煙草疫霉活性,構(gòu)建了兩株菌固態(tài)共培養(yǎng)體系,并探究了其活性成分。采用菌絲生長速率法評價發(fā)酵提取物的抑菌活性,結(jié)合發(fā)酵后菌量,確定固態(tài)共培養(yǎng)的條件;運用正/反硅膠柱層析對活性成分進(jìn)行追蹤分離,使用高效液相色譜(HPLC)和核磁共振(NMR)及ESI質(zhì)譜,純化和鑒定活性化合物;通過盆栽試驗驗證共培養(yǎng)發(fā)酵對煙草黑脛病的防治效果。結(jié)果表明,兩株生防菌固態(tài)共培養(yǎng)發(fā)酵的初始條件為:枯草芽孢桿菌(106CFU/mL,接種量3%)接種12 h后再接種棘孢木霉(106CFU/mL,接種量1.5%);發(fā)酵14 d時,枯草芽孢桿菌菌量達(dá)到1.58×1010CFU/g,棘孢木霉菌量達(dá)到6.75×1010CFU/g,并且提取物的抗菌活性最強,抑制率達(dá)到73.25%;從活性組分中分離得到一個單體化合物,鑒定為harziandione。盆栽防病效果表明,采用固態(tài)培養(yǎng)基共培養(yǎng)發(fā)酵的產(chǎn)物對煙草黑脛病的防效優(yōu)于單培養(yǎng),并能夠改善土壤理化性質(zhì)。該研究為煙草黑脛病生防菌劑的研發(fā)提供了新的思路和方法。
固態(tài)發(fā)酵;共培養(yǎng);抗卵菌活性;harziandione
煙草疫霉是引起煙草黑脛病的主要病原菌,對煙草生產(chǎn)危害嚴(yán)重[1]。目前,煙草黑脛病的防治依然是以化學(xué)防治為主[2],亟需加強生物防治方法和產(chǎn)品的研究與開發(fā)。生防微生物通過產(chǎn)生抑菌物質(zhì)、與病原菌競爭營養(yǎng)和空間、寄生在病原菌內(nèi)或使植物產(chǎn)生誘抗作用來發(fā)揮防病和抗病作用,具有無毒害、無殘留、安全環(huán)保等優(yōu)點[3],已經(jīng)成為煙草病害生物防治的重要方法和手段。
木霉和芽孢桿菌作為應(yīng)用最為廣泛、效果最為顯著的生防菌,對多種植物病原菌具有明顯的抑制作用。然而,單一菌種的生防效果不穩(wěn)定,采用不同生防菌株進(jìn)行共培養(yǎng)發(fā)酵,可以提高優(yōu)勢菌株生存及生防效果[4]。本實驗室前期構(gòu)建了棘孢木霉HG1和枯草芽孢桿菌tpb55液體共培養(yǎng)發(fā)酵體系[5],對煙草黑脛病具有較好防治效果,然而發(fā)酵后菌量和代謝產(chǎn)物產(chǎn)量較低,抗菌活性有待提升。
目前文獻(xiàn)報道的共培養(yǎng)菌劑的發(fā)酵主要為液態(tài)發(fā)酵,但液體發(fā)酵保存期短,不利于儲存和長距離運輸,在生產(chǎn)中會排放大量的污水。固態(tài)發(fā)酵具有產(chǎn)量高、產(chǎn)物穩(wěn)定性好、生產(chǎn)成本低、后期處理簡單、污染少等優(yōu)點[6]。與液體發(fā)酵相比,固態(tài)發(fā)酵含水量較少,養(yǎng)分和代謝產(chǎn)物呈現(xiàn)明顯的分層現(xiàn)象,從而能夠更好刺激微生物持續(xù)發(fā)酵。另外,在固態(tài)發(fā)酵中,代謝產(chǎn)物對菌株的抑制效果較小,發(fā)酵產(chǎn)物的終濃度高,能夠產(chǎn)生更多的次級代謝產(chǎn)物[7-8]。Ola等[9]將植物內(nèi)生尖孢鐮刀菌和枯草芽孢桿菌在大米培養(yǎng)基上共培養(yǎng),產(chǎn)生了4種單培養(yǎng)時沒有的化合物,并且共培養(yǎng)后,代謝物產(chǎn)量與單培養(yǎng)相比提高了78倍。段金柱等[10]在綠色木霉產(chǎn)纖維素酶的發(fā)酵研究中發(fā)現(xiàn)固體發(fā)酵產(chǎn)率(742~827 U/g)比液體發(fā)酵產(chǎn)率(640~663 U/g)高25%,并且能夠產(chǎn)生更多的活性酶組分。
為了建立高效和抑菌活性更強的共培養(yǎng)發(fā)酵體系,本研究采用固態(tài)發(fā)酵方法對棘孢木霉HG1和枯草芽孢桿菌tpb55進(jìn)行共培養(yǎng),以發(fā)酵后兩株生防菌的菌量和提取物對煙草疫霉的抑制率為衡量標(biāo)準(zhǔn),確定最優(yōu)固態(tài)發(fā)酵條件;在此基礎(chǔ)上,開展抑菌組分及活性成分的追蹤分離;最后,通過菌株發(fā)酵的固體培養(yǎng)基防治煙草黑脛病的盆栽試驗,評估土壤理化性質(zhì),驗證其防病效果。
1 材料與方法
1.1 菌株來源
棘孢木霉HG1分離自海南紅樹林樣品[5],在馬鈴薯葡萄糖瓊脂(PDA)培養(yǎng)基上28 ℃培養(yǎng);枯草芽孢桿菌tpb55分離自煙草葉面[11],在營養(yǎng)瓊脂(NA)培養(yǎng)基上28 ℃培養(yǎng)。病原菌為煙草疫霉JM01[12],分離自煙草黑脛病株,在燕麥瓊脂(OA)培養(yǎng)基上28 ℃培養(yǎng)。以上菌株采用甘油–80 ℃保存于中國農(nóng)業(yè)科學(xué)院煙草研究所海洋農(nóng)業(yè)研究中心。
1.2 主要試劑和儀器
1.2.1 主要培養(yǎng)基和試劑 馬鈴薯葡萄糖瓊脂培養(yǎng)基(PDA)、營養(yǎng)肉湯培養(yǎng)基(NB)、營養(yǎng)瓊脂培養(yǎng)基(NA)、燕麥培養(yǎng)基(OA),購自北京索萊寶科技有限公司。甲醇為分析純和色譜純,二氯甲烷、乙酸乙酯和石油醚均為分析純,購自中國國藥集團(tuán)化學(xué)試劑公司。硅膠(100~200目),購自中國青島海洋化工廠;反向硅膠,購自德國EMD Millipore公司;Sephadex LH-20凝膠,購自美國GE Healthcare公司;GF254硅膠板,購自中國煙臺江友硅膠開發(fā)有限公司。
1.2.2 主要儀器 CX23顯微鏡(日本Olympus);LRH-250生化培養(yǎng)箱(上海一恒);ZQZY-CF9.9振蕩培養(yǎng)箱(上海知楚);Hei-VAP Value旋轉(zhuǎn)蒸發(fā)儀(德國Heidolph);Waters e2695高效液相色譜儀(美國Waters);DD2 500 MHz NMR核磁共振波譜儀(美國Agilent);ESI-MS Micromass Q-TOF質(zhì)譜儀(美國Waters)。
1.3 棘孢木霉HG1和枯草芽孢桿菌tpb55共培養(yǎng)接種比例的優(yōu)化
1.3.1 固態(tài)培養(yǎng)基及種子液的制備 固態(tài)培養(yǎng)基制備:1000 mL錐形瓶中加入90 g大米和110 mL蒸餾水,121 ℃高溫滅菌20 min。
棘孢木霉HG1種子液制備:棘孢木霉在PDA平板上28 ℃培養(yǎng)10 d。無菌水沖洗,使用紗布過濾菌絲,吸取上清,用血細(xì)胞計數(shù)板在顯微鏡下確定棘孢木霉孢子液濃度。無菌水稀釋成1×106CFU/mL孢子懸浮液備用。
枯草芽孢桿菌tpb55種子液制備:在NA平板上劃線,于28 ℃培養(yǎng)12 h,挑取單菌落于NB液體培養(yǎng)基里,180 r/min,28 ℃培養(yǎng)12 h。測菌液600值,無菌水稀釋成1×106CFU/mL菌懸液備用。
1.3.2 棘孢木霉HG1和枯草芽孢桿菌tpb55共培養(yǎng)接種比例的確定 設(shè)置枯草芽孢桿菌tpb55單培養(yǎng)接種1.5 mL種子液,棘孢木霉HG1單培養(yǎng)接種1.5 mL種子液,枯草芽孢桿菌tpb55和棘孢木霉HG1按1∶1,1∶2,2∶1,1∶10,10∶1比例共培養(yǎng)接種,加入到大米培養(yǎng)基中后攪拌使其混合。接種完成后,于25 ℃靜置培養(yǎng)30 d。
取1 g培養(yǎng)基,用1 mL無菌水稀釋成10-3、10-4、10-5、10-6不同梯度的菌液。取100 μL的菌液分別在含鏈霉素和氯霉素(10 mg/mL)的PDA固體平板,含咪酰胺(10 mg/mL)的NA固體平板上涂板,在28 ℃培養(yǎng)1~2 d,統(tǒng)計單菌落的數(shù)量,計算菌量。
靜置培養(yǎng)30 d后,大米培養(yǎng)基先使用乙酸乙酯超聲浸取兩遍,浸取的乙酸乙酯旋蒸濃縮至干。再使用甲醇和二氯甲烷(1∶1)超聲浸取兩遍,浸取液先旋蒸濃縮后用水轉(zhuǎn)出,在水相中加入等體積的乙酸乙酯萃取3次,旋蒸至干。兩次蒸干的乙酸乙酯相,合并后得到提取物。
1.3.3 共培養(yǎng)提取物對煙草疫霉的抑制率分析 采用菌絲生長速率法[5]測定提取物對煙草疫霉的抑菌率:取30 mg提取物加入150 μL二甲亞砜(DMSO)溶解,配置成200 mg/mL的溶液,取50 μL溶液加入到10 mL的燕麥培養(yǎng)基中,配成終濃度1 mg/mL的含藥培養(yǎng)基,倒入6 cm的培養(yǎng)皿中制成平板培養(yǎng)基。用打孔器從活化7 d的煙草疫霉平板上取5 mm的菌碟,倒置在平板中央,28 ℃培養(yǎng)36 h。采用十字交叉法測量菌絲生長的直徑,以只加入DMSO的燕麥培養(yǎng)基作空白對照。每處理重復(fù)3次。
菌落直徑(cm)=測量菌落直徑?0.5 (1)
抑菌率(%)=(對照菌落直徑?處理菌落直徑)/對照菌落直徑×100 (2)
1.4 棘孢木霉HG1和枯草芽孢桿菌tpb55共培養(yǎng)接種的順序和時間優(yōu)化
按照優(yōu)化后的接種比例,設(shè)置枯草芽孢桿菌tpb55和棘孢木霉HG1不同接種順序和時間:枯草芽孢桿菌tpb55單培養(yǎng)(t);棘孢木霉HG1單培養(yǎng)(h);枯草芽孢桿菌tpb55和棘孢木霉HG1同時接種(th);其他共培養(yǎng)分別在先接種枯草芽孢桿菌tpb55 12 h(th12)、24 h(th24)、36 h(th36)后再接棘孢木霉HG1;先接棘孢木霉HG1,24 h(ht24)、36 h(ht36)、48 h(ht48)后再接枯草芽孢桿菌tpb55。在發(fā)酵14 d時涂板,統(tǒng)計菌量,提取代謝產(chǎn)物。將各個提取物經(jīng)過減壓硅膠柱色譜,乙酸乙酯/石油醚(10%),乙酸乙酯(100%),甲醇/水(10%)3個梯度進(jìn)行洗脫,采用菌絲生長速率法測定各個組分對煙草疫霉的抑制率。
1.5 共培養(yǎng)固態(tài)發(fā)酵活性次級代謝產(chǎn)物的分離
根據(jù)優(yōu)化后的發(fā)酵條件,發(fā)酵10瓶,提取代謝產(chǎn)物。將提取物經(jīng)過減壓硅膠柱層析,以乙酸乙酯/石油醚(5%~100%)和甲醇/乙酸乙酯(10%~50%)進(jìn)行梯度洗脫。通過薄層層析分析,合并成5個組分,采用菌絲生長速率法測定各組分在1.0 mg/mL濃度下對煙草疫霉的抑菌率。將抑菌率最高的組分經(jīng)過反向硅膠柱層析分離,以甲醇/水(30%~100%)進(jìn)行梯度洗脫,再通過高效液相色譜分離純化,采用1H和13C NMR及ESI質(zhì)譜鑒定化合物結(jié)構(gòu)。采用菌絲生長速率法測定化合物在0.1 mg/mL濃度下對煙草疫霉的抑菌率。
1.6 盆栽試驗
供試土壤來自中國農(nóng)業(yè)科學(xué)院煙草研究所即墨試驗基地(田間自然土∶滅菌基質(zhì)土=7∶3)[13]。將土壤與疫霉菌谷(1.2 g菌谷∶180 g土壤)混勻作為防病盆栽試驗的病土,將不同發(fā)酵的大米固體培養(yǎng)基與病土(3 g∶180 g)混勻作為處理。盆栽試驗總共設(shè)置3個處理:枯草芽孢桿菌tpb55單培養(yǎng)(t)、棘孢木霉HG1單培養(yǎng)(h)、枯草芽孢桿菌tpb55接種12 h后接種棘孢木霉HG1(th12),以只加入疫霉菌谷的病土作對照。取長勢一致的煙苗移入土中,設(shè)置3個重復(fù),每個處理30株煙苗。移栽7 d后統(tǒng)計發(fā)病率和病情指數(shù),計算防病效果。煙草黑脛病的病情分級參照中華人民共和國煙草行業(yè)標(biāo)準(zhǔn)(GB/T 23222—2008)進(jìn)行統(tǒng)計[14]。
1.7 盆栽土壤理化性質(zhì)測定
盆栽試驗第14天,取盆栽土。自然風(fēng)干后,通過20 mm篩,測定土壤理化性質(zhì),包括pH、電導(dǎo)率、有機質(zhì)含量(重鉻酸鉀容量法)、速效鉀含量(NH4OAc浸提-火焰光度計法)、銨態(tài)氮和磷酸根含量(SKALAR SAN+連續(xù)流動注射分析)[15]。
1.8 數(shù)據(jù)分析
使用Microsoft Office Excel 2019和SPSS 18.0進(jìn)行數(shù)據(jù)統(tǒng)計分析,Adobe Photoshop 2020作圖。
2 結(jié) 果
2.1 共培養(yǎng)接種比例的確定
由表1可知,當(dāng)枯草芽孢桿菌tpb55和棘孢木霉HG1接種比例為2∶1時,枯草芽孢桿菌tpb55(5.5×106CFU/g)和棘孢木霉HG1(2.65×107CFU/g)菌量高于其他接種比例。但值得注意的是,共培養(yǎng)后枯草芽孢桿菌菌量顯著低于單培養(yǎng),原因可能是為了得到更豐富的次級代謝產(chǎn)物,發(fā)酵時間過長,部分枯草芽孢桿菌已死亡,并且木霉的代謝產(chǎn)物對枯草芽孢桿菌產(chǎn)生了抑制作用。因此,后續(xù)將發(fā)酵時間縮短,但考慮到真菌產(chǎn)生次級代謝產(chǎn)物需要的時間較長,發(fā)酵時間確定為14 d[16]。

表1 不同接種比例HG1和tpb55在發(fā)酵30 d的菌量
注:表中t,h分別表示枯草芽孢桿菌tpb55、棘孢木霉HG1的單培養(yǎng),1∶1、1∶2、2∶1、1∶10、10∶1是枯草芽孢桿菌tpb55與棘孢木霉HG1的接種比例。不同小寫字母代表處理間<0.05水平差異顯著,下同。
Note: In the table, t and h represent the single culture oftpb55 andHG1, respectively.1∶1, 1∶2, 2∶1, 1∶10 and 10∶1 are inoculation ratios oftpb55 toHG1. There was significant difference in the level of<0.05 between different lowercase letters, the same below.
不同接種比例下的提取物對煙草疫霉抑菌率,如表2所示,當(dāng)枯草芽孢桿菌tpb55和棘孢木霉HG1接種比例為2∶1時,提取物的抑菌率(46.17%)最高。因此,綜合發(fā)酵后兩株菌菌量和提取物的抑菌活性,選用枯草芽孢桿菌tpb55和棘孢木霉HG1的接種比例為2∶1(枯草芽孢桿菌tpb55接種量為培養(yǎng)基體積的3%,棘孢木霉HG1接種量為培養(yǎng)基體積的1.5%),接種種子液濃度為1×106CFU/mL。
2.2 共培養(yǎng)接種順序和時間的確定
在枯草芽孢桿菌tpb55和棘孢木霉HG1接種比例2∶1下,對枯草芽孢桿菌tpb55和棘孢木霉HG1的接種順序和時間進(jìn)行優(yōu)化。如表3所示,在枯草芽孢桿菌tpb55先接種12 h后再接種棘孢木霉HG1,枯草芽孢桿菌tpb55(1.58×1010CFU/g)和棘孢木霉HG1(6.75×1010CFU/g)的菌量最多。且棘孢木霉HG1菌量顯著高于單培養(yǎng)。與發(fā)酵30 d相比,兩株生防菌菌量均得到了明顯的提升。如表4所示,100%乙酸乙酯提取的組分抑菌活性最高,而10%乙酸乙酯組分和10%甲醇組分活性較低,說明抑菌活性成分主要集中在100%乙酸乙酯組分中。枯草芽孢桿菌tpb55先接種12 h后再接種棘孢木霉HG1時,提取物的抑菌率(73.25%)顯著高于其他處理。因此,共培養(yǎng)選用的接種順序和時間為先接種枯草芽孢桿菌tpb55,12 h后再接種棘孢木霉HG1。
綜上所述,固態(tài)共培養(yǎng)發(fā)酵條件:在枯草芽孢桿菌tpb55接種12 h后接種棘孢木霉HG1,枯草芽孢桿菌tpb55(106CFU/mL)接種量為培養(yǎng)基體積的3%,棘孢木霉HG1(106CFU/mL)接種量為培養(yǎng)基體積的1.5%。

表2 不同接種比例HG1和tpb55提取物對煙草疫霉的抑菌率

表3 HG1和tpb55在不同接種時間發(fā)酵14 d的菌量

表4 不同接種時間的提取物組分的減壓組分對煙草疫霉的抑制率
2.3 抑菌活性成分的分離及結(jié)構(gòu)鑒定
靜置培養(yǎng)14 d后提取發(fā)酵產(chǎn)物,共得到提取物2.3 g。測定5個減壓組分對煙草疫霉的抑菌率,如表5和圖1所示,ht2的抑菌活性(74.69%)顯著高于其他組分,ht2組分經(jīng)過反向硅膠柱色譜和高效液相色譜分離純化得到的化合物1,鑒定為萜類化合物harziandione,結(jié)構(gòu)如圖2所示。在100 μg/mL濃度下,harziandione對煙草疫霉的抑制率為19.8%。
harziandione的核磁數(shù)據(jù):1H-NMR(500 MHz,CDCl3):H2.91(2H,overlapped,H-4b,5),2.56(1H,d,=13.5 Hz,H-12b),2.46(3H,overlapped,H-8b,12a,14),2.26(1H,d,=7.0 Hz,H-2),2.12(3H,s,H-20),2.05(3H,overlapped,H-4a,8a,15b),1.90(1H,dd,=10.5,5.0 Hz,H-7b),1.53(1H,t,=7.5 Hz,H-15a),1.51(3H,s,H-19),1.41(1H,t,=11.0 Hz,H-7a),1.11(3H,d,=6.0 Hz,H-18),1.00(3H,s,H-17),0.98(3H,s,H-16);13C-NMR(125 MHz,CDCl3):C214.4(C-3),197.9(C-11),149.4(C-9),146.4(C-10),59.9(C-12),59.3(C-2),53.0(C-14),51.6(C-6),49.5(C-1),42.6(C-4),39.9(C-13),29.9(C-5),29.8(C-7),29.5(C-8),26.6(C-15),25.0(C-16),23.2(C-17),22.5(C-20),20.9(C-18),20.7(C-19);ESIMS:/302.31[M+2H]+。

表5 提取物減壓組分對煙草疫霉的抑制率
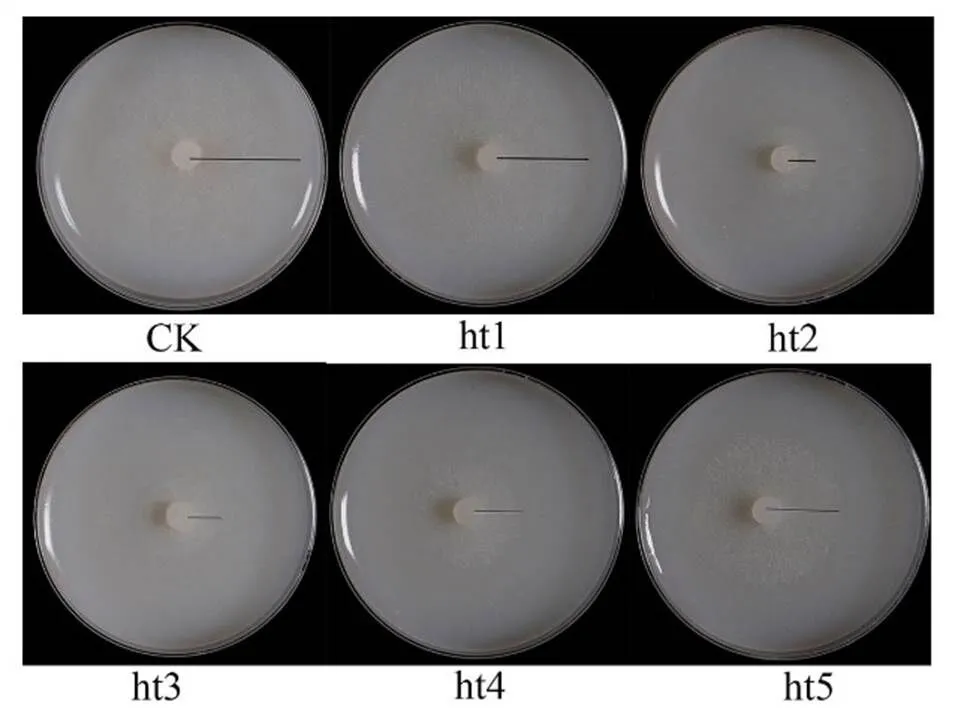
圖1 提取物減壓組分對煙草疫霉的抑制活性

圖2 harziandione結(jié)構(gòu)及對煙草疫霉的抑制率
2.4 盆栽試驗及土壤理化性質(zhì)
如表6所示,在處理后第7天,處理組的病情指數(shù)較對照組相比均顯著降低。80%的對照組煙苗在7 d時莖部發(fā)軟變黑、枯萎和死亡,而70%~80%的處理組煙苗依舊健康。其中棘孢木霉HG1與枯草芽孢桿菌tpb55共培養(yǎng)的防治效果優(yōu)于棘孢木霉HG1、枯草芽孢桿菌tpb55單培養(yǎng),其病情指數(shù)為27.78,防治效果為61.94%。
土壤理化試驗表明(表7),施加固態(tài)共培養(yǎng)棘孢木霉HG1與枯草芽孢桿菌tpb55后,土壤理化性質(zhì)有所改善。處理14 d后,處理組的盆栽土壤pH相較對照組顯著提升,而電導(dǎo)率則比對照組土樣有所下降。此外,與對照組相比,處理組的土壤中硝態(tài)氮和磷酸根含量得到提升,說明生防菌的施加可提升土壤中微量元素的含量,有利于植物的生長和對病原抵抗力的增加。

表6 盆栽試驗7 d時的病情指數(shù)和防治效果
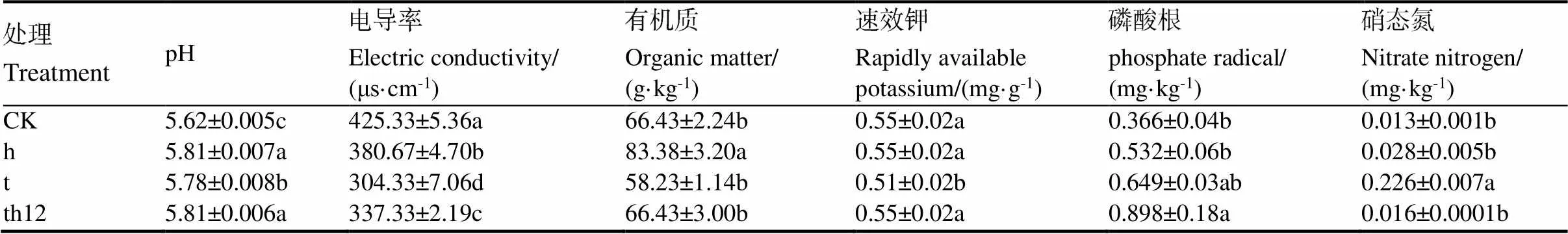
表7 土壤理化性質(zhì)
3 討 論
本實驗室前期采用液體培養(yǎng)基對兩株菌進(jìn)行發(fā)酵,但發(fā)酵后兩株菌菌量較低,在發(fā)酵14 d時,枯草芽孢桿菌tpb55最大菌量為1.2×108CFU/mL、棘孢木霉HG1最大菌量為2.34×106CFU/mL。在木霉和芽孢桿菌共培養(yǎng)中,木霉一般起主導(dǎo)作用[17]。目前菌株的共培養(yǎng)發(fā)酵主要是液體發(fā)酵,但在液體培養(yǎng)基中真菌產(chǎn)孢困難。與液體培養(yǎng)基相比,固體培養(yǎng)基更接近木霉生長環(huán)境,木霉能夠在固體培養(yǎng)基表面和內(nèi)部產(chǎn)孢,提高孢子產(chǎn)量[18]。段婉冬[19]采用甜葉菊渣固體培養(yǎng)基發(fā)酵木霉,培養(yǎng)4~6 d,木霉的孢子數(shù)量能達(dá)到7×109CFU/g。本研究采用大米培養(yǎng)基進(jìn)行固態(tài)發(fā)酵,增加了兩株生防菌共培養(yǎng)后的菌量,枯草芽孢桿菌tpb55達(dá)到1.58×1010CFU/g,棘孢木霉HG1達(dá)到6.75×1010CFU/g。
目前尚未有枯草芽孢桿菌和棘孢木霉固態(tài)共培養(yǎng)發(fā)酵的文獻(xiàn)報道。不同菌株的最佳固體發(fā)酵條件不同,使用不同菌株進(jìn)行共培養(yǎng)時,需優(yōu)化明確最佳共培養(yǎng)發(fā)酵條件。CHEN等[20]確定了當(dāng)使用黃孢原毛平革菌與綠色木霉對秸稈進(jìn)行固態(tài)發(fā)酵降解時,兩株菌的最佳接種比例為1∶1。楊壯等[21]在對乳桿菌進(jìn)行固態(tài)發(fā)酵時確定其最佳的接種量為4.80%,最佳的發(fā)酵時間為51.30 h,隨發(fā)酵時間延長黃精多糖的得率反而降低。王小兵等[22]發(fā)現(xiàn)短小芽胞桿菌和解淀粉芽胞桿菌共培養(yǎng)發(fā)酵16 h時,菌量達(dá)到峰值。本研究發(fā)現(xiàn),當(dāng)枯草芽孢桿菌tpb55和棘孢木霉HG1的接種比例為2∶1時,提取物具有更高的抑菌活性,能夠促進(jìn)更多的抗煙草疫霉物質(zhì)的產(chǎn)生;枯草芽孢桿菌tpb55接種12 h后接種棘孢木霉HG1發(fā)酵14 d時菌量最多,tpb55和HG1的菌量分別為1.58×1010、6.75×1010CFU/g,效果優(yōu)于共培養(yǎng)發(fā)酵30 d。
Harziane型二萜化合物是由GHISALBERTI等[23]于1992年從哈茨木霉中發(fā)現(xiàn)的一類化學(xué)分子,它含有獨特的四環(huán)6/5/4/7碳骨架和5~6個相鄰的立體中心。目前已知的harziane型二萜化合物幾乎都是從木霉中分離發(fā)現(xiàn)的,但其對病原卵菌的抑制作用尚無相關(guān)報道。Li等[24]從深海木霉屬真菌的發(fā)酵產(chǎn)物中分離鑒定出7種harziane型二萜,發(fā)現(xiàn)在C-8,C-18位點上有羥基的二萜能夠抑制NO的生成,具有抗炎癥的作用;而這7種二萜類化合物對常見的植物病原真菌均沒有明顯的抑菌活性。本研究采用活性追蹤的方法從枯草芽孢桿菌tpb55和棘孢木霉HG1固態(tài)共培養(yǎng)的提取物中分離得到一個二萜類化合物harziandione,在100 μg/mL濃度下,對煙草疫霉的抑菌活性為19.8%,具有一定的抑菌活性。但與組分ht2的抗菌活性(74.69%)相比,harziandione的活性不強。原因可能是單體化合物產(chǎn)量較低,使用的測試濃度較低,因此活性沒有達(dá)到預(yù)期,同時,活性組分中的不同化合物可能具有協(xié)同作用,這需要后續(xù)的深入研究。
4 結(jié) 論
本試驗篩選出的棘孢木霉HG1與枯草枯草芽孢桿菌tpb55最佳的固態(tài)共發(fā)酵培養(yǎng)條件為枯草芽孢桿菌tpb55接種12 h后接種棘孢木霉HG1,枯草芽孢桿菌tpb55(106CFU/mL)接種量為3%,棘孢木霉HG1(106CFU/mL)接種量為1.5%。從共培養(yǎng)的發(fā)酵提取物中分離得到單體化合物harziandione,在100 μg/mL時對煙草疫霉的抑菌活性為19.8%。采用固態(tài)共培養(yǎng)發(fā)酵對煙草黑脛病的盆栽防治效果為61.94%,優(yōu)于單培養(yǎng)。同時能夠改善土壤pH,提高土壤中微量元素含量。本研究構(gòu)建的枯草芽孢桿菌和棘孢木霉固態(tài)共培養(yǎng)體系,具有開發(fā)成為新型抗煙草疫霉生防菌劑的潛力。
[1] GUO D, YUAN C, LUO Y, et al. Biocontrol of tobacco black shank disease () byBa168[J]. Pestic Biochem Physiol, 2020, 165: 104523.
[2] 彭麗娟,丁海霞,陸錚錚. 貴州煙草黑脛病菌對甲霜靈的抗藥性測定[J]. 貴州農(nóng)業(yè)科學(xué),2014,42(8):92-95.
PENG L J, DING H X, LU Z Z. Drug resistance ofagainst metalaxyi (WP) in Guizhou[J]. Guizhou Agricultural Sciences, 2014, 42(8): 92-95.
[3] LA SPADA F, STRACQUADANIO C, RIOLO M, et al. Trichoderma counteracts the challenge ofinfections on tomato by modulating plant defense mechanisms and the expression of crinkler, necrosis-inducingprotein 1, and cellulose-binding elicitor lectin pathogenic effectors[J]. Front Plant Sci, 2020, 11: 583539.
[4] MA Q, CONG Y, FENG L, et al. Effects of mixed culture fermentation ofandon its constituent strains and the biocontrol of tomato Fusarium wilt[J]. J Appl Microbiol, 2022, 132(1): 532-546.
[5] 張希芬,林偉,李清鈺,等. 抗煙草疫霉活性木霉與芽孢桿菌共培養(yǎng)體系的構(gòu)建與優(yōu)化[J]. 中國煙草科學(xué),2022,43(1):61-68.
ZHANG X F, LIN W, LI Q Y, et al. Construction and optimization of a co-culture system of anti-HG1 andTpb55[J]. Chinese Tobacco Science, 2022, 43(1): 61-68.
[6] 唐堂,王琪,周衛(wèi)強,等. 固態(tài)發(fā)酵技術(shù)研究分析及應(yīng)用[J]. 工業(yè)微生物,2020,50(5):55-59.
TANG T, WANG Q, ZHOU W Q, et al. Solid-state fermentation technology research analysis and application[J]. Industrial Microorganisms, 2020, 50(5): 55-59.
[7] LOUHASAKUI Y, WADO H, LATEH R, et al. Solid-state fermentation of Saba banana peel for pigment production by[J]. Braz J Microbiol, 2023, 54(1): 93-102.
[8] RAHARDIO YS, TRAMPER J, RINZEMA A. Modeling conversion and transport phenomena in solid-state fermentation: a review and perspectives[J]. Biotechnol Adv, 2006, 24(2): 161-179.
[9] OLA A R, THOMY D, LAI D, et al. Inducing secondary metabolite production by the endophytic fungusthrough coculture with[J]. J Nat Prod, 2013, 76(11):2094-2099.
[10] 段金柱,曹淡君. 固體發(fā)酵與液體發(fā)酵生產(chǎn)纖維素酶產(chǎn)率與催化性能比較[J]. 糧食與飼料工業(yè),2000(3):24-26.
DUAN J Z, CAO D J. The compare of SSF and LSF with trichodema viride for cellulase production in yield and catalysis property[J]. Grain and Feed Industry, 2000(3): 24-26.
[11] 張成省,孔凡玉,關(guān)小紅,等. 煙草葉圍細(xì)菌Tpb55菌株的鑒定及其抑菌活性[J]. 中國生物防治,2008(1):63-68.
ZHANG C S, KONG F Y, GUAN X H, et al. Identification and antagonistic activity of tobacco phyllosphereTpb55[J]. Chinese Journal of Biological Control, 2008(1): 63-68.
[12] ZHANG C S, GAO J M, HAN T et al. Integrated control of tobacco black shank by combined use of riboflavin andstrain Tpb55[J]. Bio Control, 2017, 62(6): 835-845.
[13] 王耀晨. 花椒籽炭基有機肥防治煙草黑脛病研究[D]. 北京:中國農(nóng)業(yè)科學(xué)院,2020.
WANG Y C. Study on control of tobacco black shank disease with biochar-based fertilizer of prickly ash seed[D]. Beijing: Chinese Academy of Agricultural Sciences, 2020.
[14] 國家煙草專賣局. 煙草病蟲害分級調(diào)查方法:GB/T 23222—2008[S]. 北京:中國標(biāo)準(zhǔn)出版社,2008.
State Tobacco Monopoly Administration. Grade and investigation method of tobacco diseases and insect pests: GB/T 23222—2008[S]. Beijing: Standards Press of China, 2008.
[15] 鮑士旦. 土壤農(nóng)化分析[M]. 北京:中國農(nóng)業(yè)出版社,2000.
BAO S D. Soil agrochemical analysis[M]. Beijing: China Agricultural Publishing House, 2000.
[16] 鮑澤安. 海洋真菌sp. S212B的次級代謝產(chǎn)物和生物活性研究[D]. 咸陽:西北農(nóng)林科技大學(xué),2022.
BAO Z A. Studies on chemical constituents and bioactivities of marine fungussp. S212B[D]. Xianyang: Northwest A&F University, 2022.
[17] KARUPPIAH V, LU Z X, LIU H, et al. Co-cultivation of T. asperellum GDFS1009 and B. amyloliquefaciens 1841: Strategy to regulate the production of ligno-cellulolytic enzymes for the lignocellulose biomass degradation[J]. J Environ Manage, 2022, 301: 113833.
[18] NEE, NIGAM P S, PANDEY A. Solid-state fermentation technology for bioconversion of biomass and agricultural residues[J]. Biotechnology for Agro-industrial Residues Utilisation, 2009, 197-221.
[19] 段婉冬. 甜葉菊渣固體發(fā)酵木霉NJAU 4742及發(fā)酵菌劑對玉米苗期生長的影響[D]. 南京:南京農(nóng)業(yè)大學(xué),2020.
DUAN W D. Solid state fermentation ofNJAU 4742 with stevia residue ang its effects on corn growth in seeding stage[D]. Nanjing: Nanjing Agricultural University, 2020.
[20] CHEN K J, TANG J C, XU B H, et al. Degradation enhancement of rice straw by co-culture ofand[J]. Sci Rep, 2019, 9(1): 19708.
[21] 楊壯,劉怡琳,李隆熙,等. 固態(tài)發(fā)酵制備黃精多糖的工藝優(yōu)化、理化特性及抗氧化活性[J]. 食品與發(fā)酵工業(yè),2023(7):1-9.
YANG Z, LIU Y L, LI L X, et al. Process optimization, physicochemical properties and antioxidant activity of polygonatum sibiricum polysaccharide prepared by solid-state fermentation[J]. Food and Fermentation Industry, 2023(7): 1-9.
[22] 王小兵,付寬寬,顧紅亞,等. 復(fù)合芽胞桿菌共培養(yǎng)條件的響應(yīng)面優(yōu)化研究[J]. 江西農(nóng)業(yè)學(xué)報,2021,33(12):1-7.
WANG X B, FU K K, GU H Y et al. Optimization of co-culture conditions of compoundby response surface methodology[J]. Acta Agriculture Jiangxi, 2021, 33(12): 1-7.
[23] GHISALBERTI E L, HOCKLESS D C R, ROWLAND C, et al. Harziandione, a new class of diterpene from[J]. J. Nat. Prod, 1992, 55: 1690-1694.
[24] LI H X, LIU X, LI X, et al. Novel Harziane diterpenes from deep-sea sediment fungussp. SCSIOW21 and their potential anti-inflammatory effects[J]. Mar Drugs, 2021, 19(12): 689.
Study on Co-culture ofandby Solid-state Fermentation against Tobacco Black Shank Disease and Their Bioactive Secondary Metabolites
PENG Zhixin1,2, ZHAO Donglin2, LIN Wei3*, GAO Gui4,GUAN Zhikun5, WANG Yaobin5, ZHANG Chengsheng2, LI Wei1*
(1. College of Life Science, Yangtze University, Jingzhou, Hubei 434000, China; 2. Tobacco Research Institute, Chinese Academy of Agricultural Sciences, Qingdao 266101, China; 3. Nanping Branch, Fujian Tobacco Company, Nanping, Fujian 353000, China; 4. Qianxinan Prefecture Branch, Guizhou Tobacco Company, Xingyi, Guizhou 562400, China; 5. Shandong Qingdao Tobacco Co., Ltd., Qingdao 266000, China)
In order to improve the biomass ofHG1 andtpb55 in the co-culture system, and increase their anti-oomycetes activities against, and to explore the bioactive ingredients, the solid-state fermentation system was constructed. The anti-oomycetes activities were evaluated by the mycelium growth rate method. The solid-state fermentation conditions were determined by the anti-oomycetes activities and biomass of HG1 and tpb55. The bioactivity guided separation and isolation of fermentation extracts by silica gel and octadecylsilyl silica gel (ODS) column chromatography (CC), as well as high performance liquid chromatography (HPLC), together with NMR and ESI mass spectrometry were applied to clarify and identify the bioactive ingredients. Finally, pot experiments were applied to verify the control effect of solid-state co-culture of HG1 and tpb55 on tobacco black shank. The results showed that the optimal solid-state fermentation condition was as follows: the inoculation sequence was first(106CFU/mL, 3%) 12 h and then inoculated with(106CFU/mL, 1.5%). After 14 d of fermentation, under the optimal condition, the bacterial amounts of tpb55 were 1.58×1010CFU/g and the spore amounts of HG1 were 6.75×1010CFU/g, with the strongest anti-oomycete activity towards(inhibition rate 73.25%). A pure compound was isolated from the bioactive fraction and identified as harziandione. The results of pot experiments showed that the control effect of solid co-culture strains on tobacco black shank was significantly better than that of single culture, reached 61.94%. The co-cultured strains could also improve soil physical and chemical properties. This study provided a new idea and method for the research and development of co-culture biocontrol agents for tobacco black shank disease.
solid state fermentation; co-culture; anti-oomycetes activity; harziandione
S435.72
A
1007-5119(2023)06-0036-08
福建省煙草公司南平市公司科技項目(NYK2021-01-03);中國煙草總公司黔西南州公司科技項目(2022-07);山東省煙草公司科技項目(201837020027209);青島市科技惠民示范專項(23-3-8-xdny-2-nsh)
彭治鑫(1999-),男,在讀碩士研究生,主要從事植物病害生物防治研究。E-mail:P18671073969@163.com*通信作者。E-mail:李 偉,wetli@yangtzeu.edu.cn;林 偉,lw160718@caas.cn
2023-07-25
2023-11-14
10.13496/j.issn.1007-5119.2023.06.006

