基于rGO-AuNPS修飾絲網印刷電極的電化學生物傳感器快速檢測甲基對硫磷
耿俊豪 李雪芝 周建平 陳昌華
(新疆大學智能制造現代產業學院,新疆 烏魯木齊 830000)
有機磷農藥在防治病蟲害方面可以發揮重要作用。甲基對硫磷(MP)作為一種典型的硝基芳香族有機磷農藥,在使用過程中容易造成水、土壤和空氣污染,甚至破環人體內乙酰膽堿酶(AChE),肌肉無法放松,導致呼吸困難甚至死亡[1-2]。
當前,用于檢測MP的技術有氣相色譜法[3]、高效液相色譜[4]、比色法[5]、熒光生物探針等多種方法[6]。盡管這些方法能夠提供高的靈敏度和選擇性來檢測農藥殘留,但價格昂貴、操作繁瑣、耗時較長,無法滿足一些實際要求,特別無法用于現場檢測[7]。
基于AChE的MP電化學生物傳感器已被證明可以提高檢測效率,以簡單、快速、選擇性好、成本低、易于小型化等優點在農藥殘留檢測中受到了廣泛的關注[8]。在電化學分析中,常用的分立式三電極體系在檢測過程中盡管檢測體系各項參數良好,但靈活性較差,很難在現場對農藥殘留進行分析檢測[9]。絲網印刷電極(SPCE)作為一款具有輕薄、便攜、集成化程度高等特點的電極,簡化了操作步驟,是一種可用于現場快速檢測的電化學感知器件[10-11]。
為了提高AChE電化學生物傳感器的性能,增加傳感材料的表面積和提高導電性能是實現快速響應的關鍵。石墨烯基納米復合材料因其出色的比表面積、優異的導電性以及出色的化學穩定性而備受關注,是目前研究的重要焦點[12]。與氧化石墨烯(GO)相比,還原氧化石墨烯(rGO)的導電能力顯著提升,而且已被廣泛驗證[13]。電化學還原GO與傳統熱還原方法和化學還原方法相比,具有簡單、省時、綠色等優點[14]。此外,rGO和金納米顆粒(AuNPS)的結合具有獨特的性質,可以作為電子傳導途徑,促進氧化還原體系和電極材料之間的電子轉移。如金納米顆粒具有很好的生物相容性和良好的導電性,強大的吸附能力,以及獨特的物理和化學屬性,由于這兩個組分之間的協同作用,將金負載到石墨烯或其衍生物上時,金的電催化活性進一步提高[15]。
研究通過層層組裝將rGO、AuNPS和AChE固定在電極表面,制備具有AChE/rGO/AuNPS/SPCE結構的生物傳感器,對生物傳感器的電子傳輸特性、結構穩定性、催化活性和存儲穩定性進行評價,優化傳感器的催化時間,并進行真實樣本測試,完成對甲基對硫磷的快速檢測。
1 材料與方法
1.1 試劑與儀器
氧化石墨烯分散液:南京先鋒納米材料科技有限公司;
乙酰膽堿酯酶(來自電鰻,500 U)、乙酰硫代膽堿氯化物(ATCl)、戊二醛(GA,50%)、牛血清白蛋白(BSA):美國Sigma-Aldrich公司;
磷酸二氫鈉、磷酸氫二鈉、氯化鈉、氯化鉀、鐵氰化鉀、亞鐵氰化鉀、硫酸鉀、氯金酸:分析純,國藥集團化學試劑有限公司;
甲基對硫磷:北京百靈威科技有限公司;
絲網印刷電極:波探科技(威海)有限公司;
電化學工作站:DH7000C型,江蘇東華分析儀器有限公司;
場發射掃描電子顯微鏡:JSM-7610FPlus型,深圳市藍星宇電子科技有限公司;
X射線光電子能譜儀:ESCALAB 250Xi型,美國Thermo Fisher Scientific公司。
1.2 AChE/rGO/AuNPS/SPCE的制備
首先將絲網印刷電極在0.1 mol/L PBS(pH 7.4)中施加范圍-0.6~+0.8 V的循環電位,掃速100 mV/s,進行電極激活,直到獲得穩定的循環伏安圖。處理完用蒸餾水對電極表面進行沖洗。如圖1所示,取5 μL 0.5 mg/mL的GO分散液滴涂在電極表面,使其自然干燥,之后將其置于0.1 mol/L KCl溶液中CV還原,施加0~-1.8 V的電位以100 mV/s的速度掃描5圈,然后用蒸餾水沖洗,并在室溫下自然干燥。再通過CV法進行電沉積納米金,將樣品浸入含有0.01 mol/L K2SO4和0.001 mol/L HAuCl4的溶液中沉積10 min,最后,將10 μL的AChE(0.2 U/μL)和2.0%的BSA混合液滴涂于電極表面(記為AChE/AuNPS/rGO/SPCE),35 ℃干燥30 min,完成AChE/rGO/AuNPS/SPCE的構建。

圖1 GO、rGO和rGO/AuNPS修飾的SPCE的SEM圖像
1.3 甲基對硫磷電化學檢測
AChE/rGO/AuNPS/SPCE先在1 mmol/L的ATCL中孵育5 min,再進行DPV表征。將傳感器浸泡在一定濃度的MP溶液中,抑制10 min,接著在1 mmol/L的ATCL中孵育5 min,最后進行DPV表征。按式(1)計算甲基對硫磷對傳感器的抑制率。
I=[(I0-Icat)/I0]×100%,
(1)
式中:
I——傳感器抑制率,%;
I0——傳感器在被抑制前催化1 mmol/L ATCl時的峰值電流,μA;
Icat——傳感器在被抑制后催化1 mmol/L ATCl時的峰值電流,μA。
1.4 數據處理
采用Origin 2021軟件對試驗數據進行處理分析并繪圖。
2 結果和討論
2.1 材料表征
通過SEM技術,對GO、rGO、rGO/AuNPS改性SPCE的表面形貌特征進行了表征。從圖1(a)和圖1(b)可以清晰地觀察到電極表面上石墨薄膜獨有的褶皺紋理,這些褶皺提高了修飾電極的比表面積,為修飾金納米提供更多的活性位點[16]。此外,GO和rGO薄膜中C和O的存在也可以通過EDX圖像得到證實,如圖2(a)和圖2(b)所示。GO中O的信號從22.08%顯著降低到13.21%,說明GO成功還原為rGO。基于圖1(c),大量AuNPS密集且均勻分散在rGO膜表面。rGO/AuNPS納米復合材料的EDX光譜也顯示了C、O和Au信號的存在,如圖2(c),包括83.36%的C元素、2.58%的O元素和14.06%的Au元素。這些結果清楚地證實了rGO/AuNPS納米復合材料在SPCE上的形成[17]。為了進一步驗證復合納米材料成功修飾在電極表面,使用X射線光電子能譜儀測試電極表面的化學元素組成和價態分布,并對能譜進行分析如圖3所示。圖3(a)中出現了C1s、O1s和Au 4f的峰,并分別對其進行了擬合。圖3(b)和圖3(c)在284.8,532.4 eV處分別為O1s和C1s的特征峰,圖3(d)為Au 4f的特征峰,其在84.3,88.0 eV處出現兩個特征峰,分別歸屬于Au 4f7/2和Au 4f5/2,表明Au元素被有效修飾在電極表面。
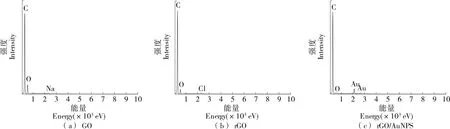
圖2 GO、rGO和rGO/AuNPS修飾的SPCE的EDX圖像
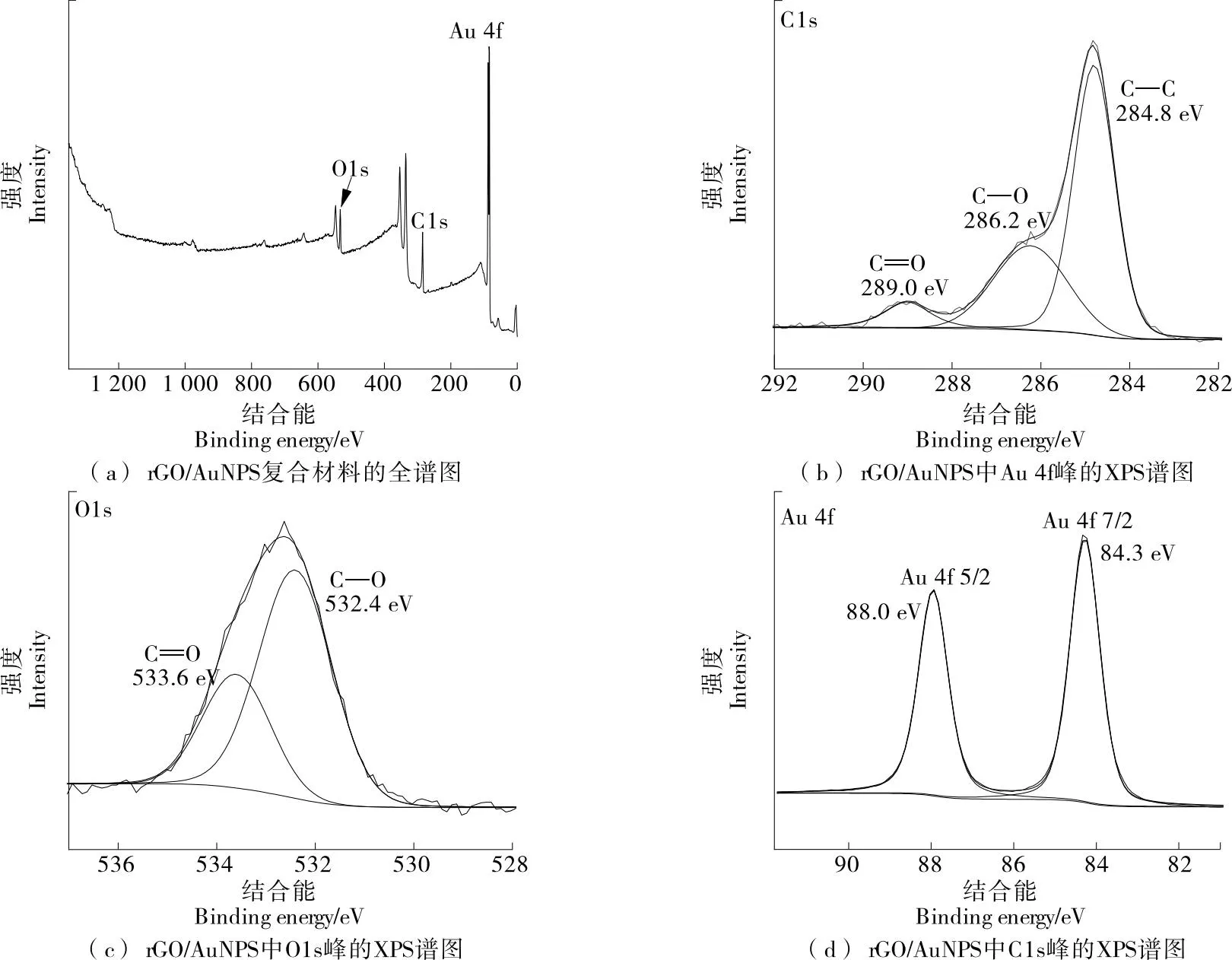
圖3 rGO/AuNPS的XPS能譜圖及組成元素的XPS譜圖
2.2 生物傳感器的催化活性
生物傳感器的催化活性是傳感器最重要的性能參數之一。米氏常數(Km)可以用來衡量酶的親和力,其值越小,表明酶的親和力越強。米氏常數可以通過Lineweaver Burk方程計算:
(2)
式中:
Icat——添加ATCl時的電流值,μA;
Imax——ATCl飽和狀態下的最大電流值,μA;
C——ATCl濃度,mmol/L;
Km——米氏常數,mmol/L。
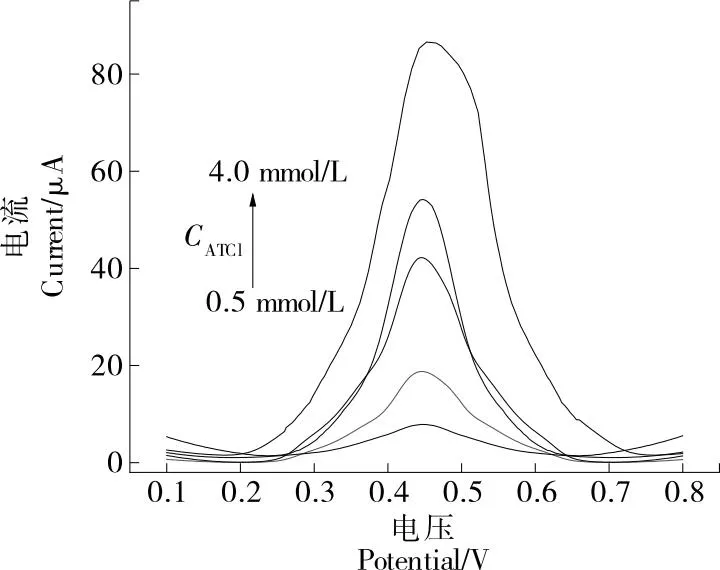
圖4 AChE/AuNPS/rGO/SPCE電極對不同濃度ATCl的DPV響應
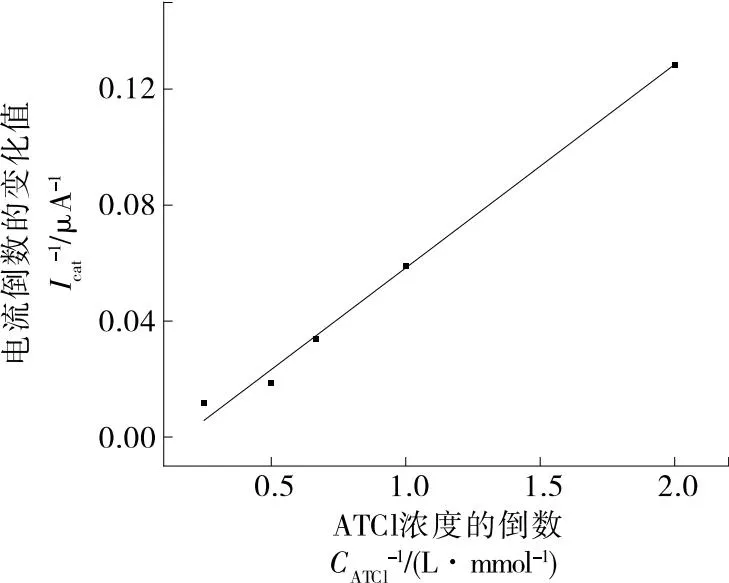
圖5 峰值電流的倒數與乙酰硫代膽堿氯化物濃度的倒數的校準曲線
2.3 電化學表征
圖6(a)描述了在5 mmol/L Fe3(CN)6/0.1 mol/L KCl溶液中不同修飾電極的CV圖,掃描速度為0.1 V/s,電位范圍為-0.6~0.8 V。在未修飾任何材料前,SPCE具有明確的可逆電化學響應。經過GO修飾,峰值電流顯著下降,主要歸因于GO的導電性較差。此外,與裸電極和GO修飾電極相比,還原后的rGO修飾的SPCE具有很好的導電性,表明rGO的優異導電性和大表面積有助于加快整個電化學過程[20]。
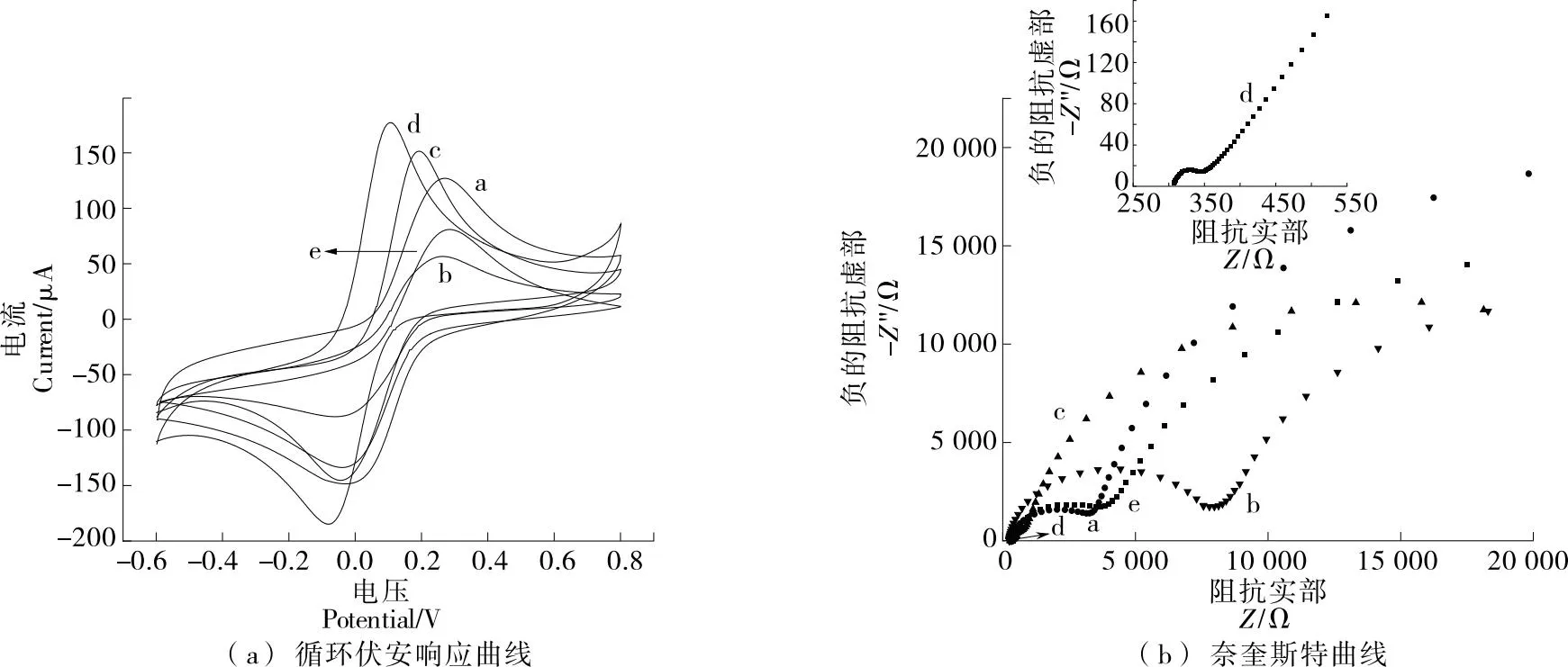
a. SPCE b. GO/SPCE c. rGO/SPCE d. AuNPS/rGO/SPCE e. AChE/AuNPS/rGO/SPCE
在沉積AuNPS后形成rGO/AuNPS復合材料,AuNPS充當電子轉移通道,進一步提高rGO膜的導電性,改性層和電解質(離子)之間的電荷轉移過程加快并更有效地發生。根據Randles-Sevcik方程測定了修飾rGO/AuNPS電極的電活性表面積,并與SPCE的電活性表面積進行了比較。
Ip=(2.69×105)n3/2ACD1/2v1/2,
(3)
式中:
Ip——循環伏安響應的峰值電流,μA;
n——氧化還原反應中的電子轉移數;
A——電極表面積,cm2;
C——氧化還原指示劑Fe3(CN)6的濃度,mol/L;
D——擴散系數,cm2/s;
v——掃描速率,V/s。
2.4 優化設計
從圖7(a)可以看出,響應電流的最大值在pH 7.5時,電解液過酸或過堿都會影響所固定的AChE的生物活性。因此,在隨后的試驗中選用pH 7.5的PBS。從圖7(b)可以看出,隨著AChE酶修飾量的增加,峰值電流會先上升后下降,可能是由于AChE的過厚導致其電阻增大。因此,選擇10 μL AChE作為最佳修飾量。從圖7(c)可以看出,AChE的最適溫度為35 ℃,溫度超過35 ℃其峰值電流出現下降,可能是溫度過高對酶活性造成了影響。從圖7(d)可以看出,酶的修飾時間對其影響較小,最終選擇30 min作為AChE的修飾時間。從圖7(e)可以看出,當底物濃度為1.0 mmol/L時,MP對AChE的抑制率達到最大,當ATCl濃度>1.0 mmol/L 時,抑制率呈下降趨勢。這是因為ATCl濃度的增加導致酶活性中心逐漸被底物占據,在此過程中,酶分子上積累了過多的底物,產生了膽堿、乙酸等非活性中間體,這些不活躍的中間產物影響了電流反饋。因此,后續試驗選擇1.0 mmol/L作為底物濃度。另外,抑制時間對抑制率也有一定的影響,如圖7(f)所示,AChE/AuNPS/rGO/SPCE在50 ng/mL的MP溶液中浸泡不同時間。結果表明,MP對AChE的抑制率隨抑制時間的延長而增加,當抑制時間超過10 min時,曲線趨于平穩,表明農藥與酶的結合達到了平衡。因此,選擇浸泡時間為10 min。
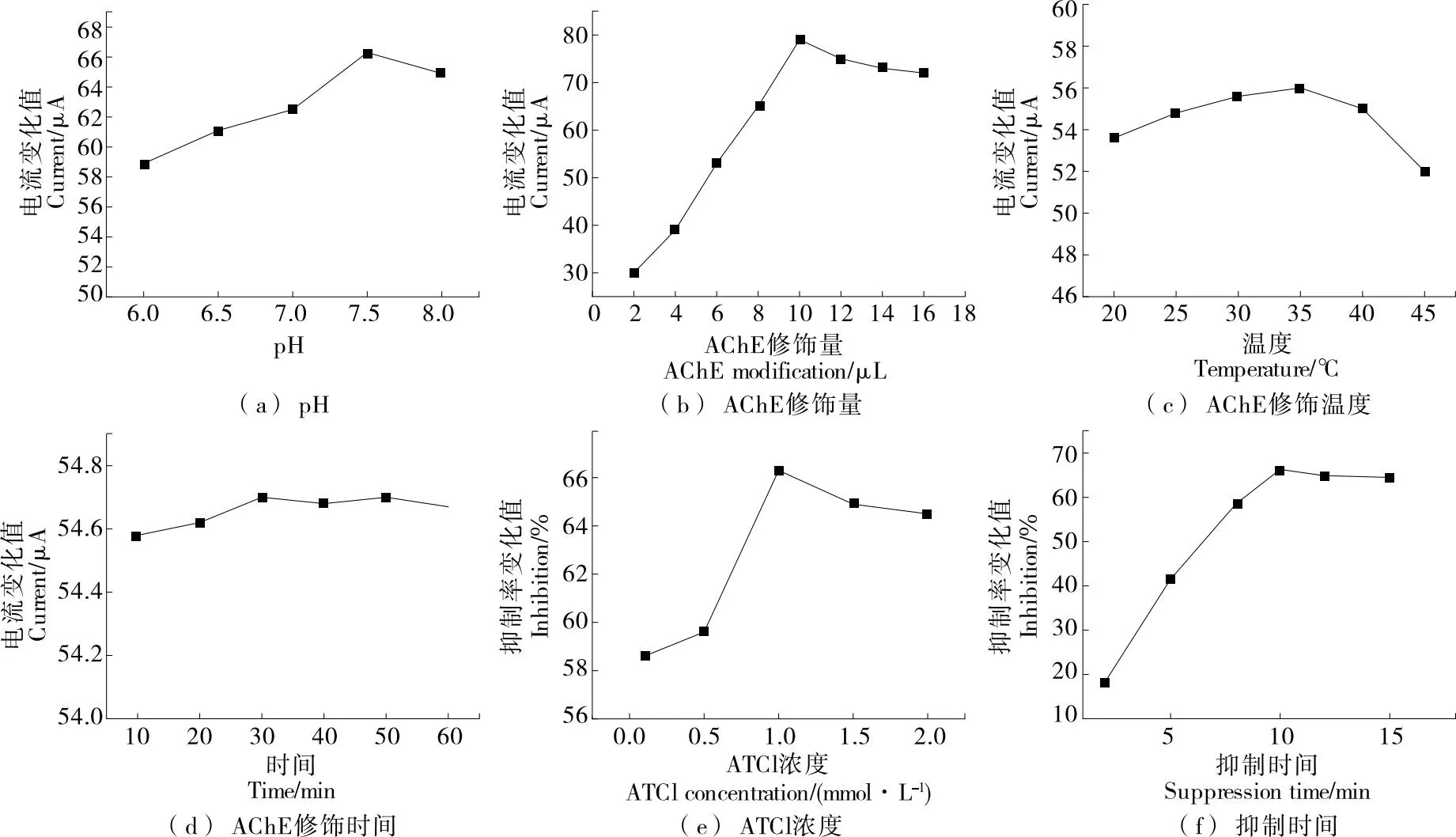
圖7 pH值、AChE修飾量、底物濃度和抑制時間優化圖
2.5 農藥含量檢測
圖8(a)顯示在最優底物濃度的情況下進行DPV測試,隨著不斷加大農藥質量濃度,傳感器催化活性降低。由圖8(b)可以看出,隨著農藥質量濃度的增加,抑制率呈線性變化。顯示了兩個線性范圍:1~50 ng/mL的抑制率方程分別為I=0.513 8CMP+10.298(R2=0.981),50~500 ng/mL 的抑制率方程為I=0.066 5CMP+34.561(R2=0.987)。該傳感器的檢出限為0.692 ng/mL(使用3σ/N規則計算)。表1總結了不同修飾電極材料對于MP的電化學檢測。
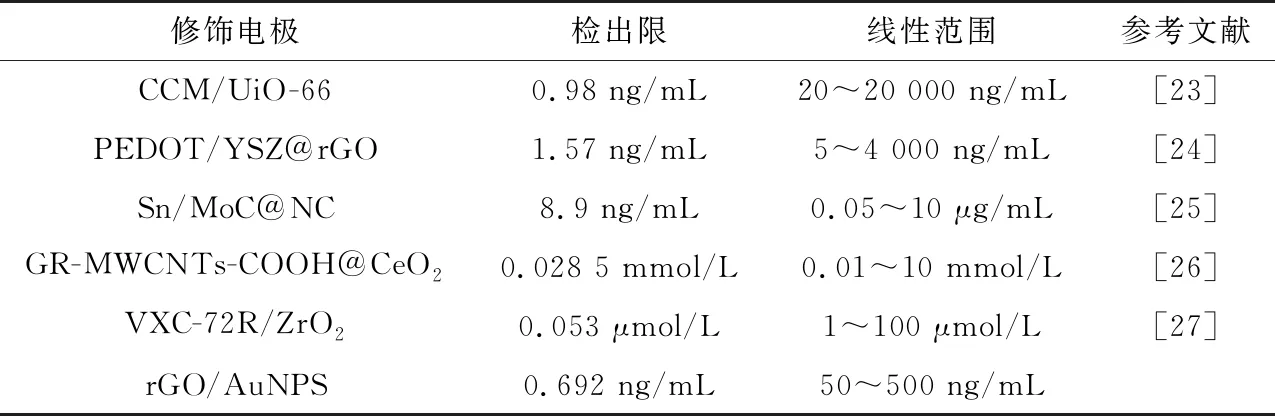
表1 與常見修飾電極的比較
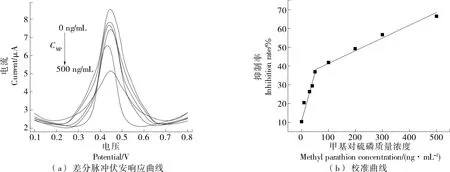
圖8 AChE/AuNPS/rGO/SPCE在不同濃度甲基對硫磷抑制10 min后在1 mmol/L ATCl中的差分脈沖伏安響應曲線和抑制率與甲基對硫磷質量濃度之間的關系
2.6 干擾研究
為評估AChE/AuNPS/rGO/SPCE的選擇性,將0.1 mol/L NaCl、KCl和K2SO4、0.1 mmol/L PBS、1 mg/mL葡萄糖(Glucose)分別加入到質量濃度為50 ng/mL的MP中。如圖9所示,添加干擾后MP溶液的電流響應無明顯變化,表明制備的傳感器在受到干擾時仍具有令人滿意的選擇性。
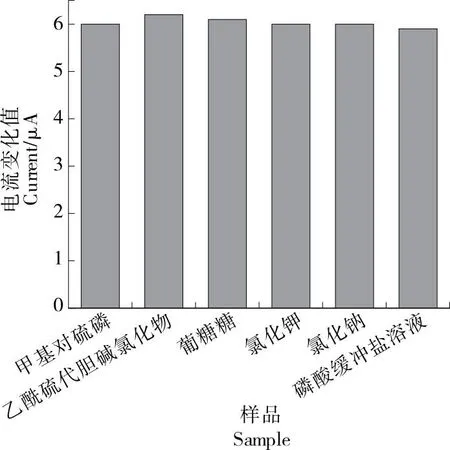
圖9 不同物質對MP安培響應的干擾
2.7 實際樣品檢測
通過向生菜和蘋果樣品中添加一定量的MP來進行回收試驗。樣品是從附近菜市場購買,用破壁機榨汁,并用PBS稀釋10倍。將MP添加到稀釋的果汁樣品中以制備所需濃度MP測試溶液。收集其上清液進行電化學分析。計算其回收率,結果見表2。由表2可知,MP在樣品中的回收率為93.6%~101.6%,相對標準偏差(RSD)為1.84%~6.12%,與氣相色譜法的檢測結果基本一致。
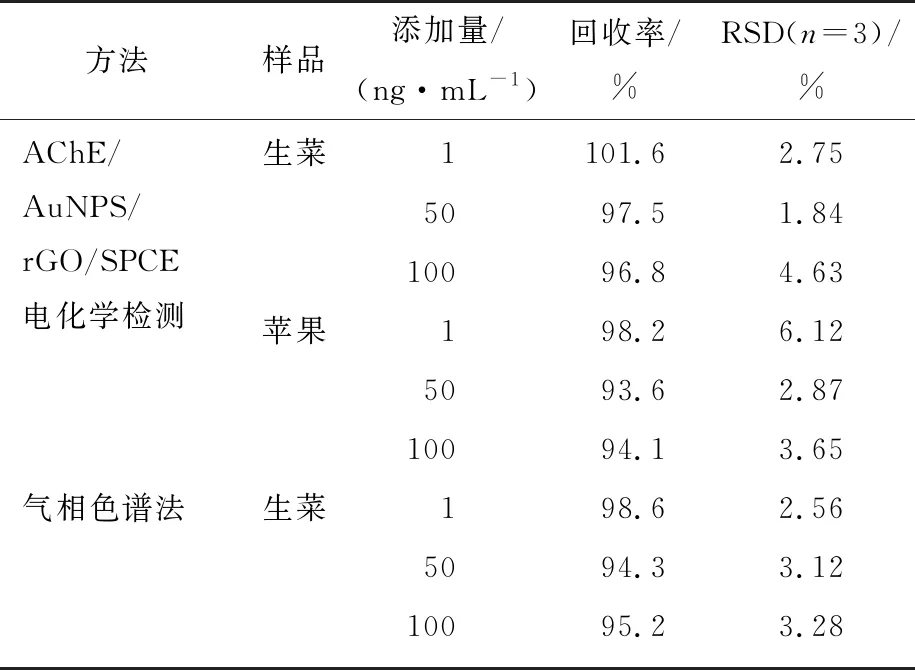
表2 樣品中甲基對硫磷的檢測
結果表明,該生物傳感器可以非常準確地檢測甲基對硫磷。
2.8 重現性、重復性、儲存穩定性
選取5個酶電極,在最優試驗條件下,研究了酶電極的重現性、重復性與儲存穩定性,記錄其對1 mmol/L底物的DPV響應電流,其相對標準偏差范圍為3.10%~5.60%。單個電極連續5次在1 mmol/L底物溶液中測定的標準偏差為4.30%。隨后用PBS沖洗后儲存在4 ℃的冰箱中,干燥密封。測量結果為在7 d后保持初始狀態95%以上,在30 d后仍保留了其初始電流響應的80%。結果表明,相比于傳統的三電極,該絲網印刷電極依然具有不錯的穩定性。
3 結論
該傳感器將還原氧化石墨烯、金納米顆粒和乙酰膽堿酶采用逐層組裝的方法修飾在絲網印刷電極表面,制備了乙酰膽堿酶/金納米顆粒/還原氧化石墨烯/絲網印刷電極電化學生物傳感器用于檢測甲基對硫磷。結果表明,甲基對硫磷的線性范圍為5~500 ng/mL,檢出限為0.692 ng/mL,具有低成本和良好的選擇性與穩定性。

