不同制備方法對青稞抗性淀粉消化性的影響
王則徐,周文菊,陳正行,張鑫,杜艷,涂兆鑫,李娟,4*
1(江南大學 糧食發酵與食品生物制造國家工程研究中心,江蘇 無錫,214122)2(青海華實科技投資管理有限公司, 青海 西寧,810016)3(青海華實青稞生物科技開發有限公司,青海 西寧,810016)4(江蘇省生物活性制品 加工工程技術研究中心,江蘇 無錫,214122)
青稞是我國青藏高原地區特有的傳統經濟作物,因其有高β-葡聚糖、高纖維、高蛋白、低血糖生成指數和低熱量等特點,符合現代消費者所需的膳食結構,引起了國內外研究者廣泛的關注[1]。淀粉是人體主要的能源物質,青稞中含有60%~80%的淀粉。根據淀粉消化性能和生物可利用性,將其分為易消化淀粉(rapidly digestible starch,RDS)、慢消化淀粉(lowly digestible starch,SDS)和抗性淀粉(resistant starch,RS)[2]。研究表明,抗性淀粉在對人體控制血糖、降低血脂、促進礦物質吸收等方面具有明顯功效。
抗性淀粉又稱抗酶解淀粉,具有類似于膳食纖維的生理功能,對糖尿病、心腦血管疾病等具有較好的預防作用。大量文獻資料顯示,常見的抗性淀粉多由小麥淀粉、玉米淀粉等制備。青稞中淀粉含量較高,是制備抗性淀粉的理想原料。然而,應用青稞淀粉(highland barley starch,HBS)制備抗性淀粉方面的研究相對較少。壓熱冷卻法(hydrothermal cooling cycle method,HC)和酶解脫支法(enzymatic branching method,EB)是常用的抗性淀粉制備方法。其中HC處理的HBS經高溫高壓處理后顆粒結構塌陷,冷卻過程中淀粉分子重結晶,呈現不規則的塊狀,形成抗酶解耐熱結構[3],而EB處理則用酶降解淀粉分子,使淀粉分子的聚合度和直鏈A支鏈淀粉的比例達到適合形成RS的程度,進而促進RS的形成[4]。但這2種方法所得抗性淀粉含量不高(HC處理的RS含量在8%左右[3],EB處理的RS含量在10%左右)。研究表明,多種制備方法聯合處理淀粉是一種有效提高抗性淀粉含量的方法。濕熱法(damp heat method,DH)是一種在低濕度條件下對淀粉進行熱處理的方法,具有提高直鏈和支鏈淀粉相互作用和提高抗性淀粉含量的優點。因此,以青稞淀粉為原料,采用HC-DH或EB-DH聯合處理方法以期望得到高抗性、高熱穩定性和低消化性的青稞抗性淀粉(highland barley resistant starch,HBRS)。
1 材料和方法
1.1 材料與試劑
昆侖14號黃青稞粉(100目),青海華實科技投資管理有限公司;D-葡萄糖(GOPOD法)檢測試劑盒,無錫浩正生物科技有限公司;淀粉葡萄糖苷酶(黑曲霉),上海泰坦科技股份有限公司;無水乙醇、NaOH、HCl溶液、Na2CO3(均為分析純),國藥集團化學試劑有限公司。
1.2 儀器與設備
BSC-250型恒溫恒濕箱、HHS型數顯恒溫水浴鍋,上海博訊實業有限公司醫療設備廠;GZX-9246 MBE型數顯鼓風干燥箱,上海一恒科學儀器有限公司;UV-3200型紫外分光光度計,上海美譜達儀器有限公司;D2 PHASER型X射線衍射儀,德國布魯克AXS公司;BCD-258 WDPM型冰箱,青島海爾股份有限公司;Thermo1510酶標儀,賽默飛世爾科技(中國)有限公司;SU8100 冷場發射掃描電子顯微鏡,日本株式會社日立高新技術;AX224ZH/E 型電子天平,奧豪斯儀器(常州)有限公司。
1.3 實驗方法
1.3.1 青稞淀粉提取
參考張慧娟等[5]的方法略有修改:稱取青稞粉300 g,加入1 500 mL 4 g/L的NaOH溶液浸泡2 h。然后用濃鹽酸調節pH至中性,離心(4 800×g,10 min)。舍棄上清液、上層黃色黏稠液體和暗黃色固體,用去離子水多次洗滌下層沉淀物,離心(4 800×g,10 min),舍棄上清液及上層黃色黏稠液體,保留下層白色固體沉淀。用無水乙醇洗滌沉淀2次,抽濾,置于平皿中自然干燥,即得HBS。
1.3.2 HBRS的制備
1.3.2.1 壓熱冷卻循環法和酶解脫支法制備HBRS
采用韓麗瑤等[6]的方法略有修改:稱取HBS 10 g,加入去離子水100 mL,攪拌均勻,在125 ℃條件下處理45 min,取出,冷卻至室溫,隨后于4 ℃冰箱中放置12 h,以上操作重復3次。將淀粉糊冷凍干燥,粉碎,過篩(100目),即得HC制備的HBRS。
稱取HBS 10 g,加入去離子水100 mL,攪拌均勻,在125 ℃條件下預糊化45 min,取出冷卻至55 ℃,用濃鹽酸調節pH值至4.5,并在淀粉糊出現明顯凝膠時,加入6 U/g普魯蘭酶,于50 ℃環境中孵育6 h。將酶解后的淀粉糊在125 ℃壓熱處理45 min,隨后于4 ℃冰箱中放置24 h。將淀粉糊冷凍干燥,粉碎,過篩,即得EB制備的HBRS。
1.3.2.2 HC-DH和EB-DH聯合制備HBRS
稱取HC和DH制備的HBS各1 g,控制水分含量為30%,室溫放置過夜。在105 ℃烘箱密封放置2 h,取出,于50 ℃條件下干燥24 h。之后加水保持水分30%,重復2次之前操作。淀粉糊冷凍干燥,粉碎,過篩,即得HC-DH和EB-DH制備的HBRS。
1.3.3 淀粉的結構性質
1.3.3.1 X-射線衍射及相對結晶度測定[7]
利用X-射線衍射儀(X-ray diffraction,XRD)對淀粉的結晶特性進行表征。測試條件:衍射角范圍5°~35°,掃描速率2°/min,在40 kV和40 mA條件下進行掃描。相對結晶度(relative crystallinity,RC)使用MDI-Jade 6.5軟件(Material Date,Inc.Livermore,California,USA)進行分析。計算如公式(1)所示:
(1)
式中:RC,相對結晶度;Ac,淀粉結晶區面積;Aa,淀粉無定形區的面積。
1.3.3.2 傅立葉變換紅外光譜測定[8]
將HBS(HBRS)與適量KBr充分混合(1∶100),研磨后進行壓片,然后置于傅立葉變換紅外光譜儀中檢測。掃描波數范圍及儀器分辨率分別為 400~4 000 cm-1和4 cm-1。
1.3.4 糊化特性
稱取HBS(HBRS)3 g,加入到裝有25 mL蒸餾水的樣品盒中并充分攪拌,將樣品盒置于快速黏度分析儀樣品槽內,開始15 s以150 r/min攪拌,將淀粉溶液混勻。淀粉的糊化特性用黏度參數表示[9]。
1.3.5 HBS(HBRS)的顆粒形態觀察
HBS(HBRS)顆粒形態特征使用掃描電子顯微鏡進行觀察。將HBS(HBRS)樣品平鋪于帶有導電膠帶的鋁制坩堝上并進行真空噴金處理,樣品的顆粒形態特征在3.0 kV,5.00 μm條件下進行觀察,圖像放大倍數為500×[10]。
1.3.6 淀粉消化特性
用改良后的Englyst方法[11]測試HBS(HBRS)的體外消化率。稱取100 mg HBS(HBRS),置于離心管中,糊化后加入玻璃珠,密封,將離心管于37 ℃恒溫振蕩,振蕩速率為120 r/min;加入4 mL新鮮配制的消化液并開始計時;分別在20和120 min吸取100 μL水解液,加入900 μL無水乙醇滅活消化酶;離心(8 000×g,2 min),收集上清液,利用3 mL葡萄糖氧化酶試劑盒(GOPOD)測定上清液中的葡萄糖含量。20 min內消化的淀粉部分為RDS, 20~120 min內消化的淀粉部分為SDS,120 min內未消化的淀粉部分為RS。
1.3.7 淀粉功能特性
稱取HBS(HBRS)0.5 g,置于預先稱重的離心管中,加入去離子水6 mL,混勻,在30 ℃水浴中保持30 min,每10 min渦旋5 s。離心(3 000×g,15 min),上清液轉移到恒重的培養皿中,在105 ℃干燥4 h[12]。稱取沉淀物質量,并根據公式(2)和公式(3)計算淀粉的持水性和水溶性。
(2)
(3)
式中:sp,持水性,%;m1,沉淀質量,g;m2,樣品質量,g;m3,被溶解樣品質量,g;sw,水溶性,%。
1.3.8 數據統計分析
每個樣品至少平行測定3次,所有實驗結果用平均值±標準差表示。運用SPSS 18.0軟件(SPSS Incorporatd,Chicago)進行方差分析,并利用Tukey方法分析數據的顯著性。
2 結果與討論
2.1 淀粉的結構性質
2.1.1 X-射線衍射及相對結晶度
由圖1可知,HBS在15.15°、17.15°、18.19°、23.23°均具有衍射峰,為A型結晶結構。與HBS相比,EB制備的HBS在17°處衍射峰的強度有所上升,在18°處的衍射峰強度下降,有類似B型結晶結構。HC、HC-DH和EB-DH制備的HBS衍射峰基本消失,淀粉無定形區增加,整條曲線接近饅頭峰,說明HC、HC-DH和EB-DH處理能破壞HBS的結晶結構和雙螺旋結構。HC處理對HBS結構改變的原因主要是在高溫高壓的環境中HBS原有的晶體結構被破壞。淀粉顆粒由有序的結晶區和無序的無定形區組成,其中結晶區主要由支鏈淀粉起到骨架作用,其直鏈分支和長短不同的游離直鏈分子平行排列,通過氫鍵作用形成大致有規則的束狀體即為微晶束[13]。EB制備過程中,HBS微晶區的支鏈分支被普魯蘭酶酶解切斷,支鏈淀粉的支撐作用減弱,大量短直鏈呈游離狀態分布于淀粉顆粒中,從而降低了RC。結晶度是表征淀粉顆粒結晶結構的一個重要指標,其指標會影響淀粉的理化性質和應用[14]。HBS經HC和EB處理后,其RC從29.05%分別降低至12.85%(HC)和10.11%(EB)。經過HC-DH和EB-DH處理后,RC進一步顯著降低,分別為4.75%(HC-DH)和3.59%(EB-DH)。表明HBS經過不同方式處理后,其晶體結構轉變為無定型結構,從多晶狀態轉變為非晶態。

圖1 不同制備方法對HBS X-射線衍射圖譜及 相對結晶度的影響Fig.1 Effect of different preparation methods on the HBS X-ray diffraction spectrum and its relative crystallinity
2.1.2 傅立葉變換紅外光譜
由圖2可知,與HBS相比,HC-DH和EB-DH制備的HBRS在3 400~3 100 cm-1處的吸收峰向低波數方向遷移,并形成了更寬和更深的吸收峰,表明HBRS中短直鏈淀粉鏈由于分子間和分子內相關的復雜振動拉伸而產生更多氫鍵,使分子間的結構變得更加緊密,影響了淀粉顆粒對淀粉酶作用的敏感性,阻礙了淀粉酶水解,降低了HBS的回生值[15]。淀粉分子的短程有序性可由紅外光譜中1 047/1 022 cm-1吸收峰的吸光度比值來表征[16]。其中1 047/1 022比值越大,表明顆粒內短程有序度越高。由圖3可知,HC和EB處理后的青稞淀粉樣品的1 047/1 022吸光度比值顯著降低(P<0.05),而再經過DH處理后1 047/1 022比值又有所減小,說明青稞淀粉經過
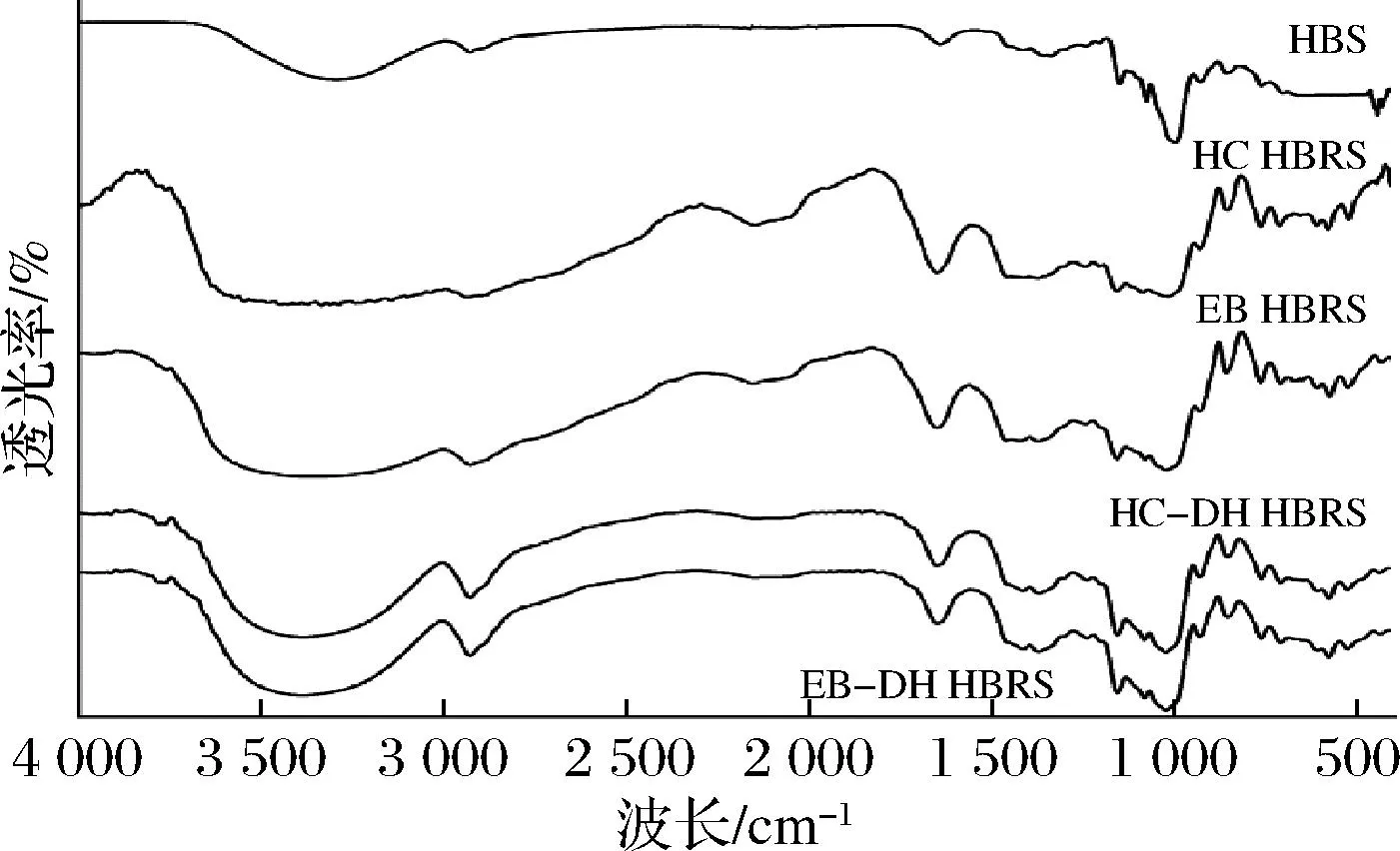
圖2 不同制備方法對HBS紅外圖譜的影響Fig.2 Effect of different preparation methods on the infrared mapping of HBS
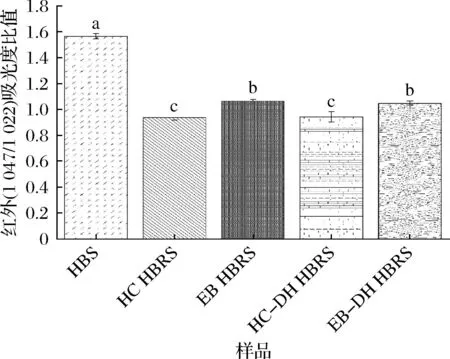
圖3 不同制備方法對HBS紅外光譜中1 047/1 022 cm-1 吸光度的比值的影響Fig.3 Effect of different preparation methods on the ratio of the absorbance of 1 047/1 022 cm-1 in the infrared spectrum of HBS
HC-DH和EB-DH處理后,樣品的雙螺旋結構解旋,結晶度降低,該結論與XRD所得結論一致。
2.2 RVA
峰值黏度與谷值黏度之差即衰減值則反映了HBS(HBRS)的熱糊穩定性,衰減值越大,則其熱糊穩定性就越差[17]。由表1可知,HBS衰減值為1 766 cP。經HC和EB處理的HBRS的峰值黏度顯著降低(P<0.05)。再經過HC-DH和EB-DH處理后HBRS的衰減值有極顯著減小(P<0.05)。表明HC-DH和EB-DH可顯著提高HBS的熱糊穩定性。
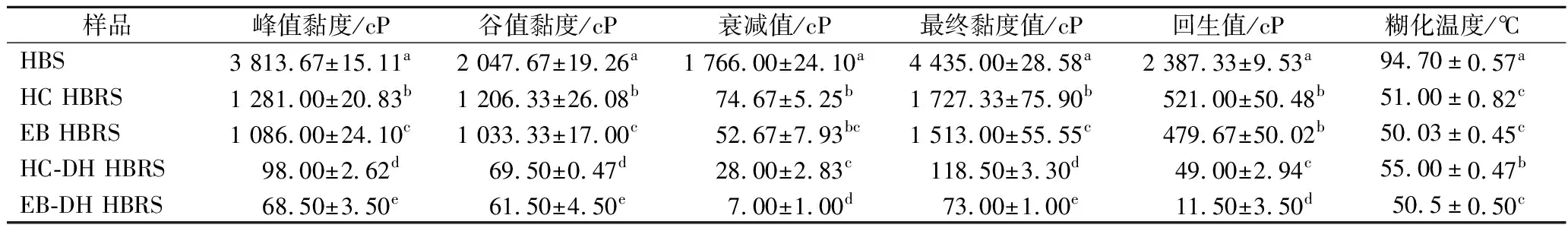
表1 不同制備方法對HBS糊化特性的影響Table 1 Effect of different preparation methods on the gelatinization characteristics of HBS
糊化溫度反映了淀粉糊化的難易程度,糊化溫度越高,淀粉糊化越困難[18]。HBS經過不同方式處理后,糊化溫度顯著降低(P<0.05),表明HC、EB、HC-DH和EB-DH處理均能明顯改善HBS的糊化性能。
圖4反映了不同處理方法對HBS糊化特性的影響,結合表1可以較為細致地得出HBS經過HC或EB處理后其糊化性能得到較大改善,而HC-DH和EB-DH處理對HBS糊化性能改善效果更為突出。
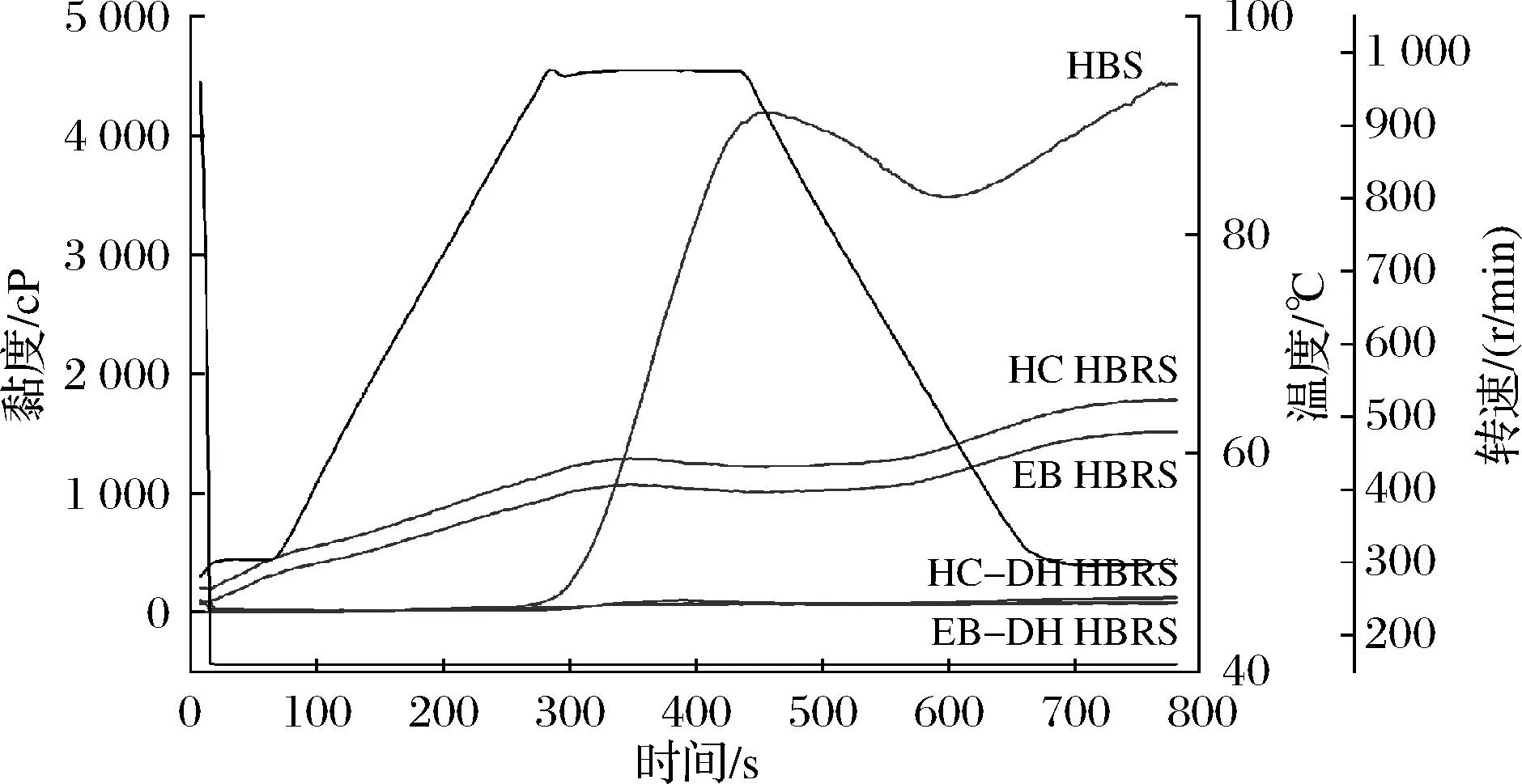
圖4 不同制備方法對HBS糊化特性的影響Fig.4 Effect of different preparation methods on the gelatinization characteristics of HBS
2.3 淀粉的顆粒形態觀察
如圖5所示,HBS顆粒形態呈現球形或橢圓形且表面光滑,無明顯裂痕。HC處理后,青稞淀粉顆粒之間發生聚集且表面比較粗糙,呈現不規則的鱗片狀,幾乎沒有完整的淀粉顆粒形狀。其原因可能是在HC過程中,HBS大部分發生糊化,顆粒吸水膨脹,導致體積增大而后破裂,失去原有晶體結構[19]。DH處理后的淀粉,其原本顆粒結構和性質消失,淀粉顆粒相互連結,且體積明顯增大,表面凹凸不規則,淀粉顆粒也出現了粘結現象。HC-DH和EB-DH處理時,可能由于DH處理的高溫環境使其水分蒸發至顆粒表面,促使HBS顆粒相互黏連,顆粒變大。當結束DH過程后,溫度的降低使顆粒表面形成塌陷,出現凹坑,表現出不同強度的固態連接,表觀結構發生明顯變化,形成不規則堆積結構,出現大量塊狀物[20]。這些結構的產生與上文中XRD和紅外得出的處理前后晶體結構和結晶度產生變化相對應。在一定程度上揭示了HBS(HBRS)樣品顆粒形態的變化與其消化性之間的關聯。

a-HBS;b-HC HBRS;c-EB HBRS;d-HC-DH HBRS; e-EB-DH HBRS圖5 不同制備方法對HBS微觀結構的影響Fig.5 Effect of different preparation method on the microstructure of HBS
2.4 淀粉體外消化率
由表2可知,糊化HBS中RDS、SDS和RS含量分別為85.45%、9.73%和4.81%。經過HC處理后,RDS含量顯著減少(P<0.05),SDS與RS含量均顯著增加(P<0.05)[21]。這是由于HC處理的本質是高溫高壓產生的直鏈分子在回生過程中進行了重結晶,形成致密的抗酶解結構,而EB處理則是普魯蘭酶作用于α-1,6糖苷鍵而產生更多的直鏈淀粉[22]。HC和EB處理后HBS的消化率變弱。HC和EB與DH聯合處理可以降解淀粉分子,部分破壞原存在于天然淀粉中的螺旋、結晶和層狀結構。DH處理后的HBS具有更高的抗酶水解性(RS增加)[23]。HC-DH和EB-DH處理可以在多個尺度上改變結構來有效調節HBRS的消化率[24],并最終將部分RDS/SDS轉化為RS,HC-DH和EB-DH后,RDS和SDS質量分數顯著減少,而與此同時RS的質量分數大幅提高。根據以上結果,可以得出HC-DH和EB-DH處理過程中的水熱效應/酶作用會導致淀粉層次結構被破壞,從而改變HBS(HBRS)消化和糊化特性,進而在消化過程中表現出較高的抗酶水解能力和在糊化過程中顯示出較高的耐水熱效應能力。
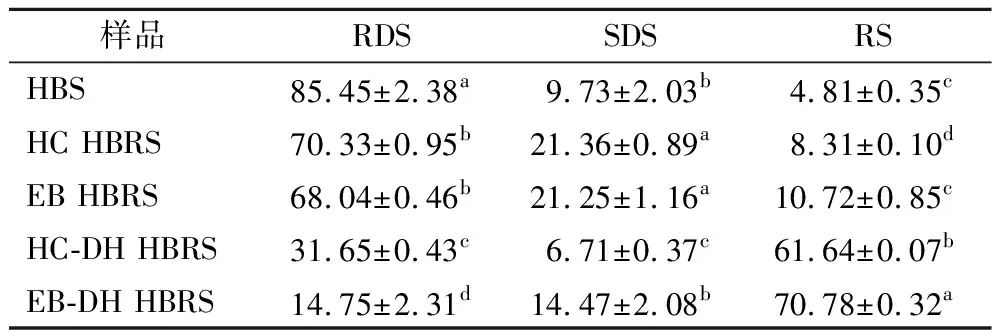
表2 糊化HBS(HBRS)體外消化率 單位:%
2.5 淀粉功能特性
如表3所示,HBS經過HC、EB、HC-DH或EB-DH處理后,持水性顯著增加(P<0.05),可能是由于HC或EB處理使HBS結晶結構被破壞,并促進淀粉和水之間的氫鍵相互作用,從而增加吸水指數[25]。HC-DH制備的HBRS的持水性略微增加,EB-DH處理的HBRS持水性有所減小,但均顯著高于HBS(P<0.05)。HBS的水溶性指數最低(0.42%),HC制備的HBRS水溶性指數最高(11.86%)。水溶性指數通常用作確定淀粉成分破壞程度的指標。經改性后HBS水溶性指標明顯提高,表明HBS結構在水熱效應下進一步被破壞。
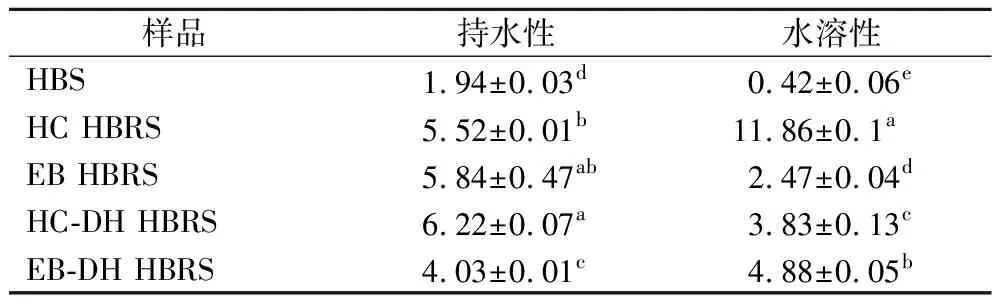
表3 HBS(HBRS)持水性和水溶性 單位:%
3 結論
抗性淀粉在小腸中不被吸收和酶解,但能在大腸中被腸道菌群發酵,生成短鏈脂肪酸,因此具有調節血糖水平和改善腸道環境作用。本文從結構和消化性等角度出發對HC或EB制備的抗性淀粉及HC-DH或EB-DH聯合制備的抗性淀粉改善機制進行分析得出:HC-DH和EB-DH處理使HBS的相對結晶度減小,淀粉顆粒破裂,短程有序性、消化率和糊化溫度降低,糊化特性得到調節。此外,與HC和EB相比,聯合處理成功地提高了HBS的抗性淀粉含量。XRD與紅外結果表明了不同處理方法對HBS(HBRS)結構方面的改變,其中HC-DH和EB-DH對HBS產生的結構破壞尤其明顯。可以得出HBS經過聯合處理后,其晶體結構轉變為無定型結構,從多晶狀態轉變為非晶態。可能正是由于原本較穩定的晶體結構被破壞和新結構的產生,從而使HC-DH和EB-DH處理后得到的HBRS對淀粉酶敏感性降低和更高的抗性淀粉含量。糊化特性和功能特性研究結果也佐證了HC-DH和EB-DH處理比單一的HC和EB處理能得到更優質的HBRS。本文的研究結果有助于我們從結構的角度,通過與HC和EB對比更好地理解HC-DH和EB-DH處理的方法對HBS消化率、糊化特性和功能特性的影響,為后續更深入研究制備方法對HBRS構效關系的影響、制備更優質的HBRS奠定基礎。