一株高效降解馬鈴薯糖苷生物堿菌株的篩選鑒定及降解特性研究
宋菲,李晨,閆子茹,張娜,田洪濤,4,5*
1(河北農業大學 食品科技學院,河北 保定,071000)2(邢臺學院 生物科學與工程學院,河北 邢臺,054001) 3(保定學院 生物化工與環境工程學院,河北 保定,071000)4(河北省益生功能性乳制品技術創新中心, 河北 保定,071000)5(國家北方山區農業工程技術研究中心,河北 保定,071000)
馬鈴薯作為一種糧、菜、飼和工業原料兼用型經濟作物[1],不僅產量高栽培適應性廣,而且營養價值高[2-3]。在收獲、貯藏、運輸和銷售過程中,機械損傷、溫度、濕度和光照等因素會導致塊莖中糖苷生物堿(glycoalkaloids, GAs)的含量急劇上升[4-5]。GAs是茄科和百合科植物產生的次級代謝產物,又名龍葵素。馬鈴薯中GAs主要成分為α-茄堿和α-卡茄堿,其均以茄啶作為苷元并連接一個三糖側鏈(圖1)。GAs對所有的哺乳動物都有毒性,且人類對GAs的毒性更加敏感[6]。在我國,由于馬鈴薯中GAs含量上升而造成的產業損失高達15%~20%。這嚴重制約著馬鈴薯產業化發展和糧食安全。因此,降低馬鈴薯塊莖中GAs的含量,減少馬鈴薯產業損失顯得尤為重要。
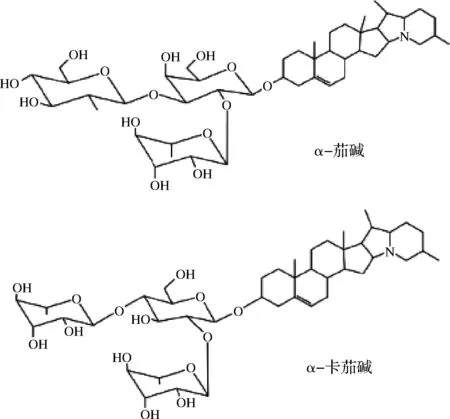
圖1 α-茄堿和α-卡茄堿的化學結構Fig.1 The structures of α-solanine and α-solanine
截止目前的實際生產中,沒有專用試劑用于抑制馬鈴薯塊莖產生GAs。通過施用氯苯胺靈(chlorpropham,CIPC)在抑制發芽的同時抑制塊莖中產生GAs。但CIPC在安全性上存在一定風險,歐盟自2019年起已禁止使用CIPC。物理方法(控制溫濕度、CO2濃度以及避光)也是控制馬鈴薯GAs含量的手段。但是此方法會增加成本,尤其在經濟欠發達地區。在運輸和銷售過程中難以控制儲存條件。通過基因改造進行馬鈴薯育種,必須在降低塊莖中GAs含量的同時維持植株其他器官中GAs的水平,從而保持整個植株的抗性,導致基因改造育種周期長、降毒率不高。因此,亟需尋找新的高效安全的解毒技術。
生物降解是利用微生物或其產物來降解食品中的污染物,包括外源污染物和內源毒素。微生物可以在生長過程中將有毒的污染物轉化為無毒化合物。到目前為止,已經開發出許多微生物來降解食品中的污染物。有研究表明,紅串紅球菌[7]、結合分枝桿菌[8]和嗜麥芽窄食單胞菌[9]可以降解黃曲霉毒素B1。乳酸菌[10]、枯草芽孢桿菌[11]和小片球菌[12]可降解葡萄及其制品中的赭曲霉毒素。微生物降解以其代謝多樣性,降解產物對食品和環境沒有二次污染等優點成為有效去除食品毒素污染物的首選技術。
本研究從發芽綠化的馬鈴薯塊莖中分離篩選高效降解馬鈴薯GAs的菌株,通過16S rDNA測序結合菌落形態、生理生化試驗進行菌株鑒定,評價其安全性并探究其降解特性和降解產物,以期得到馬鈴薯GAs高效降解菌,為開發馬鈴薯GAs的生物降解技術提供科學依據及技術支撐。
1 材料與方法
1.1 試驗材料
1.1.1 供試材料
馬鈴薯塊莖購自河北省保定市蓮池區人人樂超市。
1.1.2 試劑與儀器
α-茄堿、α-卡茄堿,上海源葉生物科技有限公司;乙腈、甲醇,均為色譜純,德國Merck公司;PCR試劑盒,北京博邁德基因技術有限公司;質粒提取試劑盒,天根生化科技(北京)有限公司;藥敏試劑盒,杭州濱和微生物試劑有限公司。
1260高效液相色譜儀,安捷倫科技有限公司;PCR儀,美國Bio-Rad公司;YXQ-SG46-280S型蒸汽滅菌器,上海博迅實業有限公司醫療設備廠;SHP-250型生化培養箱,上海精宏實驗設備有限公司。
1.1.3 培養基
LB液體培養基(g/L):蛋白胨10、牛肉膏3、NaCl 5,調節pH 至7.5;固體培養基添加瓊脂15 g;121 ℃高壓滅菌20 min。
無機鹽液體培養基(g/L):NaCl 1、KH2PO40.5、K2HPO41.5、(NH4)2SO42、MgSO40.2,調節pH至7.0,121 ℃滅菌20 min。
篩選培養基:在無機鹽培養基中添加α-茄堿或α-卡茄堿至終質量濃度為50 μg/mL。
1.2 試驗方法
1.2.1 馬鈴薯塊莖內生菌的分離
參考葉文雨等[13]的方法對馬鈴薯塊莖進行表面消毒。選取綠皮、發芽處塊莖和芽進行研磨,加入1 mL無菌水,取100 μL涂布于LB培養基平板,置于30 ℃培養箱中。
1.2.2 GAs降解菌株的篩選
將分離的內生菌接種至篩選固體培養基中,30 ℃培養72 h。挑取菌體分別接種至篩選液體培養基中,30 ℃、200 r/min培養72 h。以不接菌的培養基為空白對照,培養條件同上。參照HENNESSY等[14]的方法并加以改進建立薄層色譜法(thin-layer chromatography,TLC)檢測方法:將10 μL培養液點樣于GF254硅膠板上,以正丁醇∶乙醇∶水(2∶1∶1,體積比)為流動劑,顯影液為50%硫酸,顯影時間5 min。將初篩到的菌株按上述方法培養,使用HPLC檢測α-茄堿和α-卡茄堿的含量。HPLC檢測條件:色譜柱,Agilent ZORBAX Eclipse Plus C18(4.6×250 mm,5 μm);柱溫40 ℃;檢測器VWD;流動相,V(0.01 mol/L磷酸鹽,pH 7.6)∶V(乙腈)=40∶60;進樣量10 μL;檢測波長210 nm。降解效率按公式(1)計算:
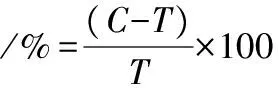
(1)
式中:C,對照組中GAs含量,μg/mL;T,試驗組中GAs含量,μg/mL。
1.2.3 菌株鑒定
1.2.3.1 菌落及細胞形態觀察
將篩選得到的GAs降解菌株劃接種于LB固體培養基中,30 ℃培養24 h后觀察菌落形態特征,并用革蘭氏染色法和孔雀綠染色法進行細胞染色觀察。
1.2.3.2 生理生化試驗
菌株的生理生化試驗參考《常見細菌系統鑒定手冊》[15]進行測定。
1.2.3.3 16S rDNA鑒定
利用十六烷基三甲基溴化銨(cetyltrimethylammonium bromide,CTAB)法[16]提取菌株的基因組DNA。以基因組DNA為模板,參照葉文雨等[13]的方法,采用通用引物27F/1492R進行16S rDNA PCR擴增。將擴增成功的PCR產物送至北京六合華大基因科技有限公司進行測序。測序結果在NBCI(https://blast.ncbi.nlm.nih.gov)上進行BLAST對比。使用MEGA-X軟件,Neighbor-joining方法進行系統發育樹構建。
1.2.4 安全性評價
1.2.4.1 藥敏試驗
以劃線的方式將待測菌液涂布到LB固體培養基中。用無菌鑷子取藥敏片貼于培養基表面。30 ℃培養24 h后,觀察抑菌圈。
1.2.4.2 質粒提取
按照質粒提取試劑盒說明書進行質粒提取,并以1%的瓊脂糖凝膠電泳進行檢測。
1.2.4.3 有害代謝產物評價
參照《常見細菌系統鑒定手冊》[15]中的方法,檢測降解菌株的硝基還原酶、氨基脫羧酶活性、吲哚檢測。
1.2.4.4 溶血活性檢測
將菌液涂布于血瓊脂培養基中,30 ℃培養24 h后,觀察溶血圈,金黃色葡萄球菌ATCC 25923作為陽性對照。
1.2.5 降解特性測定
挑取菌株C11的單菌落,接種于LB液體培養基,30 ℃ 200 r/min培養至OD600值為1.0獲得種子培養液。將菌株C11種子液以1%接種量分別接種于含α-茄堿或α-卡茄堿(50 μg/mL)的LB液體培養基中,分別檢測不同溫度(20、25、30、35、40 ℃)、pH(5.0、6.0、7.0、8.0、9.0)、時間(1、3、5、7 d)、GAs初始質量濃度(12.5、25、50、75、100 μg/mL)、接種量(1%、5%、10%)和金屬離子(Mn2+、Al3+、Cu2+、Fe3+、Fe2+、Mg2+、Zn2+,0.1 mmol/L)對降解率的影響。
1.2.6 降解活性成分測定
菌株C11培養至對數期后,根據LEI等[17]的方法分離胞外培養液、胞內提取物和微生物細胞。將α-茄堿和α-卡茄堿(終質量濃度50 μg/mL)添加到菌株C11全細菌培養物和各組分中,30 ℃孵育72 h,測定GAs含量。
1.2.7 降解產物測定
將菌株C11分別接種到含有α-茄堿或α-卡茄堿(50 μg/mL)的 LB 液體培養基中,37 ℃、200 r/min培養72 h。取 1 mL培養液,加入1 mL體積分數10%的乙酸,混合均勻后12 000×g離心15 min,取上清液。上清液經過有機濾膜(0.22 μm)過濾后,參照鄭旭等[18]的方法通過液相色譜-離子阱-飛行時間串聯質譜(liquid chromatography-ion trap-time of flight mass spectrometry,LC-IT-TOF-MS)檢測降解產物。
1.3 數據統計分析
采用SPSS 18.0進行數據分析,GraphPad Prism 7作圖。
2 結果與分析
2.1 GAs降解菌株的分離篩選
通過TLC檢測到一株可同時降解α-茄堿和α-卡茄堿的菌株C11,結果見圖2。α-茄堿的標準曲線為y=4.346x+46.93,R2=0.997 2, α-卡茄堿的標準曲線為y=4.051x+32.05,R2=0.998 8, 兩者R2均大于0.99,滿足檢測要求。HPLC檢測菌株C11對α-茄堿和α-卡茄堿降解率分別為(71±2.0)%和(72.3±1.6)%,具有較好的GAs降解效果。
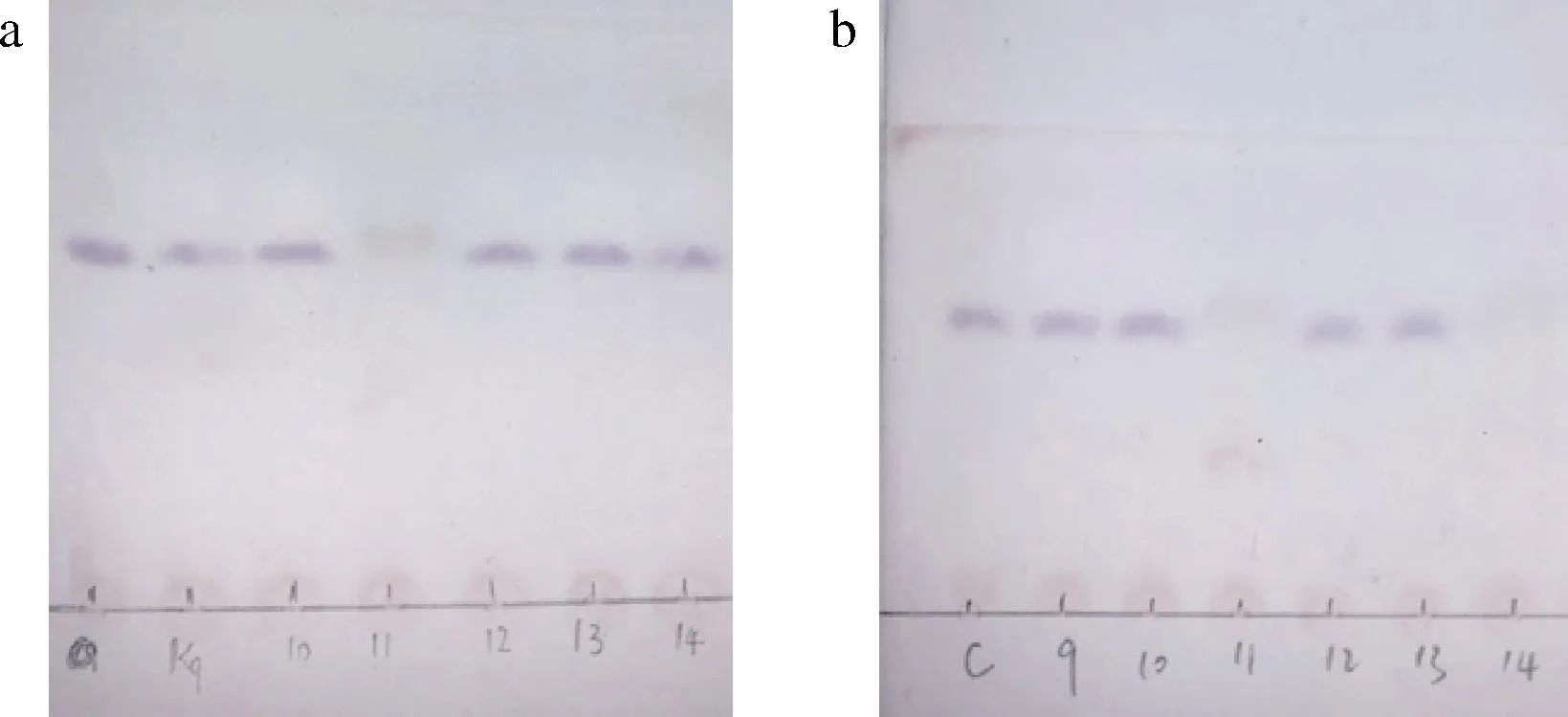
a-α-茄堿;b-α-卡茄堿圖2 TLC檢測GAsFig.2 Detection of GAs by TLC
2.2 GAs降解菌株的鑒定
2.2.1 形態學特征
菌株C11的形態學特征見圖3。C11菌落白色、不透明、菌落大,邊緣褶皺表面光滑。菌株C11為革蘭氏陽性菌,菌體呈桿狀,且具有芽孢。

a-菌落形態;b-革蘭氏染色;c-孔雀石綠染色圖3 菌株C11的形態學特征Fig.3 Morphological characteristics of strain C11
2.2.2 生理生化試驗
表1顯示降解菌的生理生化試驗結果。菌株C11的V.P.試驗、甲基紅試驗和硝酸鹽還原為陰性,接觸酶和明膠液化為陽性,該菌株能利用淀粉、半乳糖、葡萄糖和山梨醇,不能利用木糖醇,不能水解酪蛋白,苯丙氨酸脫氨酶反應陰性,不脫氨。

表1 降解菌的生理生化測定Table 1 Physiological and biochemical features of degrading strain
2.2.3 16S rDNA鑒定
將菌株C11的16S rDNA測序結果在NCBI-BLAST進行同源性分析并構建系統發育樹,結果見圖4。經同源性分析,菌株C11為芽孢桿菌屬。系統發育樹結果顯示,菌株C11與Bacillusvelezensis遺傳相對距離最近,同源性上最近。結合菌株的形態學特征和生理生化鑒定,菌株C11可確定為貝萊斯芽孢桿菌,命名為BacillusvelezensisC11。
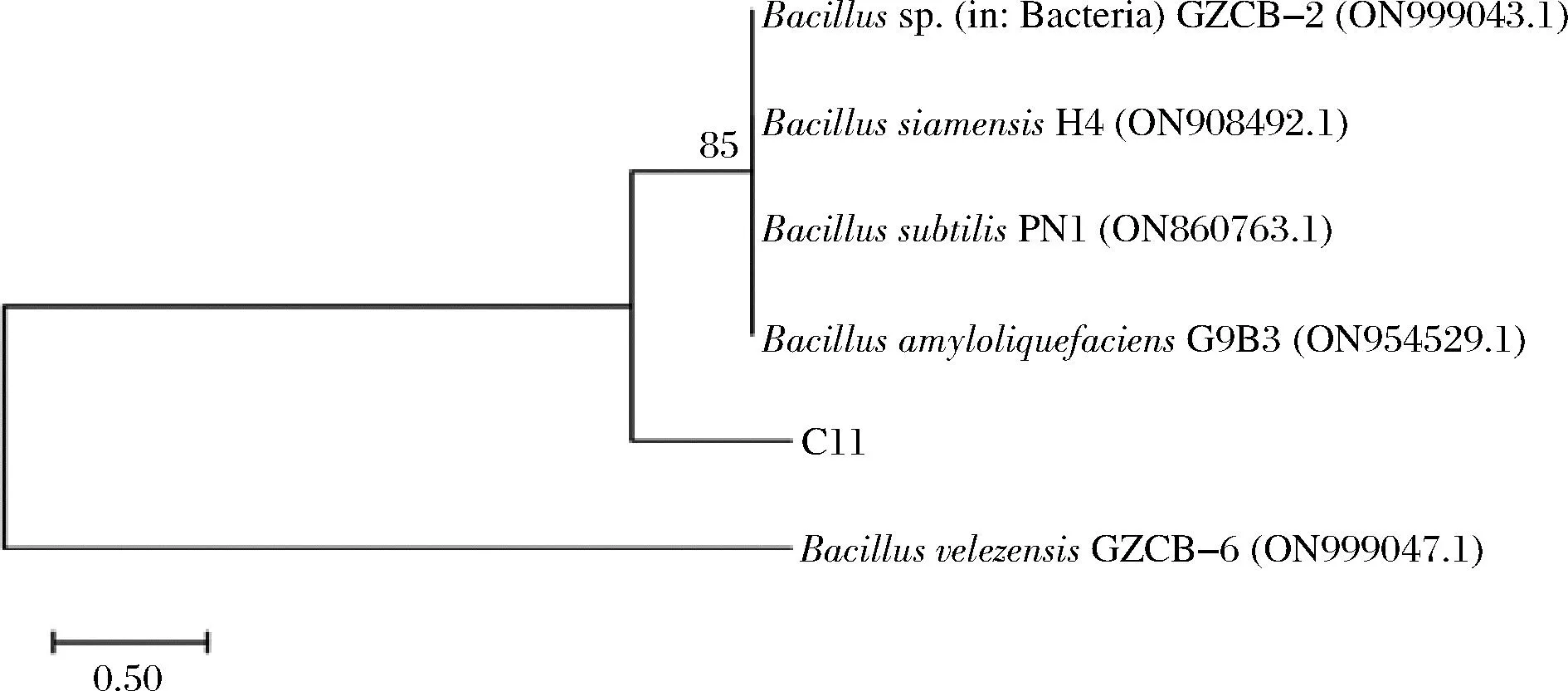
圖4 基于16S rDNA序列的菌株C11系統發育樹Fig.4 Phylogenetic tree of strain C11 based on 16S rDNA sequencing
2.3 安全性評價
2.3.1 藥敏試驗
菌株C11對常抗生素敏感性測定結果見表2。菌株C11對頭孢他啶、乙酰螺旋霉素、阿奇霉素、麥迪霉素和四環素具有抗性。

表2 降解菌對常見抗生素的敏感性Table 2 Sensitivity of degrading strain C11 to common antibiotics

續表2
2.3.2 質粒檢測
對菌株C11進行質粒提取,結果顯示菌株C11中不含有質粒(圖5)。

M-DNA marker;1-含有質粒的芽孢桿菌菌株;2-菌株C11圖5 菌株C11質粒提取電泳圖Fig.5 Plasmid extraction electrophoresis of strains C11
2.3.3 有害代謝產物檢測
菌株C11的有害代謝產物的測定結果見表3,硝基還原酶和氨基酸脫羧酶活性為陰性,吲哚試驗結果為陰性,表明菌株C11不產生亞硝酸鹽、生物胺和吲哚。
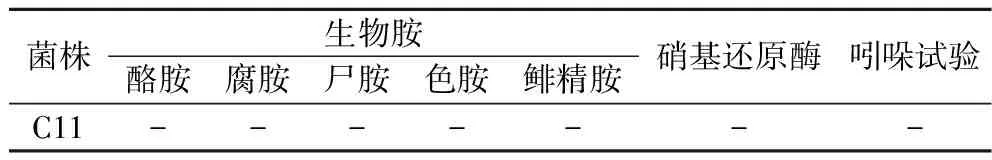
表3 菌株C11的有害代謝產物檢測Table 3 Detection of harmful metabolites of strain C11
2.3.4 溶血試驗
菌株C11的溶血試驗結果見圖6。陽性對照菌株金黃葡萄球菌ATCC 25923周圍出現溶血圈,表明實驗準確。菌株C11的菌落周圍沒有觀察到溶血圈,表明菌株C11沒有溶血活性。

a-菌株C11;b-ATCC 25923圖6 菌株溶血試驗結果Fig.6 Hemolysis test results of strains
2.4 降解特性測定
菌株C11對GAs的降解特性見圖7。菌株C11在30 ℃時降解率達到最大,對α-茄堿和α-卡茄堿的降解率分別為79.84%和80.36%。并且菌株在20~35 ℃對GAs的降解率均大于50%。因此,30 ℃是菌株C11對GAs的最適降解溫度,同時菌株C11在20~40 ℃均能有效降解GAs。
菌株C11在pH為6.0時,對GAs的降解率最高。在pH 5.0~8.0的范圍內菌株C11對GAs的降解率在60%以上。因此菌株C11對GAs的最適降解pH為6.0,并且在較寬的pH范圍內有效降解GAs。
隨著時間的增加,菌株C11對GAs的降解率逐漸增加,在5 d后對GAs的降解率達到90%以上。隨著GAs濃度的升高,菌株C11的降解作用有所下降,但降解率均在65%以上。 結果表明,菌株C11能夠耐受并降解高濃度的GAs。菌株C11的接種量對GAs的降解率沒有顯著影響。1 mmol/L的Cu2+對菌株C11降解GAs有抑制作用,Mn2+對菌株C11降解GAs有激活作用。

a-溫度;b-pH;c-培養時間;d-GAs初始濃度;e-接種量;f-金屬離子圖7 菌株C11對GAs的降解特性Fig.7 Degradation characteristics of GAs by strain C11
2.5 降解GAs的活性成分測定
將菌株C11的全細菌培養物與各種組分的GAs降解率進行比較(圖8),全細菌培養液的降解率最高為79.81%(α-茄堿)和81.78%(α-卡茄堿),使用微生物細胞降解率為67.52%(α-茄堿)和59.75%(α-卡茄堿),使用胞內提取物降解率為50.56%(α-茄堿)和46.37%(α-卡茄堿),使用胞外培養液降解率為4.96%(α-茄堿)和8.24%(α-卡茄堿)。結果表明降解GAs的活性成分位于細胞內。
2.6 降解產物的測定
LC-IT-TOF-MS對LB液體培養基中GAs的代謝產物進行檢測,結果如圖9所示。碎片的質荷比(m/z)由陽離子模式質譜掃描獲取,結合降解產物性質,α-茄堿和α-卡茄堿的降解產物可能有茄啶(圖9-c和圖9-d)和膽固醇(圖9-e和圖9-f)。

圖8 菌株C11不同組分對GAs的降解率Fig.8 Degradation rate of GAs by different compositions of strain C11
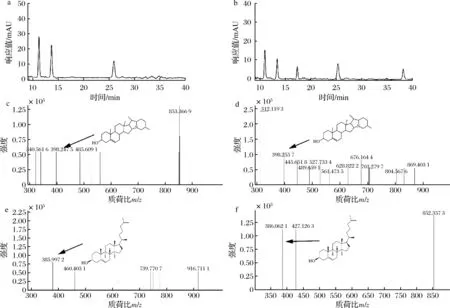
a-對照組α-茄堿和α-卡茄堿的液相色譜;b-菌株C11降解α-茄堿和α-卡茄堿的液相色譜; c、e-菌株C11降解α-茄堿代謝產物的質譜;d、f-菌株C11降解α-卡茄堿代謝產物的質譜圖9 菌株C11 降解GAs的代謝產物Fig.9 Metabolites of GAs by strain C11 degrading
3 結論與討論
本研究從發芽和綠化馬鈴薯塊莖中篩選得到GAs降解菌株C11,經鑒定為貝萊斯芽孢桿菌(Bacillusvelezensis)。菌株C11可以制備為菌劑,在馬鈴薯收獲后施用于其表面以期在貯藏期間降低GAs含量。菌株C11為芽孢桿菌,形成的孢子能夠在各種土壤和植物環境中定殖并且在環境中保持更長的時間,也是芽孢桿菌用于制備菌劑的優勢。由于這一特性,菌株C11能夠在馬鈴薯塊莖中長時間定殖,從而獲得更為持久的GAs降解能力。
對菌株C11進行體外安全性評價發現,雖然菌株C11對部分抗生素有抗性,但是不含有質粒,因此不存在耐藥因子轉移的風險。同時,菌株C11不具有溶血性,不產生有害代謝產物,綜上,可判定菌株C11具有一定的安全性。后續可通過動物試驗進一步評價菌株C11的安全性。貝萊斯芽孢桿菌是常見的生防菌,對多種病原菌均具有良好的抑制作用[19-20]。
菌株C11對GAs的最適降解條件為30 ℃、pH 6.0。菌株C11培養5 d即可對GAs的降解率達到90%以上。并且菌株C11具有良好的環境適應性,以及能夠耐受并降解高濃度的GAs。三糖側鏈的性質強烈影響GAs的毒性。菌株C11在細胞內可能通過脫糖基化去除三糖側鏈,生成茄啶,后者可能代謝為膽固醇,再被微生物代謝利用,從而達到解毒的效果。菌株C11將茄啶代謝為膽固醇過程中是否存在中間代謝產物還需進一步確定。這些結果表明菌株C11是一株具有較高潛力的GAs降解菌株。
本研究從發芽綠化馬鈴薯塊莖中分離篩選得到一株馬鈴薯GAs高效降解菌,經鑒定為貝萊斯芽孢桿菌C11,體外安全性試驗表明菌株C11具備一定的安全性。菌株C11具有良好的環境適應性和GAs耐受性,在較大的溫度和pH值范圍內以及在短時間內有效降解GAs。菌株C11可能在細胞內將GAs降解為膽固醇后進一步代謝利用。本研究為開發綠色安全的馬鈴薯GAs生物降解技術從而確保食品安全提供了科學依據和技術支持。