青稞蛋白降血糖肽的純化、結構鑒定及體外降血糖和抗氧化活性
陶 瑾, 張莉方, 徐寧莉, 朱雪洋, 張國強
(安徽工程大學生物與食品工程學院,蕪湖 241000)
青稞(HordeumvulgareL. var. nudum Hook. f.),屬禾本科大麥屬谷物,種植歷史悠久,是藏區居民主要食糧和重要農產品加工原料[1]。青稞主要分布于青藏高原裸大麥區,一年一熟制,具有耐寒性強、生育期短、適應性廣、產量穩定等優點[2,3]。青稞含有較高的蛋白質和不飽和脂肪酸,而且賴氨酸和色氨酸含量較其他谷物相比更高,“三高兩低” 即高蛋白、高膳食、高維生素和低糖、低脂的膳食結構被當代健康生活飲食所提倡[4]。研究表明,飲食中長期添加大麥粉可以對高脂血癥、糖尿病和動脈硬化起到一定的預防作用[5,6]。目前對于青稞中的β-葡聚糖[7]、酚類、黃酮類[8]和抑制性神經遞質γ-氨基丁酸[9]研究較多。青稞的價值隨著科技的發展在不斷被挖掘,其應用范圍也將擴大。然而,關于從青稞中提取具有降血糖活性肽的報道不多。
近年來,因為肽具有結構簡單、活性高、生物友好性等優點[10],食源性生物活性肽研究數量的顯著增加[11]。可以通過酶、化學和微生物水解的方法來制備生物活性肽,其中酶水解是最為有效和經濟的方法[12]。特定的蛋白酶有獨特的酶切位點,使蛋白質水解具有可預測性。由于肽結構的激素樣特性或作為拮抗受體抑制劑的作用,可以發揮它們的生物活性,并且其生物活性主要是受到特定氨基酸序列的影響[13,14]。天然活性肽較合成降血糖和抗氧化劑相比,具有安全、無毒害的優勢。多項研究已成功在動植物中分離和鑒定出具有降血糖活性的肽[15]。Shibu等[16]通過堿性蛋白酶水解馬鈴薯蛋白制備具有降血糖活性的馬鈴薯蛋白多肽(肽序列:DIKTNKPVIF),通過動物實驗驗證十肽可調節小鼠血糖、控制了血漿總甘油、總膽固醇、胰島素和糖化血紅蛋白水平,有益于改善胰島和肝、心、腎組織損害。Gu等[17]通過木瓜蛋白酶水解小米蛋白分離出具有降血糖活性的小米蛋白多肽(肽序列:AATHTGPLS、TTPHGGPPILT),分子對接表明,2種多肽均可通過氫鍵和π-π占據DPP-IV的活性中心。胡宇航等[18]等通過堿性蛋白酶水解玉米蛋白獲得具有α-糖苷酶抑制活性的玉米蛋白多肽(肽序列:APALLPF),通過細胞實驗驗證玉米蛋白多肽能抑制HepG2細胞(人體肝癌細胞)生物活性,促進細胞凋亡。
因此,植物蛋白擁有降血糖的潛力,綜合青稞具有的降血糖功效,研究以青稞蛋白(藏青2000)為原料,探究青稞蛋白水解物的降血糖和抗氧化活性。通過評估α-葡萄糖苷酶抑制力和水解度篩選蛋白酶,確定酶解最佳工藝條件。然后以α-葡萄糖苷酶抑制活性為指標通過超濾和Sephadex G-15對粗肽分級純化,測定其抗氧化、降血糖活性。純化后活性最高的組分通過多肽測序進行進一步分析。研究旨在深入了解青稞肽的降血糖和抗氧化能力,并為未來具有降血糖功能的食品或藥品開發提供參考。
1 材料與方法
1.1 材料與試劑
青稞蛋白:堿溶酸沉法制備;木瓜蛋白酶(2.0×105U/g)、菠蘿蛋白酶(3.0×105U/g)、胰蛋白酶(1.3×105U/g)、中性蛋白酶(1.0×105U/g)、酸性蛋白酶(7.0×105U/g)、堿性蛋白酶(2.0×105U/g)、ABTS、DPPH、α-葡萄糖苷酶、4-硝基苯基-α-D-呋喃葡萄糖苷(pNPG)、α-淀粉酶(枯草桿菌)、葡聚糖凝膠G-15、3,5-二硝基水楊酸、碳酸鈉、38%甲醛水溶液、酒石酸鉀鈉,試劑均為分析純。
1.2 儀器與設備
PHSJ-5雷磁pH計,LGJ-10真空冷凍干燥機,超濾離心管(3、10、30 ku),SPECTRAMAX M5酶標儀,HL-1S恒流泵,BSZ-100型自動收集器,UV- 5200紫外可見分光光度計,Thermo EASY nLC液相色譜儀、Thermo Orbitrap Fusion Lumos質譜儀。
1.3 方法
1.3.1 蛋白酶的篩選
選取胰蛋白酶、菠蘿蛋白酶、木瓜蛋白酶、堿性蛋白酶、中性蛋白酶、酸性蛋白酶,底物質量濃度取2 g/100 mL,加酶量取10 000 U/g,分別在各自最適酶解溫度、最適pH的條件下,酶解4 h[19],選定α-葡萄糖苷酶抑制活性為主要測定指標,選定水解度為輔助參考指標,考察各蛋白酶酶解物的降血糖活性,確定最適蛋白酶。水解度(degree of hydrolysis,DH)的測定采用甲醛滴定法[20]進行測定,DH計算中氮含量采用GB/T 5009.5—2016 《食品中蛋白質的測定》測定。
1.3.2 酶解條件的確定及優化
取青稞蛋白以超純水溶解,調節pH,加入選定最適蛋白酶,恒溫且不停攪拌一段時間,酶解過程中保持溶液pH恒定,酶解結束后,在100 ℃水浴15 min滅酶,4 000 r/min的條件下離心15 min,取上清液即為青稞粗肽。考察在底物質量濃度(1、2、3、4、5 g/100 mL),加酶量(6 000、8 000、10 000、12 000、14 000 U/g),酶解時間(1、2、3、4、5、6 h)和酶解溫度(30、40、50、60、70 ℃)條件下,以α-葡萄糖苷酶抑制活性為指標的降血糖活性。在此基礎上,通過Box-Behnken響應面實驗優化,選定自變量為底物濃度(A)、加酶量(B)、酶解時間(C),α-葡萄糖苷酶抑制率為相應值,響應面設計方案見表1。
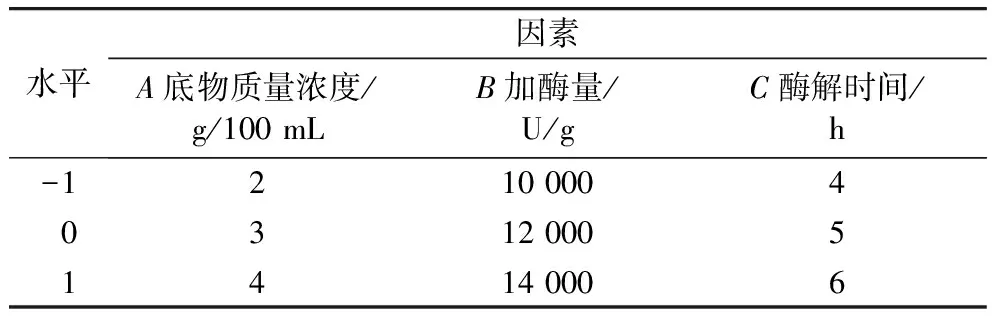
表1 Box-Behnken設計因素水平表
1.3.3 體外降血糖活性的測定
1.3.3.1 α-葡萄糖苷酶抑制活性測定
依次取20 μL樣品,50 μL PBS(0.2 mol/L,pH 6.8)和50 μL pNPG(1 mg/mL)溶液加入96孔酶標板, 37 ℃反應10 min,再加入50 μL α-葡萄糖苷酶,在37 ℃中反應30 min,最后添加80 μL Na2CO3(0.2 mol/L)終止反應,并在405 nm波長下測定吸光值[21]。

(1)
式中:A0為對照組吸光度;A1為樣品組吸光度;A2為背景組吸光度。
1.3.3.2 α-淀粉酶抑制活性測定
取50 μL樣品和50 μL α-淀粉酶加入5 mL離心管,37 ℃反應10 min,后加入150 μL 質量分數5%的淀粉溶液,37 ℃反應10 min,最后加入200 μL DNS試劑,沸水浴5 min終止反應,冷卻后稀釋至3 mL在540 nm處測定吸光度值[22]。計算同式(1)。
1.3.4 體外抗氧化活性的測定
1.3.4.1 ABTS+自由基清除率測定
ABTS+工作液的配制參考文獻[23]。在96孔酶標板中加入50 μL樣品和200 μL ABTS+溶液混勻靜置10 min,于734 nm處測定吸光值。計算同式(1)。
1.3.4.2 DPPH自由基清除率測定
取樣品1 mL和0.2 mmol/L DPPH 2 mL于比色管,混勻,室溫下避光反應30 min,在517 nm波長處測定吸光值[24]。計算同式(1)。
1.3.5 青稞降血糖肽的分離純化
1.3.5.1 超濾分級
將青稞粗肽酶解液依次通過30、10、3 ku的超濾離心管,離心條件為3 000 g,30 min。收集各截留液和過濾液可得4個組分分別為:>30 ku(E-1)、10~30 ku(E-2)、3~10 ku(E-3)和<3 ku(E-4)。冷凍干燥后測定4個組分的抗氧化、降血糖活性。
1.3.5.2 凝膠分離純化
選定Sephadex G-15凝膠分離青稞小分子質量粗肽。將經過預處理的Sephadex G-15凝膠裝入層析柱(2 cm×6 cm)中,樣品溶液(20 mg/mL)經0.22 μm 濾膜處理后,上樣量為1 mL,以超純水洗脫,流速為0.5 mL/min,檢測波長為214 nm,按出峰情況收集各個峰洗脫液并進行冷凍干燥[25],測定各個組分體外降血糖及抗氧化活性,將降血糖活性最強的組分進行結構鑒定。
1.3.6 降血糖肽結構鑒定
使用液質聯用LC-MS鑒定肽結構。首先將E-4用20 μL溶解液(體積分數0.1%甲酸、5%乙腈)溶解,充分振蕩渦旋,14 000 r/min,4 ℃離心20 min,上清液轉移到上樣管中,吸取8 μL液質聯用檢測。流動相A為0.1%甲酸(體積分數),流動相B為0.1%甲酸、80%ACN(體積分數)。梯度洗脫條件:0~7 min,VA∶VB=97∶3;7~46 min,VA∶VB=92∶8;46~51 min,VA∶VB=68∶32;51~56 min,VA∶VB=56∶54;56~60 min,VA∶VB=1∶99。質譜參數:分析時長60 min,一級質譜質核比掃描范圍50 ~1 550m/z,分辨率為12×104,自動增益控制(AGC)4e5,最大進樣時間50 ms;二級質譜分辨率 3×104,最大進樣時間100 ms,自動增益控制(AGC)1e5,分離窗口m/z,TopN: 20,NCE/stepped NCE: 32。采用PEAKS軟件進行數據庫檢索。
1.3.7 數據處理
實驗均重復3次,實驗數據均以平均值±標準偏差表示。采用Design Expert 11.0中的Box-Behnken設計優化酶解條件,Origin 2021和 SPSS 24.0統計數據和作圖;采用Duncan和ANOVA法進行差異顯著性檢驗和方差分析。
2 結果與分析
2.1 蛋白酶的篩選
由于不同蛋白酶的酶切位點及作用方式不同,對其生物活性大小也有影響[26]。由圖1可知,不同蛋白酶水解產物對水解度和α-葡萄糖苷酶抑制活性均有差異,其中胰蛋白酶水解產物的水解度(達24.25%)和α-葡萄糖苷酶抑制活性(達61.63%)最高,顯著高于其他蛋白酶(P<0.05)。其次為堿性蛋白酶,中性蛋白酶水解效果最差且α-葡萄糖苷酶抑制活性最低。研究表明,降血糖活性水解效果好的酶主要集中在胰蛋白酶和胃蛋白酶、堿性蛋白酶中[27]。馮俊[28]通過堿性蛋白酶水解茶籽粕蛋白,水解度最高的組分其α-葡萄糖苷酶抑制活性也是最佳的。實驗表明水解度與α-葡萄糖苷酶抑制活性有一定相關性,根據實驗結果選定胰蛋白酶進行后續實驗。

圖1 不同蛋白酶水解產物的α-葡萄糖苷酶抑制率和水解度
2.2 單因素實驗結果
由圖2可知,底物濃度對α-葡萄糖苷酶抑制活性的影響最大,底物質量濃度在3 g/100 mL達到最大,呈現先上升后下降的趨勢,說明增加一定的底物濃度有利于獲得較高α-葡萄糖苷酶抑制活性的肽。其次的影響因素為酶解時間,3 h后,酶作用于酶切位點,肽鏈長度縮短,氨基酸組成改變,從而使得抑制率明顯降低[29],隨著酶解時間到4 h后,α-葡萄糖苷酶抑制活性趨于穩定略有下降,可能的原因為蛋白被過度水解為短肽降低了α-葡萄糖苷酶抑制活性。底物濃度固定后,隨著加酶量的增加,酶解程度增加,α-葡萄糖苷酶抑制活性也相應增加,在添加量達10 000 U/g后趨勢變緩。當酶解達到飽和狀態時反應速率由底物質量分數決定,繼續增加酶量對水解度的影響不大[30]。酶解溫度在35 ℃時,α-葡萄糖苷酶抑制活性最高,整體隨酶解溫度的升高呈現先上升后下降的趨勢,在酶的最適溫度范圍附近,酶解效率越高,高溫會破壞蛋白酶的結構從而降低水解效率[31]。
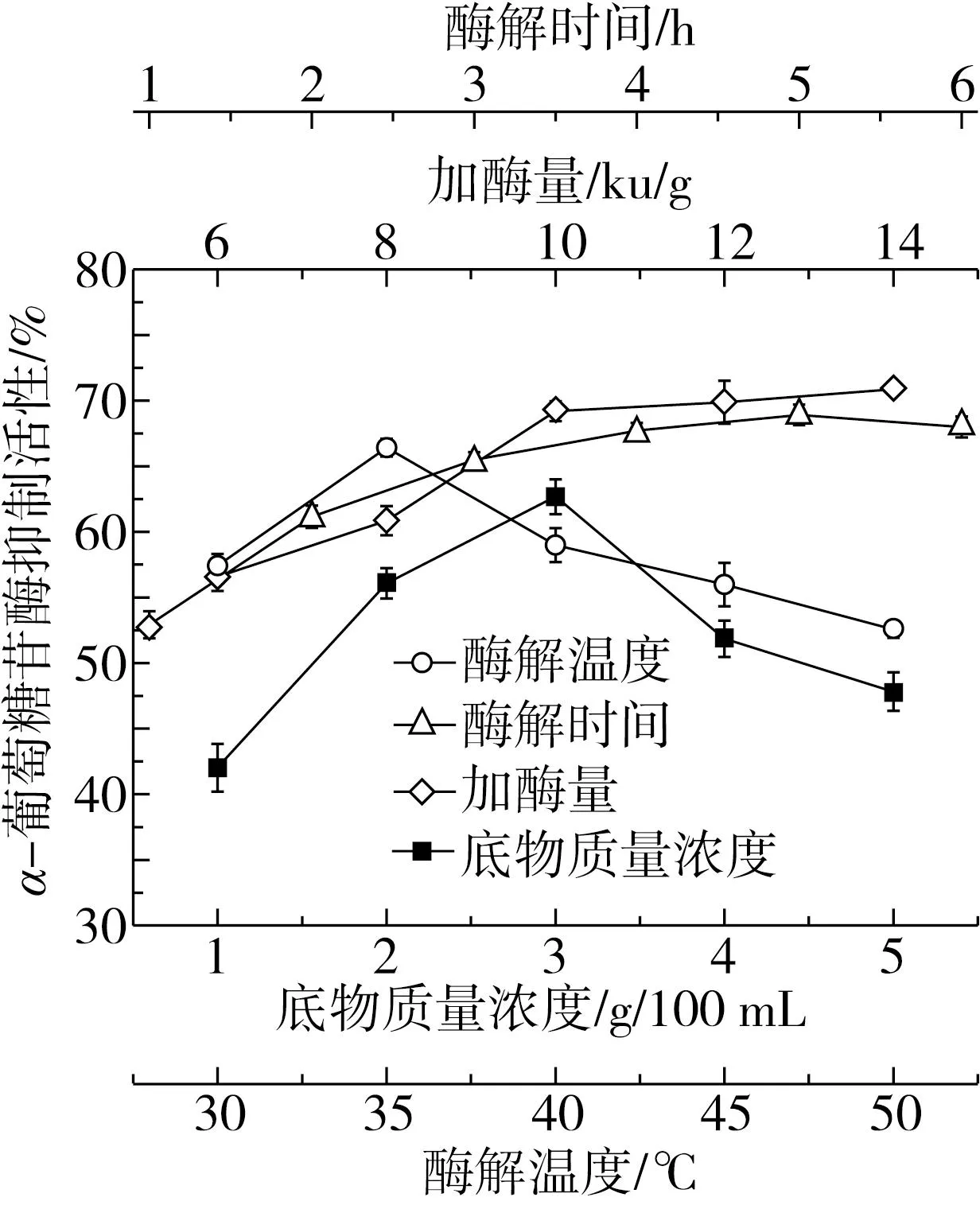
圖2 單因素對α-葡萄糖苷酶抑制活性的影響
2.3 響應面分析結果
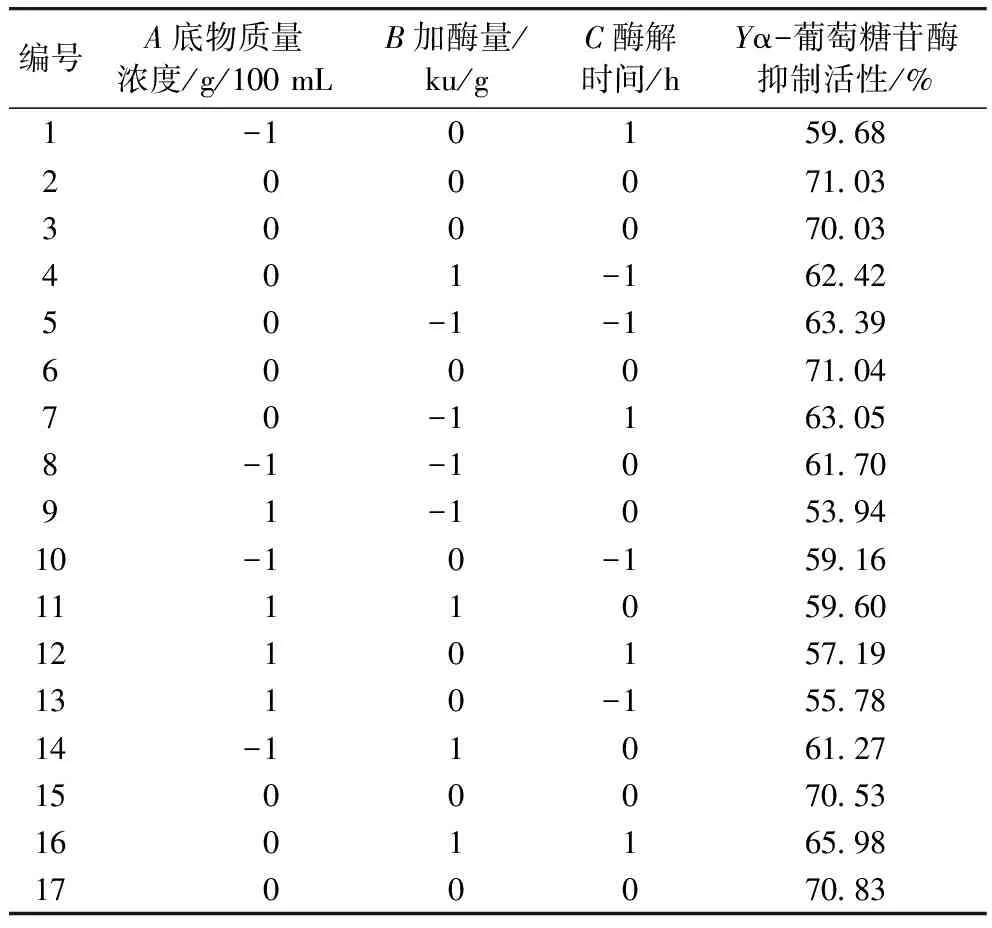
表2 響應面設計及結果
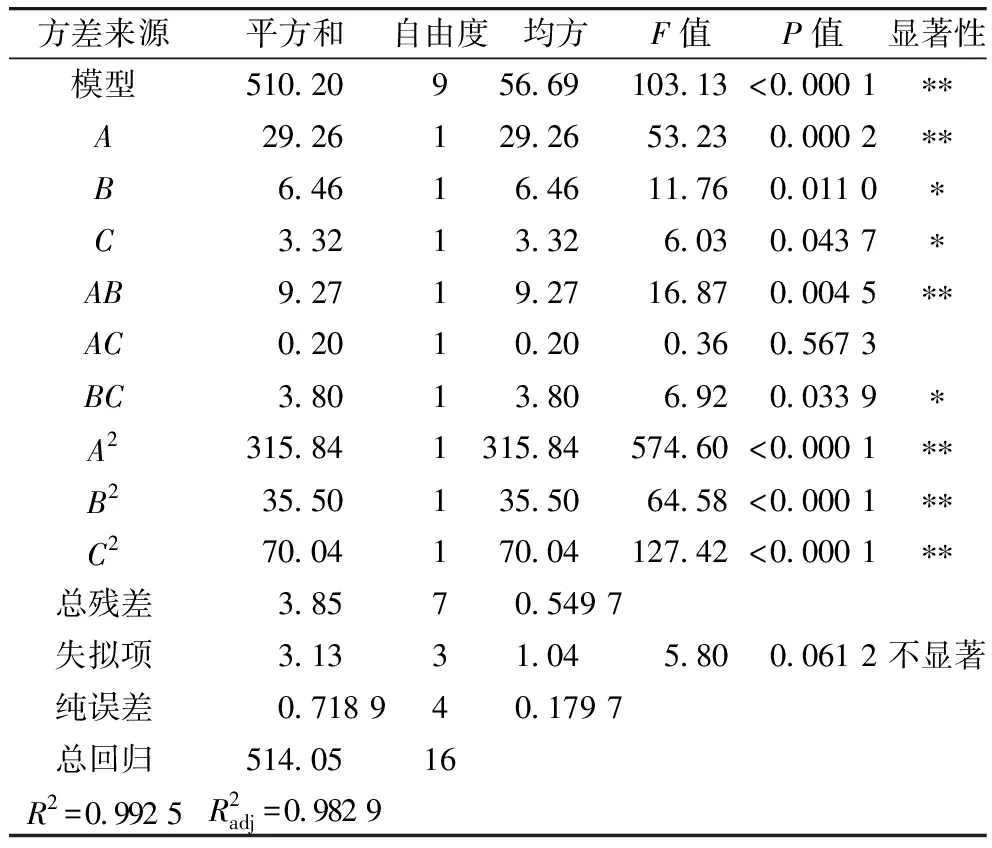
表3 方差分析結果
由表3可知,AB、BC兩兩因素具有交互作用(P<0.05),AC兩兩因素間差異不顯著(P>0.5)。軟件分析得出最佳酶解工藝參數為:底物質量濃度為2.903 g/100 mL、加酶量為12 291 U/g、酶解時間為5.093 h,此條件下,α-葡萄糖苷酶抑制活性為70.88%,根據實際實驗情況,將制備工藝參數修正為底物質量濃度為3 g/100 mL、加酶量為12 000 U/g、酶解時間為5 h,在此條件下做3次平行驗證實驗,α-葡萄糖苷酶抑制活性為70.96%,與模型預測值基本一致,實驗設計方案可行。
2.4 超濾分級
采用胰蛋白酶進行青稞蛋白水解,水解液依次通過裝有截留分子質量為 3、10、30 ku 的超濾離心管后,分離可得分子質量分別為>30、10~30、3~10、<3 ku的4種不同分子質量段的超濾組分并對其命名。超濾后的各組分均具有抗氧化和降血糖活性,4個組分降血糖及抗氧化能力見表4。分級后的水解產物有顯著差異(P<0.05)。降血糖活性中,E-4的α-淀粉酶和α-葡萄糖苷酶抑制活性顯著高于其他組分(P<0.05),為(1.790±0.066)、(15.21±0.096)mg/mL;抗氧化活性中,E-4對ABTS和DPPH自由基的能力也顯著高于其他組(P<0.05),達(5.120±0.082)、(8.070±0.057)mg/mL。此結果與趙婉宏等[32]得到超濾后最小的組分具有最好的降血糖活性和抗氧化活性,對α-葡萄糖苷酶抑制率最高,對DPPH、羥自由基清除能力和還原力也遠高于其他超濾組分的結果一致。張一帆等[33]對楊梅蛋白水解液超濾得到具有良好的抗氧化和α-葡糖糖苷酶抑制活性的最佳分子質量段為<5 ku。蘆鑫等[34]研究表明,芝麻蛋白水解物顯示出較強的抗氧化活性的組分也為低分子質量組。這些肽具有較強生物活性可能歸因于其低分子質量,因此選定分子質量<3 ku的E-4組分為下一步分離對象。
2.5 凝膠分離


圖3 Sephadex G-15分離圖譜
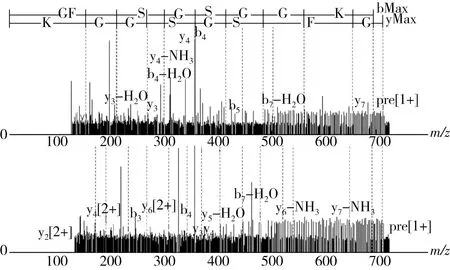
圖4 青稞蛋白多肽的二級質譜圖
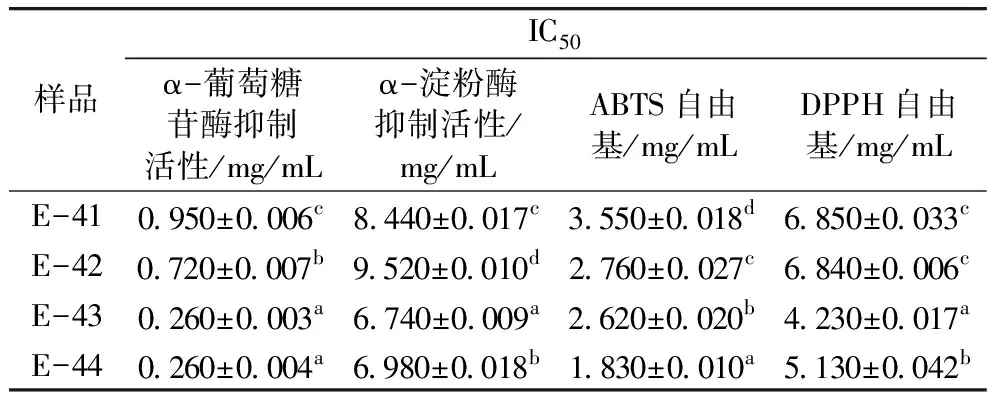
表5 凝膠分離組分的降血糖及抗氧化活性
2.6 質譜鑒定
通過LC-MS/MS測定和對比數據庫檢索,可得2條八肽,氨基酸序列為GFSGSGGK,即甘氨酸(Gly)-苯丙氨酸(Phe)-絲氨酸(Ser)-甘氨酸(Gly)-絲氨酸(Ser)-甘氨酸(Gly)-甘氨酸(Gly)-賴氨酸(Lys),分子質量分別為695.32 u,荷質比m/z為348.67;氨基酸序列為GVGAGAAR即甘氨酸(Gly)-纈氨酸(Val)-甘氨酸(Gly)-丙氨酸(Ala)-甘氨酸(Gly)-丙氨酸(Ala)-丙氨酸(Ala)-精氨酸(Arg),分子質量分別為657.36 u,荷質比m/z為329.68。2條肽鏈均由親水、疏水和堿性氨基酸組成,其N端為親水氨基酸且C端為堿性氨基酸。Famuwagun等[36]研究發現對堿性蛋白酶水解茄子葉蛋白中α-淀粉酶抑制活性最好的肽段氨基酸序列含有堿性、疏水堿性氨基酸結構。Li等[37]以胃蛋白酶和胰蛋白酶水解小球藻中分離出具有DPP-IV抑制活性的多肽結構末端氨基酸為堿性氨基酸。Fernando等[38]以枯草桿菌蛋白酶-胰蛋白酶-風味酶三酶復合水解沙丁魚毛囊蛋白分離出2條六肽氨基酸,其序列N端為親水氨基酸,C端為堿性氨基酸。因此,推測青稞蛋白多肽的降血糖活性可能與氨基酸序列的組成有關。
3 結論
研究篩選出胰蛋白酶為最適蛋白酶水解青稞蛋白,確定青稞蛋白水解最佳工藝條件為底物質量濃度為3 g/100 mL、加酶量為12 000 U/g、酶解時間為5 h。將酶解后的粗肽通過超濾和Sephadex G-15柱分離純化得到具有較高生物活性的目標蛋白肽。最佳組分E-43的α-葡萄糖苷酶和α-淀粉酶抑制活性抑制能力、ABTS和DPPH自由基清除能力的IC50分別為0.26、6.74、2.62、4.23 mg/mL。質譜測得活性肽氨基酸序列為:Gly-Phe-Ser-Gly-Ser-Gly-Gly-Lys、Gly-Val-Gly-Ala-Gly-Ala-Ala-Arg,荷質比m/z為348.67、329.68,分子質量為695.32、657.36 u。2條八肽的氨基酸序列N端均為親水氨基酸,C端均為堿性氨基酸。通過將氨基酸序列與現有研究中具有降血糖活性的氨基酸序列比較推斷其較強的降血糖能力可能與氨基酸組成有關。證明了青稞蛋白肽具有潛在藥理價值。

