理氣補血湯對失神經脛骨骨折愈合的影響*
陳一仁 張燕 劉俊寧 牛素生 杜夢凡 陳燦 胡斌涵 黃茂暢趙宇
隨著工業和交通等行業的發展,骨折伴周圍神經損傷的發生率明顯增加。周圍神經對于維持骨骼內穩態和骨折愈合至關重要[1-2],骨折端失神經支配后,因神經肽類物質缺少,導致成骨細胞活性降低,破骨細胞活性增加,肌肉萎縮等情況,骨折將發生延遲愈合甚至不愈合[3-4],成為臨床治療的難點。雖然目前臨床神經損傷修復技術取得了長足進步,但由于神經再生速度緩慢,約為1 mm/d[5],使得即使做了神經修復,骨折端仍有很長時間處于無神經支配狀態,使骨折愈合受到嚴重影響[6],因此改善此段時間內骨折端骨痂質量,對提高失神經骨折的臨床治療效果具有非常重要的意義。
理氣補血湯是福建省名中醫王和鳴教授整理的南少林骨傷經驗方,具有理氣活血、益氣補血、補肝腎、強筋骨之效,臨床主要用于治療骨折延遲愈合[7]。有研究發現理氣補血湯可顯著延緩失神經骨骼萎縮[8-9]。本研究采用切斷SD 大鼠右側坐骨神經加右側脛骨骨折克氏針內固定的方法建立失神經骨折模型,探討理氣補血湯對坐骨神經損傷后脛骨骨折愈合的影響,為臨床治療伴周圍神經損傷的骨折提供實驗依據。
1 材料與方法
1.1 實驗材料與藥物制備
1.1.1 實驗動物 2022 年8 月—2023 年8 月選擇SPF 級3 月齡雄性SD 大鼠27 只,體重160~180 g,由北京華阜康生物科技股份公司提供,合格證號:SCXK(京)2019-008。按隨機數字表法分為A、B、C 三組,每組9 只。A 組:單純脛骨骨折內固定+生理鹽水,B 組:坐骨神經切斷+骨折內固定+生理鹽水,C 組:坐骨神經切斷+骨折內固定+理氣補血湯。實驗動物處理方法經福建中醫藥大學動物倫理委員會審核通過,倫理號:2022134。
1.1.2 主要儀器與試劑 中藥旋蒸儀(上海亞榮生化儀器廠,RE2000 mA)、石蠟包埋機(湖北錦源醫療科技有限公司,JY-BMC)、病理切片機(美國Thermo 公司,HM-325)、生物顯微鏡(德國徠卡微系統有限公司,DM2700P)、小動物X 光機(美國KUBTEC 公司,XRAY-Imaging)、烏拉坦(上海源葉生物科技有限公司,MFCD00007966)、伊紅染色液(北京索萊寶科技有限公司,G1080)、蘇木素染色液(北京索萊寶科技有限公司,G1100)、馬松三色染色試劑盒(北京索萊寶科技有限公司,G1340)、大鼠Ⅰ型膠原C 端肽(CTX-Ⅰ)酶聯免疫吸附試驗(ELISA)試劑盒(武漢華美,CSB-E12776r)、大鼠Ⅰ型前膠原N 端前肽(PⅠNP)ELISA 試劑盒(武漢華美,CSB-E12774r)、大鼠骨堿性磷酸酶(BALP)ELISA 試劑盒(武漢華美,CSBE11865r)、大鼠抗酒石酸酸性磷酸酶-5b(TRACP-5b)ELISA 試劑盒(武漢華美,CSB-E08491r)
1.1.3 藥物制備 理氣補血湯(黃芪、太子參、制首烏、當歸、白芍、續斷、骨碎補各9 g,川芎6 g,炙甘草3 g),由福建中醫藥大學耗材平臺提供,按常規方法煎煮,旋轉蒸發儀將其濃縮為2 g/mL 理氣補血湯水煎液,置4 ℃冰箱保存備用。
1.2 方法
1.2.1 模型制備 大鼠適應性飼養1 周后,使用烏拉坦腹腔注射麻醉大鼠。
A 組造模方法:麻醉成功后大鼠取仰臥位,剃除右膝及小腿毛發,消毒,鋪無菌洞巾。稍屈曲膝關節,脛骨內側平臺緊貼髕韌帶,以20 mL 注射器針頭開口,沿脛骨長軸方向將直徑0.8 mm 的克氏針穿入脛骨骨髓腔,于脛骨內側中上1/3 處縱向切口約1 cm,暴露脛骨。將插入骨髓腔的克氏針緩慢退出約2/3,用直徑為2 cm 的電動鋸片(厚度為0.1 mm)沿脛骨上1/3 處垂直縱軸切割(5 000 r/min,切割時為防止骨骼灼傷,用生理鹽水不停滴切割處),當脛骨橫斷2/3 時,組織鉗掰斷脛骨剩余處,然后將克氏針經過骨折處,重新插入骨髓腔內。確認斷端位置良好后,牢固固定。生理鹽水沖洗傷口,縫合肌肉和皮膚。
B 組、C 組造模方法:麻醉后剃除右臀區、股后區及脛骨處毛發,先取俯臥位,消毒,鋪無菌巾,取股后外側切口,依次切開皮膚和筋膜,自臀淺肌與股二頭肌之間的肌間隙分離,暴露坐骨神經,于股骨中上1/3 交界處切除1 cm 坐骨神經,將坐骨神經近端其反折縫于肌肉處,逐層縫合傷口。大鼠改仰臥位,進行脛骨骨折克氏針內固定,具體操作方法同A 組
1.2.2 干預方法 A 組、B 組予以0.9%生理鹽水10 mL/(kg·d)灌胃,C 組予以理氣補血湯灌胃。灌胃劑量根據“人和動物體表面積折算的等效劑量比率表”換算。術后第1 天予以灌胃,根據動物體重,每周調整灌胃劑量。
1.3 觀察指標及評價標準
1.3.1 X 線檢查 干預28 d 后麻醉大鼠,取俯臥位,右下肢髖、膝關節屈曲90°,腳尖沖外,拍攝右側脛骨側位片,由2 名讀片經驗豐富的觀察者按照Lane-Sandhu 評分標準[10]進行評分。Lane-Sandhu評分標準見表1。
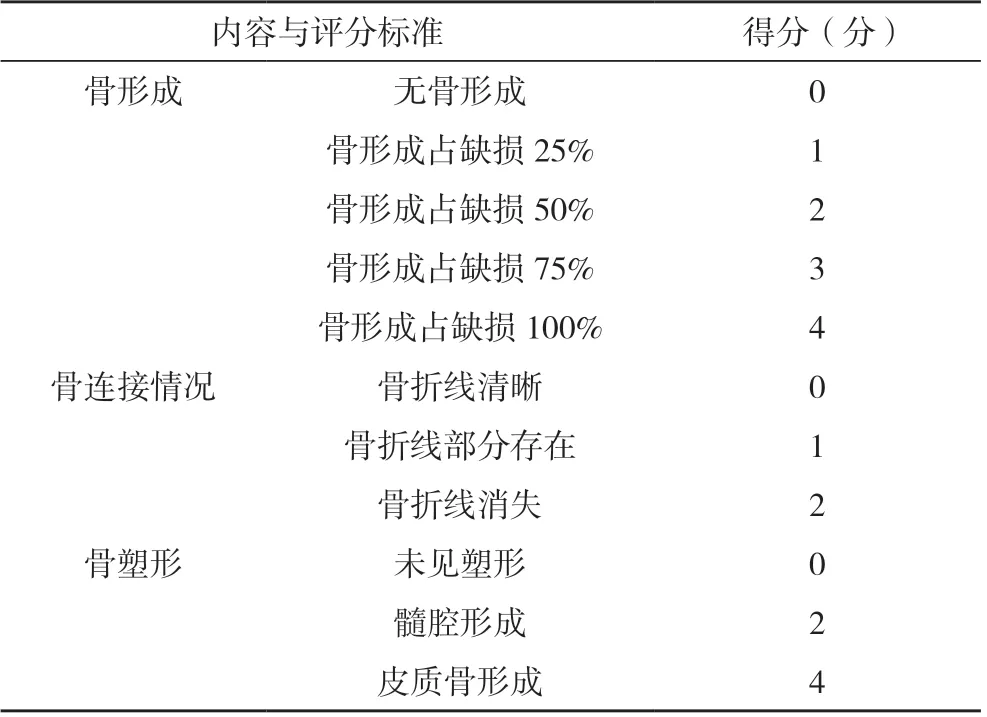
表1 Lane-Sandhu X線評分標準
1.3.2 ELISA 檢測 拍攝X 線片后,采用腹主動脈取血方式取動脈血,室溫下靜置2 h,離心機以3 000 r/min,離心15 min 后,抽取上清液,-80 ℃保存,ELISA 檢測血清BALP、PⅠNP、CTX-Ⅰ、TRACP-5b。1.3.3 蘇木素伊紅(HE)及馬松染色 取血后,離斷右膝及右踝關節,剝離脛骨周圍附著的肌肉,保留骨膜和骨痂完整,取出克氏針,多聚甲醛固定48 h,10%乙二胺四乙酸(EDTA)溶液脫鈣,脫鈣后保留骨折線上下5 mm,HE 染色觀察骨折端骨痂生成情況;馬松染色觀察膠原分布排列情況。
1.4 統計學處理
實驗數據采用SPSS 25.0 統計軟件進行分析處理,所有計量資料用(±s)表示,組間比較采用單因素方差分析,樣本均數間的兩兩比較采用LSD-t 檢驗,以P<0.05 為差異有統計學意義。
2 結果
2.1 三組X 線檢查結果
干預28 d 后,脛骨側位片顯示骨折線均位于右脛骨中上1/3 左右處,骨折對線、對位良好,均獲得解剖復位。A 組骨折處骨痂基本大部分已吸收,骨折線模糊,骨痂基本塑形完畢,見圖1A;B 組骨折處骨折線部分模糊,骨痂呈梭形膨大,有連續性骨痂通過骨折線,骨痂重塑未完成,見圖1B;C 組骨折處骨折線模糊,少量骨痂存留,見圖1C。Lane-Sandhu 評分結果:A 組為(8.33±0.88)分,B 組為(5.00±0.76)分,C 組為(8.17±0.73)分,B 組明顯低于A 組、C 組,差異均有統計學意義(P<0.05),C 組評分雖較A 組低,但兩組比較差異無統計學意義(P>0.05)。
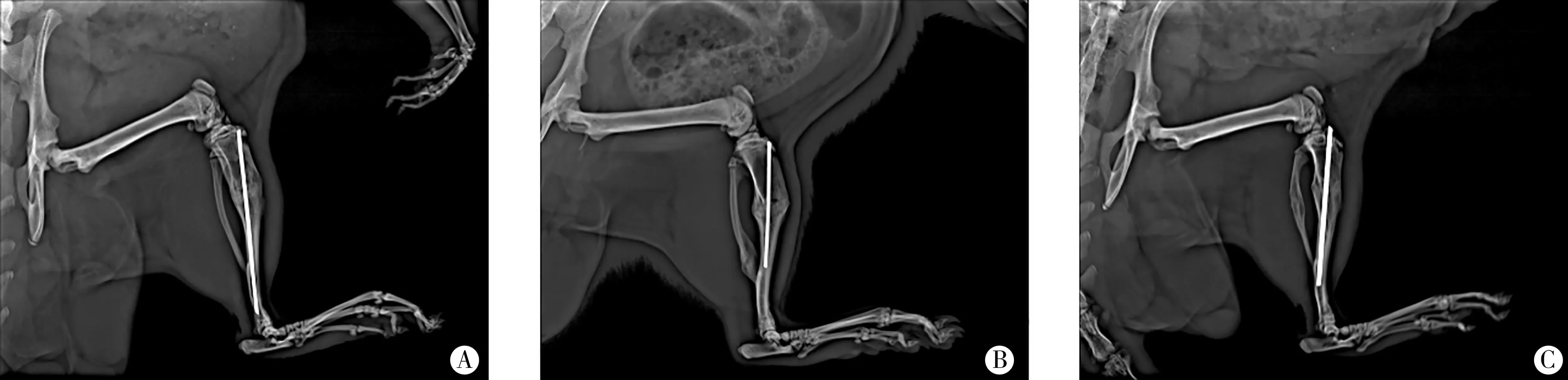
圖1 三組大鼠脛骨側位X線檢查結果
2.2 三組HE 染色結果
干預28 d 后,A 組骨痂成熟明顯高于B 組、C 組,C 組較B 組成熟度好。A 組骨痂HE 染色可見軟骨細胞數量較少,已轉化為編織骨,骨髓腔部分貫通,呈有序排列,骨小梁體積較大,沿應力方向排列,見圖2A;B 組中可觀察到大量軟骨細胞,骨化重建不夠,骨小梁排列紊亂,可見骨吸收產生的較大空腔,見圖2B;C 組仍可見少量軟骨細胞,大部分已轉化為編織骨,骨髓腔部分貫通,見圖2C。
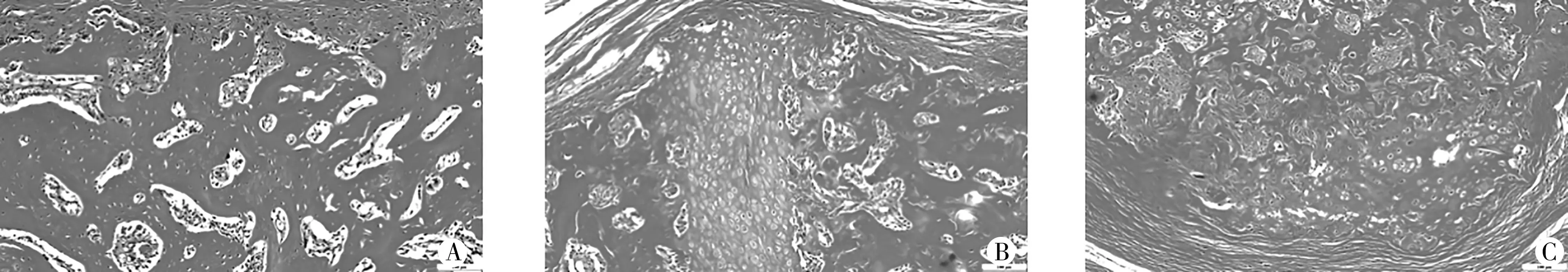
圖2 三組大鼠脛骨骨痂HE染色結果(100×)
2.3 三組馬松染色結果
干預28 d 后,馬松染色A 組可觀察到大量鈣化骨痂,鈣化骨痂與周圍骨骼相融,膠原纖維基本已被吸收,少量膠原纖維散在分布于鈣化骨痂周圍,見圖3A;B 組可見骨痂外部有大量軟骨細胞,膠原纖維部分被吸收,分布于軟骨細胞周圍,見圖3B;C 組觀察到軟骨細胞數量較B 組數量少,膠原纖維未被完成吸收,骨痂外部的骨痂基本已經鈣化,見圖3C。
圖3 三組大鼠脛骨骨痂Masson染色圖結果(100×)
2.4 三組ELISA 檢測結果
干預28 d 后A 組血清中BALP、PⅠNP 均高于B 組、C 組,C 組BALP、PⅠNP 均高于B 組;A 組CTX-Ⅰ、TRACP-5b 均低于B 組、C 組, 而C 組CTX-Ⅰ、TRACP-5b 均低于B 組,差異均有統計學意義(P<0.05)。見表2。
表2 三組ELISA檢測結果(±s)

表2 三組ELISA檢測結果(±s)
*與A 組比較,P<0.05;#與B 組比較,P<0.05。
組別BALP(U/L)PⅠNP(pg/mL)CTX-Ⅰ(pg/mL)TRACP-5b(mIU/mL)A 組(n=9)45.70±0.94487.97±10.0152.85±1.613.18±0.61 B 組(n=9) 29.92±0.29* 343.00±14.03* 73.56±0.93* 5.39±0.13*C 組(n=9) 36.67±0.22*# 418.32±22.64*# 63.62±3.61*# 4.62±0.11*#F 值183.7819.4819.53113.72 P 值0.000.000.000.00
3 討論
周圍神經對于維持骨骼內穩態和骨折愈合至關重要[11],其通過分泌神經肽類物質如降鈣素基因相關肽(CGRP)、神經肽(SP)、血管活性肽(VIP)等,調控成骨細胞活性、破骨細胞數量,影響骨骼穩態和骨折愈合[12];通過調節肌容量及肌肉收縮對骨折端產生力學刺激等[13-14],促進骨折愈合。當骨折端失神經支配后,在愈合過程中因神經肽類物質缺少,成骨細胞活性下降,破骨細胞活性增加,肌肉萎縮缺乏力學刺激等因素,導致骨折延遲愈合甚至不愈合。
夏群等[15]證實,失神經支配脛骨破骨細胞指數及破骨細胞吸收表面遠大于正常神經支配組,在形成大量骨痂的同時,骨吸收較多,骨痂排列雜亂。馬昕等[16]發現周圍神經切斷后股骨骨折大鼠術后4 周X 線顯示其骨痂較單純股骨干骨折組多,組織學顯示周圍神經切斷組骨痂量雖然多,但其中類骨質較多,骨鈣的沉積相對較少,而且骨痂缺乏血管和正常的骨小梁結構,骨重建不夠理想。
針對失神經骨折的治療,需要考慮神經修復和骨折修復兩個方面。雖然隨著顯微外科技術的進步,神經損傷修復技術包括神經吻合術、自體神經移植、神經移植物等多種方法能較好地恢復受損神經的連續性[17-19],但由于神經的再生速度緩慢,骨折端仍有很長時間處于無神經支配狀態,嚴重影響了骨折愈合質量。因此改善此段時間內骨折端骨痂質量,延緩肌肉萎縮,為神經的再支配爭取寶貴的治療時間,這將對提高失神經骨折的臨床治療效果具有非常重要的意義。
理氣補血湯由黃芪、太子參、當歸、白芍、制首烏、川芎、續斷、骨碎補、炙甘草組成,具有理氣活血、益氣補血、補肝腎、強筋骨之效。在張安楨等[7]研究中以理氣補血湯治療骨折延遲愈合43 例,43 例全部獲得臨床愈合,除3 例股骨頸骨折畸形愈合,其余功能恢復均較滿意。前期實驗研究中發現理氣補血湯能顯著減緩肌動蛋白、肌球蛋白表達的下降[8],顯著抑制失神經支配骨骼肌膠原纖維的形成[20-21],從而延緩了肌肉萎縮,還能促進周圍神經損傷的修復[22]。在此基礎上,本研究進一步觀察了理氣補血湯對坐骨神經損傷后脛骨骨折愈合的影響。
本研究通過橫斷大鼠脛骨,克氏針內固定骨折斷端形成了大鼠脛骨骨折模型。克氏針不能完全控制骨折端的旋轉移位,因此該骨折模型的愈合屬于二期愈合,更符合臨床常見骨折愈合過程。實驗結果顯示干預28 d 后,坐骨神經切斷加脛骨骨折組(B 組)的骨折線部分模糊,骨痂呈梭形膨大,而坐骨神經完整僅脛骨骨折組(A 組)的骨痂塑形基本完畢,其結果與丁云等[23]研究結果一致,說明坐骨神經損傷明顯影響了骨折愈合過程。理氣補血湯干預后的C 組,雖還有少量骨痂存留,但骨折線基本模糊,Lane-Sandhu 評分明顯高于B 組,與A 組評分無明顯差異;HE 染色、馬松染色顯示理氣補血湯干預后可使坐骨神經損傷后的脛骨骨折處的軟骨向骨痂轉化、骨痂成熟度得到提升,說明理氣補血湯可明顯改善坐骨神經損傷后的脛骨骨折愈合質量。
PⅠNP 反映成骨細胞合成骨膠原的能力,用于監測成骨細胞活力,可作為預測骨折愈合的影響因子之一[24];BALP 由成骨細胞分泌,是反映成骨細胞活性的標志物,在礦化過程中可水解無機磷酸鹽,有益于類骨質的礦化,類骨質在成骨細胞的作用下礦化形成骨質,則骨痂進一步成熟,力學強度提升[25-26];TRACP-5b 主要來源于破骨細胞,參與降解骨基質中鈣磷礦化物,是破骨細胞活性和骨吸收狀態的臨床標志物[27];CTX-Ⅰ也是反映骨吸收的標志,主要反映Ⅰ型膠原的降解,Ⅰ型膠原是類骨質的主要物質基礎[28],其占比對骨折的修復和力學強度影響較大。
本研究結果顯示單純脛骨骨折的A 組BALP和PⅠNP 均明顯高于合并坐骨神經損傷的B 組(P<0.05),主要與周圍神經損傷后CGRP 和SP 分泌下降,成骨作用減弱有關[29-30]。而理氣補血湯干預后的C 組血清中BALP 和PⅠNP 含量均明顯高于B 組(P<0.05),說明理氣補血湯干預后骨折端的成骨反應增強。同時坐骨神經損傷后B 組的CTX-Ⅰ和TRACP-5b 的表達均明顯高于無坐骨神經損傷單純脛骨骨折的A 組(P<0.05),印證了失神經后破骨細胞活性增加,骨吸收增多,這與張貴春[31]的結論一致,而理氣補血湯干預的C 組其CTX-Ⅰ和TRACP-5b 的含量均明顯低于B 組(P<0.05),說明理氣補血湯干預后骨痂質量的改善與抑制破骨細胞活性和骨質過度吸收有關。
綜上所述,理氣補血湯可改善坐骨神經損傷后脛骨骨折愈合質量,其機制可能與調控破骨和成骨過程,促進骨痂成熟,調節骨痂重塑有關,但其具體作用機制及其對骨痂力學性能的影響,需進一步研究明確。

