方解石晶體電子結構及(104)面表面特性第一性原理計算
謝瑞琦 王 勛 趙志輝 周武昌
(1.礦冶科技集團有限公司礦物加工科學與技術國家重點實驗室,北京 100160;2.昆明理工大學國土資源工程學院,云南 昆明 650093)
方解石是一種碳酸鹽礦物,是最常見的天然碳酸鈣,分布極廣,常與鎢礦、螢石、菱鎂礦、錫石等礦物共伴生,是常見的脈石礦物之一。由于與方解石共伴生的目的礦物通常含有Ca、Mg等與方解石表面活性位點活性相近的位點或Sn等較易形成螯合作用的位點,導致方解石與目的礦物分離困難[1-4]。
為了更有效地將方解石與目的礦物分離,研發高選擇性的浮選藥劑具有重要意義,而浮選藥劑的選擇性與礦物表面特性息息相關。第一性原理計算為研究者從微觀角度探明礦物晶體表面特性提供了良好的渠道。目前關于方解石結構的第一性原理計算研究主要分為以下幾類,第一類是研究方解石與水分子間的作用,如王杰等[5]利用第一性原理研究了方解石的晶體結構及其與水分子及水分子簇的吸附作用,研究結果表明方解石在與水反應時O的活性最強,其Ca和O位點與單個水分子形成吸附,水分子簇與方解石作用時,水分子間及水分子與方解石表面均存在氫鍵作用。第二類是研究某一浮選藥劑與方解石間的作用,如張多陽等[6]計算了菱鎂礦、白云石和方解石的能帶、態密度及與常見捕收劑、抑制劑作用,為礦物浮選分離藥劑的選擇提供了參考。張英等[7]計算了白鎢礦、螢石和方解石的電子結構及聚丙烯酸鈉與礦物作用的吸附能。第三類是研究金屬摻雜對方解石的影響,如陳鴻[8]研究了鐵、鎂、鋁等元素對方解石和白云石晶體結構和表面性質的影響,結果表明,鎂、鋁、鐵在常溫下不易在方解石中通過晶格取代形成雜質缺陷,鐵雜質會降低水分子在方解石表面的吸附。
以上研究闡明了方解石部分表面特性及其與常見藥劑的作用,但未對方解石體相的特性及切表面后的變化、表面電荷差分密度及與常見極性基的作用進行系統研究。本文利用Materials Studio軟件計算分析了方解石晶體體相和方解石(104)面的布居、能帶及總態密度和分態密度,并計算分析了方解石(104)面的弛豫、電荷差分密度以及與常見極性基的前線軌道能級差。通過從微觀角度分析方解石的表面特性,本文揭示了方解石體相晶體特征、方解石(104)面表面活性位點的電子特性及其與藥劑極性基間的作用,可為研發高選擇性方解石浮選藥劑提供參考。
1 模擬與計算方法
1.1 方解石晶體結構及優化
方解石的晶體結構原始數據來源于American Mineralogist Crystal Structure Database[9]。采用Materials Studio中的CASTEP模塊對方解石結構進行優化。優化過程中,參考文獻[10-11],交換相關泛函為GGA-PBE、k點取樣密度為4×4×2、截斷能設置為500 eV。贗勢采用OTFG超軟贗勢。自洽迭代過程中的收斂標準為:能量最大變化不超過2×10-5eV,原子最大位移不超過0.000 2 nm,原子間內應力不超過0.1 GPa,SFC收斂標準為1×10-6eV。最終優化得到的方解石晶胞參數為a=b=0.499 0 nm,c=1.706 1 nm,α=β=90.00°,γ=120.00°,與文獻[5]中的計算結果及實驗值均接近,說明構建的晶體結構合理,具有代表性。
1.2 表面模型建立
方解石(104)面為方解石常見解理面,因此選擇方解石(104)面作為研究對象。在盡可能縮短計算時間且能維持穩定的表面性能及盡量避免上下兩底面間的干擾的情況下,構建了切割厚度為3,真空層厚度為2.0 nm的方解石(104)表面slab模型。優化后的方解石晶胞及優化后的方解石(104)表面如圖1所示。

圖1 優化后的方解石晶胞和優化后的方解石(104)面Fig.1 The optimized calcite cell and optimized calcite (104) surface
2 計算結果與討論
2.1 方解石晶體分析
2.1.1 布居分析
布居為原子核外電子的分布排列位置,方解石的原子Mulliken布居結果如表1所示。

表1 方解石原子Mulliken布居Table 1 The atom Mulliken population of calcite
從表1可以看出:方解石同種元素化學環境一致,說明方解石結構對稱性較強。方解石中荷正電的原子為C和Ca,其中C所帶電荷為0.79 e,其價電子構型為C 2s0.842p2.37,s軌道失去了1.16個單位的電子,p軌道得到了0.37個單位的電子,主要是3 s軌道失去電子;Ca所帶電荷為1.40 e,其價電子構型為Ca 3p64s2.11,s軌道得到了0.11個單位的電子。方解石中荷負電的原子為O,其所帶電荷為-0.73 e,其價電子構型為O 2s1.802p4.93,s軌道失去了0.20個單位的電子,p軌道得到0.93個單位的電子,主要是p軌道得到電子。
礦物Mulliken鍵布居可反映化學鍵的性質,其值越接近0,表明鍵的離子性越強,而其值越接近1,表明鍵的共價性越強[12]。方解石的Mulliken鍵布居值如表2所示。
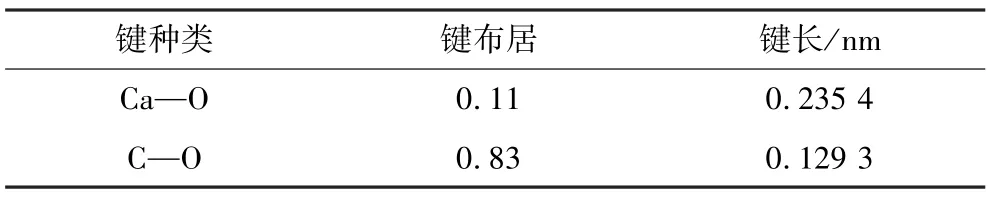
表2 方解石Mulliken鍵布居Table 2 The bond Mulliken population of calcite
由表2可知,方解石中的Ca-O和C-O布居值僅有1種,說明方解石對稱性較強,結構簡單[13]。Ca-O鍵的布居值為0.11,說明其具有一定的離子性,C-O鍵的布居值為0.83,說明其具有較強的共價性,Ca-O的鍵長遠大于C-O的鍵長。破碎磨礦時,Ca-O鍵最易斷裂,因此,Ca為方解石表面的陽離子活性位點,O為方解石表面的陰離子活性位點。
2.1.2 能帶和態密度分析
方解石的能帶間隙寬度為5.101 eV,因此為絕緣體[12]。圖2所示是方解石總態密度圖和各原子的分態密度圖。方解石的總態密度主要分為4部分;第1部分為-39~-36 eV之間,這部分完全由Ca的s軌道組成;第2部分為-24~-15 eV之間,這部分Ca、O、C均有貢獻,其中,C主要由s軌道貢獻低能部分,p軌道和少量s軌道貢獻高能部分;O主要由s軌道貢獻,p軌道貢獻較小;Ca主要由p軌道和極少量d軌道貢獻;第3部分為-9~0 eV之間,該部分主要由O和C及少量的Ca參與構成。其中,C的s軌道和p軌道主要組成-9~-3 eV的低能部分;O的s軌道組成低能部分,p軌道在整個能量范圍內都有較大的貢獻,特別是在費米能級附近,因此O是方解石中最活躍的原子[14]。此外,Ca在費米能級附近也有少量的貢獻,說明Ca也有一定的活性;第4部分為3~18 eV之間,所有原子都有軌道參與貢獻。
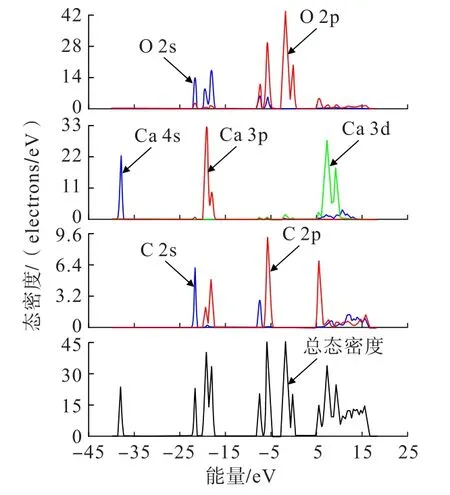
圖2 方解石總態密度圖和各原子分態密度圖Fig.2 The total and partial density of state of calcite
2.2 方解石(104)表面特性
2.2.1 方解石(104)面的結構弛豫
方解石晶體中原子呈周期性分布,但切表面后,表面原子將不再呈現出周期性分布,表面原子的受力也將發生改變,為了使系統平衡,表面原子會通過弛豫而發生重構現象[15]。方解石(104)面表面原子優化前后的分數坐標變化值如表3所示。

表3 方解石(104)面表面原子優化前后的分數坐標變化值Table 3 The change of fractional coordinate value of atoms on calcite (104) surface before and after the optimization
由表3可知,方解石的表面原子在優化以后,均產生了一定弛豫現象。Ca原子在Z軸方向的弛豫最為明顯,C在3個方向的弛豫相對較小,碳酸根的3個O原子在3個方向表現出了不同的弛豫程度。
2.2.2 方解石(104)面的布居分析
方解石(104)面表面原子之間的相對位移以及配位數相較于體相發生了變化,原子外層電子和鍵長都隨之發生變化。表4為方解石(104)面表面原子的Mulliken布居分布,可以看出相較于方解石體相結構,方解石(104)面表面原子的外層電子都發生了一定程度的變化。C的價電子構型變為C 2s0.832p2.36,s軌道相較于體相多失去了0.01個單位的電子,p軌道相較于體相少得到了0.01個單位的電子,總電子數減少為3.18,電荷變為0.82 e。O的價電子構型變為2種,分別為O 2s1.802p4.91和O 2s1.812p4.96,相較于體相,其s軌道分別少失去了0個單位的電子和0.01個單位的電子,p軌道分別多失去了0.02個單位的電子和少失去了0.03個單位的電子,所帶電荷分別為-0.72 e和-0.77 e。Ca的價電子構型變為Ca 3p64s2.10,與體相變化不大,s軌道相較于體相少得到了0.01個單位的電子,p軌道無變化。雖然Ca僅具有一種價電子構型,但表面存在具有2種電子總數的Ca,電子總數分別為8.56和8.55,電荷分別為1.44 e和1.45 e。

表4 方解石(104)面表面原子的Mulliken布居Table 4 The atom Mulliken population of calcite (104) surface
表5為方解石(104)面表面電子的鍵布居。由表5可知,方解石表面的Ca-O鍵和C-O鍵的布居值和鍵長較體相發生了明顯改變,其對稱性變差。C-O鍵的布居值由體相的0.83變為0.89和0.78。Ca-O鍵的布居由體相的1種鍵布居值0.11變為3種鍵布居值0.14、0.11和0.10。此外,當Ca-O布居值為0.11時,其鍵長較體相的0.235 4 nm變長,鍵強變弱。

表5 方解石(104)面表面原子的Mulliken鍵布居Table 5 The bond Mulliken population of calcite (104) surface
2.2.3 方解石(104)面的態密度分析
圖3為方解石(104)面表面原子的總態密度圖和各原子的分態密度圖。與體相類似,方解石(104)面的總態密度也分為4部分,且能量范圍基本一致,但態密度發生了變化。第1部分為-39~-36 eV之間,這部分完全由Ca的s軌道組成;第2部分為-24~-15 eV之間,這部分Ca、O、C均有貢獻,其中,Ca主要由p軌道,C主要是s軌道貢獻,O的s軌道和p軌道均有較大貢獻;第3部分為-9~0 eV之間,這部分主要由C和O的s軌道和p軌道構成,少量Ca參與貢獻,第4部分為3~18 eV之間,所有原子都有軌道參與貢獻。與體相一致,費米能級附近主要由O的p軌道和少量Ca的d軌道構成,因此,O為方解石(104)面最活躍的原子,其次是Ca原子。
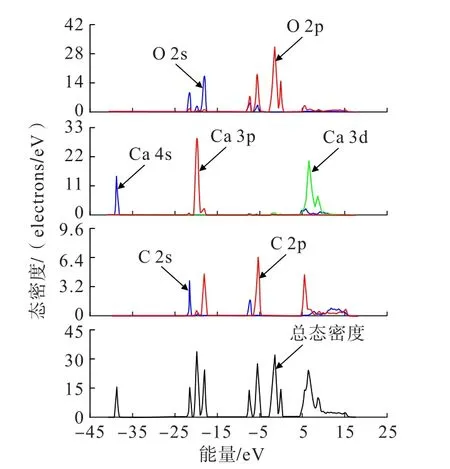
圖3 方解石(104)面表面各原子總態密度圖和分態密度圖Fig.3 The total and partial density of state of calcite (104) surface
2.2.4 方解石(104)面的差分電荷密度圖
方解石(104)面表面原子的差分電荷密度如圖4所示,深色區域表明電荷密度高,淺色區域表明電荷密度低。Ca-O鍵電荷密度較C-O鍵電荷密度低,說明Ca-O鍵的鍵能較C-O鍵低,這與布居分析結果一致。此外,方解石(104)面中O為多電子位點,C和Ca為缺電子位點,缺電子位點和多電子位點交替出現,得失電子程度不同,各原子表現出不同的化學活性。

圖4 方解石(104)面表面差分電荷密度Fig.4 The electron density difference of calcite (104) surface
2.2.5 方解石(104)面前線軌道能級差
物質發生化學反應時,物質HOMO中的電子分別流向對方的LUMO,只有物質A(或B)的HOMO與物質B(或A)的LUMO的能量比較接近,對稱性也互相匹配時,才容易發生電子轉移,當物質A的HOMO與物質B的LUMO能級差和物質B的HOMO與物質A的LUMO能級差不一致時,電子轉移以能級差絕對值低的流向為主。由于陽離子捕收劑主要以靜電吸附和氫鍵作用與礦物表面作用,而陰離子捕收劑主要以鍵合吸附為主,因此,本部分主要計算常見陰離子捕收劑的極性基與方解石間的HOMO和LUMO的最低能級差絕對值|ΔE|min來預測化學相互作用的難易程度。|ΔE|min越小,說明電子轉移越容易發生,即反應越容易發生[16-18]。表6所示是極性基團與方解石(110)面的前線軌道能級差。

表6 陰離子基團與方解石(104)面表面的前線軌道能量Table 6 The frontier molecular orbital energy of anionic group and calcite (104) surfaces eV
由表6可知,-COOH、-CONHOH、-OSO3H等基團[19-21]與方解石(104)面間的能級差絕對值相對較小,說明方解石(104)面易與陰離子捕收劑作用,其中,-OSO-3最易與方解石(104)面作用。方解石(104)面表面荷正電的活性位點為Ca,其易與含-COOH、-CONHOH、-OSO3H等官能團的陰離子捕收劑作用,其中,含-OSO-3基團的藥劑可能最易與方解石(104)面作用。
3 結 論
(1)方解石晶體中,荷正電的原子為Ca和C,荷負電的原子為O。方解石同種元素化學環境一致,說明方解石結構對稱性較強,結構簡單。Ca-O鍵具有較強的離子性,C-O鍵具有較強的共價性,因此,Ca-O鍵最易斷裂,Ca為方解石表面的陽離子活性位點,O為陰離子活性位點。
(2)方解石的能帶間隙寬度為5.101 eV,為絕緣體。其能帶主要分為4個部分,O和Ca在費米能級附近的態密度均有貢獻,因此O和Ca是方解石中的活性原子,其中O的p軌道在費米能級附近的態密度貢獻最大,因此O是方解石中最活躍的原子。
(3)方解石(104)面表面原子價電子構型、布居、鍵長、態密度等較體相均發生了變化,但費米能級附近主要還是由O的p軌道和少量Ca的d軌道構成。差分電荷密度圖表明方解石(104)面Ca-O鍵電荷密度較C-O鍵電荷密度低,說明Ca-O鍵的鍵能較C-O鍵低,不同種類原子表現出不同的電子得失情況。
(4)極性基團與方解石(110)面的前線軌道能級差表明:方解石(104)面易與含-COOH、-CONHOH、-OSO3H等官能團的陰離子捕收劑作用,其中,含-OSO-3基團的藥劑可能最易與方解石(104)面作用。

