地奧心血康基于腸道菌群改善阿霉素致心臟毒性的作用研究
袁楚橋,王濤,鄒文俊
以阿霉素(Doxorubicin,DOX)為代表的蒽環類藥物產生的心臟毒性已成為威脅腫瘤患者生存的嚴峻問題。當前有高達60%的癌癥患者接受蒽環類藥物治療[1],隨著化療周期的增加,患者出現藥物劑量依賴性的不可逆心肌損傷,最終導致充血性心力衰竭(congestive heart failure, CHF)[2],其病機與氧化應激、炎癥、線粒體損傷、鈣離子超載等多種損傷因素有關[3]。臨床通過對DOX進行化學結構修飾,或與右丙亞胺(Dexrazoxane),β受體阻滯劑、輔酶Q10、維生素D等藥物聯用以治療阿霉素致心臟毒性[4-5],但右丙亞胺存在明顯的骨髓抑制作用,其余心臟保護劑亦缺乏高級別循證醫學證據確證其療效。因此,尋找療效穩定,副作用小的藥物是目前臨床面臨的一個緊迫問題。
近年研究表明,心臟與腸道存在密切關聯,心肌受損后供血能力下降,可能導致腸粘膜毛細血管通透性增加,造成腸道內環境改變,腸道菌群及其代謝產物紊亂[6],菌群變化產生的內毒素通過腸粘膜進入體循環,引發全身炎癥反應,加深心臟損傷[7],形成心肌損傷與腸道損傷的“惡性循環”。而化療藥物DOX不僅特異性蓄積于心臟組織,且其通過糞便排泄,可破壞腸道黏膜蛋白的物理屏障引起腸道損傷[8-10]。因此,調控腸道菌群可能成為干預DOX心臟毒性的一個新思路。
地奧心血康(Di'aoxinxuekang, DKKX)是1 9 8 9 年獲批的原二類中藥,收載于2 0 2 0版《中國藥典》,由薯蕷科植物穿龍薯蕷(DioscoreanipponicaMaκino)根莖提取物組成,它具有多種生物功能和藥理活性,如抗炎,擴張冠脈血管,改善心肌缺血等。DXXK含有豐富的皂苷類成分,具有顯著的心臟保護作用[11],同時已有研究表明DXXK的原料藥物穿龍薯蕷可以調節腸道菌群,調控大腸桿菌、白色葡萄球菌等菌株的活性[12],且薯蕷皂苷元作為DXXK的主要有效成分,可以提高大鼠腸道中乳酸菌轉化率,維持腸道內環境穩態[13]。綜上所述,DXXK作為可通過調控腸道菌群以終止心腸互損的惡性循環。本研究旨在通過DOX致大鼠心肌損傷模型,以腸道菌群為切入點,探究DXXK對DOX心臟毒性的改善作用。
1 材料和方法
1.1 材料和儀器
地奧心血康膠囊購自成都地奧集團(成都,中國),批號190801。注射用多柔比星(批號:2112E3)購自深圳萬樂藥業有限公司(深圳,中國)。肌酸激酶同工酶(CK-MB)、乳酸脫氫酶(LDH)(批號:142622001)的血清生化試劑盒購自深圳邁瑞生物醫療電子有限公司(深圳,中國);心肌肌鈣蛋白(cTnT)、腦鈉肽(BNP)、腫瘤壞死因子-α(TNF-α)、白介素-1β(IL-1β)、白介素-6(IL-6)等酶聯免疫吸附測定試劑盒購自武漢伊萊瑞特有限公司。
RM6240BD型多道生理信號采集處理系統(成都儀器廠)、AE224型分析天平(上海舜宇恒平科學儀器有限公司)、RM2235型石蠟切片機(德國Leica公司)、DM1000徠卡顯微成像系統、TGL-16高速冷凍離心機(湘儀離心機儀器有限公司)、V4800高通量組織研磨儀(北京鼎昊源科技有限公司)、多功能酶標儀。
1.2 實驗動物
8周齡雄性Sprague Dawley大鼠體質量220~240 g,購自北京華阜康生物科技股份有限公司(北京,中國,No.SCXK (京) 2019-0008)。所有動物在特定的條件下飼養,溫度(20±5℃),相對濕度(55%±5%),交替光照(12 h光照/12 h黑暗周期),自由飲食飲水。所有操作均按中國《實驗動物愛護和使用指導原則》進行。
1.3 實驗設計
實驗前,所有動物均適應性喂養1周。大鼠隨機分為6組(n=6):對照組、DOX組、Dexrazoxane陽性組、DXXK低、中、高組。其中對照組每周腹腔注射生理鹽水,其余每周腹腔注射阿霉素(生理鹽水配制)1次,按照2.5 mg·kg-1, 1 mL/100g劑量給藥,連續6周,總劑量 15 mg·kg-1;同時,DXXK組大鼠分別按50 mg·kg-1、100 mg·kg-1、200 mg·kg-1劑量每天灌胃,對照組及模型組給予等量蒸餾水,連續6周。末次灌胃結束后,禁食禁水12 h,以腹部按摩法收集大鼠糞便,放入凍存管中液氮速凍,放入-80℃冰箱中保存備用。用異氟烷麻醉,采集每只大鼠的腹主動脈血并收集心臟及結腸內容物。
1.4 蘇木精-伊紅染色
將心臟組織用4%多聚甲醛固定,石蠟包埋。切割石蠟切片(5 μm厚),并將其安裝在玻璃片上進行蘇木精-伊紅(HE)染色。組織學圖像用光學顯微鏡(奧林巴斯,東京,日本)以×400倍的倍率拍攝。
1.5 SD大鼠心功能檢測
在大鼠末次灌胃給藥后放入小動物麻醉機,使用異氟烷麻醉大鼠。將其仰面固定在實驗臺上,使用生物信號采集系統采集大鼠的心電圖信號,將正負電級分別插入大鼠右上肢和左下肢,將底線插入大鼠的右下肢,記錄各組大鼠15 min的Ⅱ導聯的心電圖,記錄其P波、T波、R波、Q波、S波、ST波幅度和大鼠的心率情況。
1.6 心肌酶和炎癥因子檢測
取大鼠心臟組織,稱重后按照說明書加入生理鹽水,加入高通量組織研磨儀制備勻漿,按相應試劑盒說明書要求,測定肌酸激酶同工酶MB(CK-MB)、乳酸脫氫酶(LDH)、心肌肌鈣蛋白(cTnT)、腦鈉肽(BNP)、腫瘤壞死因子α(TNF-α)、白介素1β(IL-1β)、白介素6(IL-6)水平。
1.7 16S rRNA擴增序列測定
處死動物前,取糞便放入無菌EP管中,保存于-80°C中進行16S rRNA分析。獲得的最終序列用于操作分類單位(OTUS)分析。根據最大樣本量分析結果,采用樣本序列隨機抽樣的方法,計算了基于豐度的蓋度估計器和CHAO1等代表物種豐富度的alpha多樣性指數和以PCoA分析代表的β多樣性指數。
1.8 統計分析
本研究數據通過 SPSS 23.0 軟件進行處理,數據以均值±標準差(SD)表示,若數據滿足正態分布且方差齊,則兩組比較采用t檢驗,多組比較采用單因素方差分析;若其不滿足,則采用秩和檢驗。若P<0.05,則表示數據差異具有統計學意義。
2 結果
2.1 地奧心血康對阿霉素致心臟損傷大鼠心臟功能及形態的影響
與對照組相比,模型組P波及Q波幅度顯著降低(P<0.01),R波、T波、S波、ST波幅度明顯升高(P<0.01),提示模型組大鼠存在心肌缺血及心電電位異常,如圖1(A-F);心肌組織出現纖維變性及壞死,且出現心肌纖維溶解或斷裂,部分區域心肌纖維胞質內含空泡,如圖2 B;與模型組相比,陽性藥組和DXXK高劑量組的 P波及Q波幅度顯著升高(P<0.01),R波、T波、S波、ST波幅度顯著降低(P<0.01);心臟組織結構完整,未見明顯增生或炎性浸潤,心肌纖維形態正常如圖2 C、F;而DXXK低劑量組P波、Q波、R波、S波、ST波幅度均存在升高趨勢,但差異不具有統計學意義;DXXK中劑量組P波、R波幅度存在升高趨勢,S波存在降低趨勢,但均無統計學意義;T波、Q波、ST波幅度顯著升高(P<0.05),如圖1 (A-F)。DXXK低、中劑量組的能顯著改善心肌組織炎性細胞浸潤及纖維結締組織增生,但改善效果弱于高劑量組,如圖2D、E。
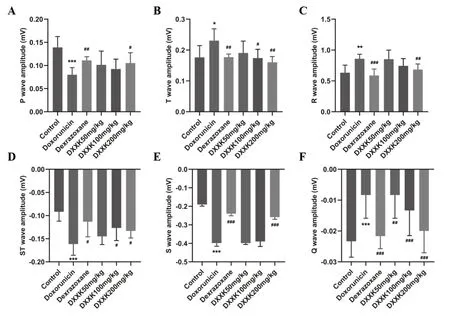
圖1 心血康對阿霉素致心肌損傷大鼠心電圖的影響(A-F)心電圖P波幅度、T波幅度、R波幅度、ST波幅度、S波幅度、Q波幅度。
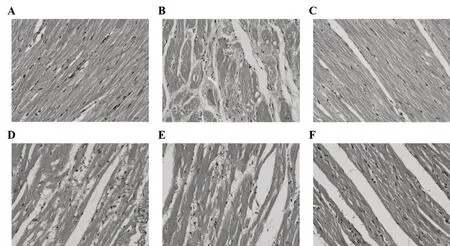
圖2 心血康對阿霉素致心肌損傷大鼠心肌病理變化的影響(A-F)分別為對照組、模型組、陽性組、心血康低、中高、劑量組心臟組織病理情況。
2.2 地奧心血康對阿霉素致心臟損傷大鼠心肌酶及炎癥因子水平的影響
與對照組大鼠相比,模型組C K-M B、LDH、BNP、cTnT水平升高,差異具有顯著性(P<0.01);與模型組相比,陽性藥組、DXXK中、高劑量組的CK-MB、LDH、BNP、cTnT水平顯著降低(P<0.01);心血康低劑量組CK-MB、LDH、cTnT水平具有降低趨勢,但差異沒有統計學意義,BNP水平顯著降低(P<0.01),如圖3。炎癥與心肌損傷密切相關,本實驗檢測了大鼠心臟組織的炎癥因子水平,。與對照組相比,模型組IL-1β、IL-6、TNF-α等炎癥因子水平顯著上升(P<0.01);與模型組相比,陽性藥組、DXXK低、中、高劑量組的炎癥因子水平均有不同程度降低,差異均具有統計學意義(P<0.05),如圖4。
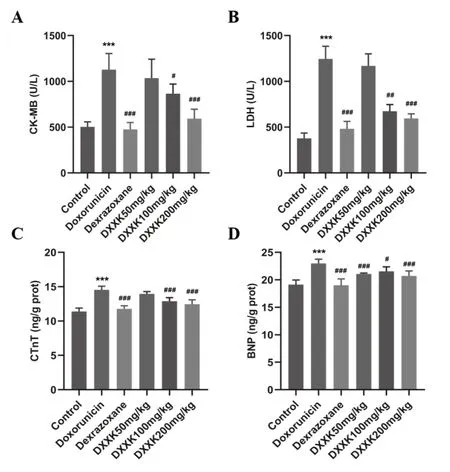
圖3 心血康對阿霉素致心肌損傷大鼠心肌酶水平的影響A:CK-MB;B:LDH;C:cTnT;D:BNP水平。
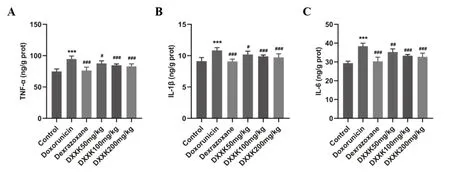
圖4 心血康對阿霉素致心肌損傷大鼠炎癥因子水平的影響A:TNF-α;B:IL-1β;C:IL-6水平。
2.3 地奧心血康對阿霉素致心臟損傷大鼠腸道菌群多樣性的影響
根據前兩部分的結果,選取對照組、模型組、DXXK高劑量組進行后續研究。通過雙端測序發現,18個樣本共獲得個OTUs,對照組、模型組、DXXK組OTU數目分別是2178、1480、1676,共有OTUs57個,如圖5 A。
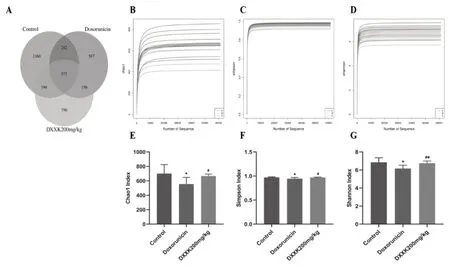
圖5 心血康對阿霉素致心肌損傷大鼠腸道菌群Alpha多樣性的影響A:樣本組間OTUs韋恩圖;B:Chao1指數稀釋曲線;C:Simpson指數稀釋曲線;D:Shannon指數稀釋曲線;E:Chao1指數分析;F:Simpson指數分析;G:Shannon指數分析
Alpha多樣性檢測結果表明,隨著測序量增加,曲線趨近平滑,僅增加少量新物種,說明測序數據量已經合理。Chao1指數可以估計群落中包含的物種數目;Shannon指數通過信息熵計算,Shannon指數越大,群落的不確定性越高,則該群落中未知因素越多,即多樣性高;Simpson指數的數值范圍在0-1之間,當群落中物種數僅為1時, Simpson值為0,直觀理解為多樣性最小;當物種種類趨近無限多,且各物種數目一致時,該群落的物種豐富度最高,均勻度最高,Simpson值為1。本研究中,各組樣本的 Chao、Shannon、Simpson 等指數見圖5 B-D。與對照組相比,模型組Chao1 指數、Shannon指數及Simpson指數顯著降低(P<0.05);與模型組相比,DXXK組的Chao1 指數、Shannon指數及Simpson指數顯著升高(P<0.05),如圖5E-G。
本研究基于unweighted unifrac 距離算法,采用主坐標分析法(Principal Coordinates Analysis,PCoA),評估大鼠腸道菌群 β 多樣性,見圖6。結果表明,橫坐標PC1 為 17.46%,PC2 為 17.07%,;由PC1軸距離可見,3組組間差異明顯,模型組點群與對照組偏差較大,而心血康組與對照組距離較近,說明二者菌群結構相似度較高。
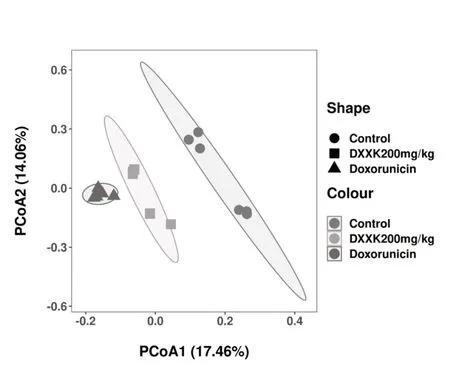
圖6 心血康對阿霉素致心肌損傷大鼠腸道菌群Beta多樣性的影響
2.4 地奧心血康對阿霉素致心臟損傷大鼠腸道菌群組成的影響
根據物種豐度表和物種注釋表,本研究選取豐度TOP30物種分類,如圖7A。在門水平上,3組的優勢菌群均為厚壁菌門(Firmicutes)、擬桿菌門(Bacteroidota),變形菌門(Proteobacteria)、疣微菌門(Verrucomicrobia)。與對照組相比,模型組厚壁菌門、變形菌門占比上升,疣微菌門占比下降;與模型組相比,心血康組厚壁菌門、變形菌門和疣微菌門占比下降,擬桿菌門占比上升,如表1。在屬水平上,對照組的優勢菌屬為:未知的Muribaculaceae菌屬(Muribaculaceae_unclassified)、乳酸菌屬(Ligilactobacillus)、乳桿菌屬(Lactobacillus)、HT002菌屬(HT002)、艾克曼菌屬(Akkermansia);模型組的優勢菌屬為:未知的Muribaculaceae菌屬、乳桿菌屬、乳酸菌屬、埃希氏桿菌屬(Escherichia-Shigella)、HT002菌屬;心血康組的優勢菌屬為:未知的Muribaculaceae菌屬、乳桿菌屬、普雷沃氏菌屬(Prevotella)、乳酸菌屬和HT002菌屬,如圖7B。在3組的共有優勢菌屬中,與對照組相比,模型組未知的Muribaculaceae菌屬、乳酸菌屬的占比降低,乳桿菌屬和HT002菌屬占比升高;與模型組相比,心血康組乳桿菌屬、乳酸菌屬、HT002菌屬占比降低,未知的Muribaculaceae菌屬的占比上升,如表2。
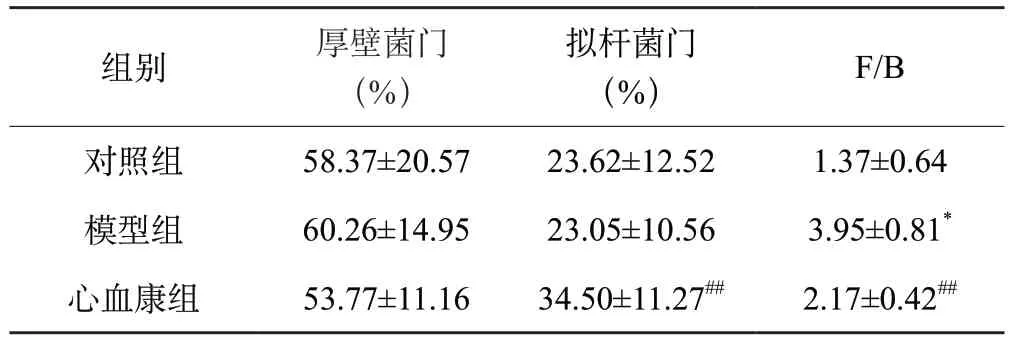
表1 樣本組間腸道菌群厚壁菌門、擬桿菌門相對豐度及比值
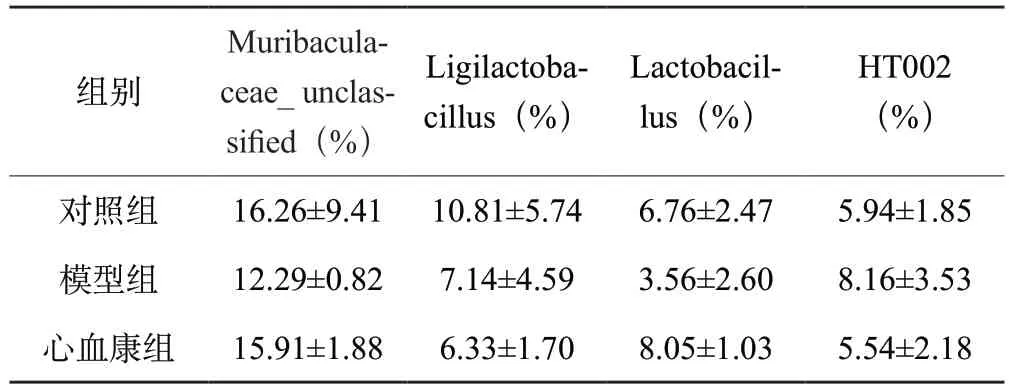
表2 樣本組間腸道菌群共有優勢菌屬相對豐度
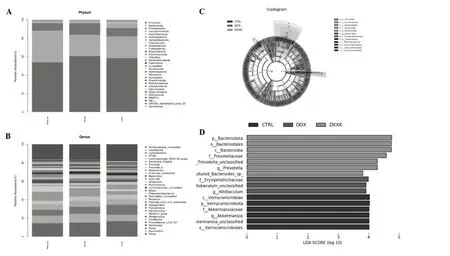
圖7 心血康對阿霉素致心肌損傷大鼠腸道菌群物種豐度及組成的影響A:樣本組間門水平物種豐度堆疊圖;B:樣本組間屬水平物種豐度堆疊圖;C:樣本組間差異分析進化分支圖;D:樣本組間差異分析分布柱狀圖
本研究采用LEfSe(LDA Effect Size)分析3組組間在豐度上有顯著性差異的物種,設置LDA閾值為4,篩選結果如圖7C、D。對照組的差異物種主要為擬桿菌門(p_Bacteroidota)、擬桿菌綱(c_Bacteroidia)、擬桿菌目(o_Bacteroidales)、普雷沃氏菌科(f_Prevotellaceae)、普雷沃氏菌屬(_Prevotella_unclassified;g_Prevotella)、類桿菌屬(_Bacteroides_sp_);模型組的差異物種主要為丹毒絲菌科(f_Erysipelotrichaceae)、異桿菌屬(Allobaculum_unclassified;g_Allobaculum);心血康組的差異物種主要包括疣微菌門(p_Verrucomicrobiota)、疣微菌綱(c_Verrucomicrobiae)、疣微菌目(o_Verrucomicrobiales)、艾克曼菌屬(f_Akkermansiaceae;
g_Akkermansia; Akkermansia_unclassified)
3 討論
中醫理論認為“心與小腸相表里”,心氣可以推動血液順暢運行,促進腸道泌別清濁的功能。同時“小腸主津”,可吸收水谷精微之津液以供心化血,兼養百脈[14]。而腸道菌群作為維持腸道穩態的重要角色,被稱為“微生物器官”,是心腸聯系的重要橋梁,而腸道菌群失調則可能通過介導炎癥反應、氧化應激誘發多種心臟疾病[15],前期研究表明,心血康可以通過調控氧化應激保護心肌損傷[16],因此本研究基于16S rRNA測序技術探究地奧心血康通過調控腸道菌群抑制阿霉素心臟毒性的作用。
本研究結果表明,阿霉素在造成嚴重的心臟損傷的同時,還減少腸道細菌OTUs數目,抑制大鼠腸道菌群豐度及多樣性,并導致菌群結構異常偏移。而心血康不僅可以顯著恢復心肌細胞膜電位,改善心肌纖維化和炎性浸潤,降低心臟炎癥及心肌酶水平,還能夠調整心肌損傷大鼠的菌群豐度及多樣性,并恢復異常偏移的菌群結構,使其貼近正常水平。
有研究表明,腸道中的優勢菌群厚壁菌門和擬桿菌門的比值(Firmicutes/Bacteroidota,F/B)可以體現腸道內穩態水平,F/B異常升高往往與炎癥反應或肥胖相關[17]。通過物種堆疊圖分析,本實驗3組大鼠的腸道菌群結構均存在差異,與對照組相比,模型組厚壁菌門相對豐度升高,擬桿菌門相對豐度降低,F/B 值增大,說明阿霉素誘導大鼠腸道內環境紊亂。給藥后,DXXK組厚壁菌門相對豐度降低,擬桿菌門相對豐度升高,F/B 值減小,說明地奧心血康可以改善阿霉素誘導的菌群紊亂。在屬水平上,3組大鼠的腸道菌群存在結構差異,心肌損傷大鼠志賀菌屬、乳桿菌屬及HT002菌屬相對豐度較對照組明顯上升,給藥后豐度回調,說明心血康可能通過調控上述菌屬的數量以恢復菌群穩態。另外,與對照組及模型組比較,心血康組中普雷沃菌屬豐度顯著升高,該菌屬作為腸道重要的基石菌屬,其代謝產物短鏈脂肪酸(SCFAs)對于腸道粘膜具有顯著的保護作用[18],說明心血康在保護阿霉素誘導的心肌損傷的同時,可能通過調控菌群穩態,并間接參與修復腸道粘膜,對腸道產生保護作用。
LEfSe 結果表明,對照組特征細菌主要為擬桿菌、普雷沃氏菌和類桿菌等常見腸道菌種;模型組的特征細菌則為異桿菌,高豐度的異桿菌通常出現于肥胖大鼠異常的腸道環境中[19],說明阿霉素的干預促進了該致病菌的增殖;而心血康組的特征細菌為艾克曼菌屬,艾克曼菌可以分解腸道粘蛋白,利用分解糖苷鍵的糖苷酶,將寡聚糖分解成單糖為更多的益生菌所發酵利用[20]。該結果表明,心血康可以通過上調益生菌活性改善腸道內環境。
綜上,地奧心血康可以調控阿霉素致心肌損傷大鼠的腸道微生物環境,可能通過恢復菌群結構,參與修復腸道粘膜,提高益生菌活性并抑制致病菌生長等途徑,改善因心肌損傷導致的大鼠腸道菌群紊亂。本研究以腸道菌群為切入點,探究地奧心血康的心臟保護作用,并為其作用機制提供新的視角。

