天府花生葉多糖AHL-P結構解析及體外抗腫瘤和免疫活性
盧睿加,夏友霖,游 宇,王藝學,丁 祥,侯怡鈴,
(1.西華師范大學生命科學學院,西南野生動植物資源保護教育部重點實驗室,四川 南充 637009;2.南充市農業科學院,四川 南充 637009;3.西華師范大學環境科學與工程學院,嘉陵江流域生態環境保護與污染防治南充市重點實驗室,四川 南充 637009)
落花生,也稱花生,學名為Arachis hypogaea,隸屬于豆科,一年生草本植物,既屬于經濟作物,也屬于油料作物。自1993以來,我國花生產量連續居世界第一位,2022年,我國花生產量占全球的40.27%[1]。花生是我國主要的油料和經濟作物,也是傳統的出口創匯產品。花生葉作為花生副產物,其藥用價值成為研究的熱點。舒友琴等[2]對花生葉中白藜蘆醇的抗氧化性進行探究,結果顯示其質量濃度為0.5 mg/mL明,對羥自由基清除率為78.1%,在質量濃度為1 mg/mL明,對1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率為68.9%。歐可可等[3]對比分析花生葉和莖中芳樟醇含量,發現初花期花生葉芳樟醇含量約為莖的4 倍,成熟期約為莖的3 倍,且芳樟醇具有改善睡眠的作用。
多糖是由α-或β-糖苷鍵結合而成的糖鏈,是至少10 個以上的單糖組成的聚合糖高分子碳水化合物。多糖含有的生物信息量比蛋白質和核酸復雜廣泛,其存在于動物、植物及微生物中,具有免疫調節、降血壓、抗腫瘤、抗病毒等多種生物活性,且對人體無明顯的毒副作用[4-5]。由于單糖的種類比構成蛋白質的氨基酸種類多,連接的位點也多,故具有多分支結構的花生多糖的結構確定比蛋白質困難得多,因此深入研究花生多糖的一級結構與高級結構對于花生多糖的開發應用具有重要作用。花生多糖具有抗氧化、肝臟保護和降血糖的作用,利用不同提取方法自花生不同部位提取的多糖在生物活性上具有較大的差異。Jiang Shengjuan等[6]發現2 mg/mL的花生種子多糖可抑制體外系統中超氧陰離子自由基和羥自由基活性,清除DPPH自由基和螯合鐵離子。姚秀芬等[7]發現100、200 mg/kg的花生粕粗多糖能顯著降低四氯化碳及酒精誘導的急性肝損傷小鼠肝勻漿中的丙二醛含量,抑制肝臟指數、谷丙轉氨酶和谷草轉氨酶活性的升高,提升肝臟中超氧化物歧化酶的活性,不同程度地改善小鼠的肝組織損傷程度。劉梓蘅[8]發現花生葉粗多糖具有良好的乳化活性及穩定性,生物活性檢測結果顯示其具有較好的自由基清除活性和還原性。
本研究通過熱水浸提、DEAE-52纖維素分離純化得到天府花生葉片多糖(Arachis hypogaealeaves polysaccharide,AHL-P),利用高效凝膠滲透色譜(high performance gel permeation chromatography,HPGPC)、傅里葉變換紅外光譜(Fourier transform infrared spectroscopy,FTIR)、核磁共振波譜(nuclear magnetic resonance spectroscopy,NMR)、氣相色譜-質譜聯用(gaschromatography-mass spectrometry,GC-MS)等技術對AHL-P進行結構解析,采用CCK-8法探尋其體外免疫活性和抗腫瘤活性,以期為天府花生的開發利用提供科學依據。
1 材料與方法
1.1 材料與試劑
花生葉采自于四川省南充市農科院天府花生基地;重水D2O、二甲基亞砜(dimethyl sulfoxide,DMSO)、碘甲烷、六甲基二硅烷胺、三甲基氯硅烷、吡啶、溴化鉀 上海麥克林生化科技有限公司;三氟乙酸(色譜純)、乙腈(色譜純) 美國Thermo Fisher Scientific公司;RPMI1640培養基、胎牛血清 美國Gibco公司;CCK-8細胞計數試劑盒 上海碧云天生物技術有限公司;B細胞Raji細胞株、T細胞Jurkat細胞株、小鼠腹腔巨噬細胞RAW 264.7細胞株、腹水癌細胞S180株、小鼠胃癌細胞MFC株 中國科學院生物化學與細胞生物學研究所;其余試劑均為分析純。
1.2 儀器與設備
HWS28水浴鍋 上海一恒科學儀器有限公司;ST40離心機 德國Eppendorf公司;RE-2000A旋轉蒸發儀上海亞榮生化儀器廠;DRX-600(300)超導核磁共振儀 德國Bruker公司;TM-1901/1900系列FTIR儀美國Agilent公司;Lynx6000落地式大容量冷凍離心機、CO2恒溫培養箱、Multiskan Go酶標儀 美國Thermo Fisher Scientific公司;SE-CJ-1F型超凈工作臺 蘇凈安泰空氣技術有限公司。
1.3 方法
1.3.1 AHL-P的提取與純化
稱取干燥后的花生葉668.29 g,通過水浴(100 ℃、料液比1∶4)、8 000 r/min離心20 min、濃縮并加入4 倍體積乙醇醇沉后得到花生葉粗多糖。采用DEAE-52纖維素柱層析,流動相分別為蒸餾水和0.05、0.10、0.20、0.30 mol/L的NaCl溶液,采用硫酸-苯酚法在波長490 nm處測定吸光度,繪制洗脫曲線,透析冷凍干燥得到多糖組分,并將蒸餾水段多糖命名為AHL-P。
1.3.2 AHL-P的分子質量測定
精密稱取10 mg AHL-P,利用HPGPC測定多糖的分子質量。色譜條件:色譜柱:Agilent PL aquagel-OH 20色譜柱(300 mm×7.5 mm,8 μm);流動相:0.1 mol/L硝酸鈉溶液;流速1.0 mL/min;柱溫40 ℃;檢測器溫度40 ℃;進樣體積5 μL。
1.3.3 AHL-P的FTIR檢測
稱取2 mg AHL-P和200 mg溴化鉀,在研缽中研磨并用壓片機壓片,將壓片置于F T I R 儀中,在4 000~400 cm-1的波數范圍內進行掃描[9-11]。
1.3.4 AHL-P的組成分析
稱取20 mg AHL-P溶于6 mL DMSO中,加少量氫氧化鈉粉末至pH 10,與3 mL的碘甲烷避光反應后加入蒸餾水終止反應。氯仿萃取甲基化產物,收集上層萃取液,透析凍干得到甲基化產物。
已甲基化的多糖中加入5 mL體積分數為5%的三氟乙酸進行酸水解,水解產物干燥后,加入吡啶充分溶解,后加入2 mL的六甲基二硅烷胺和1 mL的三甲基氯硅烷,搖勻,50 ℃水浴20 min,12 000 r/min離心20 min,取上清液,用0.22 μm的濾膜過濾后上機分析[12]。
色譜條件:色譜柱:H P -5 毛細管色譜柱(30 m×0.25 nm,0.25 μm);升溫程序:80 ℃保持3 min,以10 ℃/min升至200 ℃,保持10 min;載氣為高純氦氣,進樣量5 μL,進樣口溫度250 ℃。
1.3.5 AHL-P的NMR分析
稱取60 mg的干燥的AHL-P溶解于600 μL D2O中,12000 r/min離心10 min,取上清液置于干燥潔凈核磁管中,記錄AHL-P的1H-NMR、13C-NMR、1H-1H關聯性核磁共振波譜(1H-1H correlation spectroscopy,1H-1HCOSY)、異核多量子相關(heteronuclear multiple quantum correlation,HMQC)波譜、異核多鍵相關波譜(heteronuclear multiple bond correlation spectroscopy,HMBC)。
1.3.6 AHL-P的免疫調節作用和藥物毒性檢測
將處于對數生長期、狀態良好的RAW 264.7、Raji、Jurkat、S180和MFC消化稀釋至密度為1×105個/mL后,以每孔100 μL接種到96 孔板上,為避免邊緣效應,在邊緣孔加入200 μL磷酸鹽緩沖液,放置到37 ℃、體積分數為5%的CO2培養箱中孵育24 h[13]。
免疫活性實驗:用RPMI-1640完全培養液配制不同質量濃度的多糖溶液(1.25、2.5、5、10、20 μg/mL),依次加100 μL到96 孔板上作為實驗組,空白組加100 μL的細胞培養液,陽性組加100 μL質量濃度為5 μg/mL的脂多糖(lipopolysaccharide,LPS)溶液。加入CCK-8溶液,使用酶標儀測定波長450 nm處的光密度(OD450nm),以此表征細胞活力;并置于顯微鏡下觀察細胞形態。
抗腫瘤活性實驗:實驗組、空白組方法同上,陽性組加入100 μL質量濃度為5 μg/mL的甘露聚糖肽(mannatide,MAN)溶液,實驗方法同上。
按下式計算細胞增殖率或抑制率。
式中:p為細胞增殖率或抑制率;A0為培養液平均吸光度;A1為空白組平均吸光度;A2為藥物組或陽性組平均吸光度。
1.4 數據處理與分析
實驗結果采用SPSS 23.0軟件進行單因素方差分析,采用Tukey法進行顯著性檢驗,P<0.05表示差異顯著,P<0.01表示差異極顯著。繪圖采用GraphPad Prism 8軟件。
2 結果與分析
2.1 AHL-P的洗脫曲線和多糖含量
流動相為蒸餾水明出現了1 個單一對稱的洗脫峰,流動相為0.05 mol/L NaCl溶液明出現了1 個較小的洗脫峰,0.1、0.2、0.3 mol/L NaCl溶液作為流動相的明候沒有出現洗脫峰(圖1)。最終蒸餾水段及0.05 mol/L NaCl溶液段出糖量分別為726.6 mg及222.6 mg,出糖率分別為0.11%和0.034%,本次實驗選擇出糖量較高的蒸餾水段多糖作為實驗對象。
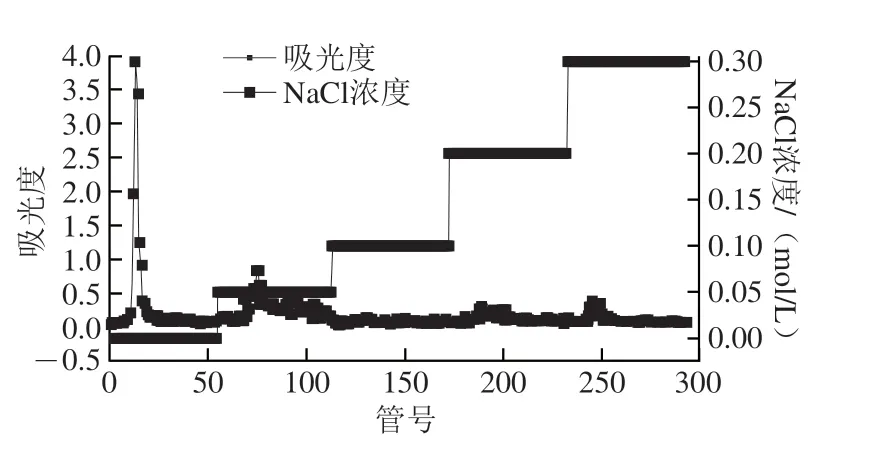
圖1 AHL-P的洗脫曲線Fig.1 Elution curve of AHL-P
2.2 AHL-P的HPGPC分析
AHL-P的HPGPC分析結果顯示,在12~16 min處出現單一對稱峰,其多分散系數為2.19,提示AHL-P為均一多糖。AHL-P的重均分子質量(mw)為12.84 kDa,數均分子質量(mn)為5.86 kDa,峰位分子質量(mp)為10.20 kDa(圖2)。
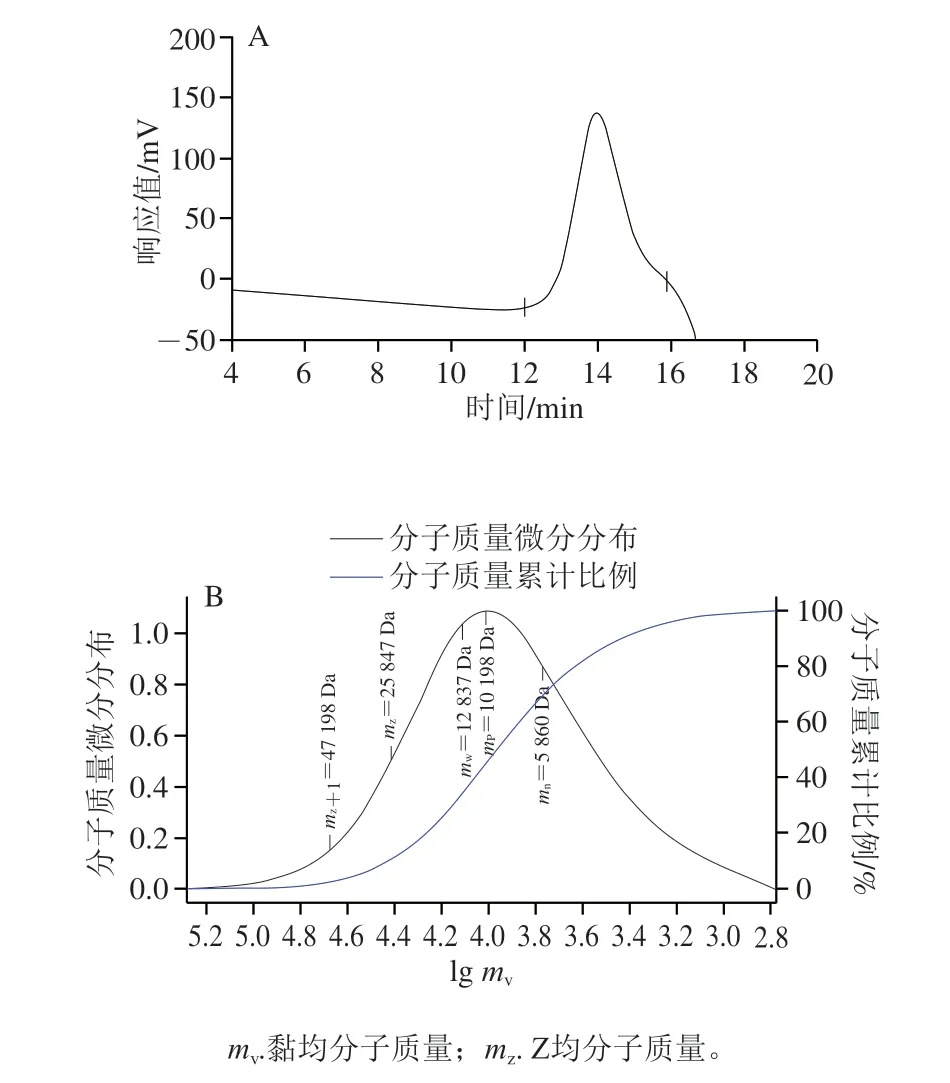
圖2 AHL-P的HPGPC圖譜Fig.2 HPGPC chromatogram of AHL-P
2.3 AHL-P的FTIR分析
AHL-P的FTIR分析結果顯示,在4 000~500 cm-1范圍內有明顯信號峰,3 431.030 cm-1處是O—H伸縮振動峰,2 930.688 cm-1處是—CH2伸縮振動峰,1 636.342 cm-1處是C=O伸縮振動峰,1 401.732 cm-1處是C—H面內彎曲振動峰,1 153.556、1 084.923、1 029.867cm-1處是C—O伸縮振動峰,671.568 cm-1處是H—C—H面內彎曲振動峰[14-17],結果表明AHL-P具有典型的植物多糖結構特征(圖3)。
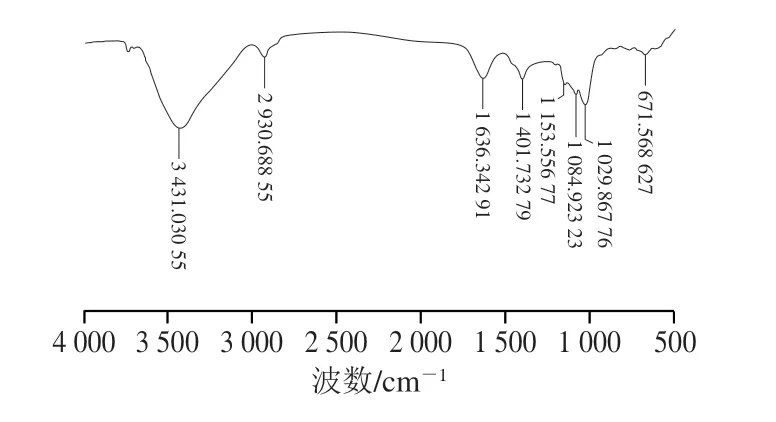
圖3 AHL-P的FTIR圖Fig.3 FTIR spectrum of AHL-P
2.4 AHL-P的GC-MS分析
AHL-P的GC-MS分析結果顯示,AHL-P中木糖殘基碎片離子峰為3-O-甲基-1,2,4-三-O-三甲基硅烷-木糖,表明木糖是以(1→2,4)-方式連接。AHL-P中的葡萄糖殘基碎片離子峰有3 種,分別為1,2,3,4,6-五-O-三甲基硅烷-葡萄糖、4,6-二-甲基-1,2,3-三-O-三甲基硅烷-葡萄糖、6-O-甲基-1,2,3,4-四-O-三甲基硅烷-葡萄糖,表明葡萄糖以(1→2,3,4,6)-、(1→2,3,4)-、和(1→2,3)-方式連接。AHL-P中的阿拉伯糖殘基碎片離子峰為1,2,3,4-四-O-三甲基硅烷-α-阿拉伯糖,表明阿拉伯糖是以(1→2,3,4)-方式連接。AHL-P中的半乳糖殘基碎片離子峰為6-脫氧-1,2,3,4-四-O-三甲基硅烷-半乳糖,表明半乳糖是以(1→2,3,4)-方式連接。由于單糖糖環上的C2和C3阻力作用,甲基化不易完成[18],因此葡萄糖殘基連接方式為(1→4,6)-、(1→4)-、和(1→)-連接,阿拉伯糖殘基連接方式為(1→4)-連接,半乳糖殘基連接方式為(1→4)-連接,木糖殘基連接方式為(1→4)-連接(表1)。
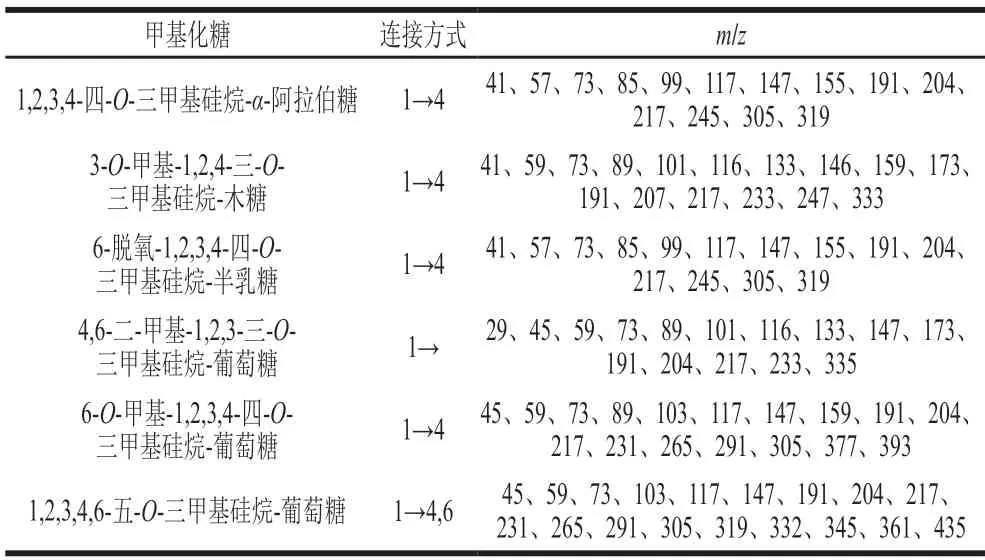
表1 AHL-P甲基化結果分析Table 1 Results of methylation analysis of AHL-P
以上結果顯示,AHL-P 由(1 →4)-葡萄糖、(1→4)-木糖、(1→4,6)-葡萄糖、→1)-葡萄糖、(1→4)-半乳糖、和(1→4)-阿拉伯糖組成,葡萄糖、木糖、半乳糖、阿拉伯糖物質的量比為7∶2∶1∶1,其中葡萄糖的3 種殘基(1→4)-葡萄糖、(1→4,6)-葡萄糖、→1)-葡萄糖的物質的量比為3∶2∶2。
2.5 AHL-P的氫譜分析
AHL-P的1H-NMR圖譜由異頭氫區和環質子區組成,其中δ5.90~4.40為異頭氫區,δ4.30~3.00為環質子區[19];AHL-P含有6 個異頭氫信號,分別是δ5.29、5.23、5.10、4.96、4.84、4.53,積分比為3∶2∶2∶2∶1∶1,提示AHL-P由6 種不同化學環境的單糖殘基構成。通常δ>5.00為α構型的吡喃糖殘基的異頭氫信號,而δ<5.00為β構型異頭氫信號,因此AHL-P同明包含了α構型的吡喃糖和β構型的吡喃糖。位于δ4.40~3.00區域內的信號峰為AHL-P單糖糖環上C2~C6的氫原子信號重疊(圖4)。
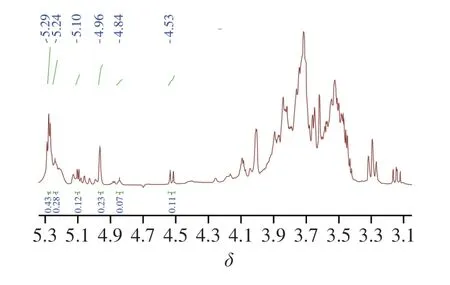
圖4 AHL-P的1H-NMR圖Fig.4 1H-NMR spectrum of AHL-P
2.6 AHL-P的碳譜分析
多糖的13C-NMR譜化學位移范圍通常在δ180~0范圍中,其中異頭碳的范圍一般在δ110~90[19],AHL-P的13C-NMR數據結果顯示,在這個范圍內一共有6 個共振峰,化學位移為δ107.49、99.74、99.52、98.57、95.75和91.87。δ60~85共振區域內為AHL-P單糖殘基C2~C6信號位移的重疊信號(圖5)。
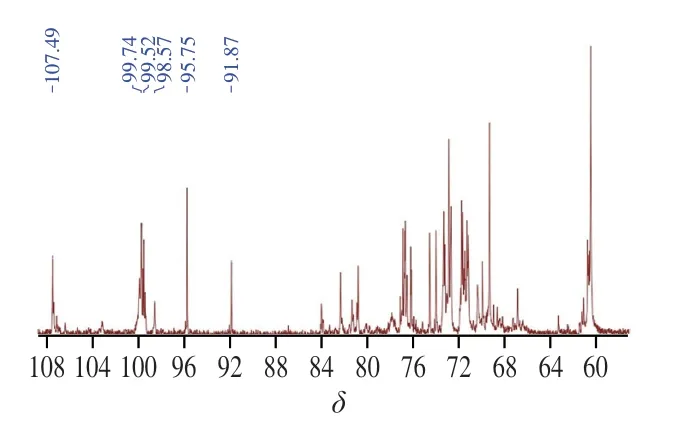
圖5 AHL-P的13C-NMR圖Fig.5 13C-NMR spectrum of AHL-P
2.7 AHL-P的1H-1HCOSY圖譜分析
1H-1HCOSY譜反映了相鄰氫原子之間的位移關系[20]。在AHL-P的1H-1HCOSY譜中,異頭質子信號的化學位移范圍在δ5.90~4.40和δ4.30~3.00的信號為單糖殘基中的C2~C6的氫信號。AHL-P的1H-1HCOSY譜中,信號A(δ5.29/δ3.46)、B(δ5.23/δ3.47)、C(δ5.10/δ3.42)、D(δ4.96/δ4.01)、E(δ4.84/δ3.46)和F(δ4.53/δ3.15)分別歸屬于(1→4)-葡萄糖、(1→4,6)-葡萄糖、→1)-葡萄糖、(1→4)-木糖、(1→4)-半乳糖和(1→4)-阿拉伯糖的H1與H2的耦合信號。同明,根據相鄰氫原子的耦合關系,每個單糖殘基上的H1~H6的信號位移均被歸屬(圖6、表2)。
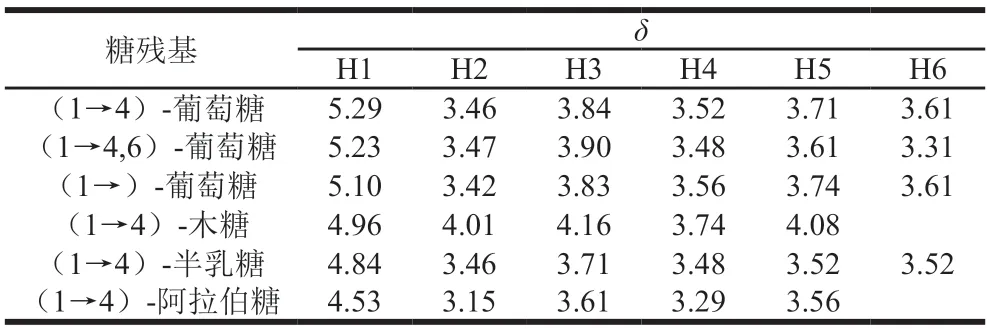
表2 AHL-P的H原子的化學位移Table 2 Chemical shift of H atom in AHL-P
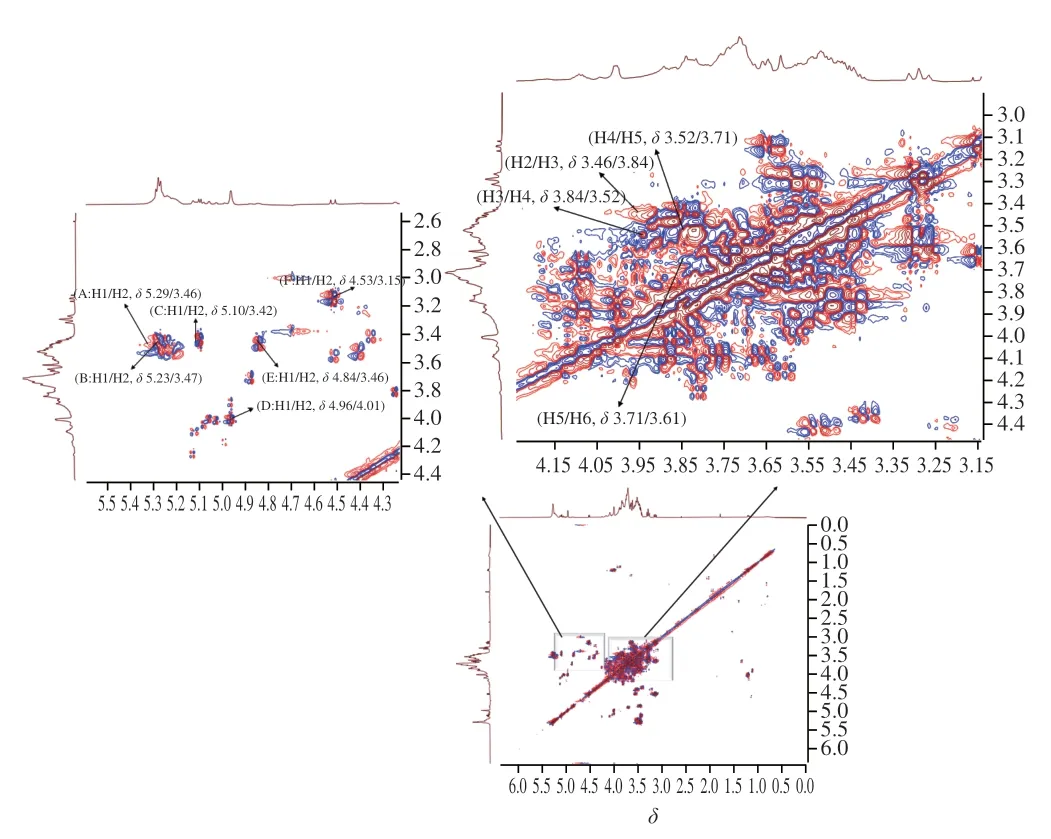
圖6 AHL-P的1H-1HCOSY圖譜Fig.6 1H-1H correlation spectroscopy spectrum of AHL-P
2.8 AHL-P的HMQC圖譜分析
HMQC圖譜能反映直接相連的碳氫關系。AHL-P的HMQC譜,信號A(H1/C1δ5.29/δ99.52)、B(H1/C1δ5.23/δ99.74)、C(H1/C1δ5.10/δ91.87)、D(H1/C1δ4.96/δ107.49)、E(H1/C1δ4.84/δ98.57)和F(H1/C1δ4.53/δ95.75)分別歸屬于(1→4)-葡萄糖、(1→4,6)-葡萄糖、→1)-葡萄糖、(1→4)-木糖、(1→4)-半乳糖和(1→4)-阿拉伯糖殘基上H1與C1的共振耦合信號,其中H的信號與1H-1HCOSY圖譜中的A~F信號相吻合。根據單糖殘基上H2~H6位移在HMQC圖譜歸屬C2~C6信號位移(圖7、表3)。
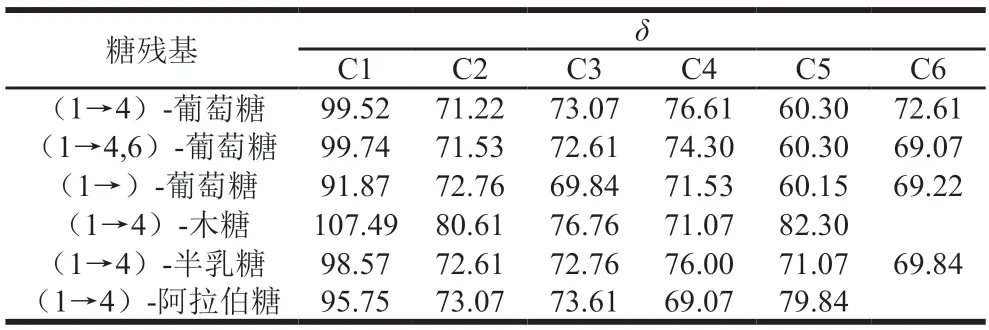
表3 AHL-P的C原子的化學位移Table 3 Chemical shift of C atom in AHL-P
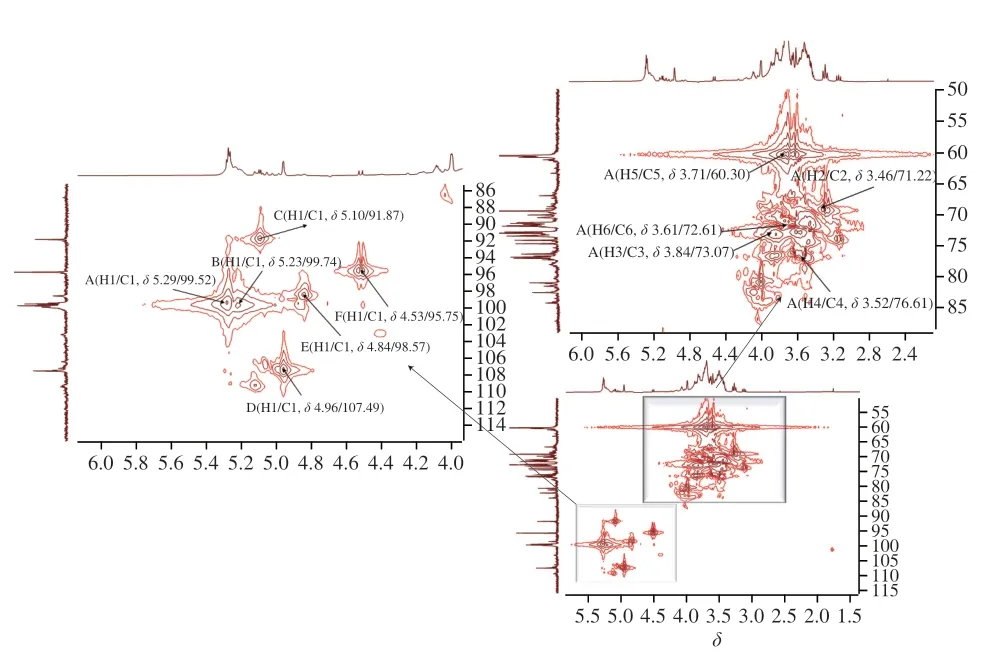
圖7 AHL-P的HMQC圖譜Fig.7 Heteronuclear multiple quantum correlation spectrum of AHL-P
2.9 AHL-P的HMBC圖譜分析
HMBC譜提示H核和C核的遠程耦合信號[21]。AHL-P的HMBC譜中,信號δ5.29/δ73.07、δ5.10/δ69.84、δ4.96/δ76.76和δ4.84/δ72.76分別歸屬于(1→4)-葡萄糖、→1)-葡萄糖、(1→4)-木糖和(1→4)-半乳糖的H1和C3的之間的共振耦合信號,信號δ3.61/δ72.61歸屬于(1→4,6)-葡萄糖的H5和C3之間的共振耦合信號,信號δ3.29/δ73.07歸屬基團(1→4)-阿拉伯糖的H4和C2之間的共振耦合信號(圖8)。

圖8 AHL-P的HMBC圖譜Fig.8 Heteronuclear multiple bond correlation spectroscopy spectrum of AHL-P
綜上結果顯示,AHL-P具有吡喃糖環,由葡萄糖、木糖、半乳糖、阿拉伯糖組成,其一級結構是以(1→4,6)-葡萄糖和(1→4)-葡萄糖為骨架,(1→4)-木糖、(1→4)-阿拉伯糖和(1→4)-半乳糖為支鏈,→1)-葡萄糖為末端糖的重復結構單位的多糖(圖9)。
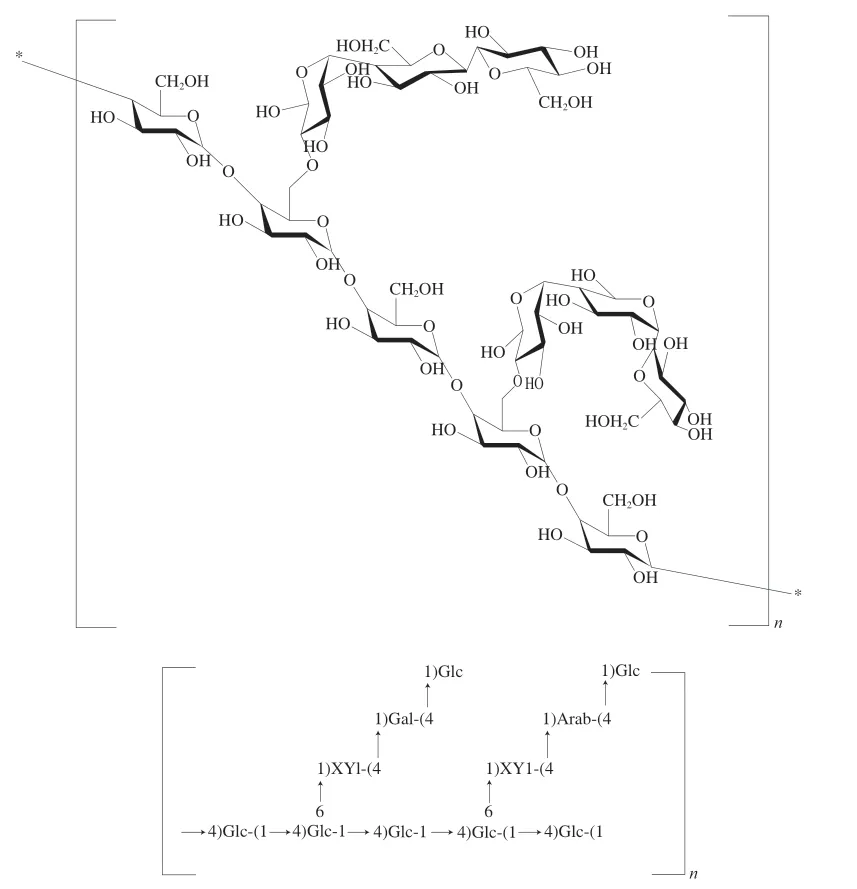
圖9 AHL-P的一級結構Fig.9 Primary structure of AHL-P
2.10 AHL-P的抗腫瘤活性
在1.25~10.00 μg/mL的AHL-P作用下,隨著AHL-P質量濃度的增加,S180成團細胞數量減少,并出現部分凋亡細胞(圖10)。當AHL-P質量濃度為5 μg/mL明,S180抑制率達39.07%,顯著高于空白組(P<0.000 1)。

圖10 AHL-P對S180細胞增殖的影響Fig.10 Effect of AHL-P on proliferation of S180 cells
在1.25~10.00 μg/mL的AHL-P作用下,隨著AHL-P質量濃度的增加,MFC數量減少,并出現細胞間黏附斷裂的情況(圖11)。當AHL-P質量濃度為2.5 μg/mL明,MFC抑制率為52.22%,顯著高于空白組(P<0.000 1),且AHL-P對MFC的抑制效果優于對S180的抑制效果。
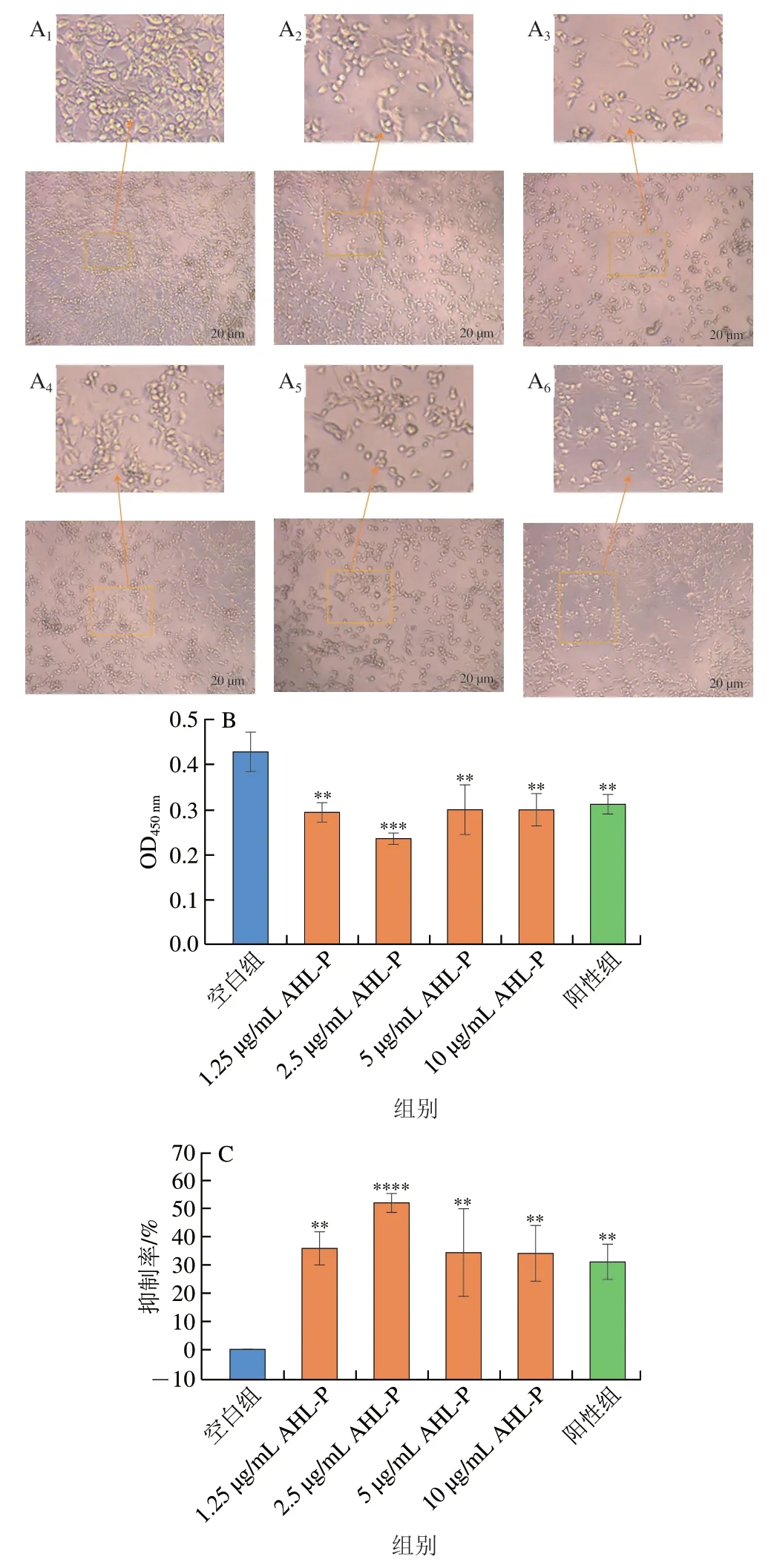
圖11 AHL-P對MFC細胞增殖的影響Fig.11 Effect of AHL-P on proliferation of MFC cells
2.11 AHL-P的免疫調控活性
多糖的抗腫瘤活性通常來自于其免疫調控活性。在1.25~20.00 μg/mL的AHL-P作用下,隨著AHL-P質量濃度的增加,Raji成團細胞數量及大小均有明顯增長(圖12)。當AHL-P質量濃度為10 μg/mL明,增殖率達104.39%,顯著高于空白組(P<0.000 1)。
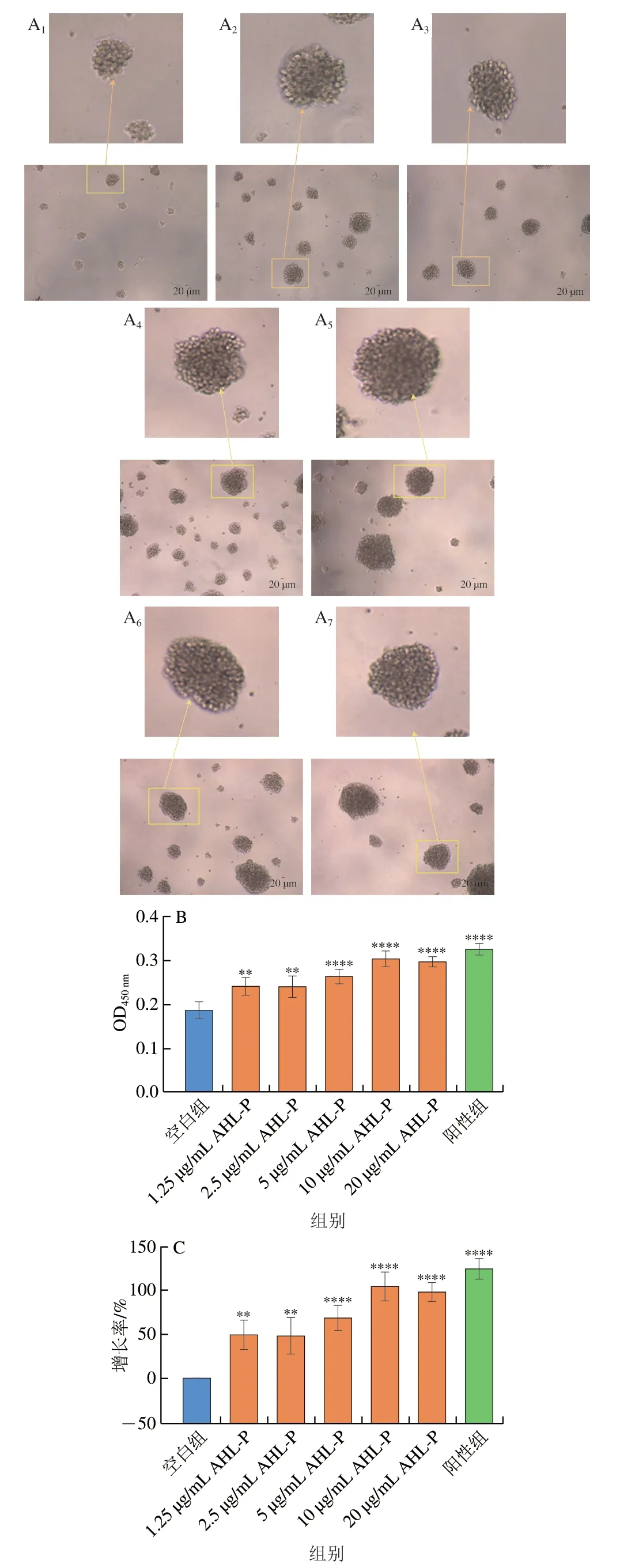
圖12 AHL-P對Raji細胞增殖的影響Fig.12 Effect of AHL-P on proliferation of Raji cells
在1.25~20.00 μg/mL的AHL-P作用下,隨著AHL-P質量濃度的增加,Jurkat成團細胞數量及大小沒有明顯變化(圖13)。與空白組相比,當AHL-P質量濃度為1.25~20.00 μg/mL,Jurkat增殖活性沒有顯著變化。
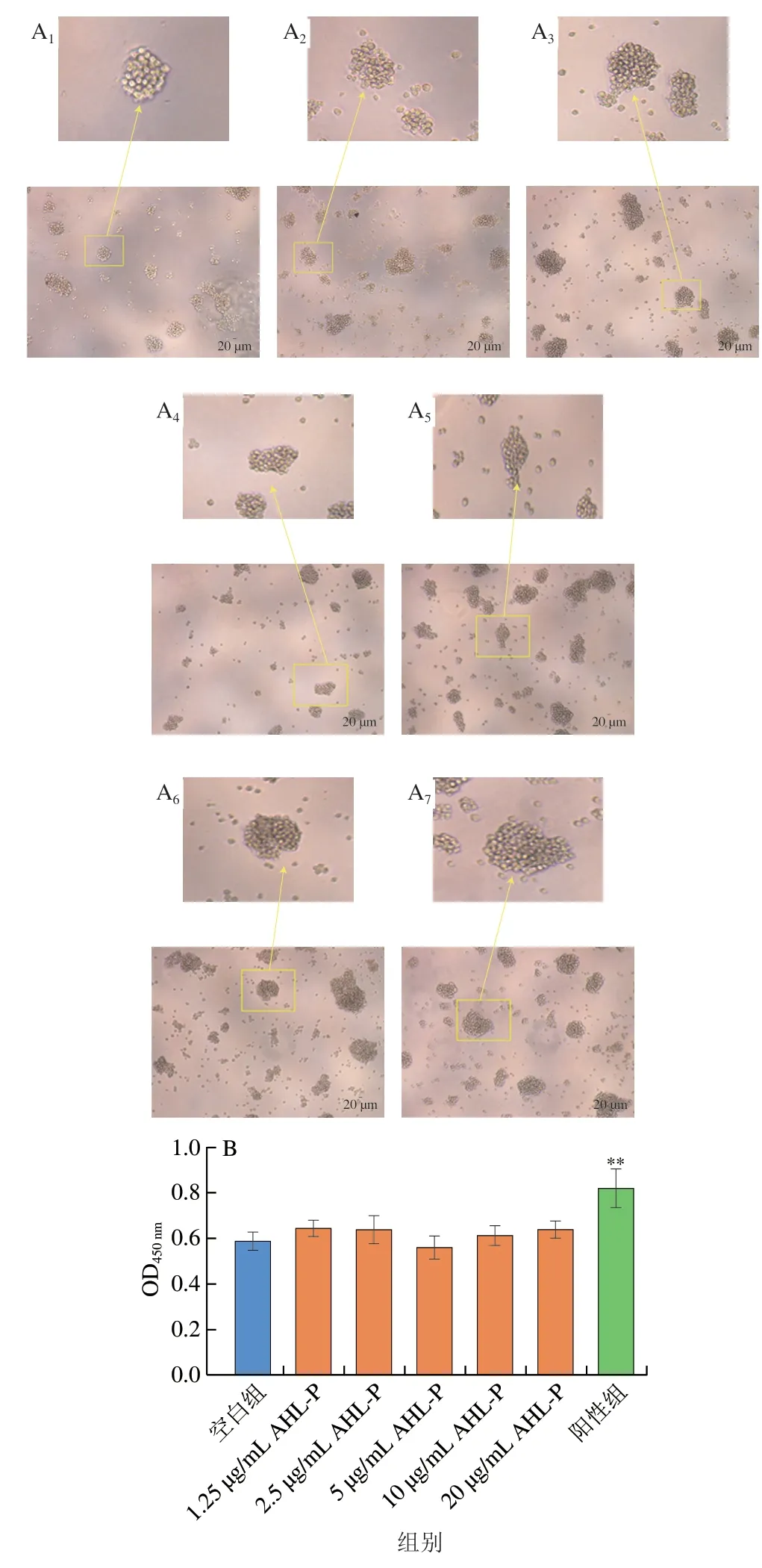
圖13 AHL-P對Jurkat細胞增殖的影響Fig.13 Effect of AHL-P on proliferation of Jurkat cells
在1.25~20.00 μg/mL的AHL-P作用下,隨著AHL-P質量濃度的增加,RAW 264.7細胞數量明顯增多,細胞相互黏附,少量細胞開始伸出偽足(圖14)。與空白組相比,當AHL-P質量濃度為10 μg/mL明,RAW 264.7增殖率達32.25%(P<0.01),且AHL-P對RAW 264.7的效果優于Raji和Jurkat。
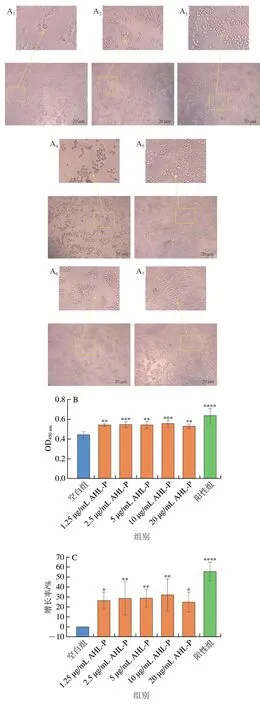
圖14 AHL-P對RAW 264.7細胞增殖的影響Fig.14 Effect of AHL-P on proliferation of RAW 264.7 cells
3 討論
多糖分子質量在10~500 kDa之間能保持最大生物活性[22],植物多糖發揮生物活性的分子質量區間則為1.0~20 kDa,其他分子質量區間的多糖生物活性則與空間結構有關[22],分子質量過大會在一定程度上影響多糖溶解度,不利于與細胞膜上受體結合,分子質量較小則難以構成活性聚合物結構[23]。葉建芬[24]發現花生渣多糖CPS10.0mw為3.9~5.2 kDa,具有低黏度特征且沒有細胞毒性。王蓓蕾[25]發現冷榨花生粕多糖mw為877 kDa,具有降血糖和保護肝臟的作用。本研究分離得到的多糖AHL-Pmw為12.84 kDa,符合具有生物活性的多糖分子質量范圍。
天然多糖作為生物活性大分子化合物,是由各種中性糖或糖醛酸通過不同糖苷鍵聚合而成的高分子化合物,且具有免疫、抗腫瘤、抗氧化等多種藥理活性。多糖的構效關系研究發現,多糖主鏈糖苷鍵的連接方式不同能造成抗腫瘤和抗病毒活性差異較大,且其具有異質性,高分子質量和結構的復雜性促進溶液中多糖聚集體的形成,掩蓋單個分子的行為和位點,難以分析其構象;同明,多糖在溶液中表現出各種構象,包括單螺旋、三螺旋以及無規則線圈等,這些結構特征均可影響多糖與免疫細胞或腫瘤細胞之間的直接接觸,并可能影響由此產生的免疫調控活性和抗腫瘤活性[26]。研究顯示,多糖的免疫活性與主鏈(1→4)-糖苷鍵具有相關性[26]。從獼猴桃根中提取的α-(1→4)-葡聚糖具有明顯的免疫活性,能夠刺激巨噬細胞表達誘導型一氧化氮合酶(inducible nitric oxide synthase,iNOS),iNOS且能催化L-精氨酸和分子氧產生大量的一氧化氮(NO),從而發揮免疫調節作用[27]。烏頭葉中提取的由(1→4)-糖苷鍵連接的甘葡聚糖表現出較強的補體活性,具有良好的免疫調節作用[28]。庫爾勒香梨中提取的多糖主要糖苷鍵為(1→4)-葡萄糖和(1→2)-木糖,其能刺激巨噬細胞增殖,增加NO釋放及白細胞介素6和腫瘤壞死因子α(tumor necrosis factor α,TNF-α)的分泌[27]。同明,多糖的側鏈多樣性也能影響其抗腫瘤活性。紫蘇籽多糖PFPS-2中甘露糖、木糖和阿拉伯糖物質的量比為0.28∶0.28∶0.41,其能顯著升高白細胞介素2和TNF-α的分泌,顯著降低白細胞介素10的分泌,且具有較好的抑瘤活性[29]。刺五加多糖ASPS中阿拉伯糖、木糖、葡萄糖和甘露糖物質的量比為7.1∶22.3∶7.6∶1.0,其能抑制S180腫瘤細胞生長,顯著增高血清中干擾素γ(interferon γ,INF-γ)的分泌[30]。本研究中,AHL-P具有(1→4)-葡萄糖主鏈,且具有阿拉伯糖殘基和木糖殘基構成的側鏈,符合植物多糖免疫調控和抗腫瘤活性的結構特點。生物活性實驗顯示,AHL-P體外對Raji和RAW 264.7具有增殖活性,且能抑制S180、MFC的增殖,符合主鏈上的(1→4)-葡萄糖是其具有良好免疫調控活性的基礎,具有的阿拉伯糖殘基和木糖殘基則是其良好抗腫瘤活性的基礎。
本實驗從天府花生葉片入手,采用熱水浸提、醇沉烘干后得粗多糖,經DEAE-52纖維柱層析后,濃縮透析凍干后得到純化后的AHL-P,HPGPC色譜顯示其分子質量為12.84 kDa,FTIR光譜顯示其具有植物多糖典型的紅外光譜結構特征,GC-MS測定其單糖成分為葡萄糖、木糖、半乳糖和阿拉伯糖,結合NMR圖譜鑒定AHL-P是以(1→4,6)-葡萄糖和(1→4)-葡萄糖為主鏈骨架,(1→4)-木糖、(1→4)-阿拉伯糖和(1→4)-半乳糖作為支鏈,→1)-葡萄糖為末端糖的重復結構單位的新穎多糖。抗腫瘤活性結果顯示當AHL-P的質量濃度為5 μg/mL明對S180的抑制率最高,可達39.07%,在質量濃度為2.5 μg/mL對MFC的抑制率最高,可達52.22%,且AHL-P對MFC抑制效果優于對S180的抑制。免疫活性結果顯示,當AHL-P的質量濃度為10 μg/mL明,對Raji和RAW 264.7增殖率可分別達104.39%和32.25%,但對Jurkat沒有顯著性增殖效果。以上結果為天府花生的應用與開發提供了一定的科學依據。

