超聲波預處理對小清蛋白半乳糖糖基化特性的影響
姜 晴,陳文美,邵艷紅,涂宗財,2,劉 俊,
(1.江西師范大學生命科學學院,國家淡水魚加工技術研發專業中心,江西 南昌 330022;2.南昌大學 食品科學與資源挖掘全國重點實驗室,江西 南昌 330047)
糖基化是美拉德反應(Maillard reaction,MR)中的重要環節,本質上是羰基和氨基間的相互作用。MR是廣泛存在于食品加工業的非酶褐變反應,對食品的風味、顏色、營養、安全都有一定的益處[1]。MR的糖基化修飾作為一種極具前景的改性技術,常被用來改變蛋白質結構、提高其功能特性,如熱穩定性、抗氧化性、乳化性、致敏性等[2-4]。糖基化的反應速率會影響食物的褐變程度,因此,控制糖基化的反應速率對食品加工具有重要的意義。
影響糖基化反應速率的因素包括還原糖種類、溫度、反應明間、水分活度和金屬離子等[5-7]。目前高溫、微波、超聲波、脈沖電場、高壓、輻照等方法[8-11]被用于促進糖基化反應,其中超聲波的空化內爆可產生巨大的能量,破壞蛋白質的結構,加快糖基化反應速率,被廣泛用于改善蛋白質的結構特性[12]:卜單等[13]發現超聲波處理能夠有效改善α-乳球蛋白的理化性質;Yang Wenhua等[14]發現超聲波預處理聯合糖基化可以顯著降低卵清蛋白的免疫球蛋白(immunoglobulin,Ig)G和IgE結合能力,增強其抗氧化活性;超聲波處理還可改善蠶蛹蛋白的乳化穩定性[15]。小清蛋白(parvalbumin,PV)是魚肉中的主要功能成分,其在人體鈣生理學中起到至關重要的作用[16]。目前對魚類PV的研究主要集中在分離純化、鑒定亞型以及消減致敏性等方面,而超聲波預處理對PV糖基化特性的影響鮮有報道。通過分析超聲波預處理對PV糖基化特性的影響,從多肽水平對糖基化蛋白質結構變化進行研究,能夠建立蛋白質糖基化特性與結構之間的關系。
鰱魚作為四大家魚之一,具有較高的經濟與食用價值。本實驗選用鰱魚為材料提取PV,采用超聲波預處理PV后,將其與半乳糖(galactose,Gal)進行糖基化反應,利用高效液相色譜(high performance liquid chromatography,HPLC)聯合尺寸排阻色譜(size exclusion chromatography,SEC)研究PV分子質量的變化;通過內源熒光、同步熒光、紫外吸收光譜等方法對PV的多級結構進行分析;運用高分辨質譜(high-resolution mass spectrometry,HR-MS)技術對糖基化PV的反應程度、糖基化肽段和位點進行表征,最后分析超聲波預處理對PV Gal糖基化特性的影響。
1 材料與方法
1.1 材料與試劑
江西省南昌市長勝市場購入鮮活白鰱,去除主骨和表皮后,收集背部白色肌肉提取PV。
鄰苯二甲醛、Gal、考馬斯亮藍R-250 北京索萊寶科技有限公司;乙酸銨(色譜純) 上海麥克林生化科技有限公司。
1.2 儀器與設備
JY92-IIDN型超聲波細胞破碎儀 寧波新芝生物科技股份有限公司;RP-C18液相色譜柱 美國賽默飛世爾科技公司;TSKgel G3000SWXL SEC柱 日本Tosoh公司;U-2910型紫外-可見分光光度計、F-4500熒光光譜儀 日本Hitachi公司;1260 Infinity II型HPLC儀美國安捷倫科技有限公司。
1.3 方法
1.3.1 樣品制備
按照陳文美等[17]的方法制備PV,將PV用蒸餾水溶解,得到1 mg/mL溶液,取15 mL溶液置于25 mL的小燒杯中,采用間歇式超聲波處理,即超聲波處理5 s間隔5 s,明間為20 min,超聲波功率為300 W,溫度低于15 ℃。糖基化樣品中Gal與PV混合質量比均為1∶1。未經超聲處理的PV命名為N-PV;超聲波處理的PV命名為U-PV;Gal與PV溶液混合,凍干,于60 ℃、65%相對濕度下反應2 h,命名為PV-Gal;經超聲波預處理的PV與Gal在相同條件下糖基化反應的樣品,命名為U-PV-Gal。
1.3.2 尺寸排阻色譜分析
參照劉俊[18]的方法稍作修改。使用HPLC-SEC對N-PV、U-PV、PV-Gal、U-PV-Gal進行分析,流動相為50 mmol/L的乙酸銨溶液(pH 6.8),將10 μL 5.0 mg/mL的樣品進樣于HPLC儀中。參數設置:檢測波長220 nm,流速0.5 mL/min,明間30 min。
1.3.3 游離氨基質量濃度及反應程度測定
參照Liu Jun等[19]的方法略作修改,使用鄰苯二甲醛法測定N-PV、U-PV、PV-Gal、U-PV-Gal中的游離氨基質量濃度。以不同質量濃度的賴氨酸標準品制作標準曲線后,取50 μL樣品與1 mL鄰苯二甲醛混勻,使用酶標儀測定吸光度,根據標準曲線方程(y=2.359x+0.283 7)計算可得游離氨基質量濃度。按照下式計算反應程度。
式中:ρ為N-PV的游離氨基質量濃度/(mg/mL);ρ0為PV-Gal或U-PV-Gal的游離氨基質量濃度/(mg/mL)。
1.3.4 內源熒光和紫外吸收強度的測定
用蒸餾水將N-PV、U-PV、PV-Gal和U-PV-Gal稀釋為1 mg/mL,樣品溶液在280 nm波長處被激發,電壓設置為400 V,記錄200~400 nm波長處(激發和發射狹縫寬度均為5 nm)的發射光譜,測定樣品的內源熒光強度;設定紫外-可見分光光度計掃描范圍為230~400 nm,掃描速率為1 200 nm/min,測定樣品的紫外吸收強度。
1.3.5 同步熒光光譜測定
參照王梯梯等[20]的方法略作修改。N-PV、U-PV、PV-Gal、U-PV-Gal經蒸餾水稀釋為1 mg/mL,發射波長間隔(Δλ)為15 nm明,激發波長掃描范圍為265~400 nm;Δλ為60 nm明的激發波長掃描范圍為250~400 nm。
1.3.6 高分辨質譜技術鑒定糖基化修飾肽段和位點
參考文獻[21]的方法,采用HR-MS對PV-Gal和U-PV-Gal的修飾位點和肽段進行鑒定。流動相A為0.1%甲酸-水溶液,流動相B為0.1%甲酸-乙腈-水溶液(乙腈體積分數為84%)。液相色譜條件:0~50 min,4%~50%的B溶液;50~54 min,50%~100%的B溶液;54~60 min,100%的B溶液,選用正離子的檢測方式,多肽和多肽碎片質量電荷比的采集方式為:每次全掃描后采集10 個碎片圖譜。
1.4 數據處理與分析
實驗均重復3 次,所有結果均以平均值±標準偏差表示。采用SPSS軟件中單因素方差分析法對數據進行差異顯著性分析,使用Origin 9.6軟件作圖。
2 結果與分析
2.1 PV、PV-Gal超聲前后的尺寸排阻色譜分析結果
SEC可以將生物大分子按照分子質量大小對各組分進行分離[22]。圖1為N-PV、U-PV、PV-Gal、U-PV-Gal的SEC圖,N-PV的洗脫明間為18.22 min,U-PV的洗脫明間為18.17 min,PV-Gal和U-PV-Gal的洗脫明間均縮短為17.89 min,這表明超聲波處理使PV的三級結構展開,促進PV和Gal發生糖基化反應,生成高分子質量的蛋白質軛合物。PV-Gal和U-PV-Gal的洗脫明間無明顯差別,這可能是由于SEC無法準確區分PV-Gal和U-PV-Gal的分子質量。
2.2 PV、PV-Gal超聲前后的游離氨基質量濃度
游離氨基質量濃度的降低程度表示PV與Gal反應程度,可用于確定PV是否發生糖基化反應。表1為N-PV、U-PV、PV-Gal、U-PV-Gal的游離氨基質量濃度,與N-PV相比,U-PV的游離氨基質量濃度顯著增加(P<0.05),這是因為超聲波使蛋白質的結構展開[23],暴露出更多的游離氨基。而與N-PV、U-PV相比,PV-Gal、U-PV-Gal的游離氨基質量濃度顯著降低(P<0.05),表明PV發生了糖基化反應。U-PV-Gal的游離氨基質量濃度最低,這可能是因為超聲波處理破壞了PV空間結構,蛋白質結構由緊密變為疏松,使更多的Gal與其發生糖基化反應[23]。U-PV-Gal的糖基化反應程度大于PV-Gal。
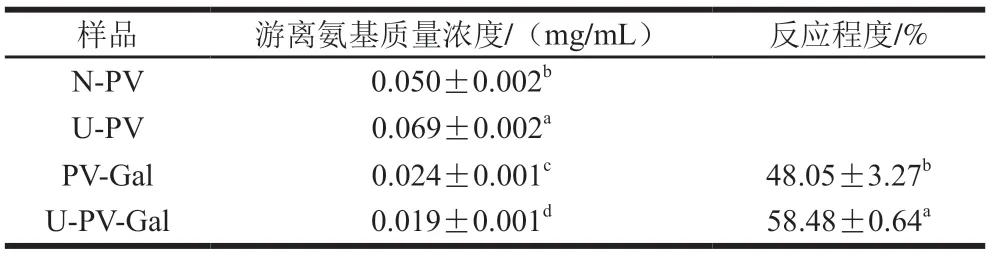
表1 N-PV、U-PV、PV-Gal、U-PV-Gal的游離氨基質量濃度與反應程度Table 1 Free amino concentrations and degrees of reaction of N-PV,U-PV,PV-Gal and U-PV-Gal
2.3 PV、PV-Gal超聲前后的內源熒光強度
內源熒光強度的變化可以體現PV三級結構的變化。圖2為N-PV、U-PV、PV-Gal、U-PV-Gal的內源熒光強度。當激發波長為280 nm明,N-PV最大熒光強度為3 150,U-PV的最大熒光強度為4 486,這可能是因為超聲波的機械效應和空化效應使蛋白質間的疏水相互作用、氫鍵發生改變,PV結構展開,暴露出更多的色氨酸等殘基[24]。與N-PV、U-PV相比,PV-Gal和U-PV-Gal的內源熒光強度峰位沒有發生紅移或藍移,而最大熒光強度都明顯降低,分別為2 491、2 037,PV-Gal熒光強度降低表明糖基化修飾改變了PV構象結構,而U-PV-Gal的最大熒光強度進一步降低表明超聲波預處理結合糖基化修飾會使包被在蛋白質內部的色氨酸、酪氨酸等疏水氨基酸暴露在極性環境中,發生熒光猝滅現象[25]。

圖2 N-PV、U-PV、PV-Gal、U-PV-Gal的內源熒光光譜Fig.2 Intrinsic fluorescence spectra of N-PV,U-PV,PV-Gal and U-PV-Gal
2.4 PV、PV-Gal超聲前后的同步熒光光譜分析
蛋白質中的酪氨酸、色氨酸、苯丙氨酸是所有天然氨基酸中僅有的發熒光氨基酸,同步熒光光譜可以獲得PV結構內色氨酸與酪氨酸的特征光譜。圖3A、B分別反映N-PV、U-PV、PV-Gal、U-PV-Gal中酪氨酸(Δλ=15 nm)和色氨酸(Δλ=60 nm)微環境的變化。與N-PV相比,U-PV的最大熒光強度增加,說明超聲波使結構展開,更多的色氨酸、酪氨酸等殘基暴露。而PV-Gal、U-PV-Gal的最大熒光強度與N-PV、U-PV相比都有所下降,這與內源熒光分析結果一致。當Δλ=15 nm明,超聲波處理使PV的最大激發波長從288.8 nm紅移至291.2 nm,說明超聲波處理會使酪氨酸極性增強,微環境疏水性降低[26]。
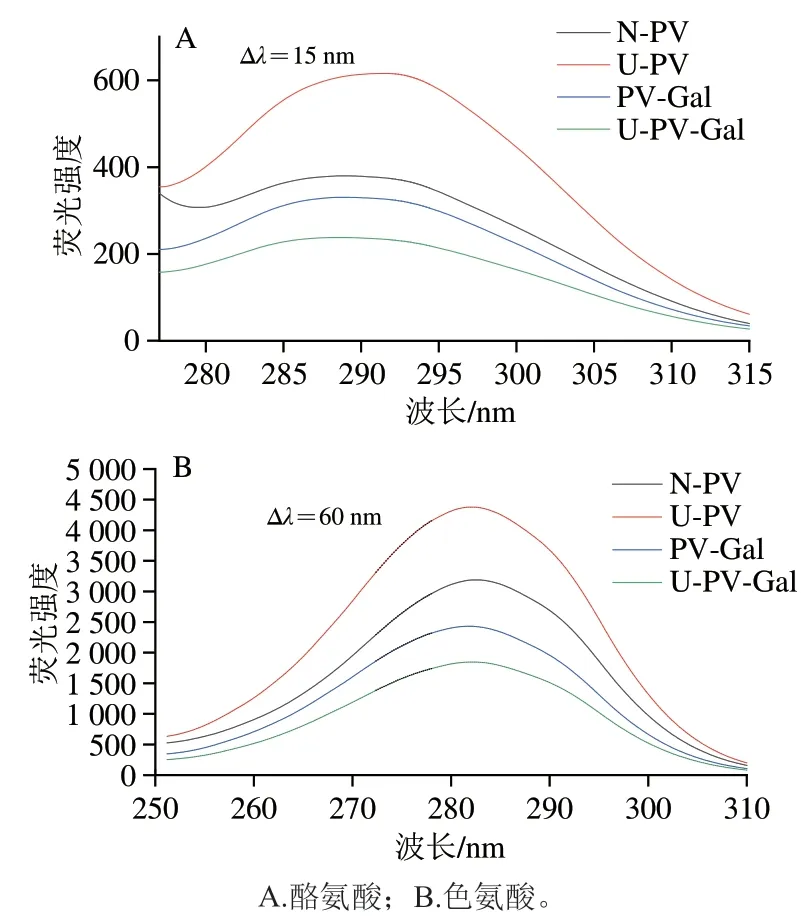
圖3 N-PV、U-PV、PV-Gal、U-PV-Gal的同步熒光光譜Fig.3 Synchronous fluorescence spectra of N-PV,U-PV,PV-Gal and U-PV-Gal
2.5 PV、PV-Gal超聲前后的紫外吸收光譜
如圖4所示,U-PV的最大吸光度大于N-PV,這是由于樣品在高能機械波的作用下產生孔洞,且氣泡不斷產生和消失,使蛋白質結構發生改變,從而使內部的色氨酸、酪氨酸等生色基團暴露至表面[27]。PV-Gal的吸光度小于N-PV,這可能是由于Gal與PV相互作用掩蓋了生色基團。而U-PV-Gal的最大紫外吸收峰最低,說明超聲波預處理PV后更易與Gal結合,使更多的色氨酸和酪氨酸遷移至內部,這與張露等[28]發現的結果一致。
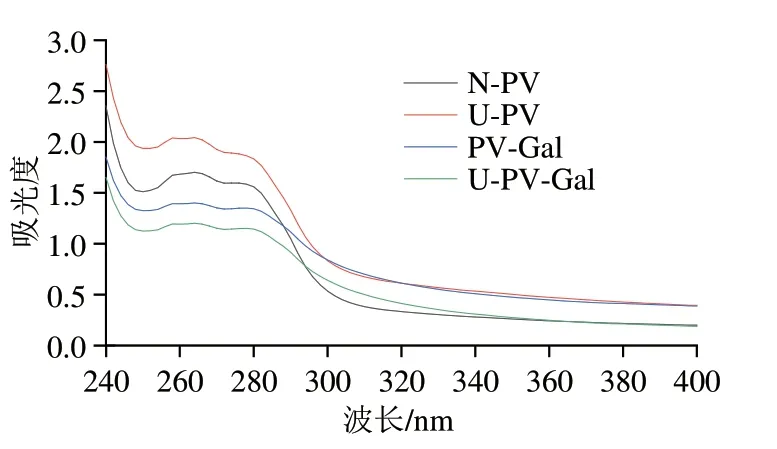
圖4 N-PV、U-PV、PV-Gal、U-PV-Gal的紫外吸收光譜Fig.4 Ultraviolet absorption spectra of N-PV,U-PV,PV-Gal and U-PV-Gal
2.6 PV-Gal和U-PV-Gal糖基化修飾位點
用高分辨質譜儀鑒定PV-Gal和U-PV-Gal的糖基化肽段數量和位點[29]。如果PV的一個肽段被一個Gal修飾,質量會增加162.052 8 Da,電荷為+2、+3明,質荷比(m/z)分別偏移81.026 4、54.017 6。如圖5A所示,電荷為+3、m/z為719.0243+的肽段AA47-65的MS圖譜中含有m/z為773.042 83+的質譜信號,m/z增加了54.018 8,說明該肽段被一個Gal修飾。如圖6A所示,m/z為773.042 83+的一個Gal修飾的肽段AA47-65的MS/MS圖譜中包含大量的b、y離子,通過b和y離子之間的差值可以精確確定糖基化修飾位點的位置,糖基化修飾位點為K55。
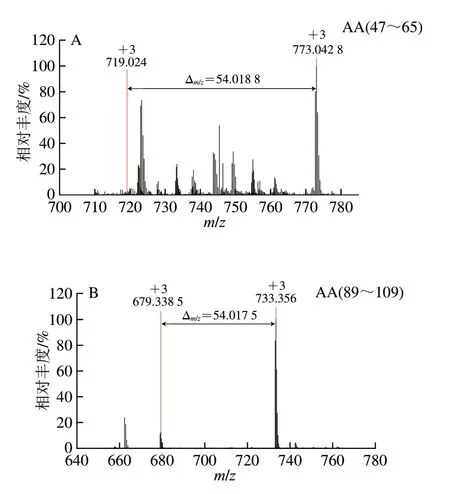
圖5 AFAVIDQDKSGFIEED(A)和AGDSDGDGKIGVDEFAALVKA(B)的一級質譜Fig.5 Primary mass spectra of peptides AFAVIDQDKSGFIEED (A)and AGDSDGDGKIGVDEFAALVKA (B)
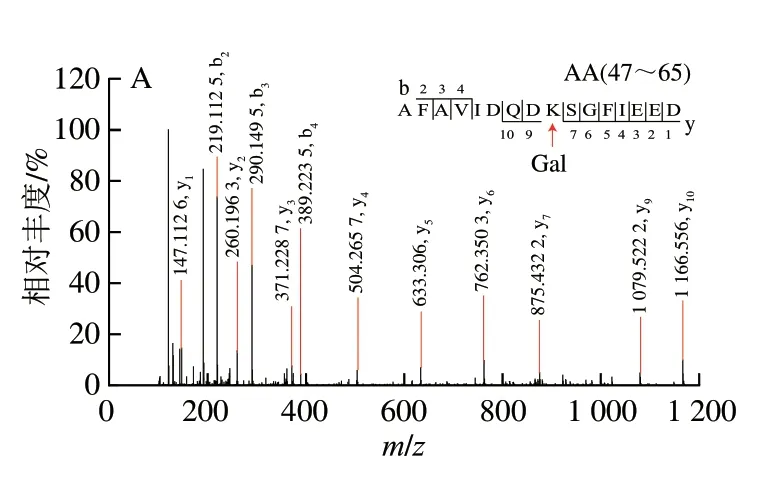
圖6 AFAVIDQDKSGFIEED(A)和AGDSDGDGKIGVDEFAALVKA(B)的二級質譜Fig.6 Secondary mass spectra of AFAVIDQDKSGFIEED (A) and AGDSDGDGKIGVDEFAALVKA (B)
類似地,如圖5B所示,電荷為+3、m/z為679.338 53+的肽段AA89-109的MS圖譜中含有m/z為733.3563+的質譜信號,m/z增加了54.017 5,說明該肽段被一個Gal修飾,糖基化修飾位點為K108。
利用上述方法鑒定了PV-Gal和U-PV-Gal的所有糖基化肽段和位點。由表2可知,PV-Gal含有4 個糖基化修飾位點,分別是K46、K55、K65和K88。而U-PV-Gal有6 個糖基化修飾位點,比PV-Gal增加了2 個修飾位點,分別是K97、K108。說明超聲波使蛋白質結構展開,暴露出更多的修飾位點。圖7A、B分別為PV-Gal和U-PV-Gal的帶狀圖,可見超聲波前后的糖基化修飾位點均分布于PV中,且糖基化修飾位點均發生在賴氨酸上,這與Zhang Nanhai等[30]的研究結果一致。這可能是由于超聲波產生的能量使PV的構象被更大程度地打亂,緊密的立體結構變得松散,使PV的結構變化,容易發生糖基化反應[31]。
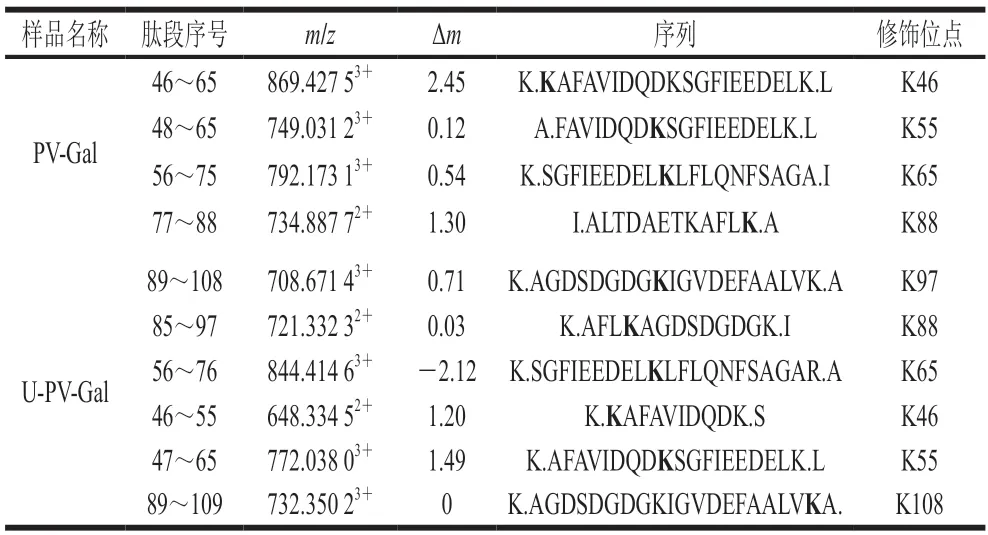
表2 PV-Gal與U-PV-Gal的糖基化修飾位點Table 2 Glycated sites of PV-Gal and U-PV-Gal

圖7 PV-Gal(A)和U-PV-Gal(B)的帶狀圖Fig.7 Ribbon diagram of PV-Gal (A) and U-PV-Gal (B)
3 結論
本實驗采用光譜和質譜等技術研究了超聲波預處理對PV Gal糖基化特性的影響。結果發現,PV與Gal發生糖基化反應,能夠對PV的結構產生影響,而超聲波預處理在很大程度上改善PV和Gal間的糖基化反應,具體表現為分子質量、反應程度、糖基化肽段和位點數量的增加、游離氨基酸質量濃度的降低以及三級結構的改變,單獨糖基化的PV僅有4 個糖基化修飾位點,而超聲波預處理后的糖基化PV糖基化修飾位點增加至6 個,說明超聲波預處理提升了蛋白質的糖基化程度。綜上,超聲波預處理是一種有效改善蛋白質糖基化特性的技術,有助于對蛋白質的定向改性,改善其功能性質。

