中草藥碳點應用研究進展△
王倩,李佳怡,沈夢怡,張倩,羅維芳,2*,唐于平,2*
1.陜西中醫藥大學 藥學院,陜西 咸陽 712046;2.陜西省中醫藥管理局中藥配伍重點研究室,陜西 西安 712046
2004 年,科研人員在電泳純化單壁碳納米管的過程中偶然發現了碳點(carbon dots,CDs)并在2006 年首次報道了CDs 的合成[1-2]。CDs 是一種粒徑較小的新型碳納米材料,不僅有傳統半導體和熒光團(小分子)的雙重優點,還有水溶性好、毒性低及生物相容性好等特點。此前,對于CDs的研究主要在合成方法及性能檢測等方面,而合成CDs的前體多數為單一化合物,如檸檬酸、甘油、L-抗壞血酸、葡萄糖、檸檬酸-尿素等。采用上述化合物前體合成CDs可能會對環境和人體造成一定危害,因而阻礙了CDs的進一步應用。近年來,隨著中藥理論的快速發展,中草藥CDs 的研究受到廣泛關注。中草藥CDs 的合成前體是藥用植物,包括根、莖、葉、花、果實、種子和其他部分,來源廣、產量大。中草藥成分復雜且不均一,含有多種活性成分,可發揮抗氧化、止血、消炎鎮痛和抗腫瘤等多種功效。本文對中草藥CDs 的合成、藥理特征及應用研究進行系統概述,并對其未來的研究前景與關鍵問題進行展望。
1 中草藥CDs的合成
CDs的合成方法主要分為2種,分別是“自上而下”合成法和“自下而上”合成法[3-8]。前者是用較小的碳前驅體(有機小分子)經過高溫熱解、微波輔助或水熱合成等方法制備CDs;后者是將大分子的碳單元通過電化學合成、激光灼燒或化學氧化等方法制備納米顆粒。其中,水熱合成法是一種成本低且較為環保的方法,因而被大多數研究者所采用(表1)。
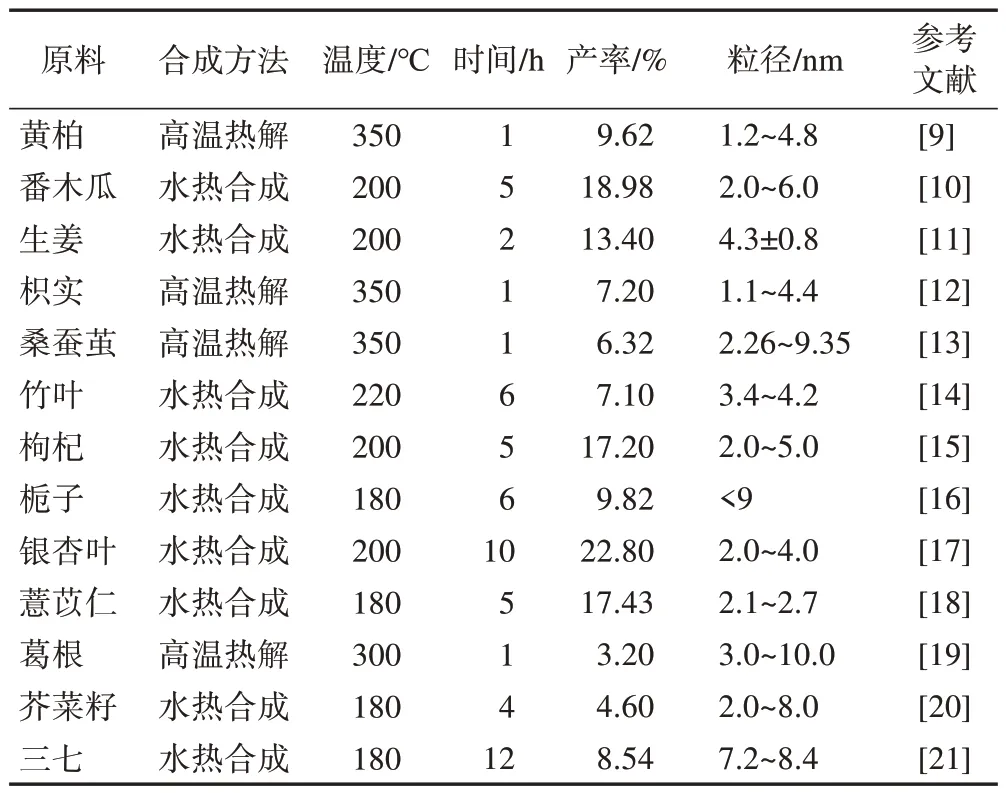
表1 中草藥CDs的合成方法
1.1 水熱合成法
水熱合成法是制備中草藥CDs常用的一種方法,此方法不僅符合綠色標準,而且合成的CDs 表面不需要經過額外的修飾與鈍化,具有毒性低的特點。制備前,中草藥需晾干,將其切成小塊或粉碎成粉末,然后浸泡在超純水中,待超聲處理完成,再將混合物轉移到不銹鋼高壓反應釜中,用特定的溫度加熱,即可獲得中草藥CDs。最后,將得到的懸浮液用0.22 μm 微孔濾膜濾過,用透析袋透析數天即可得到純化的CDs。
1.2 高溫熱解法
高溫熱解法是另一種制備中草藥CDs 的常用方法。制備前,將中草藥CDs的前體在真空或惰性氣體保護的條件下通過高溫加熱、脫水、降解和碳化等步驟除去其中可能存在的有機物質,并逐步轉化為CDs。此方法制備工藝簡單、成本低,可進行大規模生產。制備時,先將中草藥放入坩堝并用適當的溫度加熱至其碳化,然后將其碾碎放入超純水中煮沸,收集上層溶液獲得CDs。最后,將溶液用0.22 μm微孔膜濾過,用透析袋透析數天得到純化的CDs。
1.3 微波合成法
微波合成法與高溫熱解法的合成過程大體相同,但前者可在較短時間內達到預期能量,使前驅體受熱均勻。微波合成法的本質是通過一種電磁波(波長為1~100 mm)遞送能量,引發化學鍵斷裂,可顯著縮短反應時間,提高制備效率[22-23]。此外,有報道微波輔助水熱合成法可替代傳統的水熱合成法[24-25]。
2 生物學特性及藥代動力學研究
2.1 止血
中藥炮制理論記載,藥物經碳化加工后可使其性味改變,如升降沉浮發生轉化、“澀”味增加,故表現出止血功效[26-28]。黃柏(Phellodendri Chinense Cortex)為清熱燥濕藥。Liu 等[9]制備了黃柏CDs,并通過小鼠斷尾和肝劃痕模型實驗,證明了該CDs是通過激活體內血漿纖維蛋白原(FIB)系統發揮止血作用。此外,黃柏CDs 的穩定性較好,可長期儲存。碳化蒲黃(Pollen Typhae Carbonisata)為止血藥[23]。Yan 等[29]對碳化蒲黃水煎液進行分析,發現了新的水溶性CDs(PTC-CDs),證明此CDs 也是通過激活體內的FIB 系統發揮止血功效。燈心草(Junci Medulla Carbonisata)常被用于鎮靜和抗焦慮,但也有研究發現,碳化處理的燈心草還有止血功效。Cheng 等[30]在其碳化后的水溶液中發現了新的CDs(JMC-CDs),并證明JMC-CDs 不僅對血小板減少和局部出血有一定抑制作用,也可激活體內FIB 系統共同發揮止血功效。
2.2 抗腫瘤
中草藥已廣泛應用于癌癥的替代治療,可通過調節癌癥基因與抗癌基因、改變表觀遺傳修飾與腫瘤微環境等發揮輔助治療作用[12]。生姜(Rhizoma Zingiberis Recens)有抗氧化、抗癌等藥理作用。Li等[11]以生姜為碳前驅體合成了具有熒光特性和生物活性的CDs,并證明其可增加抗癌基因p53的表達、抑制體內活性氧的產生和肝癌HepG2 細胞的生長。從代謝角度看,該CDs 可在較短時間內隨尿液排出體外,避免了潛在的生物毒性。另一項研究表明,生姜CDs表面含有姜黃素(curcumin)[13],卻沒有生姜的抗癌成分6-姜辣素,再次表明中草藥經高溫碳化后活性成分與藥理作用可能發生改變。Yao 等[31]以人參皂苷Re為前體,合成了新的CDs(Re-CDs),研究表明,Re-CDs 對癌細胞的抑制作用比人參皂苷Re更強,其通過上調體內活性氧的含量和參與細胞凋亡蛋白酶介導途徑抑制癌細胞增殖。
2.3 抗痛風
嘌呤核苷酸在體內的代謝異常是誘發痛風性疾病的首要因素。黃嘌呤氧化酶(XOD)是次黃嘌呤轉化過程中的關鍵酶,也是影響體內尿酸水平的主要因素之一,其在體內過度增加會引發高尿酸血癥[15]。別嘌呤醇對其有一定抑制作用,是臨床上治療痛風和高尿酸血癥的主要藥物之一。通常情況下,可將XOD 作為判斷中草藥CDs 有無抗痛風活性的指標之一。Wang 等[12]以枳實(Aurantii Fructus Immaturus)為前驅體合成枳實CDs(AFIC-CDs),發現AFIC-CDs 可抑制高尿酸血癥大鼠血清和肝臟內的XOD 活性,降低大鼠體內尿酸、腫瘤壞死因子-α(TNF-α)和血清白細胞介素-1(IL-1)等炎癥因子含量,減輕痛風性關節炎的病理性損傷。
2.4 抗炎
脂多糖常被用來建立全身的炎癥模型,而個別中草藥卻對其有顯著的抑制作用[32-36]。例如,Wang等[28]在木炭加工的過程中發現了桑蠶繭(mulberry silkworm cocoons,MSC)-CDs,隨后用3 種經典炎癥動物模型預估MSC-CDs的抗炎作用及機制,結果表明,MSC-CDs 可減輕二甲苯誘導的小鼠耳水腫、抑制乙酸誘導的血管通透性增高、降低由脂多糖誘導的炎癥模型動物體內TNF-α和IL-6 含量,使其炎癥程度得到一定改善。曹鵬等[37]在黃芩(Scutellar Radix)炭的水煎液中分離出1 種新的碳納米類成分,該成分對二甲苯誘導的耳水腫癥狀有明顯的改善作用,同時也可降低急性腹膜炎小鼠腹腔的毛細血管通透性,具有一定的抗炎功效。
2.5 鎮痛
阿片類藥物能夠緩解和控制疼痛,5-羥色胺(5-HT)與腦啡肽(ENK)可以起到緩解疼痛的作用[26]。Zhang 等[38]利用經典熱板實驗、尾浸實驗和醋酸誘導扭體實驗研究碳酸姜CDs 的鎮痛機制,結果表明,小劑量的姜類藥物可以增加血清中ENK和β-內啡肽含量;通過比較大、中、小3 個劑量發現,C57BL/6 小鼠腦組織中ENK 含量增加,表明腦阿片系統也參與介導了碳酸姜CDs 的鎮痛作用。此外,經典熱板實驗證實了碳酸姜CDs 可調節腦組織和血清中5-HT濃度,表明姜黃素與嗎啡之間有協同鎮痛作用,但具體機制尚不清楚。目前,尚未發現此CDs 使人體產生不良反應,該研究可為鎮痛類藥物的研發提供新思路[39-44]。
2.6 藥代動力學研究
藥代動力學是闡明中藥有效成分在體內吸收、分布、代謝和排泄等動態過程的一門學科。雖然,中草藥CDs的本質是一種納米材料,但其也是由合成CDs前體中包含的主要活性成分發揮藥效,因而關于其在體內代謝與分布也是研究熱點,但卻鮮有文章報道此方面的研究成果。因此,即便中草藥CDs在細胞水平上表現出良好的安全性,但體外毒性實驗還不能證明其在整個生物系統中的安全性。因此,在后續研究中仍要不斷探索并將此方向作為研究重點[45-48]。
3 其他應用
3.1 生物傳感器
重金屬離子可通過土壤、植物和水源等途徑進入到環境中,其含量一旦超標就會對人體和環境造成不良影響,如體內Fe3+的含量發生異常波動可能引發人體慢性心力衰竭[49-52]。現有檢測方法,如光譜、色譜及電化學等方法,不僅過程復雜而且成本較高[53-55]。部分中草藥CDs可直接與重金屬離子反應,引起CDs內部電子轉移并形成穩定絡合物,出現熒光淬滅或增強現象。Sun等[33]以枸杞子(Lycii Fructus,LF)為前驅體,合成了新的水溶性LF-CDs,該CDs 表面富含羥基并基于LF-CDs 和Fe3+的內濾效應使CDs 發生熒光淬滅。Hg2+屬于劇毒性金屬離子,Sun 等[41]用梔子(Gardeniae Fructus)在不經過任何表面修飾與鈍化的情況下,合成“開-關”型氮硫共摻雜CDs(N/SCDs),用于Hg2+與半胱氨酸的檢測。此外,還有眾多中草藥CDs都可用于金屬離子的檢測(表2)。
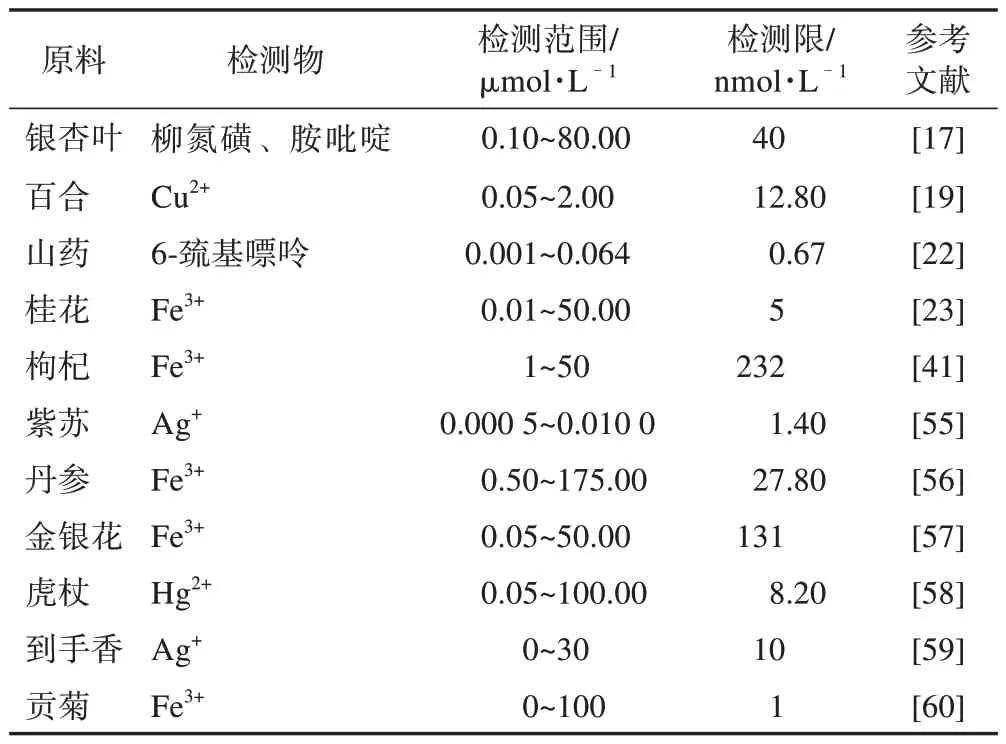
表2 中草藥CDs檢測各種金屬離子
3.2 生物成像
中草藥CDs的本質是一種粒徑較小且易被細胞吸收的納米材料。由于CDs結構中存在缺陷態與晶格缺陷態,所以具有一定的熒光可調控性。目前,已有多篇文獻報道中草藥CDs在細胞及活體組織成像方面有較好的效果[18,20-21,47-48,60-61]。Thota等[62]以檸檬草(Lemon Grass Herb,LGH)為前體合成的LGH-CDs除具有毒性低、生物相容性良好的特點外,還能夠上轉換熒光,使LGH-CDs 具有較強的穿透能力和較小的組織損傷性等特點。此外,還有許多中草藥CDs都可應用于此領域(表3)。中草藥CDs在生物成像領域的主要研究對象是細胞,而以微生物、原生動物及植物等為研究對象的生物成像還相對較少。
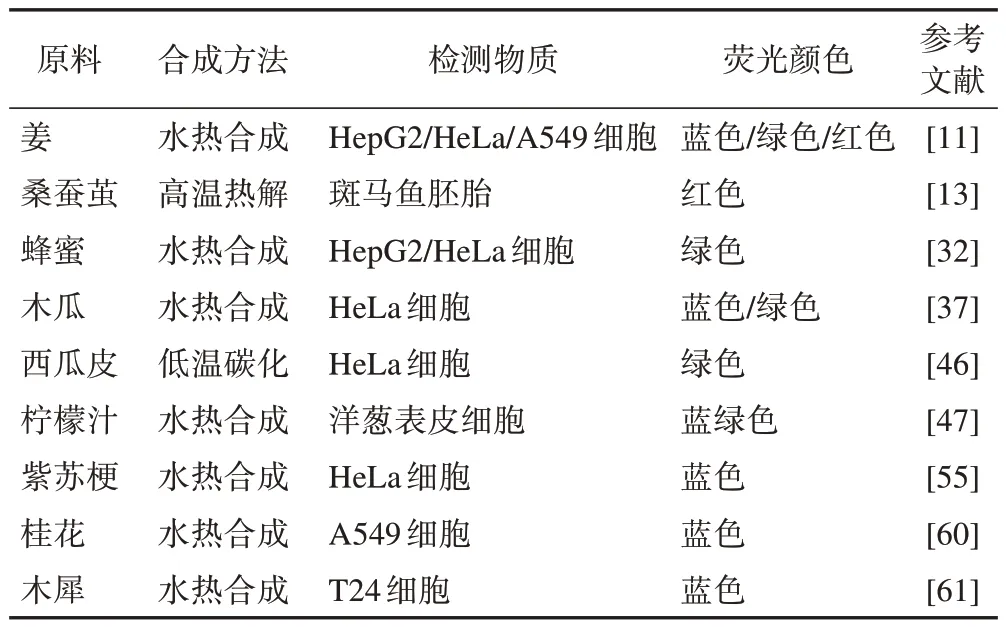
表3 能夠生物成像的中草藥CDs
4 總結與展望
CDs 作為一種新型碳納米材料有著優異的生物學特性、靈敏性、光致發光性和穩定性,被廣泛應用于離子檢測、生物成像和傳感等領域。中草藥CDs 作為CDs 的一個全新分支,具有綠色、安全的特點,也被廣泛應用于上述領域。中草藥CDs 在生物學領域中的應用可為今后治療學的發展提供新思路。中草藥CDs 也有一定缺陷,如CDs 最常用的合成方法是水熱法和微波輔助法,導致CDs 的熒光強度和粒徑大小并不穩定,因而尋求一種穩定、高效的合成方法是當前的研究熱點之一。
此外,中草藥CDs 合成的前驅體不同,其藥理活性也存在一定差異。在中藥材高溫碳化過程中,藥材中某些有效成分可能分解或產生新的有效成分。目前,中草藥CDs 在治療疾病方面已有初步的成效和進展,但在治療機制和有效成分分析等方面的研究還相對較少,可作為今后中草藥CDs 研究的一個方向。其次,雖然中草藥CDs 在體內細胞成像與傳感方面表現出良好的安全性,但經長期治療其是否會在體內積累并發生不良反應尚不清楚。中草藥CDs 的本質是納米粒子,所以其在體內的代謝途徑也是今后研究的挑戰之一。總之,中草藥CDs 在生物學領域中的應用還處于初級階段,未來有廣泛的發展空間和無限可能。
中草藥CDs 合成的前體多來源于植物,而對動物類藥物卻涉及較少,后期可開展對動物類藥物CDs 的探索研究。此外,中草藥在提取完成后,藥渣中是否仍含有部分活性成分,以及用藥渣提取合成CDs也可作為今后的研究方向。

