紅陽獼猴桃蔗糖轉運蛋白基因AcSUT2的克隆及表達分析
魯明秋 龔小見 劉林婭 龍彩鳳 趙超 黃亞成

摘要:蔗糖轉運蛋白(SUTs)能夠介導蔗糖由源組織到庫組織的裝載、運輸和卸載。以紅陽獼猴桃為材料,克隆得到紅陽獼猴桃蔗糖轉運蛋白基因AcSUT2,并對序列進行生物信息學分析。結果表明,該基因含有1 479 bp的開放閱讀框,編碼492個氨基酸,分子量和理論等電點分別為53 ku和8.82,包含12個跨膜結構域,屬于MFS家族成員和GPH超家族成員。氨基酸序列比對顯示,AcSUT2與山茶中蔗糖轉運蛋白CsSUT2同源性為84%。進化樹分析結果表明,AcSUT2屬于蔗糖轉運蛋白的SUT4亞家族。組織表達分析顯示,AcSUT2在紅陽獼猴桃各個組織中均有表達,但在雌花中表達量最高。在果實中,AcSUT2在發育的早中期(花后18~88 d)保持較高的表達量,發育后期表達量下降;CPPU能夠顯著上調AcSUT2的表達。在葉片中,AcSUT2在葉肉中的表達豐度最高,且隨著葉片的發育,在古銅期后表達量逐漸遞增。說明蔗糖轉運蛋白基因AcSUT2在紅陽獼猴桃葉片中蔗糖的裝載和果實中蔗糖卸載轉運中起著重要作用。
關鍵詞:紅陽獼猴桃;蔗糖轉運蛋白;AcSUT2基因;基因克隆;表達分析
中圖分類號:S663.401文獻標志碼:A
文章編號:1002-1302(2023)21-0036-08
獼猴桃又名奇異果,質地柔軟,口感酸甜,含有豐富的維生素C、微量元素、有機物和氨基酸,具有滋補強身等功效,有著“水果之王”的美稱,深受廣大消費者喜愛,具有極高的經濟效益[1-5]。獼猴桃作為貴州省的特色農業產業和鄉村振興戰略的重要抓手,種植面積一直在逐年增加。其中,2019年貴州省獼猴桃種植面積為3.5萬hm2[6],而2022年獼猴桃在貴州種植面積超過4萬hm2[7]。對于果樹而言,獲得高產和高品質的果實一直都是果樹學科研究的熱點和核心問題,因此挖掘果實產量和品質形成的關鍵基因并進行功能研究對獼猴桃的分子育種具有重要意義。
蔗糖作為光合作用的主要產物,其運輸和分配與作物的產量和品質息息相關[8]。蔗糖轉運蛋白(sucrose transporters or carriers,SUTs or SUCs)是一種典型的膜結合蛋白,屬于MFS(major facilitator superfamily)家族,通常具有12個典型的跨膜結構域,存在于植物的不同組織的細胞中,參與了蔗糖運輸、轉運和貯藏[9]。自首次從菠菜中發現蔗糖轉運蛋白基因SoSUT1以來,現已在眾多植物中分離得到蔗糖轉運蛋白基因,且大多數植物中蔗糖轉運蛋白基因家族包含多個成員[10]。如擬南芥中含有9個[11]、橡膠樹中含有6個[12]、水稻中含有5個[13]、胡蘿卜和芹菜中含有3個[14-15]。對蔗糖轉運蛋白序列進行同源性分析,植物SUT家族共分為SUT1、SUT2、SUT3、SUT4和SUT5這5個亞族[16]。其中SUT1亞族只存在于雙子葉植物中,SUT2亞族和SUT4亞族同時存在于雙子葉植物和單子葉植物中,SUT3和SUT5亞族僅存在于單子葉植物中,且每一類蔗糖轉運蛋白家族成員表現出不同的表達模式和生物學功能[17]。
近年來,隨著測序技術的發展,越來越多植物的基因組數據被公布,為植物SUT家族的研究奠定了基礎。研究發現,蔗糖轉運蛋白不僅僅在光合產物運輸和分配中發揮作用,還參與了植物生長發育,產量和品質形成以及應答非生物脅迫等過程。如甘薯蔗糖轉運蛋白基因與甘薯塊根淀粉積累和糖轉運相關,同時IbSUT3可以被非生物脅迫和外源脫落酸誘導表達[18]。水稻蔗糖轉運蛋白基因OsSUT4可能在水稻蔗糖源端裝載以及籽粒庫端卸載等生理過程中發揮重要作用[19];而OsSUT5則參與了水稻花粉發育與受精過程[20]。蘋果中的MdSUT4.1基因調控果實中蔗糖的積累[21],在蘋果中過表達MdSUT2.2提高了抵抗干旱、鹽脅迫等非生物脅迫的能力[22-24]。但是,目前關于紅陽獼猴桃中蔗糖轉運蛋白的研究并不多,它與果實生長發育及品質形成的關系也不清楚。本研究基于紅陽獼猴桃基因組數據和轉錄組數據,克隆了蔗糖轉運蛋白AcSUT2基因,對其序列進行生物信息學分析,并分析了其在紅陽獼猴桃果實和葉片不同樣品中表達模式,研究結果為揭示蔗糖轉運蛋白基因AcSUT2在紅陽獼猴桃果實和葉片中的功能奠定基礎,同時為培育更優秀、更高產的獼猴桃品種提供理論依據。
1 材料與方法
1.1 植物材料
供試品種為種植在貴州省六盤水市米籮鄉的8年生紅陽獼猴桃,分別選取植株健康、生長較一致的3株紅陽獼猴桃樹作為1個生物學重復進行各樣品的采集。(1)不同組織材料的采集。雄花、雌花、葉、根、樹皮于開花時采集,果實于花后118 d采集,種子于果實后熟軟化后采集。果實不同發育時期樣品的采集參照果實發育研究結果,分別在花后18、38、58、88、118 d采集。(2)CPPU處理。選擇長勢一致的紅陽獼猴桃在花后21 d用20 mg/L CPPU水溶液浸泡果實3 s,對照用水處理,于花后118 d采集果實。(3)果實不同部位樣品的采集。參照張慧琴等的研究結果[25],對花后118 d的果實分別采集果皮、外果肉、內果肉和果心。不同發育時期葉片樣品的采集,分別采集同一枝條上芽期、古銅期、淡綠期和成熟期的葉片。(4)葉片不同部位樣品的采集。選取健康的成熟期獼猴桃葉片,分別采集葉柄、主脈、二級脈和葉肉。每個試驗均設3個生物學重復,樣品采集后立即用錫箔紙包裹并置于液氮中用于RNA的提取。試驗時間為2021年12月至2022年5月。試驗地點為六盤水師范學院生物科學與技術學院。
1.2 菌株與試劑
RNAprep Pure總RNA提取試劑盒(DP441)、逆轉錄試劑盒、膠回收試劑盒(DP209)均購自天根生化科技有限公司;TransTaq@ HiFi DNA Polymerase High Fidelity(HiFi)和大腸桿菌(Escherichia coli) DH5α購自北京全式金生物技術有限公司;Phanta Max Super-Fidelity DNA Polymerase(P505)和ChamQ Universal SYBR qPCR Master Mix(Q711)購自諾唯贊-東瑞股份有限公司。DNA測序由生工生物工程(上海)股份有限公司負責完成。其他生化試劑為進口或國產分析純試劑。
1.3 基因全長cDNA的克隆
以劉林婭等改良的CTAB法[26]提取紅陽獼猴桃總RNA,濃度和質量檢測符合試驗要求用于下一步試驗。按照天根生化公司的逆轉錄試劑盒操作說明書合成cDNA第1鏈。基于紅陽獼猴桃轉錄組測序信息,設計AcSUT2基因序列的特異引物(表1),以逆轉錄的產物為模板,利用巢式PCR法對AcSUT2基因進行cDNA全長擴增。反應體系參照酶使用書,反應程序參照PCR的基本擴增程序。PCR產物經瓊脂糖凝膠電泳檢測后,按照TIANGEN公司凝膠回收試劑盒說明書進行凝膠回收,回收產物連接到pMD18-T載體送公司測序。
1.4 獼猴桃AcSUT2基因的生物信息學分析
在NCBI網站相關程序中對AcSUT2蛋白序列進行BLAST比較搜索和預測保守結構域,利用其他在線網站和軟件預測AcSUT2蛋白的理化性質、亞細胞定位預測、跨膜結構域、蛋白的二級和三級結構以及進行氨基酸同源比對和構建進化樹(表2)。
1.5 實時熒光定量PCR分析
采用伯樂公司的CFX96 Touch實時熒光定量PCR儀分析不同處理對AcSUT2基因表達的影響,具體的操作步驟以儀器說明書為準。取1 μg不同處理樣品的RNA為試驗材料,逆轉錄合成cDNA第1鏈后稀釋20倍用于實時熒光定量分析。選用SAMSC和18S作為內參基因,基因的熒光定量引物見表1,按照諾唯贊公司ChamQ Universal SYBR qPCR Master Mix(Q711)說明書設計反應程序。
1.6 數據處理
所有試驗數據均由3次重復試驗獲得,應用t檢驗法分析差異顯著性,運用最小顯著性差數法(LSD)進行單因素方差分析,差異顯著性水平均為α=0.05。
2 結果與分析
2.1 紅陽獼猴桃AcSUT2基因的克隆與序列分析
在NCBI數據庫中下載其他物種蔗糖轉運蛋白序列,通過本地BLAST工具對筆者所在實驗室的紅陽獼猴桃全長轉錄組數據庫進行比對,獲得1條包括完整開放閱讀框的基因序列。設計特異性擴增引物(表1),以紅陽獼猴桃的cDNA作為模板,克隆得到了該基因(圖1),命名為AcSUT2。序列分析顯示,該基因cDNA全長1 479 bp,與全長轉錄組數據庫中搜索得到的序列長度相符,且堿基完全一致。將擴增得到的AcSUT2序列與紅陽獼猴桃基因組數據庫(http://kiwifruitgenome.org/)進行BLAST,獲得該基因的基因組序列。對該基因組序列進行染色體定位分析,結果顯示,該基因位于紅陽獼猴桃第26號染色體5 257 975~5 263 431 bp處。利用在線軟件GSDS2.0對AcSUT2的結構進行分析,結果顯示,蔗糖轉運蛋白AcSUT2基因包含有5個外顯子和4個內含子(圖2)。
2.2 紅陽獼猴桃蔗糖轉運蛋白的生物信息學分析
通過Protparam軟件分析AcSUT2蛋白的理化性質,結果顯示AcSUT2基因編碼的蛋白包含492個氨基酸,其中亮氨酸(leucine,Leu)含量最高,占比達到11.8%。該蛋白質的分子式為 C2 439H3 792N632O650S19,預測其相對分子質量約為 53 ku,理論等電點為8.82,不穩定系數為37.34,脂肪系數為110.22,總的平均親水性系數為0.550,屬于一個較穩定的疏水性蛋白質。通過NCBI的CDD軟件預測該蛋白具有蔗糖運轉子結構域(17~484位氨基酸)和主要協同轉運蛋白家族(MFS)的保守功能結構域(34~456位氨基酸),屬于MFS家族成員,也屬于蔗糖—H+共轉運蛋白(sucrose/H+co-transporters,GPH)超家族成員。利用NetPhos 3.1 Server對AcSUT2的潛在磷酸位點進行預測,發現AcSUT2蛋白具有22個絲氨酸磷酸化位點,13個蘇氨酸磷酸化位點和2個酪氨酸磷酸化位點,說明SUT可能具有通過磷酸化修飾進行功能調控。通過SOPMA對AcSUT2蛋白二級結構進行預測,結果表明,該蛋白含有α-螺旋221個,占44.94%;β-折疊82個,占16.67%;β-轉角15個,占3.05%;無規則卷曲174個,占35.37%。同時利用SWISS-MODEL軟件預測了該蛋白的三級結構,從圖3可以看出,AcSUT2蛋白中主要的結構元件是α-螺旋和無規則卷曲,包含了少量的β-折疊和β-轉角,結果與二級結構預測相符。利用在線工具TMHMM對AcSUT2蛋白進行跨膜結構分析,該蛋白具有典型的12個跨膜結構域(分別位于第25~44、57~75、94~114、128~144、171~186、212~229、274~294、322~342、350~370、389~409、427~447和461~479位氨基酸),符合蔗糖轉運蛋白具有保守的跨膜結構域的特點。進一步利用CELLO2GO在線工具對該蛋白進行亞細胞定位預測,結果顯示AcSUT2蛋白可能主要定位于質膜上。
2.3 AcSUT2蛋白的氨基酸比對及系統進化樹分析
利用MEGA 7.0對AcSUT2蛋白和擬南芥(Arabidopsis thaliala)、水稻 (Oryza sativa)、山茶(Camellia sinensis)中的SUTs蛋白編碼的氨基酸進行序列多重比對并構建系統進化樹(圖4)。結果顯示,AcSUT2蛋白與CsSUT2、OsSUT2和AtSUC4聚在同一分支上,屬于蔗糖轉運蛋白的SUT4亞家族,推測AcSUT2蛋白可能具有同亞族蛋白相似的功能。進一步利用DNAMAN軟件對與AcSUT2蛋白在同一分支上的蛋白進行同源性比較,結果(圖5)顯示AcSUT2與CsSUT2的氨基酸序列一致性最高,達到了84%;與OsSUT2和AtSUC4的氨基酸序列一致性分別為66%和57%,表明獼猴桃與山茶的親緣關系相對較近,同屬于山茶亞目。
2.4 AcSUT2基因表達模式分析
2.4.1 AcSUT2基因的組織表達分析 為了分析AcSUT2基因在獼猴桃不同組織中的表達模式,利用qRT-PCR技術檢測了其在獼猴桃果實、樹皮和雌花等7個組織中的表達量,結果(圖6)表明,AcSUT2基因在獼猴桃的7種組織或器官中都有表達,但表達量存在差異;其他組織中的表達量均低于雌花中的表達量,推測AcSUT2基因可能在獼猴桃各個組織器官中發揮了功能 特別是在雌花的生長發育過程中起到重要作用。
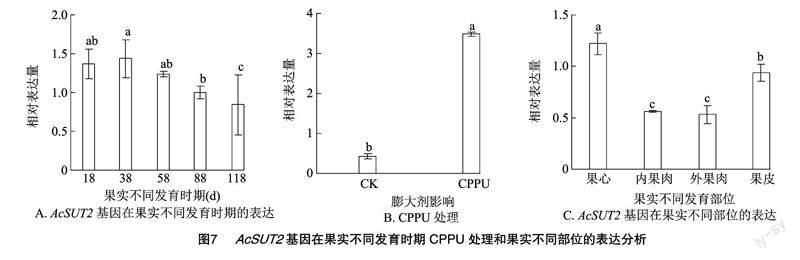
2.4.2 AcSUT2基因在果實中的表達 獼猴桃屬于呼吸躍變型果實,其果實發育過程包含了細胞分裂期、淀粉積累期和果實成熟期3個階段[24]。分析獼猴桃不同發育時期果實中AcSUT2基因的表達模式,結果(圖7-A)顯示,隨著果實的發育,AcSUT2的表達量有下降的趨勢,但在花后18~88 d的果實中AcSUT2基因的表達量維持在較高的水平,到了花后88 d果實中其表達才有明顯的下調,表明AcSUT2基因可能參與了果實的生長發育。利用qRT-PCR技術分析了AcSUT2基因在膨大劑——氯吡苯脲[1-(2-chloropyridin-4-yl)-3-phenylurea,CPPU]處理后果實和未處理果實中的表達變化情況,結果(圖7-B)表明CPPU能夠顯著上調AcSUT2基因的表達。蔗糖通常在果實不同組織間的分配具有不同的特點,為了研究AcSUT2基因是否參與了這一過程,參照張慧琴等的研究[25]將成熟期的果實分為果皮、外果肉、內果肉和果心并分析了基因在這些組織中的表達特性,結果如圖7-C所示,AcSUT2基因在果皮和果心的表達量要明顯高于外果肉和內果肉。
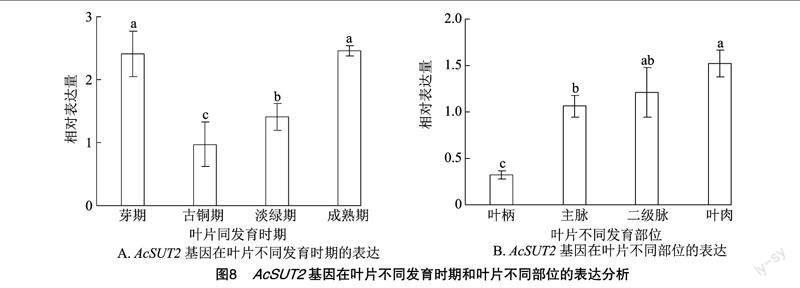
2.4.3 AcSUT2基因在葉片中的表達 蔗糖要完成“源”組織到“庫”組織的轉運,需要在葉片中進行蔗糖的裝載和運輸[27]。利用qRT-PCR分析AcSUT2基因在獼猴桃不同發育時期葉片和穩定期葉片不同部位中的表達特性,結果(圖8-A)表明,AcSUT2基因在芽期葉片中的表達量較高,而進入古銅期后,其表達量下調幅度達到2倍;之后隨著葉片的發育,基因呈顯著上調表達,穩定期恢復到芽期的水平。而穩定期葉片不同部位中AcSUT2基因的表達呈現明顯的差異性,其中AcSUT2基因在葉肉細胞中的表達豐度最高,是葉柄中表達量的3倍;在二級脈和主脈中的表達量也是葉柄中表達量的2倍(圖8-B)。
3 討論與結論
蔗糖作為光合作用的主要產物,其運輸和分配直接影響了作物的產量和品質[8]。而蔗糖轉運的載體-蔗糖轉運蛋白,在源組織韌皮部蔗糖的裝載、運輸韌皮部蔗糖的回收和運輸,以及庫組織韌皮部蔗糖的卸載過程中起著重要的作用[28]。分離鑒定紅陽獼猴桃中的蔗糖轉運蛋白,了解其表達模式,有助于解析獼猴桃蔗糖的裝載、運輸和分配機制,為獲得更優秀獼猴挑品種提供理論依據。
本研究克隆得到的紅陽獼猴桃蔗糖轉運蛋白AcSUT2基因,編碼了492個氨基酸,具有12個跨膜結構域,包含蔗糖運轉子和MFS的保守功能結構域,亞細胞定位預測在質膜上。系統發育分析該蛋白屬于蔗糖轉運蛋白SUT4亞族,且序列比對也顯示AcSUT2氨基酸序列與其他物種中SUT4亞族的蔗糖轉運蛋白的氨基酸序列具有較高的相似性。Kühn等將植物中的蔗糖轉運蛋白分為5個亞族,各亞族成員氨基酸序列的差異暗示它們在植物體內具有不同的生物學功能[16]。根據序列與功能的高度保守,AcSUT2可能與AtSUT4一樣,屬于低親和性/高轉運能力類型的蔗糖轉運蛋白,能介導高濃度蔗糖在細胞內外的運輸,參與蔗糖的裝載等過程[29]。后續將在酵母突變體(SUSY7/ura3)菌株中對AcSUT2蛋白進行蔗糖轉運活性的研究提供基礎。
目前為止,在梨[30]、蘋果[31]和桃[32]等作物中均已克隆得到蔗糖轉運蛋白基因,并明確了它們可以通過參與源器官和庫器官中蔗糖裝載、運輸、卸載和貯藏進而調控果實的生長發育和品質形成。紅陽是我國自主培育的優秀獼猴桃品種,具有紅色的內果肉和高糖低酸的優良特點[33],在四川和貴州省六盤水廣泛種植,成為國家鄉村振興的重要產業。而當前對于蔗糖轉運蛋白是否通過調控獼猴桃源組織(葉)和庫組織(果實)中蔗糖的代謝影響其優良性狀的形成尚未清楚。本研究中獼猴桃SUT4亞族成員AcSUT2的組織表達分析顯示其在所檢測的7個紅陽獼猴桃的組織和器官中均有表達,這表明AcSUT2可能參與了源器官和庫器官中蔗糖代謝,具有蔗糖轉運蛋白SUT4亞族成員表達模式和功能多元化的特點[34]。獼猴桃果實作為主要的庫器官,果實發育的早期是細胞分裂、分化的高峰期,也是淀粉大量積累的階段,因此需要充足的蔗糖輸入果實[35]。2016年陳成的研究證實,在獼猴桃果實的發育階段,蔗糖是以質外體途徑通過韌皮部卸載到果實中的[36]。在本研究中,AcSUT2基因在果實發育的早期表達量處于較高的水平,而在果實發育后期表達開始下降,且CPPU能夠顯著上調AcSUT2的表達。結果表明,AcSUT2可能在獼猴桃果實的膨大初期和快速膨大期通過介導蔗糖的卸載影響果實中蔗糖的輸入,從而調控果實的生長發育。同時,成熟期果實不同部位的表達模式顯示,AcSUT2基因主要在果心和果皮中大量表達,這很可能在于AcSUT2參與了蔗糖在果實不同組織部位的分配。葉片作為輸入果實中蔗糖的主要合成場所,其合成蔗糖能不能有效地裝載、輸出會嚴重影響果實的生長發育[37]。對葉片不同發育時期中AcSUT2基因的表達分析結果顯示,葉片從古銅期發育到成熟期,AcSUT2呈明顯的上調表達。事實上,隨著葉片的發育,葉片光合作用合成蔗糖的能力也會增強,因此高表達水平的蔗糖轉運蛋白AcSUT2可以幫助葉片中蔗糖更好地代謝。而芽期葉片中AcSUT2基因的表達量較高則主要是因為芽期的葉片屬于庫器官,需要大量的蔗糖來滿足自身的生長發育。成熟期葉片不同部位中AcSUT2基因表達模式的分析結果顯示,AcSUT2主要在葉肉組織中高度表達,表明AcSUT2基因可能是參與葉片中蔗糖裝載的候選蔗糖轉運蛋白基因,但是此結論還需要進一步驗證。
參考文獻:
[1]張 維,付復華,羅賽男,等. 湖南紅心獼猴桃品種品質評價及綜合分析[J]. 食品與發酵工業,2021,47(5):201-210.
[2]張 婷,李 琛,羅安偉,等. 8種獼猴桃不同組織部位的體外抗氧化活性[J]. 食品科學,2016,37(19):88-93.
[3]黎曉茜,龍友華,尹顯慧,等. 茉莉酸甲酯處理對獼猴桃軟腐病菌作用機制及果實品質的影響[J]. 食品科學 2019,40(15):239-248.
[4]張春蘭,李葦潔,姚紅艷,等. 不同獼猴桃品種根際AM真菌多樣性與土壤養分相關性分析[J]. 果樹學報,2017,34(3):344-353.
[5]黃 誠,周長春,李 偉. 獼猴桃的營養保健功能與開發利用研究[J]. 食品科技,2007,32(4):51-55.
[6]黃興成,朱華清,楊葉華,等. 貴州省獼猴桃產量特征及影響因素分析[J]. 中國果樹,2023(2):117-121.
[7]史 鵬. 蘋果蔗糖轉運蛋白基因的生物信息學分析[J]. 山西農業科學,2019,47(6):966-969.
[8]Xu X,Yang Y,Liu C,et al. The evolutionary history of the sucrose synthase gene family in higher plants[J]. BMC Plant Biology,2019,19(1):566.
[9]Yan N. Structural advances for the major facilitator superfamily (MFS) transporters[J]. Trends in Biochemical Sciences,2013,38(3):151-159.
[10]王利芬,張虎平,張紹鈴. 植物蔗糖轉運蛋白及其功能調節研究進展[J]. 植物研究,2012,32(4):501-507.
[11]Arabidopsis G I. Analysis of the genome sequence of the flowering plant Arabidopsis thaliana[J]. Nature,2000,408(6814):796-815.
[12]Dusotoit-Coucaud A,Brunel N,Kongsawadworakul? P,et al. Sucrose importation into laticifers of Hevea brasiliensis,in relation to? ethylene stimulation of latex production[J]. Annals of Botany,2009,104(4):635-647.
[13]Aoki N,Hirose T,Scofield G N,et al. The sucrose transporter gene family in rice[J]. Plant Cell Physiology,2003,44(3):223-232.
[14]Shakya R,Sturm A. Characterization of source-and sink-specific sucrose/K+symporters from carrot [J]. Plant Physiology,1998,118(4):1473-1480.
[15]Noiraud N,Delrot S,Lemoine R. The sucrose transporter of celery. Identification and expression during salt stress[J]. Plant Physiology,2000,122(4):1447-1455.
[16]Kühn C,Grof C P. Sucrose transporters of higher plants[J]. Current Opinion in Plant Biology,2010,13(3):288-298.
[17]Kühn C. A comparison of the sucrose transporter systems of different plant species[J]. Plant Biology,2003,5(3):215-232.
[18]王丹丹,柳洪鵑,王紅霞,等. 甘薯蔗糖轉運蛋白基因IbSUT3的克隆及功能分析[J]. 作物學報,2020,46(7):1120-1127.
[19]李孟珠,王高鵬,巫 月,等. 水稻蔗糖轉運蛋白OsSUT4參與蔗糖轉運的功能研究[J]. 中國水稻科學,2020,34(6):491-498.
[20]張雅文,包淑慧,唐振家,等. 蔗糖轉運蛋白OsSUT5在水稻花粉發育及結實中的作用[J]. 中國農業科學,2021,54(16):3369-3385.
[21]Peng Q,Cai Y,Lai E,et al. The sucrose transporter MdSUT4.1 participates in the regulation of fruit sugar? accumulation in apple[J]. BioMed Central,2020,20(1):191.
[22]Ma Q J,Sun M H,Lu J,et al. An apple sucrose transporter MdSUT2.2 is a phosphorylation target for protein? kinase MdCIPK22 in response to drought[J]. Plant Biotechnology Journal,2019,17(3):625-637.
[23]Ma Q J,Sun M H,Kang H,et al. A CIPK protein kinase targets sucrose transporter MdSUT2.2 at Ser254 for? phosphorylation to enhance salt tolerance[J]. Plant Cell And Environment,2019,42(3):918-930.
[24]Richardson A C,Boldingh H L,McAtee P A,et al. Fruit development of the diploid kiwifruit,Actinidia chinensis ‘Hort16A[J]. BMC Plant Biology,2011,11(1):182.
[25]張慧琴,謝 鳴,張 琛,等. 獼猴桃果實發育過程中淀粉積累差異及其糖代謝特性[J]. 中國農業科學,2014,47(17):3453-3464.
[26]劉林婭,楊 那,代 玥,等. 一種大量提取獼猴桃不同組織高質量總RNA的方法[J]. 江西農業學報,2020,32(9):30-34.
[27]戚繼艷,陽江華,唐朝榮. 植物蔗糖轉運蛋白的基因與功能[J]. 植物學通報,2007,24(4):532-543.
[28]許海峰,曲常志,劉靜軒,等. 蘋果液泡膜蔗糖轉運蛋白基因MdSUT4的表達分析與功能鑒定[J]. 園藝學報,2017,44(7):1235-1243.
[29]Schulz A,Beyhl D,Marten I,et al. Proton-driven sucrose symport and antiport are provided by the vacuolar? transporters SUC4 and TMT1/2[J]. Plant Journal,2011,68(1):129-136.[HJ2.03mm]
[30]Wang L F,Qi X X,Huang X S,et al. Overexpression of sucrose transporter gene PbSUT2 from Pyrus bretschneideri enhances sucrose content in Solanum lycopersicum fruit[J]. Plant Physiology and Biochemistry,2016,105:150-161.
[31]周 蘭,張利義,張彩霞,等. 蘋果實時熒光定量PCR分析中內參基因的篩選[J]. 果樹學報,2012,29(6):965-970.
[32]Tong Z G,Gao Z H,Wang F,et al. Selection of reliable reference genes for gene expression studies in peach using real-time PCR[J]. BMC Molecular Biology,2009,10(1):71.
[33]呂 巖. 紅陽獼猴桃主要特點[J]. 西北園藝,2001(3):37-38.
[34]Weise A,Barker L,Kuhn C,et al. A new subfamily of sucrose transporters,SUT4,with low affinity/high capacity? localized in enucleate sieve elements of plants[J]. Plant Cell,2000,12(8)51345-51355.
[35]張慧琴,謝 鳴,張 琛,等. 獼猴桃果實發育過程中淀粉積累差異及其糖代謝特性[J]. 中國農業科學,2014,47(17):3453-3464.
[36]陳 成. 美味獼猴桃果實中糖卸載特性分析[D]. 楊凌:西北農林科技大學,2016:19.
[37]Patrick J W,Botha F C,Birch R G. Metabolic engineering of sugars and simple sugar derivatives in plants[J]. Plant Biotechnology Journal,2013,11(2):142-156.
收稿日期:2023-02-25
基金項目:貴州省科學技術基金(編號:黔科合基礎[2020]1Y115、黔科合基礎[2019]1445號);貴州省六盤水市科技計劃(編號:52020-2022-PT-03、52020-2022-PT-20);六盤水師范學院高層次人才科研啟動基金(編號:LPSSYKYJJ201705、LPSSYKYJJ202205);六盤水師范學院科學研究計劃(編號:LPSSYLPY202213)。
作者簡介:魯明秋(1995—),男,內蒙古巴彥淖爾人,碩士研究生,研究方向植物生物化學與分子生物學。E-mail:871463532@qq.com。
通信作者:黃亞成,博士,副教授,研究方向為植物生物化學與分子生物學,E-mail:yachenghuang1314@126.com;趙 超,碩士,正高級實驗師,研究方向為中藥化學成分與藥物代謝,E-mail:chaozhao@126.com。

