胍基乙酸對許氏平鲉生長性能、消化吸收、代謝及抗氧化能力的影響
郝甜甜,于朝磊,孫永智,李寶山,王曉艷,王成強,李 璐,黃炳山
(1.山東省海洋資源與環境研究院/山東省海水漁用飼料工程技術研究中心/水生動物營養與飼料研發創新示范平臺/山東省海洋生態修復重點實驗室/煙臺市海珍品質量安全控制與精深加工重點實驗室,山東 煙臺 264006;2.煙臺經海海洋漁業有限公司,山東 煙臺 264003)
許氏平鲉(Sebastes schlegelii),隸屬于鲉形目(Scorpaeniformes) 鲉科 (Scorpaenidae) 平鲉屬(Sebastes),具有肉質鮮美、營養豐富、抗病力強等優勢,隨著國家政策的支持和消費市場的日益成熟,已成為我國北方沿海地區深水網箱養殖對象,為具有開發前景的海水魚類養殖魚種之一[1]。近年來,本課題組在許氏平鲉配合飼料氮脂比[2]、不飽和脂肪酸[3]、維生素[4]等方面開展研究,而許氏平鲉在深水網箱養殖中受風浪、潮汐和水溫、季節等環境因素影響,導致飼料中的蛋白、脂肪等能量物質更多應用于環境應激而不是用于生長,嚴重影響許氏平鲉深遠海網箱養殖的經濟效益。因此,開發功能性飼料添加劑,通過營養調控實現許氏平鲉將營養物質更多轉化為生長而不是應激供能是目前面臨的課題。
胍基乙酸(guanidinoacetic acid,GAA)又稱胍乙酸、乙酸胍,N-咪基甘氨酸,是一種甘氨酸衍生物,也是肌酸合成的唯一前體物質,與磷酸肌酸一起通過三磷酸腺苷(ATP)再生參與細胞能量代謝[5]。GAA 目前已被歐盟納入飼料添加劑目錄。已有研究表明,飼料中添加胍基乙酸具有提高動物生長性能[6]、機體氨基酸代謝、肌酸合成、抗應激和抗氧化等諸多功能[7-8]。Lim 等[9]報道,GAA 結合磷酸基團形成的GAA-p 能使卷吻沙蠶(Glycera chirori)在海底火山沉積物這種極端環境中瞬時供能,趨利避害;王子苑等[10]發現在肉牛日糧中補充GAA 能提高磷酸肌酸和ATP 等高等能量物質的存貯量或利用效率;Degroot 等[11]在肉仔雞實驗中發現,在精氨酸不足的飼料中添加GAA,GAA 對內源精氨酸具有保留效應,可使精氨酸更多的用于蛋白質合成,從而提高動物機體的生長性能。但目前GAA 在飼料中的應用研究多見于畜禽,水產方面僅見于草魚(Ctenopharyngodon idella)[12]、建鯉(Cyprinus carpiovarjian)[13]等淡水魚,而GAA 在海水魚上的研究鮮有報道。因此,本實驗研究GAA對許氏平鲉生長性能、消化吸收、代謝及抗氧化能力的影響,評估GAA在實用飼料中的適宜添加水平,旨在為GAA在許氏平鲉網箱養殖配合飼料中的應用提供理論依據和技術支撐。
1 材料與方法
1.1 實驗設計與飼料制作
以魚粉、大豆濃縮蛋白、發酵豆粕和發酵棉粕為主要蛋白源,魚油和豆油為主要脂肪源,設計粗蛋白質量分數為44.00%、粗脂肪質量分數為9.00%的基礎飼料配方。在基礎飼料中分別添加質量分數0.00%、0.01%、0.02%、0.04%、0.08%的胍基乙酸(GAA,純度≥99%,購自湖南泰仁藥業有限公司),配成5種等氮等脂的配合飼料,分別命名為D0、D1、D2、D3 和D4 組,其中D0 組為對照組。制作飼料時,所有飼料原料粉碎過孔徑0.25 mm篩,按飼料配方表(表1)混合均勻,加入魚油、豆油及適量水,再次混勻,經螺旋擠壓機加工成粒徑6 mm 的飼料顆粒,60 ℃烘干后放置-20 ℃冰箱備用。表2 為實驗飼料營養組成。
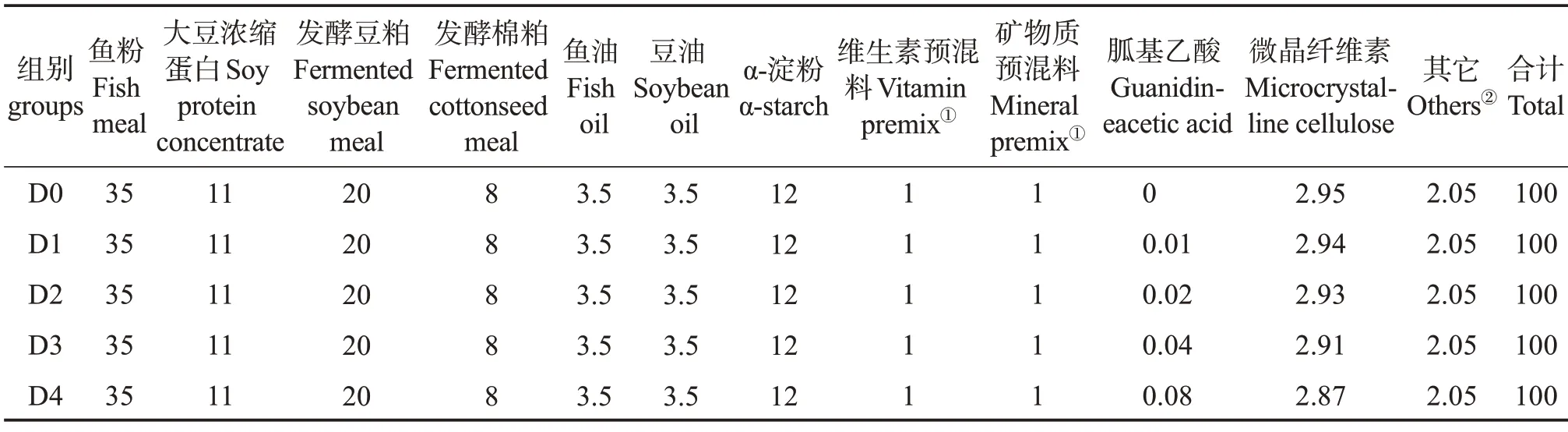
表1 基礎飼料組分質量分數Table 1 Mass fraction of basic diets components %
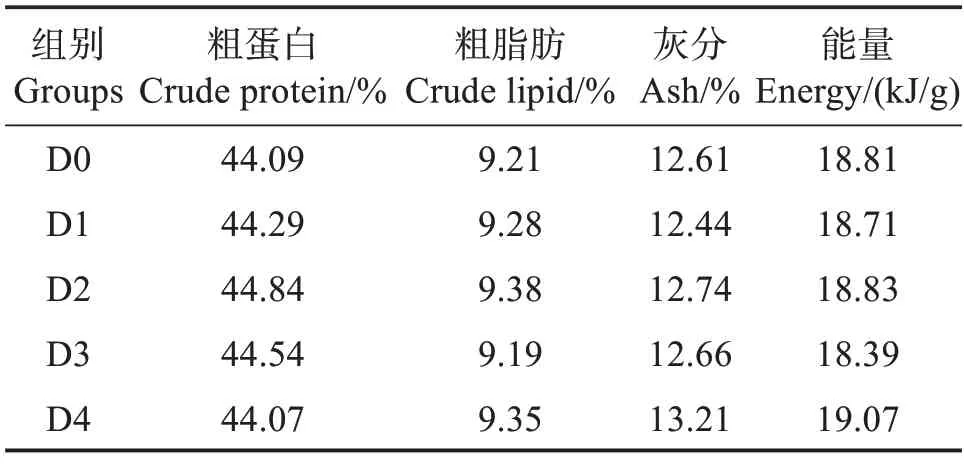
表2 實驗飼料常規營養水平(干基)Table 2 Nutrient levels of experimental diets(dry mass basis)
1.2 實驗用魚和實驗條件
實驗魚購自煙臺經海海洋漁業有限公司,養殖地點為山東省長島縣離岸網箱養殖區。正式開始實驗之前將實驗魚放入置于網箱(3 m×2 m×1 m)中暫養1 周,暫養期間投喂對照組飼料。暫養結束后,禁食24 h,挑選體格健壯,規格均一的許氏平鲉[初始體質量(125.00±1.00)g]隨機分成5 組,每組3個網箱(1 m×1 m×1 m),每個網箱20 尾魚。養殖時間為2023 年9 月28 日至11 月15 日,共49 d,每天投喂2 次(8:00、17:00),日投喂量為魚體質量的1.5%~2.0%,觀察每日攝食情況,按實際攝食情況調整投喂量。養殖期間如有死魚記錄數量并稱質量。整個實驗期間,自然海水溫度(14~22 ℃)。
1.3 樣品采集
樣品采集過程嚴格按照山東省海洋資源與環境研究院實驗動物倫理委員會要求執行,符合動物保護、動物福利和倫理原則。養殖實驗結束后,實驗魚禁食24 h,采用質量濃度為30 mg/L 丁香酚(純度≥98%)麻醉,以網箱為單位稱質量,記錄每網箱實驗魚的數量和體質量,計算成活率、增重率、特定生長率和飼料系數。每桶隨機選擇10尾魚,分別測體質量、體長,計算肥滿度,并抽血后解剖內臟分離肝臟;血樣4 ℃靜置4 h,以4 000 r/min 離心10 min,取血清,-70 ℃待測。
1.4 測定指標與方法
1.4.1 生長指標
式中,m0為實驗開始時魚體質量(g),mt為實驗結束時魚體質量(g),t為養殖周期(d),L為實驗魚體長(cm),mf為攝食量(g),wp為飼料蛋白質量分數,Ni、Nf分別為實驗開始和結束時實驗魚存活數。
1.4.2 營養成分分析 飼料和全魚的營養常規成分測定按照AOAC 方法測定。水分采用105 ℃恒溫干燥法(GB/T6435—2014),粗蛋白采用凱氏定氮法(GB/T6432—2018),粗脂肪采用索氏抽提法(GB/T6433—2006),粗灰分采用550 ℃失重法(GB/T6438—2007)。飼料能量采用燃燒法測定(IKA,C6000,Germany)。
1.4.3 腸道消化酶活力測定 腸道胰蛋白酶、淀粉酶、脂肪酶活力均采用南京建成生物工程研究所試劑盒測定,具體操作嚴格按照各試劑盒說明書執行。酶液蛋白質濃度采用考馬斯亮藍法測定。
1.4.4 血清生化指標測定 血清中谷草轉氨酶(aspartate transaminase,AST)、谷丙轉氨酶(alanine aminotransferase,ALT)活力、甘油三酯(triglyceride,TG)、總膽固醇(total cholesterol,TCHO)、高密度脂蛋白膽固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白膽固醇(low density lipoprotein cholesterol,LDL-C)、血糖(glucose,GLU)含量均采用南京建成生物工程研究所試劑盒測定。
1.4.5 肝臟糖代謝酶活力和抗氧化酶活力指標測定 將肝臟樣品與無菌生理鹽水按照質量(g)體積(mL)比1∶9 冰浴下勻漿,以4 ℃、4 000 r/min 離心10 min,收集上清液獲得肝臟勻漿液,用于肝臟糖代謝酶活及抗氧化酶活指標的測定。肝臟丙酮酸激酶(pyruvate kinase,PK)、磷酸果糖激酶(phosphofructokinase,PFK)、肌酸激酶(creatine Kinase,CK)酶活和肌酸(creatine,Cr)活力采用Elisa 試劑盒(南京建成生物工程研究所)測定;肝臟總抗氧化能力(total antioxidant capacity,T-AOC)、超氧化物歧化酶(superoxide dismutase,SOD)活力、丙二醛(malondialdehyde,MDA)含量、谷胱甘肽過氧化物酶(glutathione peroxidase,GSH-PX)活力采用試劑盒檢測(南京建成生物工程研究所)。肝臟勻漿上清液蛋白質濃度采用考馬斯亮藍法測定。
1.5 數據分析
采用SPSS 17.0 對所得數據進行單因素方差分析(One-Way ANOVA),差異顯著,則采用Duncan 氏進行多重檢驗,顯著水平為α=0.05,統計數據以平均值±標準差形式表示。
2 結果
2.1 胍基乙酸對許氏平鲉生長性能的影響
由表3 可知,各組間許氏平鲉成活率無顯著差異(P>0.05)。飼料中添加胍基乙酸顯著提高了魚體的終末質量、增重率、特定生長率和蛋白質效率(P<0.05),其中增重率在D3組達到最高值,比對照組(D0 組)顯著提高33.48%。飼料系數則呈相反趨勢,在D1、D2、D3 和D4 組顯著低于D0 組(P<0.05),并在D3 組達到最低值。飼料中添加胍基乙酸對魚體肥滿度無顯著影響(P>0.05)。
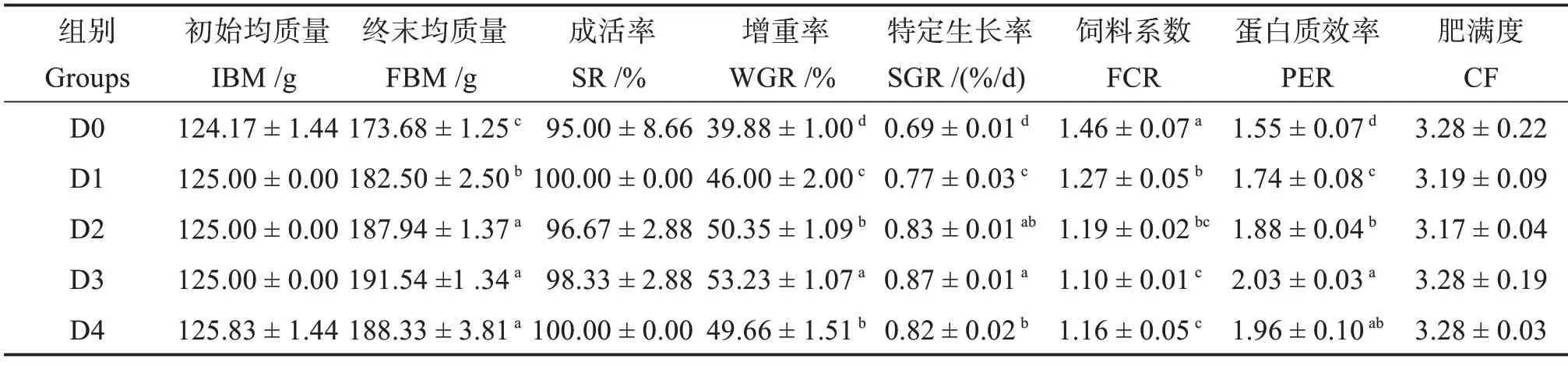
表3 胍基乙酸對許氏平鲉生長性能和形體指標的影響Table 3 Effects of guanidine acetic acid on growth performance and the morphometric parameters of Sebastes schlegelii.
2.2 胍基乙酸對許氏平鲉全魚體成分的影響
由表4可知,隨飼料中胍基乙酸含量升高,全魚粗蛋白和粗脂肪含量雖有上升趨勢,但各組之間差異不顯著(P>0.05)。各組之間全魚水分和粗灰分含量無顯著差異(P>0.05)。
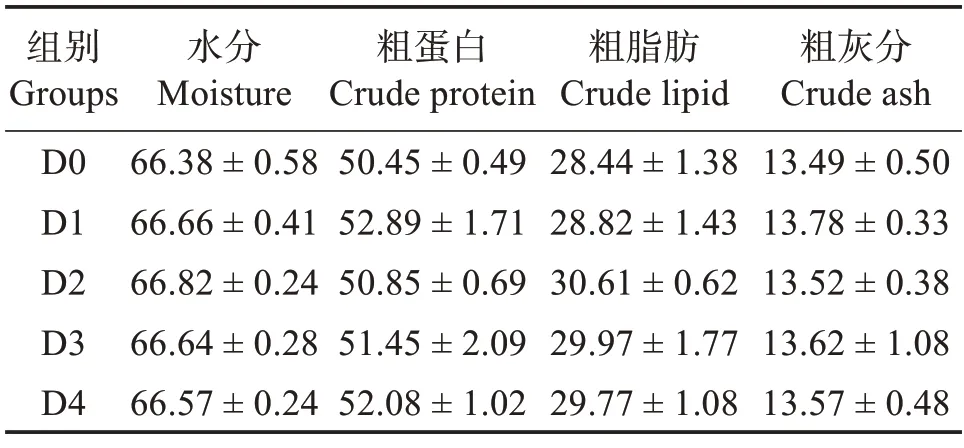
表4 胍基乙酸對許氏平鲉全魚體成分的影響Table 4 Effect of guanidine acetic acid on proximate composition of the whole body of Sebastes schlegelii
2.3 胍基乙酸對許氏平鲉腸道消化酶的影響
由表5 可知,飼料中添加胍基乙酸顯著影響了許氏平鲉腸道胰蛋白酶活力、脂肪酶活力和淀粉酶活力(P<0.05)。胰蛋白酶活力呈先上升后下降趨勢,在D3 組達到最高值,顯著高于其他各組(P<0.05);脂肪酶活力則在D3 和D4 組顯著高于其他3 組(P<0.05);淀粉酶活力變化趨勢與胰蛋白酶一致,在D1、D2、D3 和D4 組顯著高于對照組(P<0.05)。
2.4 胍基乙酸對許氏平鲉血清生化指標的影響
由表6 可知,飼料中添加胍基乙酸對血清中ALT 和AST 活力無顯著影響(P>0.05)。胍基乙酸顯著提高了血清中TG 含量,其中在D3 組達到最高值,顯著高于D0—D2 組(P<0.05),但與D4 組無顯著差異(P>0.05);TCHO 含量呈稍上升趨勢,但各組之間無顯著差異(P>0.05);高密度脂蛋白膽固醇在D1—D4 組顯著高于對照組(P<0.05);低密度脂蛋白膽固醇在各組之間無顯著差異(P>0.05)。各組之間血糖濃度無顯著差異(P>0.05)。
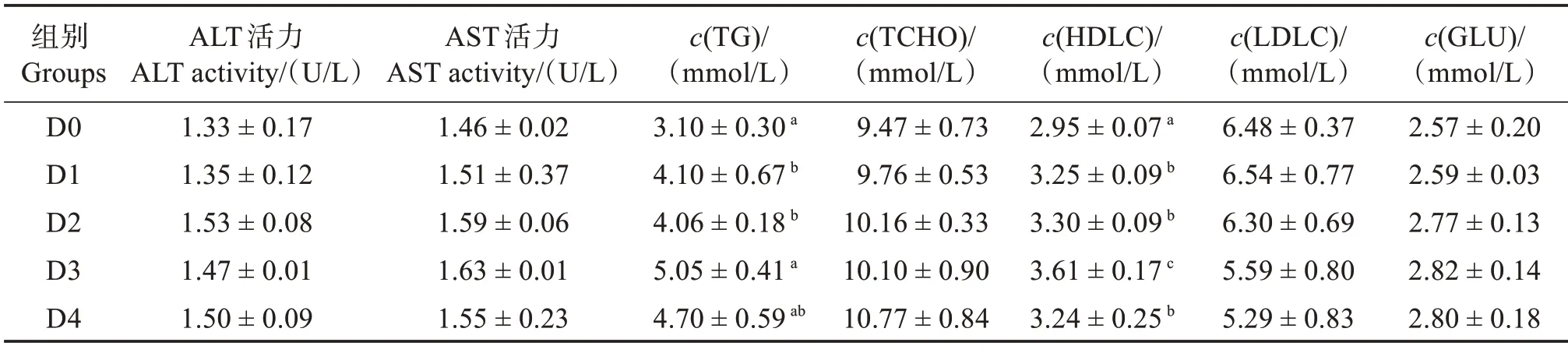
表6 胍基乙酸對許氏平鲉血清生化指標的影響Table 6 Effect of guanidine acetic acid on serum biochemical indices of Sebastes schlegelii
2.5 胍基乙酸對許氏平鲉肝臟糖代謝酶活的影響
飼料中添加胍基乙酸對許氏平鲉肝臟糖代謝酶活產生了顯著影響(P<0.05)(表7)。PK 活力和CK 活力均在D1、D2、D3 和D4 組顯著低于對照組(P<0.05);PFK 則隨胍基乙酸水平變化呈先下降后上升趨勢,在D3 組達到最低值,顯著低于對照組(P<0.05),其他組則與對照組無顯著差異(P>0.05);Cr 含量則隨胍基乙酸水平變化呈上升趨 勢,在D2—D4 組顯著高于D0 和D1 組(P<0.05)。
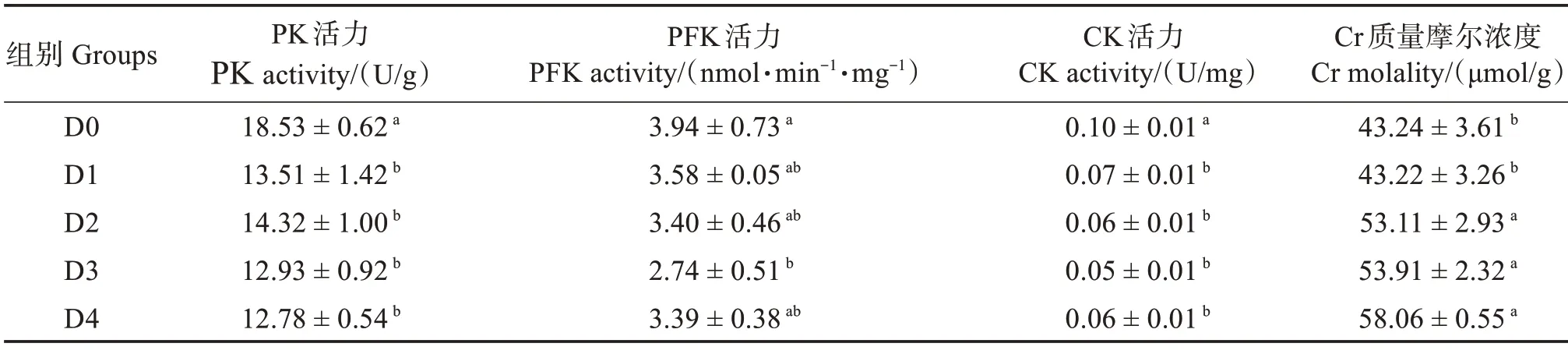
表7 胍基乙酸對許氏平鲉肝臟糖代謝酶活的影響Table 7 Effect of guanidine acetic acid on carbohydrate metabolic enzymes in the liver of Sebastes schlegelii
2.6 胍基乙酸對許氏平鲉肝臟抗氧化能力的影響
由表8 可知,飼料中添加胍基乙酸顯著提高了許氏平鲉肝臟的抗氧化能力,其中T-AOC 在D1—D4 組顯著高于對照組(P<0.05),SOD 活力在D2、D3 和D4 組顯著高于對照組(P<0.05);GSH-PX 活力則隨飼料中胍基乙酸水平的生長呈先上升后下降趨勢,在D2 和D3 組顯著高于D0、D1 和D4 組(P<0.05);MDA 含量在D1—D4 組顯著低于對照組(P<0.05)。
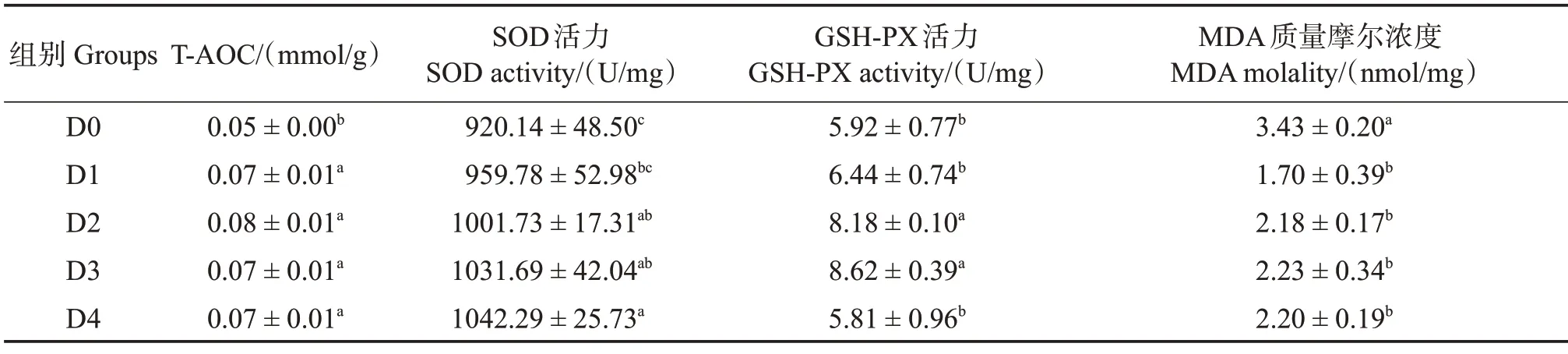
表8 胍基乙酸對許氏平鲉肝臟抗氧化能力的影響Table 8 Effect of guanidine acetic acid on antioxidant capacities in the liver of Sebastes schlegelii
3 討論
3.1 胍基乙酸對許氏平鲉生長性能和體成分的影響
生長性能是衡量深遠海網箱養殖魚類經濟效益的重要指標,提高生長性能對于提高深遠海網箱養殖競爭力尤為關鍵。班博等[14]研究表明,飼料中添加胍基乙酸,可促進動物機體能量代謝,減少碳水化合物、脂肪和蛋白質分解功能,提升動物生產性能,提高飼料利用率。研究發現,在飼料添加質量分數0.12%~0.18% 的GAA,尼羅羅非魚(Oreochromis niloticus)增重率顯著提高[15];飼料中添加300 mg/kg GAA 顯著提高草魚增重率[12];飼料中添加0.4 g/kg GAA 顯著提高牛蛙(Lithobates catesbeianus)的生長性能[16]。本實驗結果也表明,飼料中添加GAA(質量分數0.01%~0.08%)顯著提高許氏平鲉增重率和特定生長率,降低了飼料系數。基于國內外對GAA的研究,認為其促進動物生長機制主要與能量補充、節約精氨酸和促進肌纖維發育等3 個方面密切相關:(1)飼料中補充GAA 可提高磷酸肌酸和肌肉中的肌酸含量,為細胞能量代謝提供更多ATP,減少了機體脂肪和蛋白質耗能[17],從而提高魚體生長性能;(2)飼料中添加外源GAA減少了機體內源精氨酸消耗,可促使更多精氨酸用于蛋白質合成、細胞信號轉導和激素釋放等生理功能,進而促進魚體生長[18];(3)GAA 可通過抑制miR-133a-3p和miR-1a-3p的表達激活Akt/mTOR/S6 信號通路,改善肌肉組織能量,促進肌纖維的發育,進而改善動物機體生長性能[19]。肥滿度可以作為衡量魚體能量狀態的常用形體學參數[20]。本研究發現,飼料中添加GAA對許氏平鲉肥滿度無顯著影響,推測原因可能與GAA對能量代謝的調控能力有關,使得魚體脂肪的儲備和消耗處于動態平衡狀態。
李增民[21]研究表明,GAA 可以通過提高肝臟中氨基酸代謝酶(GGT)和核酸代謝酶(ADA)的活力來促進機體蛋白質的合成和沉積。但本實驗結果顯示,各組間魚體水分、粗蛋白、粗脂肪和粗灰分含量差異不顯著,表明飼料中添加GAA對魚體營養成分變化無不良影響,與在建鯉[13]、尼羅羅非魚[15]上研究結果一致。
3.2 胍基乙酸對許氏平鲉腸道消化酶的影響
魚體腸道消化酶活力反應機體消化吸收和營養利用的能力,與魚體生長發育息息相關[22]。本實驗結果表明,飼料中添加質量分數0.01%~0.08%GAA 顯著提高了許氏平鲉腸道胰蛋白酶和淀粉酶活力,0.04%和0.08%組顯著提高了腸道脂肪酶活力,說明GAA能夠通過提高腸道消化酶活力來促進魚體生長,這與本研究中許氏平鲉的生長結果一致。GAA 對魚體腸道消化酶的研究還未見報道。在畜禽上有研究證實,GAA 可以通過促進有益菌的增殖和增強消化道內α-淀粉酶、蛋白酶活力來改善動物機體消化道內環境及pH 值[23],說明GAA 可以協同改善腸道菌群及提高消化酶活力來達到促進魚體生長的效果。
3.3 胍基乙酸對許氏平鲉血清生化指標的影響
Abdel-Tawwab 等[24]研究表明血清生化指標能反應機體健康狀況。已有研究發現在畜禽飼料中添加1 200 mg/kg 的GAA 對動物機體是安全的[25],但缺少魚體方面數據。AST 和ALT 酶活力不僅可以反映機體代謝程度,還與肝細胞炎癥和變形密切相關,因此AST 和ALT 酶活力的高低可以作為判定肝功能是否受到損傷的指標[26]。本研究結果發現,飼料中添加GAA 對血清中AST 和ALT 酶活無顯著影響,表明飼料中添加GAA對許氏平鲉肝臟未造成損傷。血脂主要的代謝指標由TG 和TCHO 組成,包括HDL-C 和LDL-C,HDL-C 通過膽固醇逆向轉運把外周組織及血漿中的膽固醇運回肝臟代謝,LDL-C 則是向組織轉運肝臟合成的內源性膽固醇[27-28]。徐超等[29]研究表明,正常狀態下,魚體脂質代謝處于動態平衡狀態,當血脂水平在正常范圍內上升時,表明魚體機體內脂肪轉運程度相應增強,與魚體生長性能密切相關。張翼等[30]研究發現,在育肥肉牛飼料中添加GAA后,降低了血清中低密度脂蛋白膽固醇含量。本實驗結果發現,飼料中添加質量分數0.01%~0.08%的GAA 顯著提高了血清TG和HDL-C含量,LDL-C含量有下降趨勢,但差異不顯著,說明飼料中添加GAA能一定程度提高許氏平鲉血清中的脂質代謝。推測原因是GAA 通過提高魚體血清脂質代謝速率用于提高魚體的生長速度[31],與本實驗生長數據相吻合。
Marco 等[32]早期實驗發現,大鼠體外注射GAA后,能夠激活胰島素信號通路,而胰島素增加會導致血糖濃度降低,本實驗結果發現,飼料中添加GAA 并沒有顯著影響許氏平鲉的血糖濃度。Polakof 等[33]報道,血糖濃度變化受多種因素制約,如養殖條件、物種、魚體代謝能力、魚類對胰島素的敏感性及魚體激活胰島素的能力等,造成以上結果的差異,可能是因為物種不同導致其對胰島素的敏感性及激活胰島素的能力不同。
3.4 胍基乙酸對許氏平鲉肝臟糖代謝酶活的影響
肝臟是魚類糖脂代謝的主要場所[34]。糖酵解是魚體葡萄糖分解代謝的關鍵途徑,而PK 和PFK 則是糖酵解途徑中的兩個關鍵限速酶[35]。Yang 等[36]報道,魚類為適應環境脅迫會采取一系列與糖酵解相關的酶完成氧化磷酸化過渡到糖酵解轉化,這種反應是一種進化保守,是魚體適應環境脅迫的一種有效策略。如在鯉(Cyprinus carpio)[37]和半滑舌鰨(Cynoglossus semilaevis)[38]研究中發現,魚體受到環境脅迫時會啟動糖酵解途徑以增加葡萄糖攝取用于維持能量需求。李潔蕾等[39]報道,在保育豬飼料中補喂600 mg/kg GAA 21 d 后顯著增加了血漿中PK 和PFK 酶活力,但本實驗研究結果顯示,飼料中添加質量分數0.01%~0.08%GAA顯著降低了許氏平鲉肝臟PK 含量,在0.04%和0.08%水平下顯著降低了肝臟中PFK 含量,說明GAA 可以減少許氏平鲉肝臟中葡萄糖的分解代謝,使葡萄糖更多的以肝糖原形式儲存起來,其原因或許為GAA作為肌酸的前體物質,可以直接增加機體生命活動所需的ATP,用以緩解深遠海網箱養殖面臨的風浪、潮汐、水溫等環境應激。關于GAA 在許氏平鲉養殖中的抗應激作用還需進一步研究。
肌酸激酶(CK)與肌肉收縮、細胞能量轉運和ATP 再生有直接關系,并在肌酸代謝中發揮著能量緩沖的作用[40]。本實驗結果表明,飼料中添加GAA(質量分數0.01%~0.08%)降低了許氏平鲉肝臟中肌酸激酶活力,而在尼羅羅非魚[15]、牛蛙[16]上等研究表明飼料中添加胍基乙酸可以顯著提高CK 活性,與本實驗結果不一致,其原因可能為許氏平鲉作為肉食性海水魚類其飼料中動物性蛋白源較多,保證了魚體攝入的Cr 含量較為充足,導致額外添加的GAA 在不同營養源下的作用途徑也不一致。肌酸不足時,GAA 可補充體內肌酸的缺乏,參與機體肌酸代謝進而上調肌酸激酶的活性,用于機體能量補充[41];而肌酸充足時,額外添加的GAA 基本不直接參與肌酸激酶功能[42],其功能主要使高磷酸肌酸和ATP 等能量物質儲存起來[10],可用于抵抗網箱養殖面臨的風浪、潮汐、水溫等環境因子應激。這可能是造成本實驗中許氏平鲉肝臟肌酸激酶活力降低的原因之一。
GAA在肝臟經甲基化后轉化為Cr,Cr是細胞內能量代謝的重要物質,也是能量儲存的臨時場所[43]。本實驗中,飼料中添加GAA顯著提高了許氏平鲉肝臟中Gr 含量,說明飼料中額外補充的GAA 以Cr 的形式轉化和保留,也是許氏平鲉機體Cr 的潛在來源,與在眼斑擬石首魚(Sciaenops ocellatus)[8]上研究一致。
3.5 胍基乙酸對許氏平鲉肝臟抗氧化能力的影響
許氏平鲉網箱養殖中常受風浪、潮汐、水溫和季節等因素的影響,魚體在應對環境應激時會造成大量活性氧和自由基的積累。因此,在許氏平鲉網箱養殖中增加魚體T-AOC、SOD、GSH-PX 等抗氧化酶活力和降低脂質過氧化反應中MDA 的含量來緩解氧化應激,對提高許氏平鲉網箱養殖經濟效益具有重要意義。Aziza等[15]研究表明,在尼羅羅非魚飼料中添加質量分數0.12%~0.18%的GAA,可顯著提高魚體SOD 和GSH 酶活和降低MDA 含量;Zeng等[5]發現,飼料中添加0.4~0.6 g/kg GAA 可顯著提高牛蛙血清中T-AOC活性,降低MDA含量。在本實驗中,飼料中添加質量分數0.01%~0.08% GAA 顯著提高了許氏平鲉肝臟中T-AOC活性,降低了MDA含量;SOD活性則在0.02%~0.08%組顯著高于對照組;GSH-PX活性隨GAA 水平的變化呈先上升后下降趨勢,表明GAA可在一定程度上通過增加內源性抗氧化酶活力達到提高機體抗氧化能力的效果,與上述研究結果一致。其作用機理為:(1)與GAA 的代謝產物Cr有關,Cr已被證實可作為外源抗氧化劑來提高動物的抗氧化能力[44];(2)外源GAA 的攝入,魚體節約的部分內源性精氨酸能夠淬滅自由基,發揮抗氧化作用[45]。
4 結論
本實驗條件下,以增重率為評價指標,許氏平鲉飼料中GAA 的適宜添加量為0.04%;飼料中添加質量分數0.04%~0.08%GAA 可提高許氏平鲉腸道消化酶活力,并可通過調節代謝產物Cr的含量發揮抗氧化和能量調節作用。

