外源NO對NaCl脅迫下M26幼苗養分吸收、蔗糖代謝和氮代謝的影響
李凱 馬利萍 楊天一 張滿讓

摘 要 以蘋果砧木M26組培苗為試驗材料,采用營養液栽培,研究葉片噴施不同濃度NO供體硝普鈉(SNP)對NaCl脅迫下幼苗礦質營養元素的吸收以及蔗糖代謝和氮代謝的影響,以期為增強M26幼苗的耐鹽性研究提供參考。結果表明:外源NO能夠有效緩解NaCl脅迫對M26幼苗養分吸收以及蔗糖代謝和氮代謝的負面影響,總體上以200 μmol·L-1 SNP的噴施效果最佳。外源NO處理不僅能夠有效提升NaCl脅迫下幼苗對氮、磷和鉀的吸收,而且提高了幼苗的蔗糖代謝水平,表現為進一步提高SPS和SS的活性以及MdSPS6和MdSuSy2的表達水平,并且AI和NI的活性也得到提高,同時也有效改善了幼苗的氮代謝能力,表現為提高了NR、GS和GDH的活性與硝態氮的含量,降低了銨態氮的含量,使銨毒害降低,并且也上調了MdNR和MdNIR的表達。可見,外源NO可在一定程度上緩解NaCl脅迫對M26幼苗造成的傷害,從而提高幼苗的耐鹽性,促進幼苗生長。
關鍵詞 蘋果砧木;鹽脅迫;一氧化氮;蔗糖代謝;氮代謝
蘋果(Malus domestica Borkh.)屬于薔薇科蘋果屬多年生落葉果樹,是當今世界上栽培歷史最悠久、栽培面積最廣和產量最大的經濟類果樹作物之一,也是食用價值和經濟價值都非常高的果樹類型,在幫助農民脫貧致富、提升農村經濟狀況以及促進中國鄉村振興等方面都起到了無法替代的作用[1]。蘋果是通過嫁接進行無性繁殖的果樹,砧木作為樹體的基礎部分,對樹體的影響尤為重要,因此探究蘋果砧木對逆境的抵抗能力和適應能力,對蘋果產業發展具有重要意義[2]。
鹽脅迫作為影響植物生長和發育的主要非生物脅迫之一,會對植物的新陳代謝產生不利影響[3]。植物對鹽脅迫的感受性很強,在鹽脅迫初期,植物會受到離子毒害和滲透脅迫等初級傷害,而高濃度或者長時間的鹽害則會對植物產生次級傷害,比如氧化脅迫和營養脅迫。植物自身也已進化出一系列抗逆機制,比如離子外排和區隔化、加速合成和積累滲透調節物質、氣孔關閉、抗氧化系統的增強等,但這些應對方式都是以抑制植物生長發育為代價的,比如地上地下部的生長勢均降低、光合作用受到抑制、多種酶活性降低、生物膜的不可逆傷害,甚至是生理生化代謝過程的紊亂等[4-5]。
NO作為植物體內一種重要的小分子信號物質,其調控功能幾乎貫穿植物的整個生長發育過程,并且在植物的信號調控中具有廣泛性、多樣性和復雜性的特點[6]。大量研究表明,外源NO可在植物的多個代謝途徑以多種不同方式對非生物脅迫產生緩解作用,包括植物生長[7]、光合作用[8]、滲透調節和活性氧代謝[9]等,但目前外源NO處理對鹽脅迫下蘋果砧木幼苗的養分吸收、蔗糖代謝以及氮代謝等代謝過程的研究較少。本研究以蘋果砧木M26脫毒組培苗為試驗材料,通過營養液培養的方法探討外源噴施不同濃度的NO供體硝普鈉(SNP)對M26幼苗NaCl脅迫下養分吸收、蔗糖代謝以及氮代謝過程的緩解效應,系統闡明NaCl脅迫下外源NO緩解蘋果屬植物幼苗的作用機制,為今后NO在蘋果種植方面的應用提供理論依據,也為優勢砧木推廣提供了相應的理論指導。
1 材料與方法
1.1 試驗材料與試驗設計
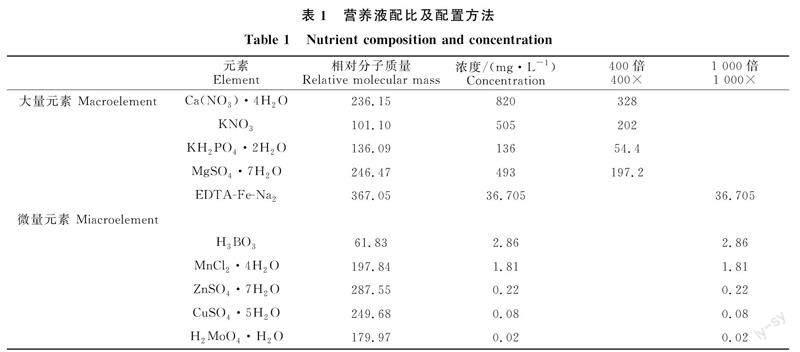
選取長勢相對一致且生長狀況良好的蘋果砧木M26脫毒組培苗,待幼苗長至6~8片真葉時,用自來水清洗并去除幼苗根部的基質和雜質后,移至裝有1/2 Hoagland營養液的水培箱進行培養(表1),并用H3PO4或KOH將pH調至 ?6.5±0.2。水培箱底部和側邊均用黑色不透光塑料膜包裹,以保證黑暗狀態,幼苗用水培定植棉固定于2 cm厚的泡沫板上,并用氧氣泵進行20? ?min·h-1的O2供應,營養液每3 d更換1次。幼苗培養和處理過程于西北農林科技大學科研溫室內完成,全程采用自然光照和水簾降溫。預培養15 d后進行處理,鹽脅迫處理使用NaCl按營養液體積比例稱量并溶解于營養液,NO處理使用供體硝普鈉(SNP)對幼苗進行葉片噴施并噴至滴水為止,每2 d噴施1次,由于SNP見光和久置易分解,所以SNP于夜間避光噴施并現用現配。試驗共設7個處理,分別為:1/2 Hoagland營養液+蒸餾水(CK)、1/2 Hoagland營養液+120?? ?mmol·L-1 NaCl+蒸餾水(T1)、1/2 Hoagland營養液+120 mmol·L-1 NaCl+50? ?μmol·L-1 SNP(T2)、1/2 Hoagland營養液+120? ?mmol·L-1 NaCl+100 μmol·L-1 SNP(T3)、 ?1/2 Hoagland營養液+120 mmol·L-1 NaCl+150 μmol·L-1 SNP(T4)、 ?1/2 Hoagland營養液+120 mmol·L-1 NaCl+200 μmol·L-1 SNP(T5)、1/2 Hoagland營養液+120? ?mmol·L-1 NaCl+300 μmol·L-1 SNP(T6),其中CK和T1處理組噴施蒸餾水作為對照,方法同噴施SNP處理組。處理期間每2 d更換1次處理液,處理 ?12 d后采集樣品用于測定各項指標。
1.2 測定項目及方法
1.2.1 礦質元素含量的測定 氮、磷和鉀含量的提取采用濃H2SO4-H2O2消煮法:準確稱取烘干后的0.1 g葉片組織于消煮管底部,每個處理設置3個平行樣,做好標記,加5 mL濃H2SO4(AR,98%),搖勻后在消煮爐上先小火加熱(需放在通風櫥中),緩慢升溫至270 ℃后,用膠頭滴管向消煮管底部滴加2~3滴H2O2,然后搖勻,每15 min滴加1次,當消煮管內的溶液呈無色或清亮后,再加熱15 min以除去消煮管中剩余的H2O2。冷卻后,將反應液定容至100 mL,顛倒混勻后分裝到10 mL離心管中待測。使用AA3連續流動分析儀(AA3; SEAL Analytical,Norderstedt,Germany)測定氮和磷元素的含量,使用火焰分光光度計(M410; Sherwood Scientific,Cambridge,UK)測定鉀元素的含量。
1.2.2 蔗糖代謝和氮代謝相關酶和物質的測定 蔗糖磷酸合成酶(SPS)和蔗糖合成酶(SS)活性的測定參照Schrader等[10]的方法,中性轉化酶(NI)和酸性轉化酶(AI)活性的測定參考Huang等[11]的方法,硝酸還原酶(NR)活性的測定參照Bressler等[12]的方法,谷氨酰胺合成酶(GS)和谷氨酸脫氫酶(GDH)的活性根據前人的研究進行測定[13],一氧化氮(NO)的含量參考Peng等[14]的方法進行測定,銨態氮和硝態氮的含量參考Zhu等[15]的方法測定。
1.2.3 相關基因表達量的測定 使用改良的CTAB法提取幼苗新葉組織的總RNA[16],總RNA濃度使用Nano Drop 2000c 分光光度計(Thermo Fisher Science Inc.America)進行測定,并用瓊脂糖凝膠電泳檢測所提取RNA的完整性和純度。使用TaKaRa PrimeScriptTM RT Reagent試劑盒進行反轉錄,具體操作按照試劑盒說明書進行。
使用SYBR PreMix Ex TaqⅡ(Takara,京都,日本)試劑盒在QuantStudio5定量儀上進行qRT-PCR反應,所有引物見表2。10 μL的反應體系包括5 μL的SYBR○R? Premix Ex TaqTM Ⅱ? ?2×,各0.5 μL的上、下游引物,1 μL的cDNA和3 μL的ddH2O。反應程序的設置參數為:95 ℃的預變性3 min,94 ℃的變性15 s,60 ℃的退火 ?20 s,72 ℃的延伸20 s,設置40次循環,最后使用2-ΔΔCt的方法計算基因的表達量,并對每個樣本進行3次獨立的生物學重復。
2 結果與分析
2.1 外源NO對鈉鹽脅迫下M26幼苗礦質元素含量的影響
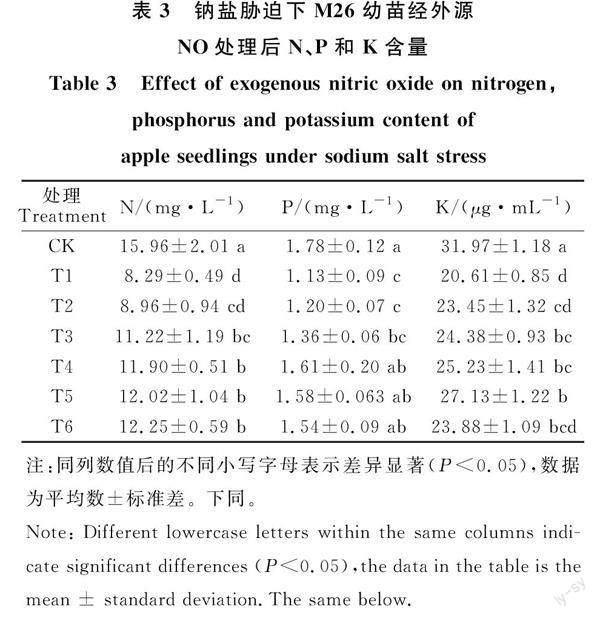
從表3可以看出,在NaCl處理下,M26幼苗葉片N、P和K元素的含量均有顯著下降,相比于CK處理分別降低48.06%、36.52%和 ?35.53%。一定濃度的SNP噴施后,不同處理組N、P和K元素的含量表現出不同程度的上升趨勢。從N元素的含量來看,相比于T1處理,T4、T5和T6 3個處理的提升最為明顯,且幅度相似,分別顯著增加43.55%、44.99%和47.77%,T3處理也有較大幅度的提升,T2處理則較T1處理無顯著變化;對于P元素含量來說,與N的含量相似,也表現為T4、T5和T6 3個處理較T1處理的提升幅度最大,分別增加42.48%、39.82%和 ?36.28%;從K元素的含量來看,T5處理較T1處理的增加幅度最大,為31.64%,T3和T4兩個處理相比于T1處理也均有顯著提升,分別升高 ?18.29%和22.42%,T2和T6處理較T1處理提升幅度較小,無顯著差異。以上結果表明,NaCl處理顯著抑制了幼苗對N、P和K 3種礦質營養元素的吸收,而一定濃度SNP的使用有助于緩解鹽脅迫對幼苗的養分吸收狀況,并以150和200 μmol·L-1的SNP改善效果最佳。
2.2 外源NO對鈉鹽脅迫下M26幼苗蔗糖代謝的影響
2.2.1 蔗糖代謝酶的活性 由圖1可知,NaCl處理提高了M26幼苗葉片的SPS和SS的活性,相比于CK分別增加28.45%和13.90%,并且顯著降低了AI和NI的活性,較CK分別下降 ?23.11%和11.18%。噴施一定濃度的SNP后,幼苗葉片SPS、SS、AI和NI活性相比于T1處理總體上均呈現出上升趨勢,但程度不同。對于SPS的活性來說,T4、T5和T6 3個處理較T1處理提升幅度最明顯,分別增加了41.97%、 ?46.54%和 ?42.24%,T3處理也有顯著提升,較T1處理增加 ?23.35%;對于SS活性,相比于T1處理,T5和T6兩個處理分別提升22.77%和24.67%,增幅顯著,T4處理較T1處理也顯著提升15.33%;從AI活性來看,相比于T1處理,各濃度SNP的處理總體變化幅度較小,以T5和T6處理的提升最顯著,分別提高19.09%和 ?17.10%,其余3個處理無顯著差異;與AI相似,各濃度SNP噴施處理的NI活性相比于T1處理提升有限,波動幅度更小,但也存在顯著性變化,以T5和T6處理的提升幅度較大,分別增加 ?6.51%和6.91%,其余3個處理則較T1處理無顯著提升。以上分析表明,NaCl處理影響了蔗糖代謝關鍵酶的活性,而200和300 μmol·L-1 SNP的噴施明顯提高了幼苗的蔗糖代謝水平。
2.2.2 蔗糖代謝相關基因的表達 由圖2可知,相比于CK處理,NaCl處理12 d后MdSPS6、MdSuSy2和MdSUT1的表達均呈現出不同程度的上調,其中MdSuSy2和MdSUT1上調顯著,MdSPS6上調程度不明顯,而MdNINV2的表達受到顯著抑制,說明NaCl脅迫下幼苗通過轉錄水平調控蔗糖的代謝;相比于NaCl處理,200 μmol·L-1?? SNP的噴施處理則不同程度地上調了MdSPS6、MdSuSy2和MdNINV2的表達,而MdSUT1的表達水平顯著下調,說明外源NO的使用在基因的轉錄水平上對蔗糖代謝進行了 ?調控。
2.3 外源NO對鈉鹽脅迫下M26幼苗氮代謝的影響
2.3.1 氮代謝相關物質的含量 由圖3可知,在NaCl處理下,M26幼苗葉片的硝態氮含量大幅降低,比CK處理顯著下降48.43%,而銨態氮和NO的含量出現不同程度的升高,其中銨態氮的含量提升幅度較大,為93.39%,差異顯著,而NO含量與CK處理相比無顯著差異。一定濃度SNP的噴施后,3種物質的含量呈現出不同的變化趨勢,且不同濃度處理間的作用效果不同,其中各濃度SNP處理組葉片的硝態氮和NO含量均表現出不同程度的上升趨勢,而銨態氮含量則相反。從硝態氮含量來看,相比于T1處理,T5和T6處理的提升幅度最明顯,分別達到了67.60%和 ?63.86%,T4處理的提升幅度較小,為31.59%,T2和T3處理的作用效果不顯著;對于NO含量,不同濃度SNP的處理相比于T1處理均有顯著升高的趨勢,但總體來看波動較小,以T3、T4和T5 3個處理提升效果最為明顯,分別較T1處理增加了27.66%、26.27%和27.66%,T2和T6處理提升幅度較小,但也差異顯著,分別提高 ?14.58%和19.91%;與上述兩種物質的趨勢相反,不同濃度SNP處理的銨態氮含量相比于T1處理總體上呈現出逐漸降低的趨勢,并以T5和T6處理的降幅最大,較T1處理分別降低 ?37.91%和42.17%,其余3個處理較T1處理也有顯著下降的趨勢,降幅分別為19.70%、 ?30.43%和 ?26.85%。可以看出,NaCl處理顯著抑制了幼苗的氮素同化能力,一定濃度的SNP處理改善了NaCl脅迫對幼苗氮代謝的抑制程度,提高了幼苗的氮代謝水平。
2.3.2 氮代謝酶的活性 由圖4可知,在NaCl處理下,M26幼苗葉片NR、GS和GDH的活性均受到明顯抑制,分別較CK處理降低 ?46.30%、56.63%和48.60%。一定濃度SNP的噴施后,相比于T1處理,大多數處理的NR、GS和GDH活性呈現出回升趨勢,但不同濃度的作用不同。對于NR活性來說,可以看出,T5處理的提升幅度最顯著,相比于T1處理增加68.88%,T6處理較T1處理也提升50.10%,其余3個處理相比于T1處理也有小幅提升,但不顯著;對于GS活性,則是T5和T6兩個處理較T1處理的提升幅度最大,分別達到93.66%和95.07%,T3和T4處理相比于T1處理也顯著提升48.42%和76.59%,T2處理的作用不顯著;從GDH的活性來看,相比于T1處理,T4處理的提升幅度最顯著,達到84.17%,且除T2處理外其余處理也均有顯著提升,較T1處理分別增加49.98%、70.82%和 ?45.42%。從上述分析可以看出,NaCl處理顯著抑制了幼苗葉片3種氮代謝酶的活性,而適宜濃度的SNP處理在一定程度上緩解了這種抑制,并以200 μmol·L-1的SNP濃度改善效果最佳。
2.3.3 氮代謝相關基因的表達 從圖5可以看出,對CK、T1和T5 3個處理幼苗葉片的部分氮代謝酶基因進行實時定量表達分析,結果顯示,在NaCl脅迫12 d后,相比于CK處理,T1處理顯著抑制MdNR和MdNIR的表達,而MdGS1和MdGDH2的表達量則呈現出不同程度的提高,并且MdGS1上調顯著,說明NaCl脅迫抑制幼苗轉錄層面的氮代謝水平,SNP的噴施對MdNR和MdNIR的表達水平有所改善,尤其是MdNIR的上調明顯,而MdGS1和MdGDH2均出現顯著下調。
3 討? 論
3.1 外源NO對鈉鹽脅迫下M26幼苗礦質元素含量的影響
作為植物生長發育最重要的3種礦質營養元素,氮、磷和鉀幾乎在植物所有的組織結構、代謝過程以及能量利用等方面發揮著不可或缺的作用[17-18]。本研究發現,NaCl脅迫導致M26幼苗葉片的N、P和K的含量顯著下降,這與唐曉倩等[19]研究結果一致,說明鹽脅迫會阻礙幼苗對養分的吸收,這可能是因為NaCl脅迫下細胞內部的Cl-和Na+驟然增多,導致細胞對NO-3、H2PO-4和K+產生競爭排斥,進而嚴重影響植物對N、P和K吸收和利用[20];適宜濃度SNP的使用促進了幼苗對N、P和K的吸收,且不同濃度的改善效果不同,但總體上呈現出上升趨勢,并以150和200 μmol·L-1 SNP的改善效果最佳,這與張倩等[21]的研究結果類似,說明外源NO可以促進植物對N、P和K 3種礦質營養元素的吸收,這可能是因為NO提高了鹽脅迫下生物膜的穩定性,從而促進離子的穩態,使幼苗體內的養分平衡得以維持。
3.2 外源NO對鈉鹽脅迫下M26幼苗蔗糖代謝的影響
蔗糖代謝是植物光合碳代謝的重要組成部分,作為蔗糖合成和分解的催化劑,蔗糖代謝酶直接調控植物體內蔗糖含量的變化[22]。大量研究表明,在鹽脅迫條件下,植物細胞內SPS和合成方向SS的活性會顯著提高,為抵抗鹽脅迫而合成和積累更多的蔗糖,AI和NI的合成則受到抑制,以此來避免更多的蔗糖被分解,從而維持細胞膨壓,促進植物的正常生長[23-24]。但也有一些研究發現,鹽脅迫不僅提高了SPS和SS的活性,而且AI和NI的活性也顯著增加[25],這可能是因為不同物種響應鹽脅迫時蔗糖代謝酶的調控作用不同。本研究發現,NaCl處理顯著提高了M26幼苗葉片的SPS和SS活性,而AI和NI的活性則有小幅下降,說明鹽害影響了幼苗的蔗糖代謝水平,而一定濃度NO的使用不僅進一步提高了SPS和SS的活性,而且也增強了AI和NI的活性,這說明NO不僅促進了蔗糖的合成和積累,而且也有效地促進了體內多余蔗糖的分解,提高了幼苗在鹽脅迫條件下的蔗糖代謝的整體水平,進而減輕NaCl脅迫對幼苗的傷害。在高等植物的蔗糖代謝中,關鍵酶的活性會受到pH和基因轉錄水平的調控。此外,蔗糖轉運蛋白(SUT)也稱蔗糖-H+共轉運蛋白,是一種生物膜結合蛋白,具有蔗糖轉運能力,廣泛存在于植物的各個器官中,是光合產物蔗糖在體內源庫間運輸的重要參與者,其表達水平與器官間蔗糖的分配密切相關[26-27]。SUT也參與植物抵御滲透脅迫的過程,研究表明,擬南芥中AtSUC2和AtSUC4的表達水平在鹽害和冷害條件下會出現顯著提高的趨勢[28]。大量研究發現,逆境脅迫會通過影響編碼酶基因的表達而間接調節蔗糖代謝酶活性的變化,通過不同程度的蔗糖合成和分解來抵御脅迫[29]。本研究發現,NaCl處理不同程度地上調了幼苗葉片MdSPS6、MdSuSy2和MdSUT1的表達,下調了MdNINV2的表達,這與陳秀玉[30]的研究結果類似,說明在NaCl脅迫下植株自身通過調節蔗糖相關代謝酶基因的差異性表達,促進了細胞對蔗糖的合成和積累,提高了蔗糖的轉運效率,以此來抵御滲透傷害;200 μmol·L-1 SNP的噴施處理使MdSPS6和MdSuSy2的表達水平得到進一步提高,說明外源NO的使用不僅對關鍵酶的活性有促進作用,而且也通過促進相關轉錄因子調控來提高蔗糖代謝水平,進而促進幼苗的生長發育進程。
3.3 外源NO對鈉鹽脅迫下M26幼苗氮代謝的影響
作為植物初生代謝中最關鍵的代謝途徑之一,氮代謝對植物的生長發育有著非常重要的影響,但氮代謝對鹽害十分敏感,在鹽脅迫條件下,植物對氮的吸收、同化和利用都會受到嚴重影響[31-32],尤其是對于氮代謝中的關鍵酶類,在鹽脅迫的傷害下,氮代謝酶的活性會受到抑制,造成氮代謝紊亂[33]。大量研究表明,鹽脅迫會通過抑制關鍵氮代謝酶的活性和促進銨態氮的積累來對植物造成傷害[34]。本研究發現,NaCl脅迫顯著抑制了M26幼苗葉片NR的活性,造成硝態氮含量降低,導致硝態氮的吸收和同化水平降低,同時GS和GDH的活性也明顯受到抑制,說明NaCl脅迫抑制了兩種銨態氮的同化途徑,使銨態氮積累增多,進而對細胞產生銨毒害,這與辛正琦等[35]的研究結果類似。研究表明,外源NO可以通過改善植物體內的氮代謝途徑來緩解逆境對植物造成的脅迫傷害[36]。本研究發現,一定濃度SNP的噴施緩解了NaCl脅迫對M26幼苗氮代謝的抑制情況,主要表現為NR、GS和GDH的活性升高,銨態氮的含量顯著增加,同時硝態氮和NO含量也呈現出增加趨勢,這與代歡歡等[37]的研究結果相似,說明NO可能通過提高對植物硝態氮的同化來促進氮代謝循環的正常運行,同時誘導GS/GOGAT和GDH兩個途徑對銨態氮的同化,以減少銨態氮對幼苗的毒害,促進氮代謝的正常運行。與蔗糖代謝相同,氮代謝進程中關鍵酶的活性也受其合成和編碼基因轉錄的調控。大量研究表明,逆境條件不僅會使氮代謝關鍵酶的活性明顯降低,使硝態氮和銨態氮同化程度減弱,而且氮素同化關鍵酶基因的表達程度亦下降[38-39]。本研究表明,NaCl脅迫顯著降低了MdNR和MdNIR的表達水平,并使MdGS1和MdGDH2的表達明顯上調,說明NaCl脅迫不僅會抑制M26幼苗氮代謝酶活性,而且也引發基因轉錄水平的變化,同時植株自身也會通過轉錄水平的變化來降低銨的毒害,而200 μmol·L-1 SNP的噴施處理則增加了MdNR和MdNIR的表達水平,并使MdGS1和MdGDH2的表達量明顯下調,這與黃潔[40]的研究結果類似,可能是因為外源NO參與了M26幼苗對NaCl脅迫下的信號轉導過程,為氮素的吸收和同化提供了正常的微環境,促進了氮代謝關鍵酶基因的表達,增強了關鍵酶的活性,進而降低NaCl脅迫對植株的 ?傷害。
4 結? 論
在NaCl脅迫下,葉面噴施NO可以有效促進M26幼苗對礦質營養元素氮、磷和鉀的吸收,并能夠提高幼苗的蔗糖代謝水平,降低銨態氮對幼苗的毒害作用,增強幼苗對氮素的同化能力和氮代謝活躍程度,從而緩解NaCl脅迫對幼苗生長的抑制作用,對提高M26幼苗的耐鹽性有明顯效果。不同濃度SNP對NaCl脅迫下M26幼苗的緩解效果不同,本研究結果表明,總體上以200 μmol·L-1 SNP的緩解效果最佳。
參考文獻 Reference:
[1]劉 榮,劉清國,范建新,等.果樹抗寒性生理生化及分子機理研究進展[J].分子植物育種,2017,15(5):2028-2034.
LIU R,LIU Q G,FAN J X,et al.Research advances in the cold-resistance physiology biochemistry and molecular mechanism in fruit crops[J].Molecular Plant Breeding,2017,15(5):2028-2034.
[2]韓曉毓,張林森,王俊峰,等.不同蘋果矮化砧木導水特性與水通道蛋白基因表達對干旱脅迫的響應[J].西北農業學報,2015,24(10):109-117.
HAN X Y,ZHANG L S,WANG J F,et al.Responses of hydraulics characteristic and aquaporin expression of several apple dwarf rootstocks in responses to drought stress[J].Acta Agriculturae Boreali-occidentalis Sinica,2015, ?24(10):109-117.
[3]MOCHIZUKI N,TANAKA R,GRIMM B,et al.The cell biology of tetrapyrroles: a life and death struggle[J].Trends in Plant Science,2010,15(9):488-498.
[4]TURAN S,TRIPATHY B C.Salt-stress induced modulation of chlorophyll biosynthesis during de-etiolation of rice seedlings[J].Physiologia Plantarum,2015,153(3): 477-491.
[5]張 婭,施樹倩,李亞萍,等.不同鹽脅迫下小麥葉片滲透性調節和葉綠素熒光特性[J].應用生態學報,2021,32(12):4381-4390.
ZHANG Y,SHI SH Q,LI Y P,et al.Osmotic regulation and chlorophyll fluorescence characteristics in leaves of wheat seedlings under different salt stresses[J].Chinese Journal of Applied Ecology,2021,32(12):4381-4390.
[6]張玲玲,吳 丹,趙子捷,等.植物一氧化氮信號分子的研究進展[J].植物學報,2017,52(3):337-345.
ZHANG L L,WU D,ZHAO Z J,et al.Research progress in nitric oxide signaling molecule in plants[J].Chinese Bulletin of Botany,2017,52(3):337-345.
[7]劉建新,王金成,王瑞娟,等.干旱脅迫下一氧化氮對燕麥幼苗生長和生理特性的影響[J].中國草地學報,2015,37(2):41-45.
LIU J X,WANG J CH,WANG R J,et al.Effects of nitric oxide on growth and physiological characteristics of oat seedlings under drought stress[J].Chinese Journal of Grassland,2015,37(2):41-45.
[8]LIU S,DONG Y,XU L,et al.Effects of foliar applications of nitric oxide and salicylic acid on salt-induced changes in photosynthesis and antioxidative metabolism of cotton seedlings[J].Plant Growth Regulation,2014,73(1):67-78.
[9]XING H,TAN L,AN L,et al.Evidence for the involvement of nitric oxide and reactive oxygen species in osmotic stress tolerance of wheat seedlings: inverse correlation between leaf abscisic acid accumulation and leaf water loss[J].Plant Growth Regulation,2004,42(1):61-68.
[10]SCHRADER S,SAUTER J J.Seasonal changes of sucrose-phosphate synthase and sucrose synthase activities in poplar wood (Populus×canadensis Moench ‘robusta) and their possible role in carbohydrate metabolism[J].Journal of Plant Physiology,2002,159(8):833-843.
[11]HUANG Y W,NIE Y X,WAN Y Y,et al.Exogenous glucose regulates activities of antioxidant enzyme,soluble acid invertase and neutral invertase and alleviates dehydration stress of cucumber seedlings[J].Scientia Horticulturae,2013,162: 20-30.
[12]BRESSLER S L,AHMED S I.Detection of glutamine synthetase activity in marine phytoplankton: optimization of the biosynthetic assay[J].Marine Ecology Progress,1984,14: 207-217.
[13]DING F,HU Q,WANG M,et al.Knockout of SLSBPASE suppresses carbon assimilation and alters nitrogen metabolism in tomato plants[J].International Journal of Molecular Sciences,2018,19(12):4046.
[14]PENG X,ZHU L,GUO J,et al.Enhancing biocompatibility and neuronal anti-inflammatory activity of polymyxin B through conjugation with gellan gum[J].International Journal of Biological Macromolecules,2020,147:734-740.
[15]ZHU F Y,CHEN M X,CHAN W L,et al.SWATH-MS quantitative proteomic investigation of nitrogen starvation in arabidopsis reveals new aspects of plant nitrogen stress responses[J].Journal of Proteomics,2018,187:161-170.
[16]GAMBINO G,PERRONE I,GRIBAUDO I.A rapid and effective method for RNA extraction from different tissues of grapevine and other woody plants[J].Phytochemical Analysis,2008,19(6):520-525.
[17]GUNES A,INAL A,ALPASLAN M,et al.Salicylic acid induced changes on some physiological parameters symptomatic for oxidative stress and mineral nutrition in maize (Zea mays L.) grown under salinity[J].Journal of Plant Physiology,2007,164(6):728-736.
[18]劉正祥,張華新,楊秀艷,等.NaCl脅迫下沙棗幼苗生長和陽離子吸收、運輸與分配特性[J].生態學報,2014,34(2):326-336.
LIU ZH X,ZHANG H X,YANG X Y,et al.Growth,and cationic absorption,transportation and allocation of elaeagnus angustifolia seedlings under NaCl stress[J].Acta Ecologica Sinica,2014,34(2):326-336.
[19]唐曉倩,白應飛,劉廣亮,等.NaCl脅迫對側柏幼苗生長及礦質離子吸收和分配的影響[J].西北農林科技大學學報(自然科學版),2018,46(9):60-66.
TANG X Q,BAI Y F,LIU G L,et al.Effects of NaCI stress on growth and mineral ions absorption and distribution of Platycladus orientalis seedlings[J].Journal of Northwest A & F University (Natural Science Edition),2018,46(9):60-66.
[20]TUNA A L,KAYA C,ASHRAF M,et al.The effects of calcium sulphate on growth,membrane stability and nutrient uptake of tomato plants grown under salt stress[J].Environmental and Experimental Botany,2007, ?59(2):173-178.
[21]張 倩,賀明榮,陳為峰,等.外源一氧化氮與水楊酸對鹽脅迫下小麥幼苗生理特性的影響[J].土壤學報,2018, ?55(5):1254-1263.
ZHANG Q,HE M R,CHEN W F,et al.Effects of extraneous nitric oxide and salicylic acid on physiological properties of wheat seedlings under salt stress[J].Acta Pedologica Sinica,2018,55(5):1254-1263.
[22]胡瑞芳,姜 慧,李玥瑩.蔗糖代謝相關酶的研究進展[J].北方園藝,2012(1):167-170.
HU R F,JIANG H,LI Y Y.Research advance on sucrose synthesize enzymes[J].Northern Horticulture,2012(1):167-170.
[23]KHELIL A,MENU T,RICARD B.Adaptive response to salt involving carbohydrate metabolism in leaves of a salt-sensitive tomato cultivar[J].Plant Physiology and Biochemistry,2007,45(8):551-559.
[24]馬文靜.外源NO對干旱脅迫下紫花苜蓿幼苗苯丙烷類代謝及miRNA調控的影響[D].蘭州:甘肅農業大學,2019.
MA W J.Effects of exogenous nitric oxide onphenylpropanoid metabolism and regulation of miRNAs in alfalfa seedlings under drought stress[D].Lanzhou:Gansu Agricultural University,2019.
[25]賈向陽,種培芳,陸文濤,等.葉施NO對NaCl脅迫下紅砂幼苗葉片和根系中氮代謝酶及營養物質的影響[J].西北植物學報,2020,40(10):1722-1731.
JIA X Y,ZHONG P F,LU W T,et al.Effect of foliar-spraying nitric oxide on the nitrogen metabolism enzyme activities and nutrients in leaves and roots of Reaumuria soongorica seedlings under nacl stress[J].Acta Botanica Boreali-Occidentalia Sinica,2020,40(10):1722-1731.
[26]GU J,ZENG Z,WANG Y,et al.Transcriptome analysis of carbohydrate metabolism genes and molecular regulation of sucrose transport gene LoSUT on the flowering process of developing oriental hybrid lily ‘SorbonneBulb[J].International Journal of Molecular Sciences,2020,21(9): 3092.
[27]王 潔,蔡昱萌,張 楠,等.植物蔗糖轉運蛋白表達的調控因素與分子機制[J].生物技術通報,2021,37(3):115-124.
WANG J,CAI Y M,ZHANG N,et al.Regulatory factors and molecular mechanism of sucrose transporters? expressions in plant[J].Biotechnology Bulletin,2021, ?37(3):115-124.
[28]GONG X,LIU M,ZHANG L,et al.Arabidopsis? AtSUC2 and AtSUC4,encoding sucrose transporters,are required for abiotic stress tolerance in an ABA-dependent pathway[J].Physiologia Plantarum,2015,153(1):119-136.
[29]丁 菲.低溫脅迫下與茶樹糖代謝相關基因的克隆與表達[D].合肥:安徽農業大學,2012.
DING F.Cloning and expression of genes related toglycometabolism in tea plant(Camellia sinensis (L.)O. Kuntze) under low temperature[D].Hefei:Anhui Agricultural University,2012.
[30]陳秀玉.外源海藻糖對鹽脅迫下番茄糖代謝影響的研究[D].天津:天津大學,2019.
CHEN X? Y.Effect of exogenous trehalose on sugar metabolism response to salt stress in tomato seedlings[D].Tianjin:Tianjin? University,2012.
[31]CAI H,ZHOU Y,XIAO J,et al.Overexpressed glutamine synthetase gene modifies nitrogen metabolism and abiotic stress responses in rice[J].Plant Cell Reports,2009,28(3):527-537.
[32]王新磊,呂新芳.氮代謝參與植物逆境抵抗的作用機理研究進展[J].廣西植物,2020,40(4):583-591.
WANG X L,L? X F.Research progress on mechanism of nitrogen metabolism involved in plant stress resistance[J].Guihaia,2020,40(4):583-591.
[33]GUO L,LU Y,BAO S,et al.Carbon and nitrogen metabolism in rice cultivars affected by salt-alkaline stress[J].Crop and Pasture Science,2021,72(5):372-382.
[34]劉雅青.外源SAM對鹽脅迫下黃瓜幼苗緩解效果及生理機制的影響[D].山西晉中:山西農業大學,2019.
LIU Y Q.Effects of exogenous SAM on the? alleviation? and physiological mechanism of cucumber? seedlings under salt stress[D].Jinzhong Shanxi: Shanxi Agricultural University,2019.
[35]辛正琦,代歡歡,辛余鳳,等.鹽脅迫下外源2,4-表油菜素內酯對顛茄氮代謝及TAs代謝的影響[J].作物學報,2021,47(10):2001-2011.
XIN ZH? Q,DAI H H,XIN Y F,et al.Effects of exogenous 2,4-Epibrassinolide on nitrogen metabolism and TAs metabolism of Atropa belladonna L. under NaCl stress[J].Acta Agronomica Sinica,2021,47(10):2001-2011.
[36]曹 慧,王孝威,鄒巖梅,等.外源NO對水分脅迫下平邑甜茶幼苗中幾種氮代謝酶的影響[J].園藝學報,2009, ?36(6):781-786.
CAO H,WANG X W,ZOU Y M,et al.Effects of exogenous nitric oxide on the several enzymes of nitrogen metabolism in Malus hupehensis (Pamp.) Rehd.seedlings under water stress[J].Acta Horticulturae Sinica,2009,36(6):781-786.
[37]代歡歡,楊 怡,山雨思,等.鹽脅迫下外源NO對顛茄氮代謝及次生代謝調控的研究[J].中國中藥雜志,2020, ?45(2):321-330.
DAI H? H,YANG Y,SHAN Y S,et al.Nitrogen metabolism and secondary metabolism regulation of atropa belladonna by exogenous NO under NaCl stress[J].China Journal of Chinese Materia Medica,2020,45(2):321-330.
[38]HUANG L,LI M,ZHOU K,et al.Uptake and metabolism of ammonium and nitrate in response to drought stress in Malus prunifolia[J].Plant Physiology and Biochemistry,2018,127:185-193.
[39]趙 琪.干旱條件下不同砧木蘋果幼苗養分吸收利用差異及機理研究[D].陜西楊凌:西北農林科技大學,2019.
ZHAO Q.Differences and mechanism of nutrient absorption and utilization of apple on different rootstocks under drought conditions[D].Yangling Shaanxi:Northwest A&F University,2019.
[40]黃 潔.鹽脅迫對水稻氮代謝的影響及一氧化氮的調控作用[D].杭州:中國農業科學院,2020.
HUANG J.Effects of salt stress on nitrogen metabolism in rice and the regulating pathway of nitric oxide[D].Hangzhou:Chinese Academy of Agricultural Sciences,2020.
Effects of? Exogenous NO Application on Nutrient Uptake,Sucrose Metabolism and Nitrogen Netabolism in M26 Seedlings under NaCl Stress
LI Kai,MA Liping,YANG Tianyi and ZHANG Manrang
Abstract In this study,M26 tissue culture seedlings of apple rootstock were used as experimental materials,we used nutrient solution cultivation to investigate the effects of leaf spraying with different concentrations of NO donor sodium nitroprusside (SNP) on the uptake of mineral nutrients,sucrose metabolism,and nitrogen metabolism of seedlings under NaCl stress.The findings provide a foundational resource for enhancing the salt tolerance of M26 seedlings.The results showed that exogenous NO effectively alleviated the effects of NaCl stress on nutrient uptake,sucrose and nitrogen metabolism in M26 seedlings,with the best overall effect of 200 μmol·L-1 SNP spraying.Exogenous NO not only effectively enhanced the uptake of N,P and K by seedlings,but also increased the level of sucrose metabolism in seedlings.This enhancement was confirmed by increased activities of SPS and SS,as well as heightened expression levels of MdSPS6and MdSuSy, the activities of AI and NI also was also increased.It improved the nitrogen metabolism of seedlings,increasing NR,GS,and GDH activity,and nitrate nitrogen content while reducing ammonium nitrogen content.thus mitigating ammonium toxicity.It also upregulated the expression of? MdNR and MdNIR.In conclusion,the exogenous NO can alleviate the damage caused by NaCl stress to M26 seedlings to a certain extent,thereby improving the salt tolerance of seedlings and promoting seedling growth.
Key words Apple rootstock; Salt stress; Nitric oxide; Sucrose metabolism; Nitrogen metabolism
Received2022-04-22Returned 2022-09-08
Foundation item Baoji Comprehensive Experiment Station of National Apple Industry Technology System (No.MRS-28).
First author LI Kai,male,master student.Research area: fruit tree cultivation breeding and physiological ecology.E-mail: lk463721167@163.com
Corresponding?? author ZHANG? Manrang,male,Ph.D,professor,doctoral supervisor.Research area: fruit tree molecules,physiological cultivation and pest and disease control.E-mail: mrz@nwafu.edu.cn
(責任編輯:郭柏壽 Responsible editor:GUO Baishou)
收稿日期:2022-04-22修回日期:2022-09-08
基金項目:國家蘋果產業技術體系寶雞綜合試驗站(MRS-28)。
第一作者:李 凱,男,碩士研究生,從事果樹栽培育種和生理生態研究。E-mail: lk463721167@163.com
通信作者:張滿讓,男,博士,教授,博士生導師,主要從事果樹分子、生理栽培和病蟲害防治等研究。E-mail: mrz@nwafu.edu.cn

