機器孵化生命,“人造子宮”時代來臨?
費雪
2022年底,一則由“子宮工廠”EctoLife發布的8分鐘短片,曾以驚世駭俗的藍圖“世界首個人造子宮設施”,成為彼時Facebook上極具爭議性的話題之一,引發了全球關注。
今年9月19日至20日,美國食品藥品監督管理局 (FDA)召開為期2天的獨立顧問會議,討論是否應該批準全球首個涉及人造子宮技術的人體臨床試驗,這再度在世界范圍內備受矚目。
隨后,《自然》雜志首頁以《人造子宮的人體試驗可能很快就會啟動》為題,發表專題報道,更將這種走向人體試驗的技術評價為“令人興奮”。
種種動向看來,機器化孕育生命的時代似將呼之欲出。在可預見的未來,“人造子宮”這一概念,是否真的要從科幻小說走向現實生活?
技術福音不是造人
EctoLife概念片中,也門分子生物學家兼電影制片人Hashem Al-Ghaili如此刻畫人造子宮技術:75個最先進的實驗室,每個有多達400個人造子宮,每年可以“孵化”3萬名嬰兒。他宣稱,這樣的“流水線”,可以幫助女性解決生育的各種問題,避免分娩之痛。
但現實發展卻有著截然不同的走向。人造子宮領域的技術先驅費城兒童醫院(CHOP),將模擬自然子宮的根本目的指向了超早產兒救治。
根據世界衛生組織(WHO)定義,妊娠37周之前出生為早產,而超早產兒則是指妊娠28周之前未足月出生的胎兒。鄭州大學第一附屬醫院產科臨床統計顯示,嬰兒死亡率與出生胎齡密切相關—胎兒在子宮內安全停留的時間越長,長期存活和健康的概率就越高。
28周以上的未足月兒,在大量的生命支持下,大多數可以存活;但28周以下的超早產兒成活率不足50%;小于24周出生,迄今則沒有幸存下來的案例。

EctoLife視頻截圖
擺脫宮腔束縛后,胎兒的手術位置也會變得靈活,手術時間也將得到延長。
“人體發育就像蓋樓,超早產兒雖然已經搭好了骨骼和器官的‘架子,但是心肺功能尚不完善。”鄭州大學第一附屬醫院產科副主任醫師楊蕾,如此形容缺少母體支持帶來的負面影響。
一方面,雖然現有醫療技術可以通過機械輔助、藥物催發等方式提升呼吸功能,但挽救過程長達數月,期間嬰兒仍面臨呼吸衰竭、心臟驟停等巨大風險。
另一方面,即使產后長期存活,后續并發癥也如影隨形,且早產兒胎齡越小,并發癥越多。據《自然》雜志報道,瑞典一項對250萬人的研究證明,78%孕28周前分娩的超早產兒,在成年后患有哮喘、高血壓和癲癇等疾病,而足月出生者中,此患病比例僅為37%。
此外,臨床還常見早產兒發生視網膜病變、壞死性小腸結腸炎、肺部感染等癥;更有甚者,一些認知、行為問題,要到孩子兩三歲后才會顯現。
模擬人體子宮的一大優勢,恰好在于可以促進心肺功能發育,降低并發疾病風險。該技術對超早產兒群體健康發育的潛在裨益,正是FDA專家一致公認的“用武之地”。
在費城兒童醫院的紀錄片中,早產胎羊的肺泡尚未發育完全,無法自主呼吸以維持生命。進入人造子宮進行體外氧合四周后,實驗胎羊的肺泡發育明顯。
密歇根大學的“人造胎盤”裝置異曲同工,試驗胎羊也在成功存活的16天內,發育出了肺和大腦的功能。以體外膜肺氧合器(ECMO)替代呼吸機向肺部提供氣壓,還可以避免機械通氣對早產兒脆弱的肺部造成組織損傷,降低疤痕和炎癥風險引發的支氣管肺發育不良(BPD)等病癥。
給胎兒動手術,可能嗎?
在用作新生兒重癥監護的一種替代治療方案之外,人造子宮的另一項應用前景則是胎兒體外手術。
2020年年底,在鄭州大學第一附屬醫院的外科學總論實驗室中,胸外科主任趙高峰所帶領的團隊憑借一個生物袋和一臺ECMO,構建起類似母體宮腔內羊膜囊的環境,已成功使早產胎羊在體外設備中存活7天,期間各項發育正常。
他們的實驗初衷,是想為患有先天性疾病、不及分娩就有流產危險的胎兒,探索孕期手術干預的可能性。
在現有技術條件下,為患病胎兒做宮內手術僅限于體表,無法打開胎兒的胸腔、腹腔等部位。但諸如先天性肺囊腺瘤等疾病,有5%的概率(每年過百病例),必須在胎中即行對畸形部位或缺陷開腔處理。
一種應對的構思是,短暫切開子宮而不取出胎兒,以維持母體循環為前提,通過調整胎兒在宮內的體位,來暴露術野位置。在小切口手術完成后,縫合子宮讓胎兒繼續在母親體內發育。
但動物實驗中,發現了難以逾越的瓶頸:切開子宮會導致宮內壓下降,調整胎位和手術動作會導致羊水外溢,這都會對胎兒和母體造成不可逆的損傷;并且,胎兒在子宮羊水內處于浮動狀態,體位很難固定,也無形中增加了手術的難度。
面對棘手的難題,人造子宮提供了另辟蹊徑的方案—索性剪斷臍帶,讓胎兒在人工裝置中繼續生長發育。如此,一來不會傷及母體健康,二來擺脫宮腔束縛后,胎兒的手術位置也會變得靈活,手術時間也將得到延長。
目前,趙高峰團隊的人造子宮胎羊體外培育實驗,已為中國填補了該領域醫學研究的空白。但與費城兒童醫院團隊開發的“新生兒發育子宮外環境”(EXTEND)相比,國內實驗模型尚存改善空間。
在人造羊水的成分、恒溫的調控方式、人造子宮袋的材料等技術細節上,EXTEND都更為適應長時間研究—CHOP團隊的早產胎羊活到了第28天,而國內團隊的人造子宮只能維持生命到一周左右。
帶來差距的根本原因是,前者裝置的ECMO供氧效率,尤其是營養和排泄循環系統的穩定性,實現了更為先進的感染防范能力。故而,要進行早產兒體外手術和保育,這條路還任重道遠。
人體試驗為時尚早
盡管“外生”之說甚囂塵上,但FDA會議最終未能按照既定日程投票,意味著EXTEND這個目前最接近人體試驗的方案,也仍欠缺成熟。FDA官員表示,現在無法確認胎兒是否真的可以從EXTEND受益,且受益程度是否高于當前臨床投入使用的護理方案。
難點之一是,這一關鍵之問的答案,無法通過外推現行動物實驗結果來獲得。美國堪薩斯城兒童慈善中心新生兒醫生斯蒂芬妮·庫科拉指出,選擇羔羊作為試驗模型,主要是因為相關發育階段的胎羊可以模擬人類在妊娠22-24周時的肺部發育情況,且可操作性較高。
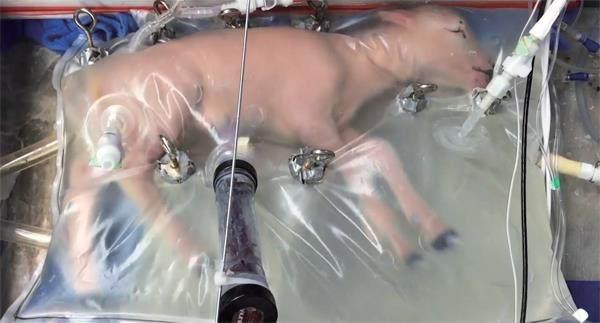
美國費城兒童醫院研究人員在2017年進行的人造子宮實驗中的胎羊

1997年2月,蘇格蘭愛丁堡,羅斯林研究所,克隆羊多莉向媒體開放參觀
要進行早產兒體外手術和保育,這條路任重道遠。
但迥異之處更多:羔羊的妊娠周期與人類并不相同,且器官發育的時間節點也不盡相似。即使在有共通性的可實驗階段,胎羊的個頭也比人類胎兒要大2-3倍,并且它們的大腦發育階段與同期的人類胎兒亦不同步。
若換選其他動物模型,結果也難臻理想—胎豬與人類胎兒的大小更為相似,但其實驗處理難度卻比羊羔更大;非人類的靈長類動物因生理指標與人類相似,本是臨床前試驗的黃金動物模型,但它們的胎兒又比人類的胎兒還要小。所以EXTEND并沒有把握,能夠在人體試驗中復制當下動物試驗獲得的成功。
而更“致命”的缺陷,則直指長期培養技術的不足。愛荷華大學研究員愛德華·貝爾團隊構建了2013年至2018年美國多地的病例數據集,統計出妊娠24周出生的超早產兒,在當前臨床技術下,能存活到1歲的概率高達71.4%。這一長期生存率,即便在目前已成功的人造子宮實驗中,也根本無法企及。
10月3日,日本《朝日新聞》報道稱,沖繩某企業自2017年開始研究人造鯊魚子宮裝置,于今年成功培育出細尾燈籠鯊的幼體,并進行了“人工分娩”。但該團隊也承認,人造子宮孵化出的鯊魚在放入海水箱培養后,幾天內全部因產后無法及時適應海水環境而死亡。
直到研究者開發出海水適應方案,“產前”就讓鯊魚寶寶們在人造子宮內逐步轉向海水環境,新一批試驗中才有一只存活超7個月—這是該物種目前最長的圈養紀錄。
這一研究結果說明,較之目前單純的“孵育”目標,要通過人造子宮實現胎兒出生后的存活和存續,技術層面還有更高的山峰留待攀越。
但科研的道德范疇,卻成為了橫亙在探索長期培養方案前的一大障礙。目前,EXTEND維持胎羊存活的28天時長,已經達到了學界公認的倫理上限,研究人員不得不終止試驗,對這些本可繼續在人造子宮中發育的胎羊進行安樂死處理,導致根本無從觀察其后續生命發展情況。
受限于此,連動物實驗的成功性尚需要打一個大大的問號,人體試驗無法獲批,也就在意料之內、情理之中。
1996年,世界上第一只體細胞克隆動物綿羊多莉誕生,“無性繁殖”的成功預言著生物技術時代的來臨。該研究被美國《科學》雜志評為1997年世界十大科技進步的第一項,但同時也遭遇了極為激烈的倫理爭議。
無疑,人造子宮代表著又一個巨大的轉型飛躍。但研究的走向是造福更多人,還是異化為“批發人類”的“潘多拉魔盒”,從技術發展到倫理論證,現在都只是個開頭。
責任編輯吳陽煜 wyy@nfcmag.com

