機械力在肝臟類器官形成中的調(diào)控作用
王 寧, 呂文良
中國中醫(yī)科學院廣安門醫(yī)院感染疾病科, 北京 100053
1 肝臟類器官
肝臟是人體內(nèi)最大的實質(zhì)器官,主要由肝實質(zhì)細胞(肝細胞)及非實質(zhì)細胞[肝星狀細胞(HSC)、肝竇內(nèi)皮細胞(liver sinusoidal endothelial cell,LSEC)、膽管細胞、免疫細胞等]構成,在解毒、生物合成、代謝和宿主防御方面發(fā)揮著多種作用[1-2]。肝臟具有強大再生能力,能夠在損傷后快速增殖自我修復[3-4],在此過程中,肝細胞快速啟動進行復制發(fā)揮關鍵作用,此外,LSEC、HSC、Kupffer 細胞等也參與了肝組織的自我損傷修復過程[5]。盡管如此,慢性病毒感染(HBV、HCV)、嗜煙酗酒的不良習慣、藥物、免疫性疾病導致的長期肝損傷,可能會引起各類慢性肝臟疾病的發(fā)生,甚至進展為嚴重肝臟疾病,包括肝硬化、肝癌甚至肝衰竭,嚴重威脅人民生活健康[6]。目前各種原因?qū)е碌母尾∫殉蔀槿蜃钪饕劳鲈蛑唬?]。因此,研究肝病發(fā)生機制,將有助于對肝臟疾病的診斷和預防,篩選新的治療靶點,開發(fā)新的治療方案,延緩甚至逆轉(zhuǎn)肝臟疾病的進程。
目前對于肝臟疾病的研究主要依靠細胞系及動物模型,細胞系作為一種二維(two-dimensional,2D)培養(yǎng),很難模擬體內(nèi)組織三維(three-dimensional,3D)結構[8],不能長期穩(wěn)定地擴增,且缺乏細胞與細胞、細胞與基質(zhì)之間的相互作用[9];動物模型雖能模擬組織生長的一定生理環(huán)境,但是動物模型構建過程復雜[10],且種屬之間的差異使得大多數(shù)人質(zhì)疑動物模型是否能真實反映人類組織器官功能和疾病狀態(tài)[11-12],在比較人類和小鼠的HSC 激活模型時,差異調(diào)控基因只有12%~18%的重疊[13]。
近年來興起的類器官技術能夠產(chǎn)生3D結構細胞,更好地模擬體內(nèi)肝組織[14-15]。類器官是由自組織的胚胎干細胞、誘導多能干細胞(induced pluripotent stem cell,iPSC)或成體干細胞(adult stem cell,ASC)體外自組裝形成的部分模擬體內(nèi)器官結構和功能的3D 細胞簇[11,16],不僅可以在體外大量擴增,且擁有遺傳穩(wěn)定性,更好地反映來源組織的體內(nèi)特征[17-18]。高度接近于體內(nèi)組織的特性使類器官培養(yǎng)在短期內(nèi)迅速發(fā)展,不同組織器官的類器官培養(yǎng)系統(tǒng)逐步受到重視并被建立優(yōu)化。截至目前,已適用于腸道、肝臟、胰腺、腎臟、視網(wǎng)膜、大腦等多種組織[19-26],在研究疾病發(fā)生機制、藥物篩選等方面發(fā)揮了重要作用[27-29],并于2018年度被Science雜志評選為年度突破技術。
有關肝臟類器官的研究始于2001年,Michalopoulos等[30]將成年大鼠肝細胞分離出來后培養(yǎng)在膠原包被的轉(zhuǎn)瓶中,并加入各種細胞必需生長因子形成了類似肝臟結構的組織,但其存活期很短。Lgr5 作為成體干細胞的普遍標志物,研究[31]顯示受損肝臟在膽管細胞附近檢測到Lgr5+表達升高,2013 年,Huch 等[32]利用分離的Lgr5+陽性干細胞構建肝臟類器官,并證實其具有保持體外長期擴增并分化成功能性肝細胞樣細胞的能力。除了ASC來源的肝臟類器官,iPCS來源的肝臟類器官也在不斷發(fā)展,iPSC 誘導分化為中內(nèi)胚層細胞后得到肝細胞和膽管細胞,3D 培養(yǎng)后進一步得到肝膽類器官[33],肝臟類器官中肝功能相關基因表達升高,膽管類器官則形成帶有初級纖毛的囊狀或者分支管狀結構,且成熟肝細胞和膽管細胞表面標志物表達均呈上升趨勢[34-35],并能在移植小鼠體內(nèi)長期生存[36]。不同類型細胞分化而來的肝臟類器官一定程度上模擬肝臟的組織形態(tài)、基因表達譜及遺傳特征,在疾病模型構建、藥物篩選、組織重建及藥物安全性評價層面有廣泛的應用前景,然而,一個始于細胞且隨著胚胎分化逐漸形成能夠行使特定功能組織的完整發(fā)育過程,在適應環(huán)境(持續(xù)生長、對抗疾病)過程中會不斷受到機械力的影響,長期以來肝臟類器官研究多關注生物學線索,忽略了機械微環(huán)境在其形成過程中的關鍵作用。
2 機械力
生物體從細胞、組織到器官的各個層次上的生命運動都是在一定力學環(huán)境中進行的,從個體發(fā)育的角度講,一個只含有一套染色體遺傳信息的單細胞,會有序地發(fā)生一系列分化增殖,最終形成具有生命活力的完整個體,這個過程是由多種化學反應和物理性質(zhì)變化所構成的復雜網(wǎng)絡系統(tǒng)。隨著分子生物學及力學測量技術的不斷發(fā)展,越來越多學者意識到機械力學在生命形成過程中的重要作用。肝臟類器官作為復雜細胞生長微環(huán)境,所呈現(xiàn)的動態(tài)生化線索和機械刺激通過機械感應驅(qū)動細胞機械轉(zhuǎn)導,最終導致組織結構的變化[37]。研究[38]發(fā)現(xiàn),肝病的進展與異常的組織結構和機械轉(zhuǎn)導密切相關。因此,深入了解機械力在肝臟類器官生成中的作用,對維持肝臟結構的完整和內(nèi)穩(wěn)態(tài)來說至關重要。
3 機械力與肝臟類器官
生物學活動中,機械力產(chǎn)生、傳遞、被感知后改變細胞功能,在控制細胞行為和組織穩(wěn)態(tài)中發(fā)揮著關鍵作用。細胞外機械力及其信號傳導是細胞微環(huán)境中調(diào)節(jié)細胞增殖、再生、分化和遷移的重要組成部分[39]。研究發(fā)現(xiàn),力學變化始終伴隨著“肝炎-肝纖維化-肝硬化-肝癌”的疾病進展過程。而力學對細胞的影響取決于與力和細胞相關的許多因素,包括力的類型、大小、持續(xù)時間等,目前研究較多的是固體應力、流體力和細胞外基質(zhì)(ECM)力學。
3.1 固體應力 固體應力大多出現(xiàn)在組織的高度增殖區(qū)域,上皮組織更新或者增殖的腫瘤推動牽拉周圍基質(zhì)時產(chǎn)生[40]。機械應力是誘導iPSC 類器官形成的關鍵技術,機械力可以通過誘導干細胞中的生物反應刺激iPSC 向軟骨細胞分化和成熟。牽引力和張力也是類器官的重要機械調(diào)節(jié)器。張力作為一種特殊的固體應力,在不同組織界面中產(chǎn)生[41]。正常狀態(tài)下,細胞-細胞或細胞-基質(zhì)間的機械張力是胚胎和器官形態(tài)變化中的一個重要因素。Muncie 等[42]設計幾何圖案化的底物模仿正常組織內(nèi)的特定形狀,使得細胞間的張力通過增強Wnt/β-catenin信號通路誘導人類胚胎干細胞(hESC)中“原腸自我組織樣”節(jié)點的形成,加速胚胎類器官形成。而由hPSC 分化產(chǎn)生的神經(jīng)外胚層組織觀察到較大的牽引應力,且與BMP-Smad 信號通路高度相關,二者共同作用于神經(jīng)板邊界的分化和形成[43];此外,收縮細胞產(chǎn)生的牽引力可以使膠原纖維排列整齊[44],通過誘導局部纖維排列和屈曲觸發(fā)非線性基質(zhì)硬化(圖1a)。另有研究[45]顯示,在移植到小鼠腸系膜的人腸道類器官中使用壓縮鎳鈦合金彈簧加入單軸應變,結果顯示組織大小及肌肉張力方面,與人類腸道有更高的相似性,提示機械力在腸類器官生成中的促進作用;Li等[46]也在機械壓力條件下觀察到小腸類器官內(nèi)分裂的細胞數(shù)目明顯增加,且小腸干細胞比例明顯增加,進一步研究發(fā)現(xiàn)力學擠壓通過調(diào)控LRP6-Axin信號體的形成增強Wnt/β-catenin信號進而調(diào)控干細胞的生長,誘導分化成為干細胞純度更高的小腸隱窩類器官。但固體應力在肝臟類器官形成中的作用還需進一步探索,為體外再現(xiàn)復雜的肝臟生理功能以及疾病病理奠定基礎。
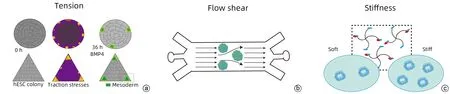
圖1 類器官形成過程中涉及不同類型機械力示意圖Figure 1 Schematic diagram of the different types of mechanical forces involved in organoid formation
3.2 流體力學 流體力學包括靜水壓力、滲透壓和剪切力[47]。靜水壓力可由高血壓相關疾病和腫瘤進展引起。高血壓對內(nèi)皮細胞及周圍組織施加的力,以及癌癥發(fā)展過程中血漿滲漏和淋巴引流不足引起的間質(zhì)液壓力升高導致靜水壓力的升高[48-49]。滲透壓主要出現(xiàn)在人體正常組織中,如人體腸道每天消化會導致滲透壓在300~450 mOsm 范圍內(nèi)的規(guī)律變化。剪切應力是機體內(nèi)流體(包括血液、間質(zhì)液、膽汁等)流動時刺激細胞產(chǎn)生的力,不同類型的剪切力對細胞和疾病產(chǎn)生不同的影響,比如穩(wěn)定的層流剪切力具有抗炎和保護動脈粥樣硬化的作用,而血流紊亂則導致血管炎癥及動脈粥樣硬化的發(fā)生[50]。
肝臟內(nèi)門靜脈和肝動脈的雙重供血使其具有復雜的循環(huán)系統(tǒng)[1],特有的流體力學微環(huán)境在類器官形成中促進細胞表型方面發(fā)揮著重要作用。早期研究發(fā)現(xiàn),肝臟類器官系統(tǒng)雖能誘導細胞大量增殖和分化,但分化并不會導致肝細胞完全成熟,只有不到1%雙核細胞,且肝細胞仍不能完全釋放白蛋白,為此,Dash 等[51]將大鼠肝細胞在膠原凝膠上培養(yǎng)48 h 后,采用灌注Transwell裝置模擬肝竇內(nèi)血流,恢復體內(nèi)正常的血流動力學,結果顯示應用流體動力學模擬體內(nèi)機械微環(huán)境可以維持體內(nèi)樣肝細胞的表型和代謝功能;Wang等[52]在3D 灌注芯片系統(tǒng)中培養(yǎng)人誘導多能干細胞獲得肝臟類器官,并顯示出更好的細胞活力和成熟肝臟基因的表達,肝臟特異性功能(白蛋白和尿素的產(chǎn)生及代謝)增強,表明流體流動產(chǎn)生的剪切力在促進肝臟類器官形成中的作用。除此之外,新型的微流控芯片通過定義局部流體剪應力改進對類器官形成的調(diào)控。據(jù)報道[53],微流控裝置(圖1b)促進胚胎和腸道類器官生成;Homan等[54]在微流控芯片下培養(yǎng)腎臟類器官時發(fā)現(xiàn),流體剪切力下的腎臟類器官具有更成熟的足細胞和管狀隔室,且細胞極性和成體基因表達增強。相似的,Kang 等[55]采用微流控平臺對原代肝細胞和LSEC 共培養(yǎng),連續(xù)灌注后發(fā)現(xiàn)原代大鼠肝細胞能維持多邊形形態(tài)且功能保持時間更長,提示三維灌注培養(yǎng)系統(tǒng)對肝臟結構和持續(xù)肝功能的支持作用,但這些系統(tǒng)存在一些缺點,它們依賴于原代肝細胞,且需要導管來同時操作多個設備,使得操作難度增加。肝祖細胞(LPC)衍生的肝臟類器官可在體外分化為肝細胞[56],但靜態(tài)培養(yǎng)時LPC體外成熟能力有限,于是Jung 等[57]將LPC 接種在培養(yǎng)基持續(xù)流動的微生理系統(tǒng)中,以恒定的流動速率向細胞輸送足夠的氧氣和營養(yǎng)物質(zhì),LPC 得以快速生長并縮回成多邊形,白蛋白表達增加,生長為成熟肝細胞。Michielin等[58]在對hPSC響應細胞外機械信號分泌蛋白質(zhì)影響從內(nèi)胚層到肝臟譜系的進展時發(fā)現(xiàn),微流控環(huán)境中的微流體刺激或暴露于外源性ECM 的刺激使得LPC 快速擴增數(shù)代并進一步分化成功能性肝細胞,顯示出形成肝臟類器官的巨大潛力。
綜上,隨著生物工程技術的不斷進步,微流控裝置作為一種新型主動機械刺激裝置在控制和研究細胞機械刺激(尤其是流體應力)對于肝臟類器官生長方面有著重要的作用。
4 ECM及其力學
近年來ECM力學在肝臟類器官形成中的作用也成為類器官機械微環(huán)境的研究焦點之一[59]。作為結構支架和生化-機械信號的傳送器,ECM能夠調(diào)節(jié)從單細胞事件到復雜事件的廣泛生物學過程,產(chǎn)生的力是刺激細胞的重要細胞外機械線索,并且對類器官的形成速率和增殖能力有顯著影響。層粘連蛋白是ECM中重要且擁有生物活性的部分,研究[60]發(fā)現(xiàn),加有層粘連蛋白511/521 的基質(zhì)上分化的肝細胞特異性標志物表達增多,且白蛋白分泌增多,體現(xiàn)ECM 在類器官形成中的作用。
剛度是ECM力學最重要的外在表現(xiàn)。人體中不同的組織和器官具有其獨特的剛度,脂肪和大腦的剛度在500~1 000 Pa,而骨的剛度高達2~4 GPa。模擬ECM力學的生物材料(如水凝膠)進行3D細胞培養(yǎng),已成功地用于培養(yǎng)來自患者和小鼠的原代細胞分化的類器官。Gjorevski等[61]發(fā)現(xiàn),具有較高剛度的黏附肽-聚乙二醇水凝膠通過Yes相關蛋白(Yes-associated protein,YAP)促進腸類器官的形成;Ng等[62]使用合成的酶交聯(lián)水凝膠模擬腫瘤生長微環(huán)境,結果發(fā)現(xiàn)較高基質(zhì)硬度與缺氧的化學環(huán)境共同作用結直腸癌患者來源類器官生長和代謝;Zhang等[63]則發(fā)現(xiàn)螺旋聚異腈多肽水凝膠(PIC)促進乳腺類器官的形成;模擬胰腺癌微環(huán)境中水凝膠硬度的增加,使得胰腺類器官感應機械信號并表達致瘤基因;將類器官置于具有不同剛度(1和60 kPa)的聚丙烯酰胺水凝膠中發(fā)現(xiàn)較軟硬度促進腎類器官的生長和分化。
有關剛度在肝臟類器官形成中作用的研究也越來越多。HSC 接種在不同成分的水凝膠上,通過調(diào)控周圍機械微環(huán)境促進3D 培養(yǎng)肝臟類器官的生成(圖1c)[64];Liu 等[65]采用具有應力剛化性質(zhì)的PIC 膠作為基質(zhì)對肝癌細胞HepG2進行3D培養(yǎng)后發(fā)現(xiàn),ECM力學刺激通過力學傳感器YAP 和KCa3.1 鉀通道調(diào)控肝癌細胞的增殖、遷移等行為,加速類器官形成。Sorrentino 等[66]采用一種化學成分的水凝膠模擬肝臟力學微環(huán)境,證實較硬水凝膠促進肝臟類器官的形成。在此過程中,Hippo 通路核效應蛋白YAP 作為整合素下游微環(huán)境機械信號轉(zhuǎn)導的關鍵蛋白[67],整合素/YAP 級聯(lián)通路通過響應ECM 力學信號促進肝臟類器官生長,并發(fā)現(xiàn)異常的基質(zhì)硬度會導致LPC 增殖能力受損。另外,肝臟類器官的每一細胞都與ECM 有物理接觸,并且通過表面的整合素與ECM 中的生化配體進行機械黏附[68]。ECM 硬度通過細胞骨架將力學信號傳遞到細胞核,促進細胞增殖、分化、遷移或凋亡[69],如肌動蛋白聚合延長突起改變其形態(tài)[70],細胞骨架作為機械支架,又與肌球蛋白協(xié)同發(fā)揮收縮張力[71],內(nèi)部和外部的物理力量通過細胞骨架影響局部的力學性質(zhì)和細胞行為。
除了ECM 剛度,其他的力學性能,如非線性彈性、黏彈性、塑性和孔隙彈性等也是類器官形成中的重要調(diào)節(jié)因子[37]。ECM 組分的纖維結構使研究者在哺乳動物和生物聚合物中觀察到非線性彈性,且隨施加應力的增大而增大[72]。自然界大多數(shù)生物組織和基質(zhì)都具有黏彈性,并表現(xiàn)出應力松弛的行為。在目前的合成黏彈性材料中,應力松弛在細胞的擴散、遷移和神經(jīng)元祖細胞的自我更新過程中展現(xiàn)出重要作用[73]。Rizwan 等[74]設計黏彈性透明質(zhì)酸水凝膠模擬肝組織的應力松弛用于原代膽管細胞的培養(yǎng),發(fā)現(xiàn)黏彈性產(chǎn)生的應力松弛與Notch 信號相互作用,通過增加YAP靶基因的表達誘導膽管細胞類器官生長。
類器官中的細胞通過動態(tài)過程對力學刺激作出反應,并適應不斷變化的條件。因此,分析細胞-ECM相互作用在肝臟類器官形成中的意義可能是探究疾病中組織紊亂和藥物反應的一條新道路。
5 小結與展望
類器官作為體外培養(yǎng)的某種類型器官的微型再現(xiàn),再現(xiàn)了人體器官和組織的部分結構,在疾病建模、藥物研發(fā)和組織/器官替代治療等方面具有重要意義。臨床研究證明,患者來源的類器官通過模擬免疫、腫瘤、代謝或感染性疾病,使得研究健康和疾病狀態(tài)下器官間的細胞通信和分子機械信號成為可能[75]。近年來,采用仿生材料模擬細胞和組織生長的機械微環(huán)境已成功用于培養(yǎng)患者或小鼠體內(nèi)分離的原代細胞,也能更好地調(diào)節(jié)肝臟類器官形成。體外主動機械刺激裝置可以通過刺激響應聚合物、微流控裝置和磁性材料等實現(xiàn);體內(nèi)可以通過置入軟機器人來實現(xiàn)。最近報道了一種微尺度動態(tài)軟儲層植入組織后通過改變固體應力、流體剪應力及周圍組織的細胞活性從而調(diào)節(jié)生物-非生物界面的生物力學,將軟機器人與多孔儲層耦合增強藥物在體內(nèi)運輸,促進其藥代動力學[76]。因此,在肝臟類器官中探索細胞微環(huán)境機械力和生化信號轉(zhuǎn)導的相互作用具有重要意義,通過理解生物和非生物因素之間的相互作用,為肝臟類器官生成系統(tǒng)提供了一個新的視角,以期更好地指導臨床治療。
利益沖突聲明:本文不存在任何利益沖突。
作者貢獻聲明:王寧負責起草和修訂論文;呂文良負責論文框架設計,終審論文并最后定稿。

