聯合BRAFV600E突變及TERT啟動子突變基因檢測對判斷甲狀腺乳頭狀癌侵襲性價值研究*
林 占 李 樞 師 柔 李德祥 黃卓雅 廖觀生
廣東省惠州市中心人民醫院 516000
近年來隨著環境、生活習慣及工作壓力的改變,甲狀腺惡性腫瘤發病率逐年上升,甲狀腺乳頭狀癌(Papillary thyroid cancer,PTC)是臨床上最為常見的甲狀腺惡性腫瘤,與20世紀90年代比較,PTC發病率上升了近50%[1-2]。多數PCT患者的10年存活率較高,但是如果侵犯到頸前肌肉、血管等甲狀腺外面的結構,則其10年存活率就會顯著降低,并且對治療效果和預后造成影響[3],因此,急需探究分子標記物對PTC侵襲性進行評估,以提高治療效果,本文旨在探討聯合BRAFV600E突變及TERT啟動子突變基因檢測對判斷甲狀腺乳頭狀癌侵襲性價值,現報告如下。
1 資料與方法
1.1 臨床資料 選取2021年6月—2023年4月在本院手術證實的120例甲狀腺乳頭狀癌(PTC)患者病理標本。納入標準:所有患者手術前未進行任何輔助治療,資料完整,知情同意自愿參與研究。排除標準:合并嚴重心肝腎功能不全、其他惡性腫瘤、精神障礙、糖尿病、吸煙酗酒、妊娠期或哺乳期患者。所選患者中男24例,女96例,年齡28~57歲,平均年齡(41.33±9.01)歲,腫瘤直徑:<1.0cm 45例,≥1.0cm 75例,UICC分期:Ⅰ~Ⅱ期57例,Ⅲ~Ⅳ期63例,雙側累及63例,根據病灶是否突破甲狀腺被膜或有無發生淋巴結轉移,分為侵襲組55例和惰性組65例。
1.2 檢測方法 DNA樣本提取:按照蠟切片樣品DNA提取試劑盒(型號:FFPE DNA,Cat NO.ADx-FF01)說明書提取樣本DNA,所提取的DNA質量在超微量分光光度計(OD-2000TM)上檢測,DNA模板濃度標化(2.0ng/μl)。
BRAF V600E突變檢測:使用美國Applied-Biosystems公司提供的熒光定量PCR系統并按照人BRAF基因V600E突變檢測試劑盒(ADx-BR01、ADxBR02)說明書要求檢測BRAF基因突變,設置陰性對照、陽性質控,按照說明書要求判定結果:需滿足樣本、陽性質控的內控信號升高,陽性質控的外控信號Ct值低于20,結果:樣本Ct值低于28則判定BRAF V600E突變,樣本Ct值28及以上則判定為未突變[4]。
TERT基因啟動子突變檢測:使用美國Applied-Biosystems公司提供的熒光定量PCR系統,并按照人TERT基因啟動子突變檢測試劑盒(PCR-熒光探針法,貨號:RPQ008)說明書要求檢測TERT C228T和C250T突變,設置陰性對照、陽性質控,按照說明書要求判定結果:需滿足樣本、陽性質控的內控信號升高,陰性對照內、外控信號均未升高,陽性質控外控信號Ct值低于14,結果:樣本外控信號Ct值低于25則判定為基因突變,Ct值25及以上則判定為未突變[5]。
1.3 研究方法 對侵襲組與惰性組患者BRAFV600E、TERT啟動子兩個位點突變陽性率以及臨床因素(年齡、性別、腫瘤直徑、UICC 分期、雙側累及)進行分析,并統計侵襲性的危險因素。
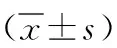
2 結果
2.1 侵襲組與惰性組患者臨床因素差異分析 侵襲組與惰性組患者性別、年齡、腫瘤直徑、UICC分期、雙側累及情況差異均具有統計學意義(P<0.05),其中侵襲組患者男性患病率更高,年齡更小,腫瘤直徑更大,UICC分期更高,雙側累及更多,見表1。

表1 侵襲組與惰性組患者臨床因素差異分析[n(%)]
2.2 侵襲組與惰性組患者BRAFV600E突變及TERT啟動子突變基因差異分析 侵襲組患者BRAFV600E、TERT啟動子突變率,以及BRAFV600E+TERT啟動子同時突變率均顯著高于惰性組,差異均具有統計學意義(P<0.05),見表2。

表2 侵襲組與惰性組患者BRAFV600E突變及TERT啟動子突變基因差異分析[n(%)]
2.3 甲狀腺乳頭狀癌侵襲性危險因素Logistic回歸分析 以PTC患者是否表現為侵襲性為應變量Y,以性別、年齡、腫瘤直徑、UICC分期、雙側累及情況、BRAFV600E、TERT啟動子突變情況作為自變量X進行Logistic回歸分析,結果顯示:性別、年齡、腫瘤直徑、UICC分期、雙側累及情況、BRAFV600E、TERT啟動子突變均進入方程,且均為PTC患者侵襲性的危險因素,見表3、表4。

表3 甲狀腺乳頭狀癌侵襲性危險因素Logistic回歸分析賦值表

表4 甲狀腺乳頭狀癌侵襲性危險因素Logistic回歸分析結果
3 討論
根據甲狀腺癌治療指南建議,病灶已經發生淋巴結轉移、甲狀腺外侵犯、遠處轉移侵襲性PTC患者推薦采取手術治療,而對于病灶未出現淋巴結轉移、甲狀腺外侵犯及遠處轉移患者推薦采取隨訪觀察,隨訪期間若發展為侵襲性PTC則給予手術治療也可[6-7]。因此,如何及早診斷PTC患者的侵襲性是臨床上的一大難點,既往多采取超聲、單一基因檢測(BRAFV600E、TERT啟動子),預測價值較低,難以準確地區分PTC患者的侵襲性,本研究旨在檢測 BRAFV600E突變及TERT啟動子突變,對侵襲組與惰性組之間的BRAFV600E、TERT啟動子兩個位點突變陽性率以及臨床因素進行分析,并統計侵襲性的危險因素,探討其判斷PTC患者侵襲性的價值,為臨床上選擇合適的方式治療PTC患者提供依據。
本研究納入樣本120例,侵襲組55例,占45.83%,僅發生突破甲狀腺被膜10例,僅發生淋巴結轉移32例,同時突破甲狀腺被膜和發生淋巴結轉移13例,惰性組65例,占54.17%,侵襲組男性發病率為62.50%顯著提高(P<0.05),表明男性PTC患者表現為侵襲性的風險顯著高于女性,侵襲組患者平均年齡為(38.27±8.26)歲顯著較低(P<0.05),表明PTC患者侵襲性的發生更傾向于年輕人,腫瘤直徑>1cm中60%的患者表現為侵襲,腫瘤直徑<1cm中29.82%表現為侵襲,UICC分期Ⅲ~Ⅳ期60.32%患者表現為侵襲,Ⅰ~Ⅱ期29.82%患者表現為侵襲,且累及雙側的患者中有63.49%表現為侵襲,差異均具有統計學意義(P<0.05),Logistic回歸分析顯示:PTC患者性別、年齡、腫瘤直徑、UICC分期、雙側累及情況均為PTC患者表現為侵襲性的危險因素,表明腫瘤直徑越大、UICC分期越高、累及雙側越多,表現為侵襲性的風險越大,與腫瘤進展有關,不斷惡化,PTC患者逐漸表現為侵襲性[8]。
目前PTC分子標記物較多,尤其是BRAFV600E、TERT啟動子(端粒酶逆轉錄酶)在PTC的發生、發展中發揮著重要作用,可作為判定PTC預后的重要分子標志物,侵襲組患者BRAFV600E、TERT啟動子突變率顯著高于惰性組,且Logistic回歸分析也表明本研究顯示:BRAFV600E、TERT啟動子突變均是PTC患者表現為侵襲性的危險因素,與既往研究一致[9]。研究表明:BRAFV600E、TERT啟動子同時突變的甲狀腺患者復發率極高,存活率與BRAFV600E、TERT啟動子突變均相關,兩個基因位點同時突變時,PTC患者的臨床病理特征最差,尤其是淋巴結轉移和甲狀腺腺外[10],本研究Logistic回歸分析顯示:BRAFV600E、TERT啟動子突變、BRAFV600E+TERT啟動子同時突變均為PTC患者變現為侵襲性的危險因素,且BRAFV600E+TERT啟動子同時突變的OR值最大,表明BRAFV600E+TERT啟動子同時突變時,PTC患者表現為侵襲性的風險最大,BRAFV600E+TERT啟動子同時突變,TERT mRNA表達水平異常增高,與BRAFV600E突變導致的MAPK通路異常激活,促使細胞無限分裂、增殖,細胞極易發生端粒危機,TERT啟動子發生突變的概率增加,活化端粒酶,保證細胞的永生化,并且BRAFV600E突變造成ETS轉錄因子增加,結合在TERT啟動子突變后產生的新位點上,增強TERT的轉錄活性[11]。
綜上所述,聯合BRAFV600E突變及TERT啟動子突變與甲狀腺乳頭狀癌侵襲性相關,雖然機制尚未明確,但可以作為判斷PTC患者侵襲性的分子標志物,同時也要適當考慮患者的年齡、性別、腫瘤直徑、UICC分期、雙側累及情況,為PTC患者治療方案的選擇提供依據。

