血清TREM-1、CRP及HO-1水平與下肢動脈硬化閉塞癥介入治療后血管再狹窄的相關性研究
肖大雷 劉清泉 張亞猛 劉 融
河南省漯河市中心醫院普外二科 462300
下肢動脈粥樣硬化閉塞癥(LEAOD)屬于外科常見疾病,主要是由于患者下肢粥樣硬化斑塊的形成,后期發展為動脈狹窄、閉塞,進而導致其出現肢體慢性缺血。臨床上主要表現為患肢冰冷、麻木、疼痛及趾或足出現潰瘍、壞死等[1]。目前常用介入治療,因其創傷小、經濟效益好、可重復操作而被廣泛應用,但此方法在治療過程中極易損傷血管內膜,進而會導致其血管再次發生狹窄,不利于預后[2]。髓系細胞觸發受體1(TREM-1)屬于一種炎癥激發受體,其參與激活機體免疫細胞及炎癥因子的分泌與調節[3]。C反應蛋白(CRP)作為一種對機體炎癥反應具備高敏感性的指標,通過增強吞噬細胞的吞噬能力而達到對機體的調節作用[4]。血紅素氧合酶1(HO-1)是血紅素降解的一種限速酶,在炎癥反應及機體氧化應激過程中發揮重要作用[5]。本研究探討血清TREM-1、CRP及HO-1水平與LEAOD介入治療后血管再狹窄的相關性,報道如下。
1 資料與方法
1.1 一般資料 回顧性分析2018年1月—2022年2月我院收治的120例LEAOD行介入治療患者的臨床資料,其中男56例,女64例;年齡45~75歲,平均年齡(65.78±9.12)歲;體重指數(BMI) 20~24kg/m2,平均BMI(21.54±1.03)kg/m2;吸煙史54例。
1.2 納入及排除標準 納入標準:(1)符合《下肢動脈硬化閉塞癥診治指南》[6]中診斷標準,且均行介入治療并置入支架者;(2)病例資料信息完善。排除標準:(1)藥物過敏史;(2)存在心、肝、腎等重要器官障礙者;(3)合并惡性腫瘤者;(4)依從性差者;(5)對手術不耐受或存在麻醉禁忌證者。
1.3 方法 (1)院外隨訪與分組:患者入院后均接受介入治療(球囊擴張術+支架成形術),治療后行1年隨訪,依據患者下肢動脈超聲或者CT血管造影(CTA)檢查結果評估是否發生再狹窄,并分為再狹窄組與未狹窄組。(2)一般資料收集:兩組患者入院后均收集性別、年齡、BMI、合并疾病、住院時間、吸煙史、病變類型、病變部位等一般資料。(3)實驗室指標檢測:抽取兩組患者術前靜脈血4ml,3 000r/min,離心15min,最后分離血清,置于-70℃冰箱保存,并使用全自動化學發光免疫分析儀(上海透景生命科技股份有限公司,型號:TESMI i100)以酶聯免疫法測定血清TREM-1、HO-1水平,以免疫比濁法測定CRP水平,所有操作均按照說明書嚴格進行。
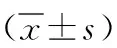
2 結果
2.1 院外隨訪 患者入院后均接受介入治療,治療結束后行1年隨訪,120例患者中再狹窄率33.33%(40/120),未狹窄率66.67%(80/120),分別設為再狹窄組與未狹窄組。
2.2 LEAOD患者介入治療后再狹窄的單因素分析 兩組性別、BMI、住院時間、吸煙史、合并高脂血癥、合并糖尿病、病變類型、病變部位比較差異無統計學意義(P>0.05),再狹窄組高血壓占比、年齡以及血清TREM-1、CRP、HO-1水平顯著高于未狹窄組,差異有統計學意義(P<0.05),見表1。

表1 LEAOD患者介入治療后再狹窄的單因素分析
2.3 LEAOD患者介入治療后再狹窄的多因素Logistic回歸分析 將單因素中有差異信息納入多因素Logistic回歸分析,行量化賦值,以介入治療后是否發生再狹窄作為因變量,將上述存在差異的單因素作為自變量,并納入Logistic回歸分析模型。經多因素Logistic回歸分析證實,高血壓、年齡≥56歲、TREM-1≥310.120ng/L、CRP≥7.535mg/L、HO-1≥13.970μg/L是LEAOD患者介入治療后再狹窄的危險因素(均P<0.05)。見表2、3。

表2 量化賦值表
2.4 年齡、TREM-1、CRP、HO-1預測LEAOD患者介入治療后再狹窄的ROC分析 經ROC分析證實年齡、TREM-1、CRP、HO-1均可用于LEAOD患者介入治療后再狹窄的預測,曲線下面積分別為0.556、0.661、0.779、0.742(均P<0.05)。見表4。年齡、TREM-1、CRP、HO-1預測LEAOD患者介入治療后再狹窄的ROC曲線見圖1。

圖1 年齡、TREM-1、CRP、HO-1預測LEAOD患者介入治療后再狹窄的ROC曲線

表4 年齡、TREM-1、CRP、HO-1預測LEAOD患者介入治療后再狹窄的ROC分析
3 討論
LEAOD是動脈粥樣硬化(AS)在下肢動脈的病理變化表現。目前治療此疾病主要方法為介入治療,但治療后部分患者會出現血管再狹窄現象。近年來,如何降低介入治療后再狹窄率成為眾多學者研究的重要課題[7]。TREM-1是一種能夠觸發并增強機體炎癥因子的介質,而CRP作為一種急性相反應物,是反映機體炎癥反應的敏感指標,另外HO-1作為一種微粒體酶,當細胞和機體組織處于炎癥反應、氧化應激、溶血等應激狀態時,其可以防止機體內部細胞介導因子的凋亡[8-9]。本研究開展回顧性分析,觀察LEAOD患者介入治療后再狹窄與TREM-1、CRP、HO-1表達水平的聯系,并通過ROC分析及多因素Logistic回歸分析觀察其因素在此類患者中的臨床應用價值,為此類疾病治療及預后提供科學依據。
本研究結果顯示,LEAOD患者介入治療后再狹窄率達33.33%,與陳懿等[10]研究中的39.80%較接近。同時,本研究發現再狹窄組高血壓占比、年齡以及TREM-1、CRP、HO-1水平顯著高于未狹窄組,提示上述因素可能是LEAOD患者介入治療后再狹窄的危險因素。安彩霞等[11]在LEAOD患者介入治療后再狹窄影響因素中也指出年齡、高血壓與LEAOD患者介入治療后再狹窄聯系密切,可與本次研究結論相互印證。
TREM-1主要表達于中性粒細胞、單核細胞以及巨噬細胞等細胞表面,其表達可觸發和增強炎癥級聯反應,且對炎癥疾病以及機體自身免疫性疾病的發生與發展起關鍵作用[12]。此次研究中再狹窄組血清TREM-1水平顯著高于未狹窄組,分析可能是TREM-1能誘導多個信號通道,激發機體骨髓單核細胞間的分化,從而致使局部單核細胞浸潤至巨噬細胞,引發炎癥因子大量釋放,最終加速AS形成。另外,TREM-1還能經由脂代謝增加細胞內脂質,導致大量泡沫細胞生成,進而促進AS形成[13]。
CRP作為炎癥過程中的重要標志物,與AS及介入治療后血管再狹窄聯系密切。其通過誘導細胞黏附分子生成、促進單核細胞表面組織因子表達以及巨噬細胞吞噬,進而破壞血管內皮功能,致使血管內皮出現增生,最終形成動脈粥樣斑塊[14]。本研究中再狹窄組血清CRP水平顯著高于未狹窄組,分析可能是支架作為一種外來刺激物,可使血小板在其表面積聚,并分泌大量炎癥因子,進而引起血栓。同時,白細胞在血管損傷處大量聚集,并分泌多種細胞因子介導炎癥反應,進而致使平滑肌細胞大量向損傷部位轉移及增殖,而新生的內膜增生則會導致血管再狹窄的發生[15]。
HO-1作為血紅素中分解代謝的限速酶,可催化和降解細胞中血紅素一氧化碳(CO)、膽綠素及鐵蛋白的產生,進而發揮生物學效應。有研究顯示[16],HO-1的干預可減輕血管內皮細胞的損傷,并抑制巨噬細胞的浸潤、泡沫細胞的生成以及血管平滑肌細胞(VSMCs)轉移和增殖,進而減緩動脈粥樣硬化斑塊的形成及縮小主動脈斑塊面積,延緩AS的發展。本研究中再狹窄組血清HO-1水平顯著高于未狹窄組,分析可能是血管內膜受到外力損傷后,通過VSMCs表達的HO-1可直接降解血紅素,并產生內源性CO、膽紅素以及鐵蛋白,上述代謝產物能通過對VSMCs的增殖和凋亡,抑制血管再狹窄的發生[17-18]。
為明確LEAOD患者介入治療后再狹窄的危險因素,本研究行ROC及經多因素Logistic回歸分析,證實有高血壓、年齡≥56歲、TREM-1≥310.120ng/L、CRP≥7.535mg/L、HO-1≥13.970μg/L是LEAOD患者介入治療后再狹窄的危險因素。因此后續在LEAOD患者介入治療中臨床醫師應對上述影響因素密切關注,以利于及時采取處理措施并降低患者再狹窄率。
綜上所述,LEAOD患者介入治療后再狹窄與高血壓、年齡以及TREM-1、CRP、HO-1表達水平相關,同時年齡≥56歲、TREM-1≥310.120ng/L、CRP≥7.535mg/L、HO-1≥13.970μg/L可用于此類患者再狹窄預測,值得臨床醫師密切關注。

