高中化學關于化學方程式及其生成物計算的解題方法研究
劉 幫
(江蘇省鹽城市射陽縣高級中學,江蘇 鹽城 224300)
高中階段的化學學科,關于化學方程式及其生成物的計算,其理論知識相對來說比較抽象,學生在掌握關于這些知識的學習方法時比較困難,導致在解題技巧的訓練上也比較不足,影響學生的解題效率以及解題正確性[1].因此學生在學習和理解這類知識時,更應該針對不同的題型加強訓練,積累解題的經驗,總結不同的解題方法,在這個過程中學生還能對自己的化學思路進行一個有效的梳理,加深對化學知識的印象與理解.因此,本文針對在化學方程式及其生成物計算中應用比較常見的解題方法進行說明,為提高學生解題技巧提供方向.
1 基于化學方程式,聯系守恒法
學習化學知識的過程中,掌握守恒定律是一個必需的過程,它基于質量守恒、電荷守恒等守恒原理,可以在關于化學方程式解題過程中給予學生方向[2].學生在面對關于化學方程式有關的題型時,要學會迅速找出隱藏在題目給出條件中的守恒關系,在這個關系的基礎上針對化學方程式進行深入的挖掘,這樣不僅可以加強學生對解題技巧的訓練,還可以加深相關知識的理解[3].
例1取一定物質的量濃度的NaOH溶液100 mL,向其通入一定量的CO2氣體,得到溶質為Na2CO3和NaHCO3的溶液A,向A中逐滴緩慢加入2 mol·L-1的鹽酸,產生CO2的體積與所加鹽酸的體積之間關系如圖1所示.(假設產生的CO2全部逸出)
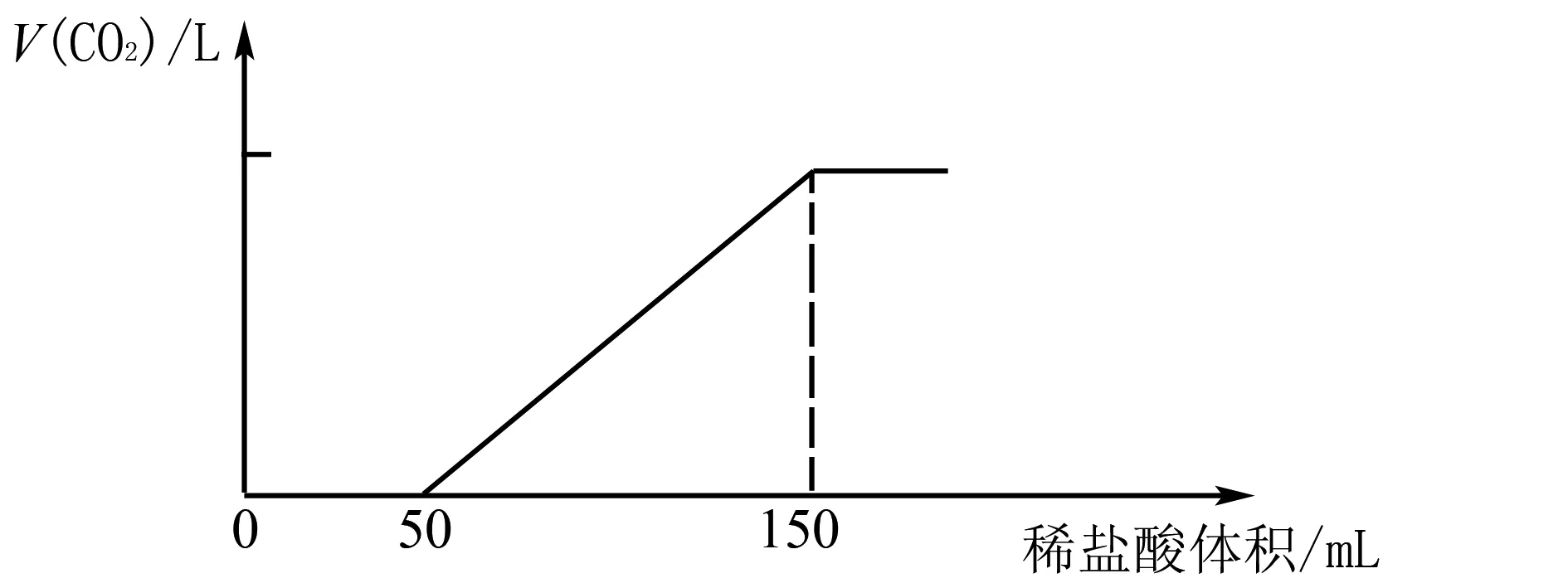
圖1 CO2的體積變化
(1)加入鹽酸0~50 mL時發生反應的離子方程式為____.
(2)Na2CO3與NaHCO3的物質的量之比是____.
(3)通入的CO2的物質的量為____.
(4)原NaOH溶液的物質的量濃度是____.
解析(1)加入鹽酸0~50 mL時發生反應:

反應離子方程式為:
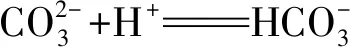

(3)根據碳原子守恒可知,n(CO2)=n(Na2CO3)+n(NaHCO3)=0.1 mol+0.1 mol=0.2 mol.故答案為:0.2 mol.
(4)根據鈉離子守恒,n(NaOH)=2n(Na2CO3)+n(NaHCO3)=0.1 mol×2+0.1 mol=0.3 mol,故c(NaOH)=3 mol/L.故答案為:3 mol/L.
2 基于生成物,善用分段法
在大多數化學方程式及其生成物的計算中,形成的生成物不止一種,它會基于反應物的濃度以及外界環節等因素而出現不同的情況[4].在分析這類化學方程式以及生成物時,學生就要針對這些因素對其進行分段,將不同情況下的反應都考慮到.在這個過程中,學生可以形成一個縝密的邏輯性思維,對于化學反應的理解也會更深一層.
例2現有mg的鈉、鎂、鋁分別與100 mL 1 mol/L的鹽酸反應,產生的氣體在相同條件的體積分別為V1、V2、V3,則V1∶V2∶V3之比正確的有幾個( ).
A.5 B.4 C.3 D.2

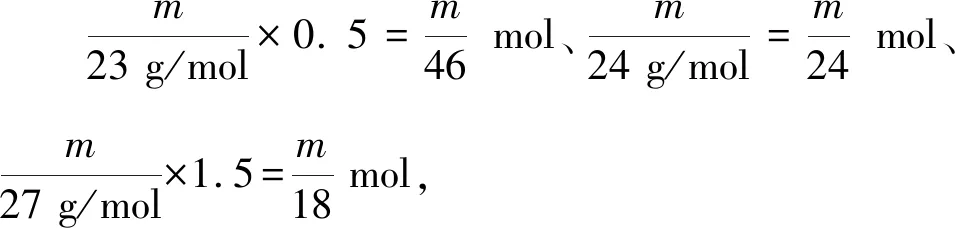
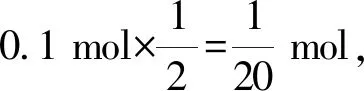
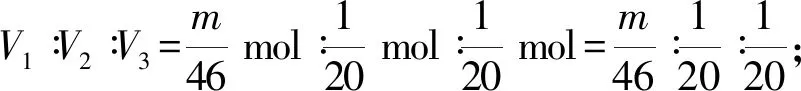
(4)當m=2.3 g時,鈉與鹽酸恰好反應,鎂、鋁均剩余,產生H2的物質的量均為0.05 mol,根據阿伏加德羅定律,V1∶V2∶V3=1∶1∶1,故④符合;
(5)當m>2.3 g時,鈉、鎂、鋁均剩余,而鹽酸過量,產生的H2的物質的量均為0.05 mol,根據阿伏加德羅定律,V1∶V2∶V3=1∶1∶1,故④符合.
故選C.
3 掌握特殊現象,巧用推斷法
在化學方程式的學習中,有些反應條件及其反應現象是比較特殊的,比如反應條件是加熱或催化,反應現象會出現有顏色的沉淀物等.學生要善于積累并掌握這些特殊的現象,在這個基礎上進行推斷,進而推理出整個聯合反應,實現正確解題[5].
例3A、B、C分別是硫酸、鹽酸、硝酸鋇三種溶液中的一種,將它們按一定順序滴入碳酸鈉溶液中至恰好完全反應,有以下現象:
(1)加入A時生成白色沉淀.
(2)向(1)中沉淀加入B時,沉淀溶解,并有氣體逸出.
(3)向(2)中生成溶液里加入C時,又有白色沉淀生成.
根據以上事實判斷,A是____C是____(寫化學式),并寫出(2)(3)反應的離子方程式____.
分析在解題時,學生要抓住碳酸鈉與不同物質反應后的特殊現象,即硫酸與碳酸鈉反應生成氣體,鹽酸與碳酸鈉反應生成氣體,只有硝酸鋇與碳酸鈉反應生成碳酸鋇白色沉淀,碳酸鋇能全部溶解在鹽酸中,從而推斷出向氯化鋇中加硫酸會生成硫酸鋇沉淀,以此來推理分析確定每一種物質,并利用發生的化學反應來書寫離子方程式.
解答硫酸、鹽酸、硝酸鋇三種溶液中,只有硝酸鋇滴入到碳酸鈉溶液中會生成碳酸鋇白色沉淀,所以A是硝酸鋇,向碳酸鋇中加入鹽酸,生成氯化鋇和水以及二氧化碳,實質是:

向氯化鋇中加入硫酸會生成硫酸鋇白色沉淀,即
所以B是鹽酸,C是硫酸.
故答案為:Ba(NO3)2;H2SO4;

4 總結
在高中化學有關化學方程式以及生成物的計算中,其涉及的知識層面比較廣泛,難度也比較大.學生在學習和理解這類知識時,應該針對不同的題型加強訓練,積累解題的經驗,總結不同的解題方法.教師可以通過基于化學方程式聯系守恒法、基于生成物善用分段法、掌握特殊現象巧用推斷法等方法,引導學生強化解題思路,全面提升學生的化學解題能力.

