基于MALDI - TOF MS 技術快速鑒定奶牛乳腺炎奶樣中疑似金黃色葡萄球菌
劉 宇,張忠兵,徐曉楓,蒲云霞,王利平,吳瓊海,琚 波,希尼尼根*
(1.內蒙古農業大學 獸醫學院 內蒙古 呼和浩特 010018;2.內蒙古綜合疾病預防控制中心,內蒙古 呼和浩特 010080)
奶牛乳腺炎作為奶牛最常見的流行疾病之一,對動物福利和奶業健康發展產生嚴重的影響。該病的流行可導致奶牛產奶量下降、牛奶品質下降、抗生素濫用等問題發生[1-3]。奶牛乳腺炎在我國發病仍較為頻繁,其中臨床型乳腺炎發病率為 9.7%~55.6%,隱性乳腺炎發病率為61.03%~79.62%[4],每年因奶牛乳腺炎所造成的經濟損失高達30億元[5]。金黃色葡萄球菌(Staphylococcusaureus,S.aureus)作為引起奶牛乳腺炎的主要病原體之一,可在人與動物之間交叉傳播引發疾病[6];同時,S.aureus對機體的免疫逃避機制和對抗生素的耐藥性導致該病治療復雜化,致使公共衛生和食品安全面臨巨大的挑戰[7-8]。因此及時準確鑒定S.aureus對療奶牛乳腺炎預防、治療和控制具有重要意義。
目前,S.aureus的檢測主要包括傳統的生化鑒定、免疫學鑒定、分子生物學和量子點標記等鑒定方法[9];傳統生化試驗因為操作過程繁雜、時間過長和結果偏差大等問題無法滿足微生物的快速鑒定。免疫學鑒定雖然縮短了檢測時間,但其工作原理為抗原抗體結合,易受其他代謝產物影響,假陽性率升高[10-11]。隨著分子生物學技術的廣泛應用為S.aureus的快速鑒定提供了幫助,基質輔助激光解吸電離飛行時間質譜(MALDI-TOF MS)作為近些年快速發展的檢測技術,已經廣泛用于微生物快速鑒定、分型和耐藥性檢測;該技術將表型分析與分子分析有機結合起來,通過采集目標菌核糖體蛋白質獲取特異性的指紋圖譜,將獲取的特異性指紋譜圖與數據庫中已有圖譜進行比對分析,實現待測菌株在屬、種水平的鑒定[12-15]。該方法具有操作簡便、快速、準確、高通量和成本低等優點。
本試驗通過MALDI-TOF MS技術對乳腺炎奶樣中分離菌株進行快速鑒定,同時選用熒光定量PCR和nuc基因的PCR擴增等方法進行方法比較,分析MALDI-TOF MS方法在鑒定S.aureus的準確程度,同時對鑒定菌株進行聚類分型及分析,為奶牛乳房炎的防控和可能污染源的追溯提供技術支持。
1 材料與方法
1.1 菌株來源本試驗中45株疑似菌株均由奶牛臨床型乳房炎奶樣中分離獲得,3株標準菌株S.aureusATCC29213、表皮葡萄球菌(Staphylococcusepidermidis)ATCC35984和大腸桿菌(Escherichiacoli)ATCC25922均由內蒙古疾病預防控制中心提供。
1.2 主要儀器MALDI-TOF MS 基質輔助激光解吸電離飛行時間質譜儀,購自鄭州安圖生物科技工程公司;PCR擴增儀、電泳儀和凝膠成像系統均購自伯樂公司;熒光定量PCR儀、全自動核酸提取儀購自碩世生物科技有限公司。
1.3 主要試劑營養瓊脂(NA)、S.aureus選擇性培養基(BP)和血平板均購自北京路橋技術股份有限公司;甲酸(FA)、乙腈(ACN)、無水乙醇和三氟乙酸(TFA)由賽默飛世爾公司提供;α-氰基-4-羥基肉桂酸(HCCA)和細菌試驗校準品(BTS)由鄭州安圖生物科技工程公司提供;Premix由日本TAKARA公司提供;熒光定量PCR引物和探針、耐熱核酸酶(nuc)擴增引物(表1)[16-17]、SDS、Tris均購于上海生工生物工程有限公司;DNA提取試劑盒由碩世生物科技有限公司提供。
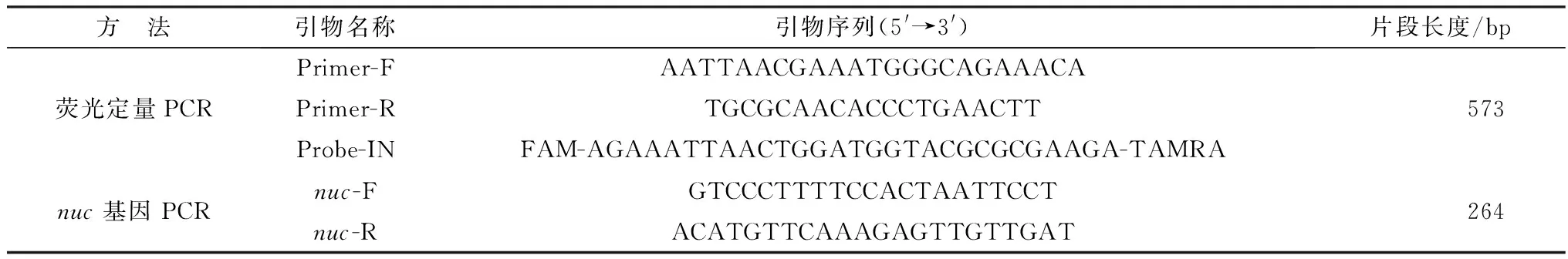
表1 引物名稱及序列
1.4 葡萄球菌的分離將呼和浩特地區13家牧場采集的257份臨床型乳房炎奶樣搖勻后吸取25 mL分別加到225 mL氯化鈉營養肉湯的勻質袋中,置于37℃恒溫培養箱中增菌培養18~24 h;將增菌液分別劃線接種到Baird-Parker平板37℃恒溫培養18~24 h;挑取特征菌落接種到血平板,再次置于恒溫培養箱培養18~24 h。挑取特征菌落進行革蘭染色、鏡檢后,將獲得的45株葡萄球菌保存備用。
1.5 MALDI-TOF MS 鑒定方法
1.5.1提取法處理 取300 μL去離子水或超純水加入到1.5 mL離心管中,用接種環刮取待測菌落5~10 mg至離心管中并混勻;向離心管中加入900 μL無水乙醇混勻;14 000 r/min離心4 min,棄上清液后再次離心2 min。用移液槍將殘留液體吸凈,此過程不能接觸沉淀;室溫干燥1~2 min后加入50 μL 70%甲酸,充分混勻;再加50 μL乙腈進行混勻;14 000 r/min離心2 min后將上清液轉移至新離心管中備用。分別取1 μL待測提取液和細菌校準液(BTS)置于MALDI靶板上,室溫晾干后滴加1 μL HCCA基質液,待充分晾干后進行檢測。
1.5.2MALDI-TOF MS檢測 儀器參數設置:線性模式為正離子P采集模式;檢測器2.65 kV,推遲極20 kV,引出極1.9 kV,聚焦極1.00 kV,激光頻率330 Hz,相對分子質量范圍2 000~20 000 Da。將載有待測液和校準液的靶板送入質譜儀內,用采集軟件進行特征指紋譜圖的采集,試驗開始時先用校準液對儀器進行校準,校準通過后開始對待測樣本進行采集。將采集的蛋白質指紋圖譜與數據庫中標準菌株指紋圖譜比對分析,通過比對質核比(m/z)和特征峰得到鑒定結果;并將采集的指紋圖譜使用分析軟件進行聚類分析[18-19]。
1.5.3結果判定 數據庫給出與鑒定菌株最為匹配的10株菌株,并給出相應分值及種屬。鑒定分數在9.500~10.000區間內,表明該匹配結果種水平置信及可能的亞種[20];分值在9.000~9.500區間內,表明該匹配結果種水平置信;分值在6.000~9.000區間內,表明該匹配結果屬水平置信;分值在6.000以下,表明該匹配結果不可置信。
1.6S.aureusnuc基因鑒定按照全自動核酸提取儀操作要求,分別提取各待測菌株基因組DNA;對待測菌株進行nuc基因PCR擴增試驗,同時以大腸桿菌(ATCC25922)、S.aureus(ATCC29213)和表葡菌(ATCC35984)做實驗對照。50 μLnuc基因PCR擴增體系:Premix(包括緩沖液、氯化鎂、dNTP、聚合酶等)25 μL、DNA模板2 μL、引物nuc-F和nuc-R各2 μL、ddH2O 19 μL;PCR反應程序:95℃預變性5 min、95℃變性1 min、49℃褪火30 s、72℃延伸20 s,進行30個循環,72℃總延伸5 min。擴增結束后進行電泳試驗,陽性產物送至上海進行基因測序,將nuc基因序列利用NCBI軟件BLAST進行比對。
1.7 熒光定量PCR鑒定將提取好的S.aureus基因組DNA進行擴增。20 μL反應體系:qPCR SuperMix(包括緩沖液、氯化鎂、dNTP、聚合酶等)10 μL、上、下游引物及探針各0.5 μL、DNA模板2 μL,補雙蒸水至20 μL;反應程序:預變性95℃ 3 min;95℃ 5 s、55℃ 60 s,再進行40個循環。Ct值≤36則判定為陽性。
2 結果
2.1 MALDI-TOF MS 檢測結果及分析通過采集軟件對45株疑似菌株進行圖譜分析,其中43株報告為S.aureus(表2),檢出率為95.6%(43/45)。其中C2、E1等28株匹配分值大于9.500,表明該匹配結果種水平置信及可能的亞種;C3、E9等15株匹配分值大于9.000,表明該匹配結果種水平置信;其余2株L11和F4分析鑒定為產色葡萄球菌。對43株S.aureus的主要離子峰進行綜合分析,其主要集中在2 000~10 000 Da區間內。在質荷比為(m/z)2 763,3 445,4 816,5 528,6 892,9 633等12處存在特征峰,各菌株特征峰基線平穩、重復性好、響應值高,圖譜質量較高,如圖1所示。同時將各菌株特征峰與數據庫內S.aureus特征峰進行比對分析,0軸以上為待鑒定菌株主要特征峰圖譜,0軸以下為數據庫S.aureus特征峰圖譜,兩者成鏡像關系的比率越大,則鑒定為同種菌株的可能性則越大,分值則越高。以R121菌株、ATCC29213為例,比對后得到分值分別為9.554和9.509,說明R121與數據庫中S.aureus鏡像比率更高,差異程度更低(圖2)。
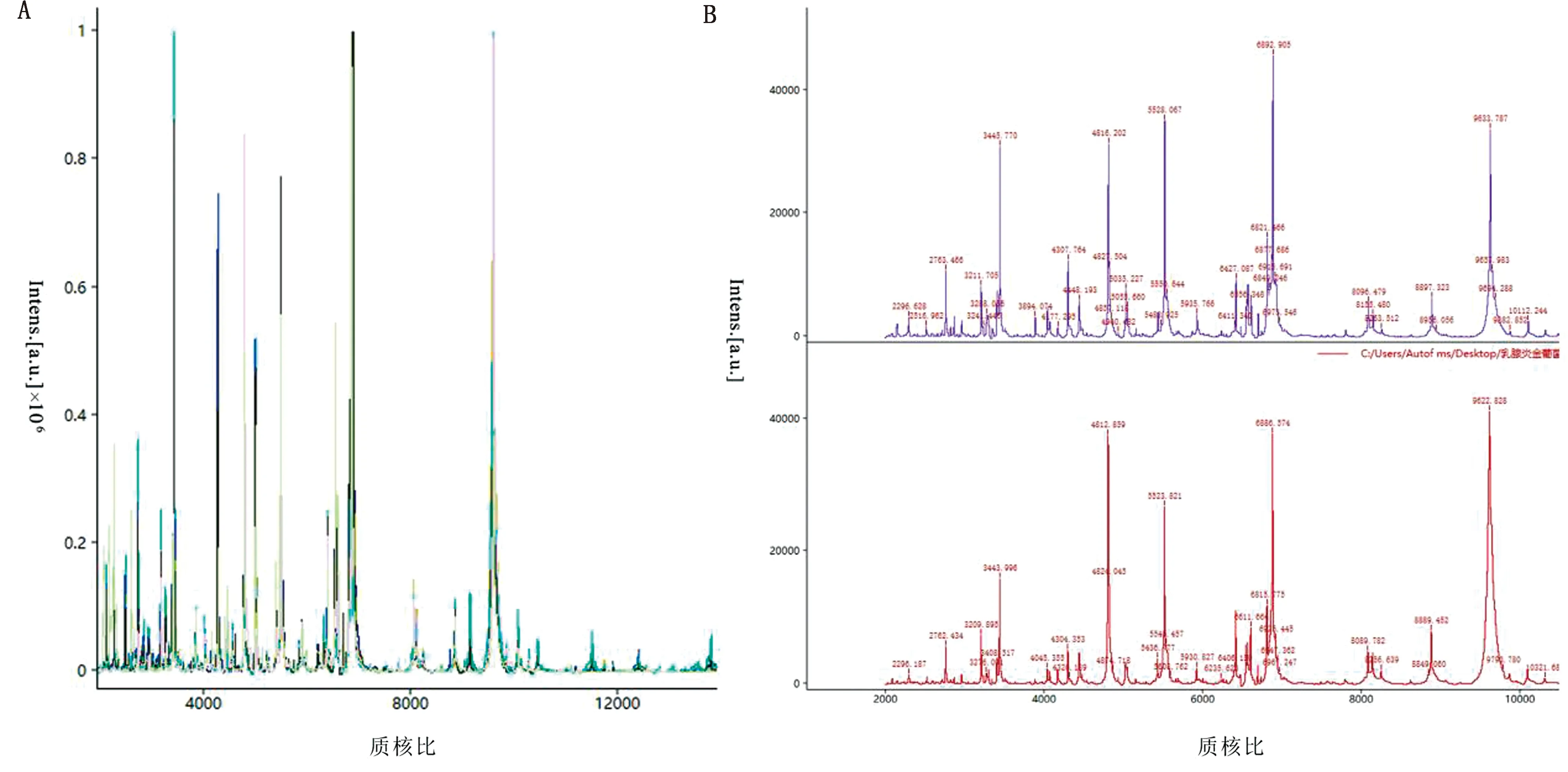
A.43株S.aureus特征峰重復性譜圖;B上.R121菌株質譜圖;B下.ATCC29213標準菌株質譜圖
A.R121;B.ATCC29213
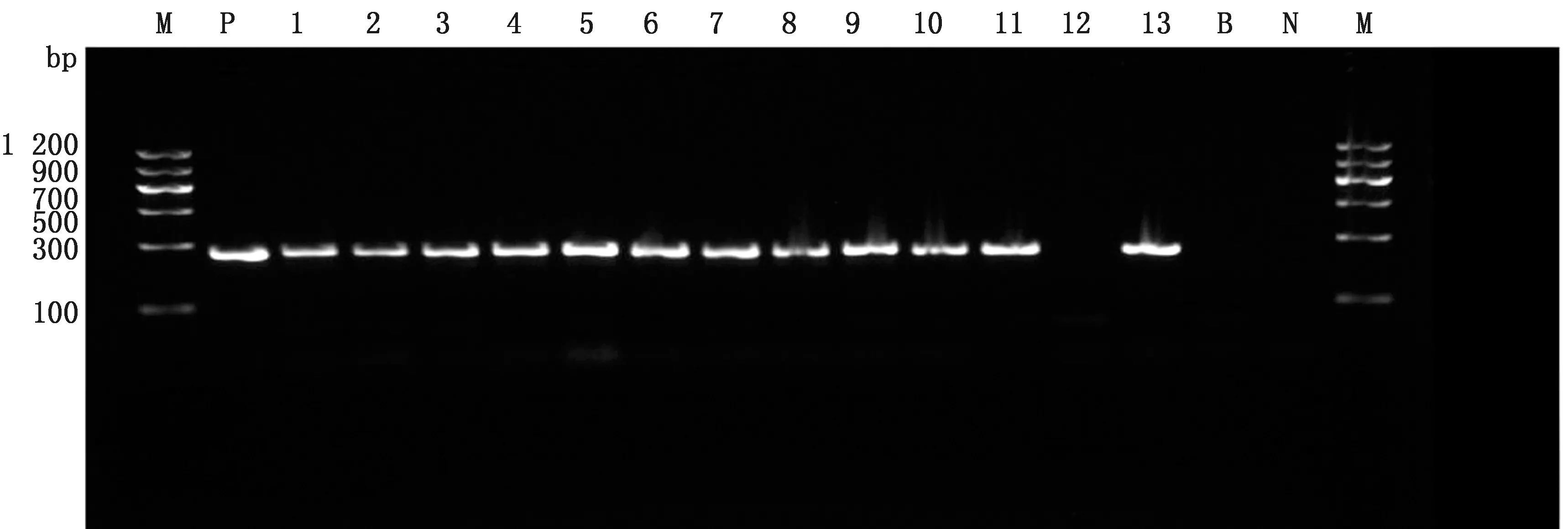
M.DL1200 DNA Marker;P.ATCC29213 S.aureus參照菌株;1~13.為表2中1~13號菌株;B.ATCC35984表葡菌參照菌株;N.ATCC25922大腸桿菌參照菌株
2.2 熒光定量PCR檢測結果通過熒光定量PCR對45株疑似菌株進行檢測,43株檢測結果為陽性,2株呈陰性,與MALDI-TOF MS和nuc基因PCR擴增鑒定一致,統計結果見表2。
2.3nuc基因PCR擴增及序列分析將45株疑似菌株進行nuc基因PCR擴增,以S.aureusATCC29213、表皮葡萄球菌ATCC35984、大腸桿菌ATCC25922作為試驗對照。43株S.aureus和S.aureusATCC29213均擴增出264 bpnuc基因條帶(圖3),與上述2種方法鑒定結果一致(表2)。表皮葡萄球菌ATCC35984、大腸桿菌ATCC25922、L11和F3未擴增出基因條帶。并對L11和F3的菌株進行16S rRNA進行擴增和測序,鑒定為產色葡萄球菌。對擴增nuc條帶進行BLAST在線比對,親緣關系均為S.aureusnuc片段,且同源關系為98.5%~100%。
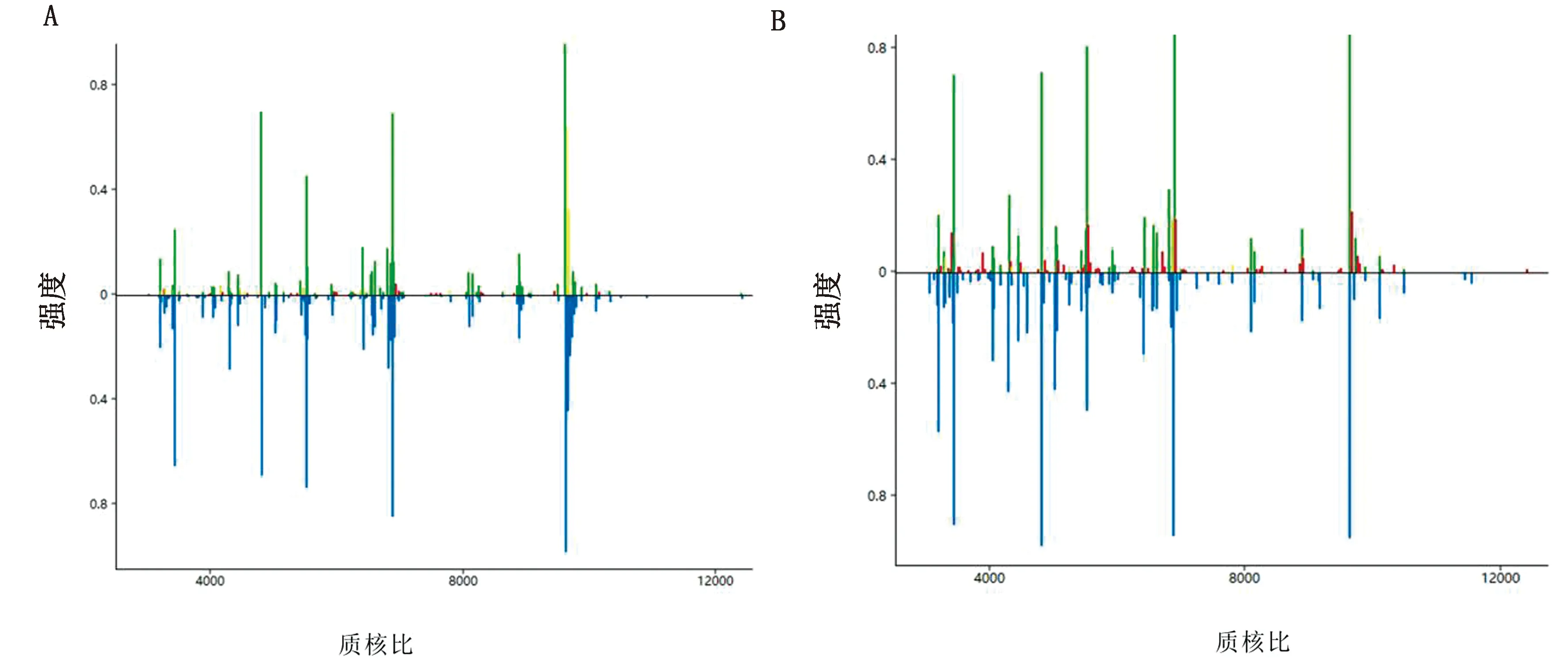
2.4 MALDI-TOF MS 聚類分析結果及分析通過對43株S.aureus指紋圖譜進行聚類分析,按照特征峰相似性得到樹狀圖,以距離表示同源性關系,差異程度為0~1 000,數值越大表明同源性越低。如圖4所示。圖中將43株菌株歸為同一類,這與MALDI-TOF MS鑒定的結果一致,同時圖4直觀的體現了43株S.aureus的相關性及同源性。在差異度800時,可分為2個型,說明兩型間菌株分子水平差異較大,同源關系較遠;在差異度500時,主要可分為5個型,且各型內菌株大多數來源于各自牧場中,說明同一牧場內多數菌株在分子水平差異較小,存在一定程度的同源關系,為牧場進一步對污染源的追溯及防控提供支持。
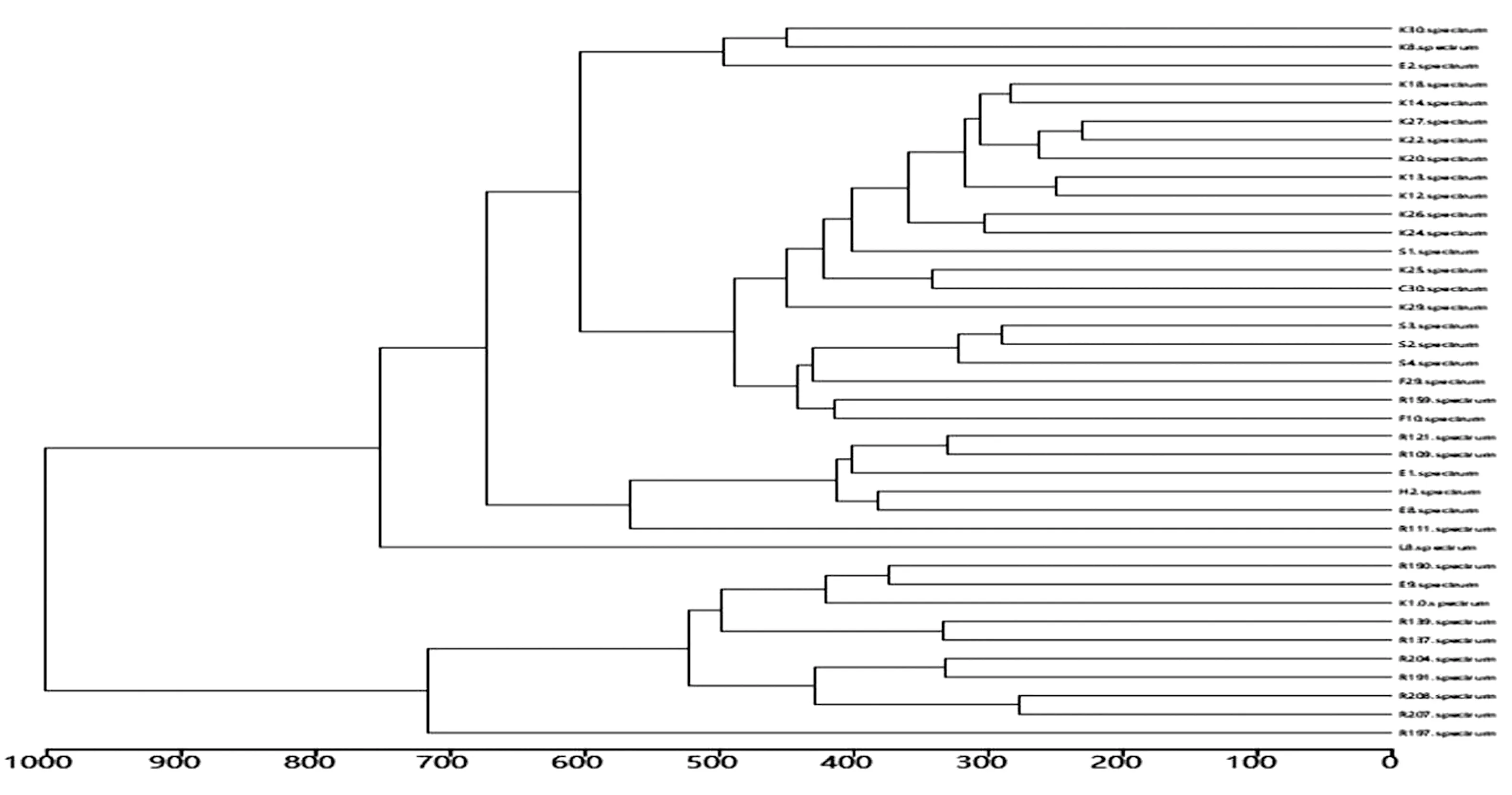
圖4 43株S.aureus MALDI-TOF MS 聚類分析圖
3 討論
MALDI-TOF MS作為近期發展的一種微生物快速鑒定的方法,是對傳統和分子鑒定方法的補充,其原理是通過獲取細菌特異性蛋白圖譜與數據庫中標準菌株圖譜進行分析比較,獲得更為準確和直接的結果[21]。它具有處理方法簡便、鑒定結果快速、準確性高、靈敏度高、高通量和成本低等優點,使得被廣泛用于醫療、環境和食品領域中,但設備價格及維護費用高昂致使一些實驗室無法承擔。其次菌株的培養、基質的選擇以及數據庫等因素也會影響試驗結果[22-23]。
本試驗中采用MALDI-TOF MS對45株疑似葡萄球菌株進行鑒定分析,43株鑒定為S.aureus,均能被鑒定到種水平。其中28株S.aureus匹配分值為大于9.500,占比為65.1%(28/43);15株S.aureus匹配分值大于9.000,占比為34.9%(15/43);與熒光定量PCR和nuc基因PCR擴增鑒定結果一致,進一步驗證了MALDI-TOF MS鑒定的可靠性。但基于鑒定時間和通量而言,熒光定量PCR檢測96個樣本需要約4h,細菌保守片段擴增測序需要約8-10小時,MALDI-TOF MS約需2 h,且1次最多可以檢測384個樣本,MALDI-TOF MS鑒定方法效率更高。就鑒定結果和準確性而言,3種方法均可以將S.aureus鑒定到種屬,且準確率為100%。同時,MALDI-TOF MS通過獲得指紋譜圖進行聚類分析,根據菌株之間差異水平進行分型,分析各菌株間的親緣關系,實現對不同來源的污染菌株進行追溯。
綜上,MALDI-TOF MS適用于對S.aureus分離株的快速鑒定,可用于臨床上快速診斷;同時對S.aureus進行快速聚類分析,對于預防和控制S.aureus引起的奶牛乳腺炎提供了技術支持。

