Drebrin蛋白抑制劑BTP-2對豬偽狂犬病病毒增殖的影響
王世平,王金圓,李昕蔓,唐 婷,楊國宇,潘佳佳
(河南農業大學 農業農村部動物生化與營養重點實驗室 河南省動物生長發育調控重點實驗室,河南 鄭州450002)
豬偽狂犬病是由豬偽狂犬病病毒(pseudorabies virus,PRV)引起的一種急性傳染病,多種家畜和野生動物均可感染,以豬感染最為普遍。該病在我國也廣泛存在,給養豬業造成了巨大的經濟損失[1]。PRV屬于皰疹病毒科、豬皰疹病毒屬,為有囊膜的線性雙鏈DNA病毒,經常被用于皰疹病毒的分子生物學特征以及皰疹病毒性疾病的研究[2]。PRV能在多種組織培養細胞內增殖,其中以豬腎和兔腎細胞最為敏感,可以引起明顯的細胞病變。PRV編碼11種糖蛋白,分別是gE、gI、gD、gG、gL、gM、gH、gC、gB、gN和gK,其中gB糖蛋白是病毒囊膜的主要成分之一,在PRV感染宿主的過程中有著重要的作用[2-3]。gB蛋白對PRV復制至關重要,它不僅參與病毒吸附和進入宿主細胞,也是PRV重要的中和抗原,能夠刺激機體產生病毒特異性體液免疫和細胞免疫反應;此外,gB基因與病毒的毒力有關,gB基因缺失的PRV由于喪失穿透能力而失去感染性[4]。因此,gB基因和蛋白的表達量變化能夠反映PRV的增殖情況。
真核細胞的細胞骨架主要包括微絲、微管和中間絲。微絲是由肌動蛋白單體(G-actin)形成的多聚體,也稱為纖維性肌動蛋白(F-actin)。除參與調控生物學過程外,肌動蛋白及其結合蛋白在病毒吸附、進入、組裝、釋放等生命活動中也發揮重要作用[5-6]。在病毒與宿主細胞相互作用的研究中發現,多種病毒如皰疹病毒、腺病毒、黃熱病毒、痘病毒、流感病毒及狂犬病毒等利用微絲及其結合蛋白入侵宿主細胞并完成其增殖過程[7-12]。發育調節腦蛋白(developmentally regulated brain protein,Drebrin)是一種微絲結合蛋白[13-14]。Drebrin 蛋白包含5個結構域,分別是N 端肌動蛋白解聚因子同源結構域、卷曲螺旋域(coiled-coil,CC)、螺旋域(helical domain,Hel)、脯氨酸富集區域和C末端[15]。Drebrin蛋白通過2個螺旋域協同結合F-actin[13,15-16]。研究發現,Drebrin蛋白可通過與病毒蛋白相互作用、重排微絲細胞骨架,從而調控病毒的感染過程。輪狀病毒的VP4蛋白可與Drebrin結合,抑制輪狀病毒進入宿主細胞。利用化學抑制劑、siRNA 沉默、CRISPR 敲除技術阻斷Drebrin蛋白的功能,增強輪狀病毒感染,而且Drebrin是通過調控發動蛋白依賴的內吞過程從而參與輪狀病毒的入胞過程[17]。另外,在HIV病毒感染宿主細胞時,Drebrin蛋白被募集到病毒囊膜糖蛋白中,并通過調節細胞骨架微絲的動態重組和其結合蛋白Profilin的表達從而調控病毒的感染[18]。宿主細胞骨架微絲存在于PRV病毒粒子中,推測微絲可能參與PRV的生活周期[19],但是微絲結合蛋白Drebrin是否參與PRV的感染過程及其分子機制并不清楚,本研究主要采用Drebrin抑制劑BTP-2阻斷其功能,檢測豬腎上皮細胞PK-15內PRV感染量變化情況,以初步判定Drebrin蛋白是否參與PRV增殖,為進一步研究PRV 感染的分子機制奠定基礎。
1 材料與方法
1.1 細胞與病毒毒株豬腎上皮細胞PK-15、PRV-HN1201、PRV-GFP由本實驗室保存。
1.2 主要試劑DMEM高糖細胞培養基(10566-016)、胎牛血清 FBS(10099-141C)、雙抗PS(15140122)購自 Gibco 公司; BTP-2 (HY-100831)購自 MCE公司;PRV病毒豬源gB單克隆抗體由本實驗室制備;Drebrin抗體(67589-1-Ig)、GAPDH抗體(60004-1-Ig)購自Proteintech公司;CCK-8(40203ES60)購自YEASEN公司;熒光定量試劑SYBR Green(7E503H1)購自Vazyme公司;RNAiso Plus購自寶日生物技術(北京)有限公司。
1.3 藥物配制及細胞活力檢測BTP-2用DMSO溶解為 10 mmol/L,-80℃凍存。將PK-15細胞以104/孔鋪至96孔板中,37℃細胞培養箱培養12 h 后,將藥物用10%FBS的DMEM培養基稀釋后以0,20,60,200,600 nmol/L 的濃度梯度加入細胞,37℃孵育培養 24 h,加入 10 μL的CCK-8,37℃條件下培養 4 h,450 nm波長測吸光度值。數據采用以下公式計算:
細胞活力=(D加藥-D空白)/(D0加藥-D空白) ×100%;
D加藥:具有細胞、CCK-8溶液和藥物溶液的孔的吸光度值;
D空白:具有培養基和CCK-8溶液而沒有細胞的孔的吸光度值;
D0加藥:具有細胞、CCK-8溶液而沒有藥物溶液的孔的吸光度值;
細胞活力:細胞增殖活力或細胞毒性活力。
1.4 熒光觀察及流式細胞術24孔板中以2.5×105/孔接種PK-15細胞,待細胞匯合度達40%左右時,將藥物用10%FBS的DMEM培養基稀釋后以0,20,60,200,600 nmol/L的濃度梯度加入細胞,37℃孵育培養 4 h。棄去原培養基,PBS清洗2遍,以感染復數MOI=0.01感染PRV-GFP株,37℃孵育1 h,棄去原培養基,PBS清洗2遍,加入維持培養基稀釋后的藥物繼續培養24 h,用熒光倒置顯微鏡觀察細胞形態以及熒光情況并拍照。與此同時,收集細胞并進行流式檢測。
1.5 實時熒光定量PCR6孔板中以1×106/孔接種PK-15細胞,待細胞匯合度達50%左右時,將藥物用10%FBS的DMEM培養基稀釋后以0,20,60,200,600 nmol/L的濃度梯度加入細胞,37℃孵育培養 4 h。棄去原培養基,PBS清洗2遍,以感染復數MOI=0.01接種PRV-HN1201株,37℃孵育1 h,棄上清,PBS清洗2遍,加入維持培養基稀釋的藥物繼續培養24/36 h,收集細胞,利用TRIzol提取總RNA,并反轉錄合成cDNA,利用熒光定量PCR引物進行擴增。試驗所使用PRV-gB、Drebrin以及內參基因 GAPDH 上、下游引物如下:PRV-gB-F:5′-GGCATCGCCAACTTCTTCC-3′,PRV-gB-R:5′-CCTCGTCCACGTCGTCCTC-3′。Drebrin-F:5′-TTGCCCAGCGACCTGATAAC-3′,Drebrin-R:5′-TATGAAAGGGCAGTACGGACG-3′。GAPDH-F:5′-GAAGGTCGGAGTGAACGGAT-3′,GAPDH-R:5′-CATGGGTAGAATCA-TACTGGAACA-3′。PCR 反應體系(10 μL):SYBR Green Mix 5 μL,上、下游引物各0.4 μL(終濃度0.8 μmol /L),模板 cDNA 1.5 μL,ddH2O 2.7 μL。反應條件:95℃預變性2 min;95℃變性15 s;60℃退火20 s;72℃延伸20 s,40個循環。將得到的Ct 值采用 2-ΔΔCt進行計算分析。
1.6 Western blot將PK-15細胞以1×106/孔鋪至6孔板中,37℃細胞培養箱培養12 h后,將BTP-2用10%FBS的DMEM培養基稀釋后以0,20,60,200,600 nmol/L的濃度梯度處理細胞,37℃孵育4 h,接毒 MOI=0.1的PRV-HN1201,置37℃吸附1 h,用PBS溶液清洗3次,加入維持培養基稀釋的藥物繼續培養24 h,RIPA 裂解液裂解,收集細胞總蛋白,制樣進行SDS-聚丙烯酰胺凝膠電泳,轉膜后用5%脫脂奶粉封閉1 h,一抗Anti-PRV-gB 4℃過夜,二抗室溫孵育1 h,然后進行ECL,以GAPDH作為內參。
1.7 病毒PFU檢測將PK-15細胞以 1.5×105/孔鋪至 12 孔板中,37℃細胞培養箱培養12 h后,將BTP-2用10%FBS的DMEM培養基稀釋后以0,20,60,200,600 nmol/L的濃度梯度處理細胞,37℃下孵育4 h,接毒 MOI=0.1的PRV- HN1201,置37℃吸附1 h,用PBS溶液清洗3次,加入維持培養基稀釋的藥物繼續培養24 h,反復凍融3次收集病毒懸液并做10倍倍比系列稀釋,共稀釋4次,然后接種于24孔板的單層PK-15細胞上(每孔細胞數量為3×105個),37℃吸附1 h,棄病毒液加入500 μL 1%FBS DMEM繼續培養4 d。后棄上清,加入4%PFA室溫固定細胞30 min,利用1%結晶紫染色30 min,流水浸洗30 min后可觀察到噬斑及未脫落的細胞,倒扣晾干后顯微鏡下數噬斑數并統計。
1.8 統計學分析所有試驗均重復3次,利用GraphPad Prism 8.0.2軟件作圖和統計學分析,免疫印跡信號強度采用Image J軟件進行灰度分析,數據均用ˉx±s表示,利用t檢驗進行顯著性分析,**表示P<0.01。
2 結果
2.1 BTP-2處理對PK-15細胞活力的影響小分子藥物BTP-2通過抑制Drebrin和F-actin結合,從而阻斷Drebrin蛋白功能[17,20-21]。為了研究Drebrin蛋白對PRV增殖的影響,利用BTP-2處理豬腎上皮細胞PK-15,利用CCK-8法檢測BTP-2對PK-15細胞活力的影響。結果如圖1所示,處理組藥物濃度在20~600 nmol/L之間時,吸光度與對照組無顯著差異(P>0.05)。故本研究選擇20~600 nmol/L作為BTP-2最適藥物作用濃度范圍。
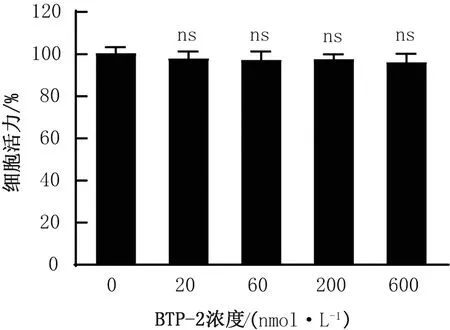
圖1 BTP-2對PK-15細胞活力的影響
2.2 流式細胞術檢測PRV-GFP的感染率不同濃度梯度的BTP-2處理PK-15細胞并接種MOI=0.01的PRV-GFP,通過熒光倒置顯微鏡(40×)觀察各組細胞的GFP熒光情況并拍照。結果如圖2A所示,與對照相比,GFP陽性細胞明顯減少,隨著濃度的升高,熒光強度逐次降低。與此同時,收集細胞并利用流式細胞儀檢測GFP陽性細胞數量,結果如圖2A,B所示,BTP-2藥物處理后PRV-GFP病毒感染率顯著降低(P<0.01),并隨著藥物濃度的升高而降低,呈藥物濃度依賴性變化。
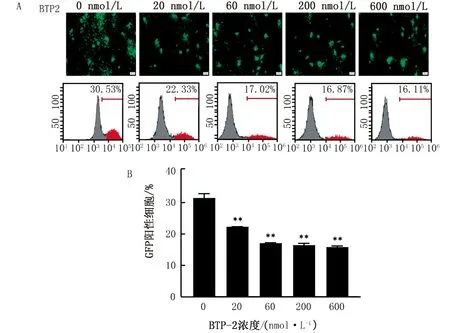
A.熒光顯微鏡(40×)和流式細胞術檢測PRV—GFP增殖情況;B.A圖的流式統計結果;**表示差異極顯著(P<0.01)。下同
2.3 實時熒光定量PCR檢測基因水平PRV感染量在細胞培養板中鋪適宜濃度的PK-15細胞,37℃過夜培養后棄掉上清液,加入不同濃度梯度的BTP-2,37℃處理4 h,接毒MOI=0.01的PRV-HN1201 37℃吸附1 h,棄掉上清,加入含有相應藥物的維持培養基繼續培養24 h,收集細胞并提取總RNA,以實時熒光定量PCR方法檢測PRV-gB和Drebrin基因表達量,結果如圖3所示,相比對照組,BTP-2處理細胞后PRV-gB和Drebrin基因表達量顯著降低(P<0.01),并呈劑量依賴性。
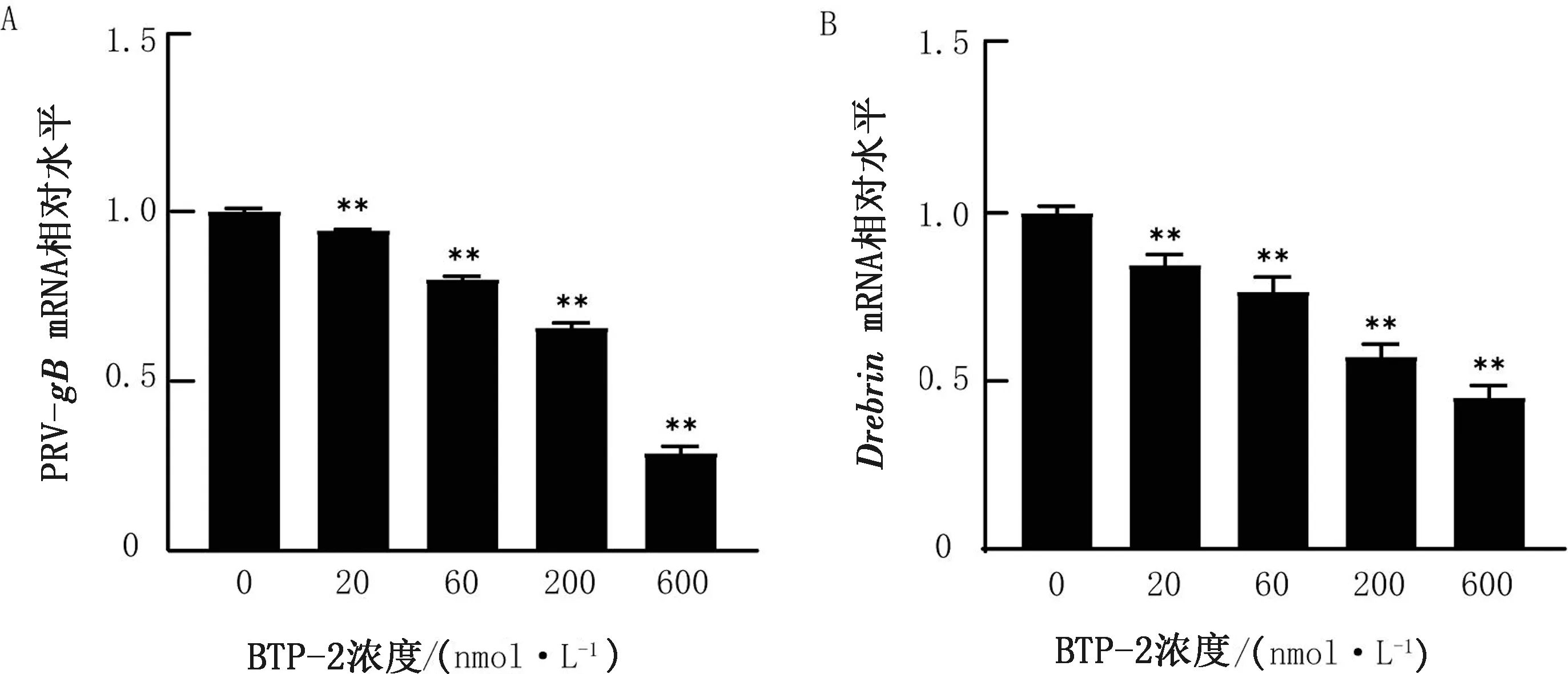
1.PRV-gB基因的表達情況;B.Drebrin基因的表達情況
2.4 Western blot檢測蛋白水平PRV感染量在細胞培養板中鋪適宜細胞數量PK-15細胞,37℃過夜培養后棄掉上清液,加入不同濃度梯度的BTP-2 37℃處理4 h,接毒MOI=0.1的PRV-HN1201 37℃吸附1 h,棄掉上清,加入含有相應藥物的維持培養基繼續培養24 h,收集細胞總蛋白,以Western blot方法檢測PRV-gB和Drebrin蛋白表達情況,結果如圖4所示,與對照組相比,BTP-2處理細胞后PRV-gB和Drebrin蛋白表達量顯著降低(P<0.01),檢測結果與基因水平一致,結果表明BTP-2處理抑制了PRV增殖。
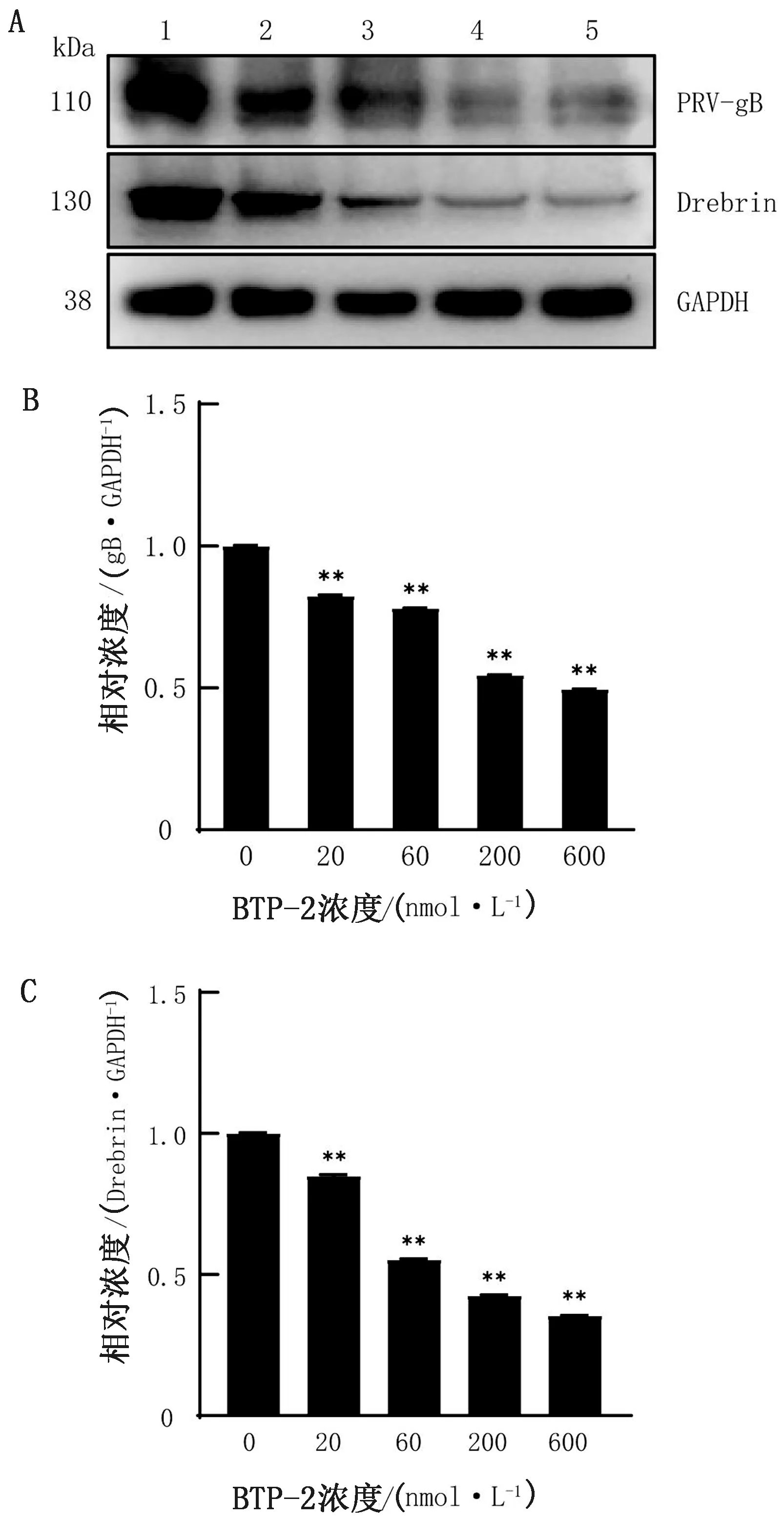
A.Western blot檢測PRV-gB、Drebrin和GAPDH蛋白的表達; B,C.為Image J軟件對圖A進行灰度值分析;1~5.BTP-2濃度梯度
2.5 PFU法檢測子代病毒滴度PK-15細胞加入不同濃度梯度的BTP-2 37℃處理4 h,接毒MOI=0.1的PRV- HN1201 37℃吸附1 h,棄掉上清,加入含有相應藥物的維持培養基繼續培養24 h,反復凍融收集子代病毒,利用噬斑法進行病毒滴度測定。結果表明,BTP-2處理細胞后PRV子代病毒滴度顯著降低(P<0.01),表明BTP-2抑制子代病毒的產生(圖5)。
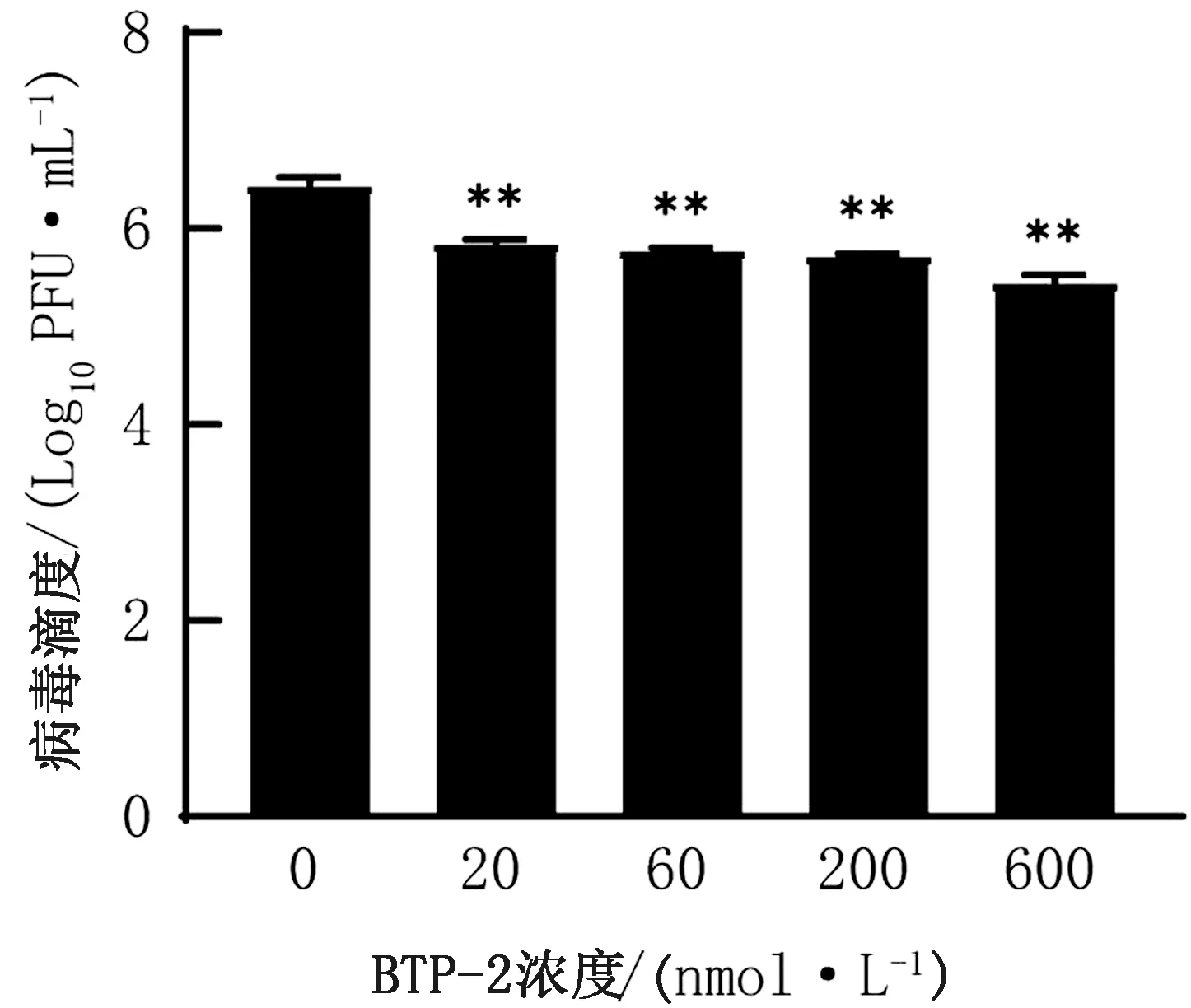
圖5 PFU法檢測PRV- HN1201子代病毒滴度
3 討論
豬偽狂犬病是由PRV引起神經系統障礙的一種傳染病,目前研究主要集中在其致病性及檢測方法,但PRV增殖過程的分子機制研究仍不夠充分。因此,研究PRV與宿主細胞相互作用的分子機制,有助于了解PRV的感染過程,進而為PRV感染的防控提供理論依據。本研究通過化學藥物處理PK-15細胞,研究宿主細胞骨架微絲結合蛋白Drebrin的抑制劑BTP2對PRV增殖的影響。
細胞骨架是真核細胞中的蛋白纖維網狀體系,主要包括微絲、微管、中間絲。病毒是專性細胞內病原體,其生活周期主要包括病毒識別并吸附宿主細胞、病毒穿入與脫衣殼、基因組復制和核衣殼裝配、囊膜形成、病毒顆粒成熟及釋放等,這一過程涉及到的細胞信號轉導、胞吞作用、免疫逃逸、胞內運輸等過程直接或間接依賴于細胞骨架[5-6,22-23]。肌動蛋白是真核細胞中最豐富的細胞骨架蛋白,在細胞中肌動蛋白的聚合和解聚以及形成功能更高的網絡組織都受到大量微絲結合蛋白的調節[24]。作為肌動蛋白結合蛋白之一,早期研究發現Drebrin蛋白主要在腦組織表達,通過調控微絲重組從而參與神經細胞的分化、發育和功能[25-27]。越來越多的研究發現,Drebrin蛋白在其他組織表達并參與免疫調節、精子生成、腫瘤生成等多種生物學功能[28-33]。近10年的研究證明,Drebrin蛋白可通過與病毒蛋白相互作用誘導宿主細胞骨架重排從而調控病毒的感染過程[17-18]。在 HIV 病毒感染期間,Drebrin蛋白被招募到病毒包膜糖蛋白中,通過調控細胞骨架微絲重排和微絲結合蛋白Profilin的積累從而參與HIV感染[18]。另外,Drebrin抑制dynamin介導的胞吞作用從而限制輪狀病毒進入宿主細胞[17]。本研究利用Drebrin抑制劑BTP2處理細胞后,PRV子代病毒滴度降低;通過細胞形態學觀察和流式細胞術檢測,發現PRV感染的細胞數量明顯減少;PRV-gB基因和蛋白表達量也明顯降低,并呈劑量依賴性,說明BTP-2處理抑制PRV增殖。以上結果表明,Drebrin蛋白參與PRV的感染過程,但是病毒增殖包括吸附、進入、復制及釋放等過程,Drebrin在PRV感染的哪個階段發揮功能及其參與PRV感染的分子機制仍需進一步探究,以期為PRV疫苗研發和抗病毒藥物研制提供理論支持。
綜上,本研究利用化學藥物處理,通過熒光顯微鏡、流式細胞術、實時熒光定量PCR、Western blot等方法分別從細胞水平、基因水平和蛋白水平,確證BTP-2處理抑制了PRV增殖,表明微絲結合蛋白Drebrin 參與PRV增殖。

