水稻耐鹽響應中鉀運輸載體的研究進展
矯金航,張雅琳,王贊彭,周博陽,劉敏敏,喻 敏,潘 婷
(佛山科學技術學院 食品科學與工程學院,國際膜生物學與環境研究中心,廣東佛山 528000)
1 鹽脅迫對水稻的危害及水稻耐鹽機理
根據聯合國糧農組織統計,全球約20%農業用地受鹽害的程度不斷加重,預計到2050年,超過1/2的耕地將鹽堿化[1]。不斷加劇的土壤鹽堿化已嚴重影響13個國家約40.3億人口(占世界人口的50%),是制約全球糧食產量和品質的主要環境因素之一[2-3]。
高鹽環境對水稻各個生長階段造成許多負面影響。萌發階段,鹽分引起水稻種子生理代謝紊亂,出苗率下降;營養生長期,Na+、Cl-在葉片的過度積累會造成葉片卷曲枯黃,抑制新葉和根系的生長發育,光合作用受阻,抗氧化酶活性下降等。進入分蘗期和成熟期后,水稻的分蘗和伸長受到鹽脅迫抑制,出現有效分蘗數降低,孕穗期縮短,抽穗延遲,穗短粒少,籽粒不飽滿等情況。
水稻對鹽脅迫的響應涉及許多生理過程,包括滲透調節、離子平衡、活性氧清除、激素調控等[4]。其中,維持K+和Na+的穩態對耐鹽性至關重要。大量鉀離子運輸載體通過吸收K+,排出Na+或將Na+區隔化于液泡內來維持細胞質中較高的K+/Na+值,以緩解鹽脅迫引起的離子毒害[5-6]。參與這些過程的鉀運輸載體可歸類為Shaker、TPKs(tandem-pore K+channels)、KT/HAK/KUP(K+transporter/high-affinity K+transporter/K+uptake transporter)、HKT(high-affinity potassium transporter)和CPAs(monovalent cation/proton antiporters)。本文就水稻鉀轉運載體在鹽脅迫條件下發揮的功能作用以及調控機理進行了綜述,并對未來研究前景予以展望,為培育耐鹽高產的水稻品種提供重要的理論依據。
2 水稻鉀運輸載體對鹽脅迫的響應及其耐鹽功能
2.1 Shaker通道
單一完整的植物Shaker鉀離子通道由4個亞基組成,每個亞基上具有6個跨膜區和1個C-末端胞內區,其中第4跨膜區上富含感受膜電位變化的正電荷氨基酸,負責控制通道開放與關閉,第5、6跨膜區間的環狀結構(P-loop)包含高度保守的特異序列,使通道具有高K+選擇性[7-9]。Shaker鉀離子通道具有不連續的電壓門控開關,可通過電壓依賴性及K+跨膜運動的方向進一步劃分為內向型整流K+通道(IR)、外向型整流K+通道(OR)、弱整流型K+通道(WR)[10-11]。
研究發現,內向整流型K+通道OsAKT1的超極化位點在鹽脅迫下被激活,促進根系K+的大量攝入[12]。OsAKT2介導K+在韌皮部裝載和再分布,有助于維持Na+、K+的穩態并抑制根部對Na+的吸收[13]。內向整流型K+通道OsKAT1和OsKAT2也參與耐鹽響應過程。OsKAT1具有內吸K+及外排Na+的作用,能夠提高酵母和水稻細胞的耐鹽性[14-15]。OsKAT2在保衛細胞K+吸收中發揮作用并通過調節氣孔開放來參與水稻耐鹽[16-17]。外向整流型K+通道OsK5.2(OsGORK)在響應鹽脅迫中可能也發揮重要作用,其轉錄水平受鹽脅迫誘導上調,有利于K+在根中的保留[18-19]。另有研究發現,OsK5.2參與調節氣孔關閉,同時將K+卸載至木質部,以提高水稻的耐鹽性[20]。
2.2 TPK通道
不同于Shaker鉀離子通道,TPK雙孔鉀離子通道每個亞基僅包含4個跨膜區及2個環狀結構(P-loop),雖然其對電壓變化并不敏感,但是由于具備高度保守的特異序列,因此同樣對K+具有高度選擇性。水稻TPK包含3名成員:OsTPKa、OsTPKb、OsTPKc[21](表1)。

表1 水稻鉀離子通道
OsTPKa和OsTPKb分別定位于細胞溶酶液泡(LVs)和小的蛋白儲存液泡(SVs)中[22-23],過表達OsTPKa和OsTPKb減少Na+積累并促進K+轉運以維持胞內離子穩態,增強對鹽脅迫的耐受性[24-25]。
2.3 KT/HAK/KUP轉運體
HAK家族在植物K+的攝取及轉運中扮演重要的角色,結構分析表明該蛋白家族具有10~14個跨膜區,且在第2和第3跨膜區之間包含1個環狀結構[26]。水稻HAK家族包含27個成員,可被劃分為4個基因進化簇:簇I、簇Ⅱ、簇Ⅲ、簇Ⅳ[27],其中簇I被認為對K+具有高親和力,簇II成員的序列和功能差異較大,而簇Ⅲ、簇Ⅳ的功能特征鮮有報道[28-29]。水稻HAK轉運體介導K+的吸收轉運和Na+的外排(表2)。大多OsHAK的表達受低鉀和鹽脅迫誘導,OsHAK1、OsHAK5和OsHAK16通過促進K+的吸收來維持植物體內較高的K/Na比[29-32],OsHAK3和OsHAK21對調節胞質內Na+/K+穩態至關重要[33-35]。OsHAK8介導K+吸收和轉運以應對低鉀脅迫,耐鹽性功能仍需進一步研究[36]。OsHAK10、OsHAK12、OsHAK17和OsHAK18受鹽脅迫誘導表達,OsHAK10可增加老葉中Na+的積累[37],OsHAK12具有Na+滲透性,參與木質部Na+的回收從而降低地上部Na+含量[38],OsHAK17和OsHAK18同樣受低鉀誘導,但不直接參與K+吸收,而參與K+在韌皮部K+轉運和再分配[39-41]。此外,某些OsHAK轉運體對種子萌發有所調節,OsHAK9介導鹽脅迫下種子萌發中Na+、K+的平衡[42],OsHAK21參與鹽脅迫下K+的吸收,并在種子萌發和幼苗建立中發揮作用[43]。
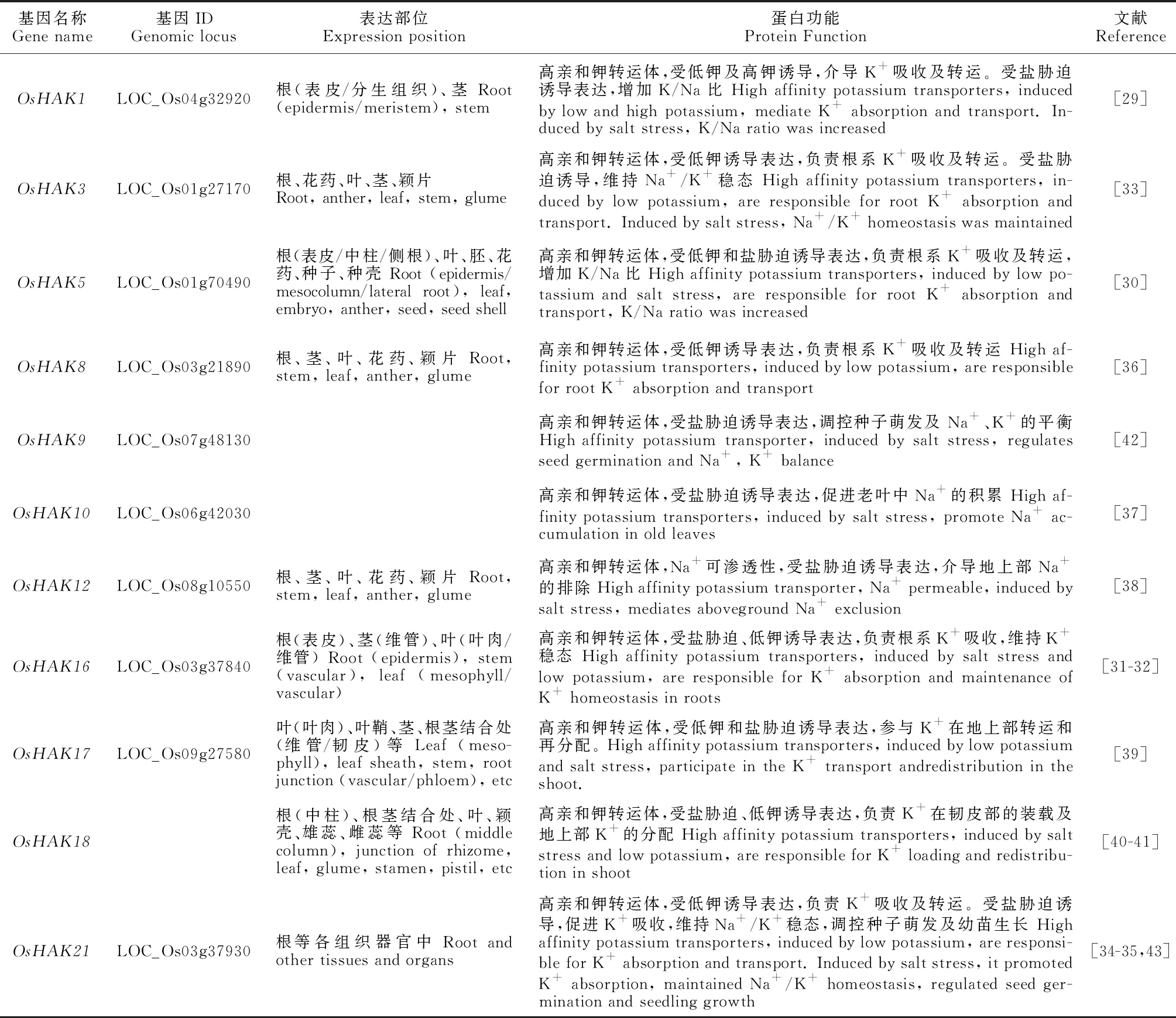
表2 水稻KT/HAK/KUP轉運體
2.4 HKT轉運體
HKT是一類Na+或K+轉運體或Na+、K+共轉運體,由4個MPM(membrane-pore-membrane motif)基序組成,每個基序由2個跨膜區和1個環狀結構(P-loop)構成[44]。HKT的離子選擇性通常由第一環狀結構的保守氨基酸性質決定[45-46]。目前已在水稻中鑒定出9個HKT基因,依據進化關系可劃分為2個亞族[47]。
I類OsHKT轉運體主要定位于木質部薄壁細胞的質膜,具有Na+選擇性[48-49](表3)。OsHKT1;1和OsHKT1;4通過降低韌皮部或木質部汁液中Na+濃度來減輕地上部離子毒害[47-52]。OsHKT1;5將木質部中的Na+卸載至薄壁細胞,同時促進K+向地上部的運輸來維持Na+和K+平衡[53-54]。OsHKT1;3與OsHKT1;5均可在鹽脅迫下促進種子萌發并恢復幼苗生長[55-57]。II類OsHKT轉運體則對Na+、K+均具有較強的滲透性,在維持水稻Na+/K+穩態中發揮作用(表3)。OsHKT2;1介導Na+的流入以補充缺鉀脅迫時K+的缺失,但其對Na+的吸收功能可被鹽脅迫迅速抑制[58-60]。OsHKT2;2在低鉀條件下誘導Na+的吸收,隨胞外K+濃度的增加,Na+轉運速率降低[61]。OsHKT2;4具有較強的K+滲透性,高Na+濃度下OsHKT2;4介導的Na+轉運活性受限[62-64]。
2.5 CPA轉運體
植物CPA家族主要包括3個家族:NHX(Na+/H+exchanger)、CHX(cation/H+exchanger)和KEA(K+efflux antiporter)。其中,NHX家族在耐鹽性方面的研究較為深入。NHX一般含有10~12個跨膜區,跨膜區之間沒有典型的環狀結構。NHX能夠催化H+與Na+和/或K+的跨膜交換,對鹽脅迫下維持植物細胞內pH平衡及離子穩態至關重要[65-66]。水稻中有5個基因編碼NHX轉運體,根據進化關系,可分為2個亞組,OsNHX1-OsNHX4為第一亞組,定位于液泡膜,OsNHX5為第二亞組,定位于內膜[67]。
研究表明,OsNHX1、OsNHX2、OsNHX3和OsNHX5均受鹽脅迫誘導表達,它們將細胞質中的Na+區隔化至液泡內或其他區室內,維持胞質內離子平衡,減少Na+的毒害[68-70],對OsNHX2、OsNHX3的進一步研究發現其主要通過將Na+儲存至葉鞘薄壁細胞中來提高水稻的耐鹽力[70-71]。OsNHX5的功能與家族其他成員略有不同,它介導低Na+轉運,KCl處理下其轉錄水平上升,推測OsNHX5具有K+/H+交換的作用[72]。OsSOS1是質膜定位的Na+/H+反向轉運體,鹽脅迫下其表達上調并通過OsCBL4-OsCIPK24-OsSOS1途徑激活,從而促進Na+外排,降低細胞內的Na+含量,調節水稻的耐鹽性[72-73]。
3 水稻鉀運輸載體在鹽脅迫下的調控機理
3.1 轉錄調控
轉錄調控是植物應對非生物脅迫的關鍵手段[74],目前已鑒定出許多響應鹽脅迫的轉錄因子家族,如bHLH、WRKY、MYB、NAC等[75],其對鉀運輸載體均具有一定的調控作用(圖1)。OsMYB106(MYB型轉錄因子)、OsBAG4(分子伴侶調控蛋白)和OsSUVH7(DNA甲基化識別酶)三者相互作用形成復合物,促進OsMYB106與OsHKT1;5中的順式結合元件MYBE結合,激活OsHKT1;5的表達,減少Na+在胞內的過度累積[76]。OsGTγ-2(trihelix transcription factor,三螺旋轉錄因子家族GTγ亞家族成員)受鹽脅迫、滲透脅迫及氧化脅迫誘導表達,研究表明OsGTγ-2直接與OsNHX1、OsHKT1;3和OsHKT2;1的啟動子相互作用并正向調節水稻耐鹽性[77]。OsNAC3(NAC型轉錄因子)通過正向調節OsHKT1;4和OsHKT1;5參與水稻耐鹽響應過程[78]。OsbHLH001(bHLH型轉錄因子)可通過特異性結合OsAKT1啟動子區的E-box序列,誘導OsAKT1的表達,促進K+流入從而調節鹽脅迫下水稻中的鉀鈉比[79]。OsbHLH035通過激活OsHKT1;3和OsHKT1;5的表達,調控鹽脅迫后的種子萌發和幼苗恢復[80]。OsJAZ9(OsTIFY11a,TIFY型轉錄因子)能夠與OsbHLH062相互作用并抑制OsbHLH062介導的對OsHAK21和OsHAK27轉錄激活[81]。轉錄因子OsbZIP72直接與OsHKT1;1啟動子區域中的ABA反應元件結合,誘導OsHKT1;1的表達以響應鹽害[82],OsbZIP71能夠與OsNHX1的啟動子結合,促進OsNHX1表達,增強水稻耐鹽性[83]。
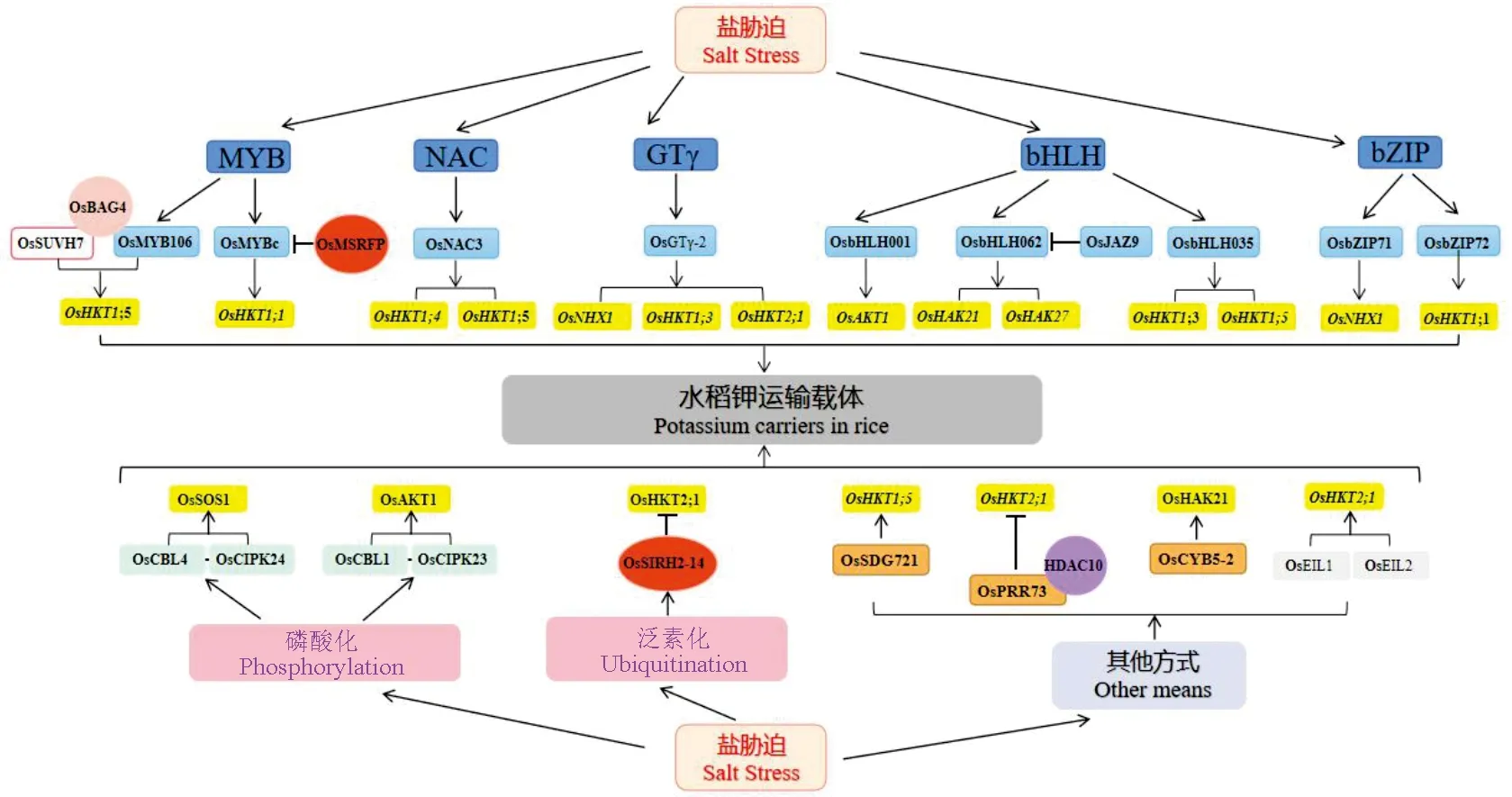
涉及激活或調控響應鹽脅迫水稻鉀運輸載體的途徑;水稻轉錄因子(TF)MYB、GTγ、bHLH、bZIP對鉀運輸載體的轉錄調控;磷酸化、泛素化等方式對鉀運輸載體活性的調控。
3.2 翻譯后修飾
蛋白質翻譯后修飾對水稻響應鹽脅迫至關重要,通過磷酸化、泛素化等修飾手段可快速調節多個細胞途徑中蛋白質活性、功能和定位以及不同蛋白間的相互作用,以減輕鹽脅迫造成的損害[84-85]。
磷酸化是最常見修飾形式,CBL-CIPK網絡在感應鹽誘導的Ca2+信號和調節Na+/K+穩態方面中發揮著關鍵作用[86-87](圖1)。
SOS信號通路是植物中首個發現參與非生物逆境的信號傳導途徑。水稻SOS途徑中,鈣結合蛋白OsSOS3/OsCBL4感知鹽脅迫引起的胞質鈣信號,與蛋白激酶OsSOS2/OsCIPK24互作并磷酸化OsSOS2,磷酸化后的OsSOS2蛋白迅速與質膜定位的OsSOS1結合并將其激活,促進Na+排出,維持細胞中離子平衡[88]。此外,鹽脅迫引發的胞質內Ca2+濃度升高,誘導OsCBL1和OsCIPK23互作并激活OsCIPK23,形成的復合物磷酸化激活OsAKT1的通道活性,促進根部K+吸收[89]。
泛素化修飾在植物應激反應中也起著作用(圖1)。E3連接酶通過改變應激響應蛋白(如轉錄因子)的穩定性來發揮調節作用,從而改變下游反應或通過降解下游級聯本身所涉及的蛋白質,其中泛素26S蛋白酶體介導的鹽相關蛋白降解在耐鹽性中發揮重要功能[90-91]。據報道,RING型E3連接酶OsSIRH2-14在高鹽條件下與OsHKT2;1在胞質和質膜上發生強烈的物理作用,并通過泛素26S蛋白酶體降解OsHKT2;1以減少Na+的吸收[92]。OsMYBc能夠與OsHKT1;1啟動子結合上調其活性,正向調控水稻的耐鹽性[88],RING型E3連接酶OsMSRFP通過泛素26S蛋白酶體介導OsMYBc降解并減弱OsMYBc對OsHKT1;1的轉錄調控作用,降低OsHKT1;1的表達[93]。
3.3 其他調控手段
除上述提及到的調控手段,一些鉀運輸載體可與其他蛋白之間產生相互作用以此來完成鹽脅迫環境下信號的傳遞、基因的表達以及對生長發育的調控等(圖1)。研究發現,在鹽脅迫下,OsSDG721(SET domaing group,具有組蛋白賴氨酸甲基轉移酶活性的蛋白)能夠結合OsHKT1;5的啟動子區域,上調OsHKT1;5的表達,維持胞內K+、Na+穩態[94]。OsPRR73(pseudo response regulator,偽應答調控蛋白)與HDAC10(Histone deacetylases,組蛋白去乙酰化酶)結合形成的復合物能夠與OsHKT2;1的啟動子區域結合,抑制OsHKT2;1的表達,從而減少細胞內Na+的流入和胞質內ROS的積累,增強水稻的耐鹽性[59]。鹽脅迫下,內質網定位的細胞色素b5(OsCYB5-2)能與OsHAK21互作,增強OsHAK21對K+親和性,促進K+內吸,從而維持細胞內K+/Na+穩態[34]。OsEIL1和OsEIL2(乙烯不敏感3-LIKE1、LIKE2)能夠直接激活OsHKT2;1在根中的表達,OsHKT2;1吸收并轉運過多的Na+,負向調控水稻幼苗的耐鹽性[95]。
4 展 望
隨著對水稻鉀運輸載體研究的不斷深入,其具體結構功能也逐漸得以揭示,但目前水稻鉀運輸載體的分子機制研究仍處于起始階段,在探究鉀運輸載體調控的方式及互作關系上仍有很大的空缺。針對這一問題,筆者認為可以從以下幾個方面展開深入探究:(1)從基因和蛋白水平對耐鹽及不耐鹽的水稻進行分析,探究不同品種類型之間鉀運輸載體的差異,進一步揭示不同材料間鹽脅迫反應的異質性。(2)鹽脅迫下,植物感知滲透壓變化和離子信號并將其轉導至細胞內部,以此改變細胞特性來應對鹽脅迫。通過分析尋找與鉀運輸載體互作的蛋白或啟動子等順式元件,來探尋鉀運輸載體在鹽脅迫信號網絡中發揮的功能作用,例如調節下游靶基因表達的轉錄因子或激酶等。(3)水稻鉀運輸載體蛋白具有不同的時間空間表達模式,進一步探究其在水稻生長的各時期階段發揮不同的作用有重要意義。例如在鹽脅迫條件下,OsHKT1;4控制生殖生長階段的Na+穩態,但不影響營養階段的Na+積累;OsHKT1;5介導的Na+調控轉運,對維持鹽害下水稻苗期和生殖期生長至關重要。(4)許多與水稻不同發育階段耐鹽性相關的QTL(數量性狀基因座),可有效控制水稻莖部和根系的K+濃度、葉片光合作用和蒸騰速率、成熟期灌漿粒數和重量等性狀。耐鹽稻雜交所鑒定的qSKC-1 QTL編碼OsHKT1;5調節鹽脅迫下的鈉鉀穩態,中國地方品種‘九彩青’中分離出的qSE3 QTL具有與OsHAK21類似的功能,可促進鹽脅迫下的種子萌發和幼苗建立。因此,進一步挖掘耐鹽稻基因,為培育耐鹽高產的水稻品種提供基因資源,并利用標記輔助育種(MAB)將耐鹽QTL轉移到優質水稻材料是實現水稻耐鹽的一種可能途徑。

