過磷酸鈣反應原理再剖析
顏 鑫
(湖南化工職業技術學院化學工程學院 湖南株洲 412004)
化工生產中有些化學反應是一步完成的,有些分為兩步、三步甚至多步才能完成,這些分步反應常有一個顯著的特點,就是兩步或多步反應相加應等于總反應。普通過磷酸鈣(簡稱過磷酸鈣,亦稱普鈣)是一種最常用的水溶性速效磷肥,主要成分是水合磷酸二氫鈣[Ca(H2PO4)2·H2O,又稱磷酸一鈣]和CaSO4,其生產原理由兩步組成[1-2]。第一步由H2SO4分解磷礦粉[主要成分是氟磷酸鈣Ca5(PO4)3F]產生H3PO4、CaSO4和HF,第二步由產生的H3PO4與剩余的磷礦粉反應生成Ca(H2PO4)2·H2O和HF,化學反應過程如下:
第一步:Ca5(PO4)3F+5H2SO4→5CaSO4+3H3PO4+HF↑
(1)
第二步:Ca5(PO4)3F+7H3PO4+5H2O→5Ca(H2PO4)2·H2O+HF↑
(2)
總反應:2Ca5(PO4)3F+7H2SO4+3H2O→7CaSO4+3Ca(H2PO4)2·H2O+2HF↑
(3)
副反應:Ca5(PO4)3F+2H3PO4+10H2O→5CaHPO4·2H2O+HF↑
(4)
3Ca5(PO4)3F+H3PO4+10H2O→
5Ca3(PO4)2·2H2O+3HF↑
(5)
第一步反應中的CaSO4為CaSO4·1/2H2O,第二步反應結束后才轉化為無水CaSO4,為了簡化反應過程,直接用無水CaSO4代替。在實際生產中,這兩步反應是過磷酸鈣生產過程的兩個不同階段,也是在不同反應器中進行的。第一步反應主要在混合器中進行,是快速放熱反應,反應時間僅為1~6 min,所需時間取決于磷礦粉的種類及粒徑、H2SO4的濃度及溫度、混合器類型等;磷礦粉主要為粉碎至D90通過0.15 mm(100目)篩的磷灰石或磷塊巖粉末,混合器通常采用立式。第二步反應在化成室和熟化倉庫中進行,化成室又分為回轉化成室、皮帶化成室、鏈板化成室等,化成時間需要20~60 min,倉庫熟化時間需要7~30 d,才能使磷礦粉的總分解率達到94%~96%,所需時間取決于磷礦粉的種類及粒徑、H2SO4的濃度及溫度、化成器類型等。總反應即H2SO4與磷礦粉反應生成過磷酸鈣、CaSO4和HF。但是在《無機化工生產技術》教學過程中發現,第一步反應和第二步反應相加并不等于總反應。即使不考慮CaSO4和Ca(H2PO4)2分子式中結晶水的存在和轉化,上述兩個分步反應式之和仍不等于總反應式。
關于過磷酸鈣生產的化學原理在相關教材中已有大量闡述[1-2],本文在此只補充剖析兩個分步反應與總反應的關系、兩步反應所分解的磷礦粉數量,并探討對過磷酸鈣實際生產的指導意義。
1 兩個分步反應之和不等于總反應的原因
1.1 磷酸分解的磷礦石物質的量實際上不到硫酸物質的量的1/3
第一步反應屬于快速反應,反應物H2SO4是二元強酸,且在反應過程中得到了充分和完全的利用。第二步反應中的H3PO4雖然是三元中強酸,但由于產物為Ca(H2PO4)2·H2O,是過磷酸鈣的主要成分,實際上磷酸相當于一元酸參與反應,且反應過程中未得到完全和充分的利用。
為簡化起見,暫不考慮磷礦粉中鈣鹽、鎂鹽和倍半氧化物等雜質在第一步、第二步反應中對H2SO4和H3PO4的消耗,僅以雜質含量較少的過磷酸鈣優等品為例進行分析。由于第一步反應中產生了HF,造成了酸的揮發流失,流失的HF與H3PO4的物質的量之比為1∶9。因此,不僅理論上第一步反應所消耗的H2SO4的物質的量要多于所產生的H3PO4的物質的量,而且是所產生的H3PO4(按一元酸計)實際物質的量的3倍以上,即理論上參與第二步反應的磷礦粉的量還不到第一步反應的1/3。實際上H2SO4分解的磷礦粉的量應大于總量的2/3,H3PO4分解的磷礦粉的量小于總量的1/3。
1.2 兩個分步反應需要乘以相應系數再相加才等于總反應
由國家標準《過磷酸鈣》(GB/T 20413—2017)可知,優等品的有效磷(以P2O5計)的質量分數≥18.0%,水溶性磷(以P2O5計)的質量分數≥13.0%,游離H3PO4(以P2O5計)的質量分數≤5.5%。假如典型的過磷酸鈣優等品中有效磷、水溶性磷、游離H3PO4的質量分數分別按19%、14%、5%進行計算,水溶性磷包括H3PO4和Ca(H2PO4)2·H2O,水溶性磷和游離H3PO4的含量之差即為Ca(H2PO4)2·H2O的含量(質量分數為9%);有效磷中另有枸溶性磷(以P2O5計,質量分數5%),枸溶性磷主要成分為CaHPO4·2H2O(磷酸氫鈣)和Ca3(PO4)2·2H2O(磷酸三鈣),見反應(4)和(5)。國家標準中各成分的質量分數和典型組成見表1。第一步反應產生的H3PO4中只有9/19即47.4%的磷酸轉化為Ca(H2PO4)2·H2O,另外仍有5/19即26.3%的H3PO4轉化為枸溶性磷,其余作為游離酸存在于產品中。

表1 典型的過磷酸鈣優等品組成(均以P2O5計) %
事實上,由于H2SO4用量通常為理論用量的103%~105%,是充分且完全利用的;H3PO4由于酸性較弱,反應后期的磷礦粉粒徑較大、反應活性較差,總有一定量的H3PO4和磷礦粉同時殘留于過磷酸鈣產品中,沒有得到充分分解和完全利用,因此H2SO4分解磷礦粉的量占磷礦粉總量超過2/3,而H3PO4分解的磷礦粉占比小于1/3。
基于上述分析,如果將第一步反應乘以7/5,第二步反應乘以3/5,然后再相加,兩步反應的磷酸相互抵消,分步反應式相加等于總反應式。這說明在過磷酸鈣生產中,兩個分步反應理論上不是1∶1的關系,而是7∶3的關系。因此,對于分步反應,有時直接相加不等于總反應式,而要根據實際反應,乘以合適的系數后再相加才等于總反應式。
2 兩步反應分解的磷礦粉比例的推測
假設反應(1)中H2SO4的理論物質的量為10,則H3PO4的理論物質的量為9。由于H3PO4只按一元酸參與反應,實際表觀物質的量只有3,可見H2SO4的物質的量是H3PO4的物質的量的3.33倍。理論上H2SO4及其產生的H3PO4能夠使磷礦粉完全分解,則磷礦粉的總物質的量應為H2SO4和H3PO4的物質的量之和13。當H2SO4的實際用量是理論用量的105%時,H2SO4的實際物質的量為10.5,產生的H3PO4實際物質的量為3.15,但磷礦粉的總物質的量并未增加,仍然是13。當過磷酸鈣產品中游離H3PO4的質量分數為5%左右時,則可以推測出H2SO4實際分解磷礦粉的比例、H3PO4理論上和實際分別分解磷礦粉的比例、產品中殘留的磷礦粉比例等,數據見表2。
表2 不同生石灰加入量的試驗結果

表2 過磷酸鈣優等品生產參數的合理估算
推測過程:
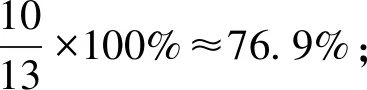
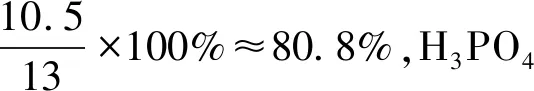
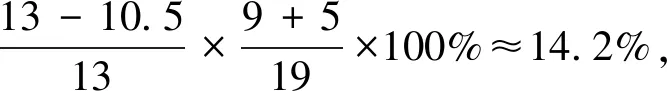
(4)計算H3PO4殘留物質的量應該為H3PO4實際物質的量×游離H3PO4在枸溶性磷中所占比例26.3%,3.15×26.3%≈0.83。
表2中的推測數據,如殘留的磷礦粉比例等與實際生產中的數據是非常接近的,說明推測的理論依據是可靠的。
3 對過磷酸鈣實際生產的指導意義
專著和教材上的內容:第一步反應理論上分解的磷礦粉占70%,第二步反應理論上分解的磷礦粉占30%[1-2];由于實際H2SO4用量為理論用量的103%~105%,實際上第一步反應分解的磷礦粉為72%~74%[1-2]。
由表2的數據可知,理論上第一步反應H2SO4分解的磷礦粉約占76.9%,第二步反應H3PO4分解的磷礦粉約占23.1%。在實際生產中,如果H2SO4用量按理論用量的105%進行計算,則反應第一階段約有80.8%的磷礦粉參與H2SO4的分解反應,剩下約19.2%的磷礦粉參與H3PO4的分解反應,但實際上H3PO4分解的磷礦粉僅為14.2%。
H2SO4用量超出理論用量越多,第一步反應占比越大,過磷酸鈣產品中過量的H3PO4就越多,殘留的磷礦粉就越少。H2SO4過量的具體數值取決于磷礦粉的種類、反應活性,也與H2SO4濃度和溫度等條件相關。一般來說,過量H2SO4的應用并不會導致過磷酸鈣產品中有游離H2SO4的存在,因為H2SO4的物質的量相對磷礦粉的物質的量始終都是不足的,而且游離H2SO4并不能與Ca(H2PO4)2共存,因為生成的Ca(H2PO4)2也將與H2SO4反應生成CaSO4和H3PO4,化學方程式如下:
Ca(H2PO4)2+H2SO4→CaSO4+2H3PO4
(6)
可見,適當過量的H2SO4只是導致過磷酸鈣產品中少量H3PO4的殘留,并不影響產品的品質和應用。但仍然要嚴格控制H2SO4用量和比例,過剩系數一般不能超過1.05,以免游離H3PO4含量超過5%,造成游離H3PO4含量超過殘余磷礦粉含量,導致整個體系呈酸性。
4 結語
(1)過磷酸鈣生產反應原理中,兩個分步反應直接相加并不等于總反應,其本質是第一步反應所有H2SO4的物質的量明顯大于第二步反應H3PO4的物質的量,H2SO4的物質的量理論上是H3PO4的物質的量的3.33倍。將第一步反應式乘以系數7/5,第二步反應式乘以系數3/5,才能抵消兩步反應中的H3PO4,然后再相加,就等于總反應式。這說明兩步反應理論上不是1∶1的關系,而是7∶3的關系。
(2)理論上第一步反應中H2SO4分解的磷礦粉應占76.9%而不是70%,第二步反應中H3PO4分解的磷礦粉理論上應為23.1%而不是30%。
(3)實際生產中,由于H2SO4用量通常超過理論用量的5%,且H2SO4反應完全,因此,過磷酸鈣優等品中第一步反應分解的磷酸粉應為80.8%。由于H3PO4酸性較弱,反應不充分,產品中殘留5%左右的游離H3PO4和5.1%的磷礦粉,殘留的游離H3PO4和磷礦粉的含量基本上是一致的,因此第二步反應分解的磷礦粉為14.2%左右。
(4)本文依據過磷酸鈣的生產原理和理論,對實際生產中H2SO4用量的上限為理論用量的105%,造成游離H3PO4含量超過殘留磷礦粉含量以及整個體系呈酸性的情況進行了切合實際的剖析,對正確估算游離H3PO4含量和殘留磷礦粉數量等具有一定的指導意義。

