pH值偏移對麥谷蛋白結構的修飾及溶解性的提升
榮玉娟,侯雨薇,曹曉倩,張佳佳,周 彬,2,*
(1.湖北工業大學生物工程與食品學院,湖北 武漢 430068;2.發酵工程教育部重點實驗室,湖北 武漢 430068)
麥谷蛋白(glutenin,Glu)是一種天然植物蛋白,具有營養豐富、來源廣泛、低致敏性、良好的生物學價值等優點。Glu由10%的高分子質量Glu和90%的低分子質量Glu組成[1]。低分子質量Glu不僅與自身結合,而且還通過分子內和分子間二硫鍵與高分子質量Glu亞基(glutenin subunits,GS)結合形成Glu聚集體[2],此結構特性大大降低了Glu的柔韌性。而且Glu富含脯氨酸和谷氨酰胺,帶電氨基酸比較少,使其在中性條件下溶解度較低,大大限制了其在食品工業中的應用[3-5]。因此采用簡單易行的處理手段提升Glu在中性條件下的溶解性對于拓寬其應用范圍具有較強的產業價值。
對蛋白修飾的研究大多集中于物理處理、化學處理和生物酶修飾等方面[6]。物理方法包括超聲波處理、熱處理、脈沖電場、高壓破碎、擠壓、冷凍等[7-9]。例如,Zhang Lei等[7]利用超聲波提高蛋白質的發泡能力和乳化能力。Buhler等[8]利用干熱改性蠶豆濃縮蛋白以增加持水能力。Liu Bohui等[9]利用球磨機處理大豆分離蛋白極大提升了蛋白的凝膠強度和持水能力。化學方法主要是通過引入化學基團對蛋白質進行修飾,包括酸堿處理、磷酸化、糖基化和脫酰胺等。例如,Majzoobi等[10]利用乙酰化提高Glu的溶解度和水結合能力。Chen Weijun等[11]利用美拉德反應增強蛋白質與水分子的相互作用從而提升糖基化產物的溶解度。Liu Xiao等[12]通過谷氨酰胺酶脫酰胺改性Glu改善了其理化性質。生物學方法多利用酶水解、酶交聯以及蛋白質相互作用等方式修飾蛋白質。如Sun Qian等[13]利用復合蛋白酶酶促修飾提升核桃谷蛋白的持水力和乳化穩定性。pH值偏移處理是一種可以定向誘導蛋白質結構變化從而有效改善蛋白質功能特性的方法,這種改性方法對Glu的影響至今少有人研究。
本研究利用不同pH值偏移處理條件對Glu進行改性,借助動態光散射(dynamic light scattering,DLS)、透射電鏡(transmission electron microscope,TEM)、熒光光譜、傅里葉變換紅外光譜、紫外光譜、十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE)等方法探究pH值偏移處理對Glu功能特性的影響。以期通過pH值偏移處理改善中性條件下Glu的溶解性及拓寬其在食品領域的應用范圍。
1 材料與方法
1.1 材料與試劑
小麥蛋白 上海阿拉丁生化科技股份有限公司;BCA蛋白濃度檢測試劑盒 碧云天生物技術有限公司;β-巰基乙醇 上海麥克林生化科技有限公司;考馬斯亮藍賽國生物科技有限公司;SDS 國藥集團化學試劑有限公司;疊氮化鈉(NaN3)上海麥克林生化科技有限公司;超純水 武漢優普儀器設備有限公司。
1.2 儀器與設備
Zeta sizer Nano-ZS 90納米粒度測定儀 英國馬爾文公司;UV2600紫外-可見分光光度計 島津儀器(蘇州)有限公司;F7000熒光分光光度計、H7650 TEM 日立科學儀器(北京)有限公司;Seven Compact精密pH計梅特勒托利多科技(中國)有限公司;Nicoletis-50傅里葉變換紅外光譜儀 賽默飛世爾科技(中國)有限公司。
1.3 方法
1.3.1 Glu的提取
將二氯甲烷和小麥蛋白以液固比7∶1(mL/g)混合,3000 r/min攪拌2 h使其均勻分散,并進行抽濾脫脂。將沉淀繼續溶于二氯甲烷中以3000 r/min攪拌3 h后抽濾再次脫脂。將沉淀和乙醇以1∶10比例混合攪拌3 h后離心取沉淀物冷凍干燥并粉碎以獲得Glu。通過凱氏定氮法測得Glu純度為(86.0±0.8)%。
1.3.2 Glu的pH值偏移處理
在500 mL 3%的Glu溶液中加入1 mL 0.02%疊氮化鈉溶液以防止滋生微生物。用HCl或NaOH溶液調節蛋白溶液pH值至1.0、2.0、3.0、10.0、11.0、12.0和13.0并攪拌4 h。在此期間,每小時測定pH值并調整至初始值。隨后將所有樣品pH值調至7.0并穩定1 h。凍干成粉末后貯藏于干燥器中備用。根據不同pH值偏移處理將Glu樣品分別命名為Glu-1、Glu-2、Glu-3、Glu-10、Glu-11、Glu-12和Glu-13,未經處理的為對照。
1.3.3 蛋白質溶解度測定
將3 份質量分數1%的Glu溶液置于2 mL離心管中10000×g、25 ℃離心10 min,并保留上清液。以牛血清蛋白為標準蛋白,通過BCA試劑盒測定蛋白離心后上清液濃度和未離心前蛋白溶液濃度。蛋白質溶解度可用上清液中蛋白質量濃度與溶液中總蛋白質量濃度的百分比表示。
1.3.4 蛋白質粒徑、PDI及Zeta電位的測定
蛋白的粒徑、Zeta電位及多分散系數(polydispersity,PDI)均由配備He-Ne激光(633 nm)的DLS納米粒度電位分析儀測定。測定前不同處理組Glu溶液均在BCA試劑盒下調至蛋白質量濃度一致(0.1 mg/mL)。
1.3.5 蛋白質表面疏水性的測定
以8-苯胺-1-奈磺酸(8-anilino-1-naphthalenesulfonic acid,ANS)作為熒光探針,測定蛋白質表面疏水性。將Glu溶液用BCA試劑盒稀釋至0.125~1.000 mg/mL,取5 mL樣品與ANS(8 mmol/L,30 μL)在黑暗中混合5 min后采用熒光分光光度計進行測定。激發波長設置為380 nm,發射波長范圍設置為400~600 nm,電壓設置為400 V,掃描速率設置為12000 nm/min,激發和發射狹縫寬度5 nm。
1.3.6 蛋白質內源熒光光譜的測定
內源熒光光譜由熒光分光光度計測定。所有樣品均10000×g、4 ℃離心10 min,測定前將所有樣品用BCA試劑盒調成同一質量濃度。將蛋白溶液(0.1 mg/mL)置于四面透光的比色皿中進行測量。激發波長設置為290 nm,發射波長范圍為300~460 nm,掃描速率為12000 nm/min,激發和發射狹縫寬度為5 nm。
1.3.7 紫外光譜的測定
紫外光譜測定采用紫外-可見分光光度計。所有樣品均10000×g、4 ℃離心10 min,測定前將所有樣品用BCA試劑盒調成同一質量濃度。將蛋白溶液(0.1 mg/mL)置于石英比色皿中進行測量。掃描范圍為200~500 nm,間隔1 nm。
1.3.8 蛋白質巰基與二硫鍵含量測定
基于已有研究[14]稍加修改。蛋白質樣品用含有8 mol/L尿素(用于測量總巰基)和不含8 mol/L尿素(用于測量暴露巰基)的Tris-Gly緩沖液(86 mmol/L Tris、90 mmol/L甘氨酸、4 mmol/L EDTA)稀釋至3 mg/mL。在5 mL樣品溶液中加入50 μL的Ellman’s試劑(5,5’-二硫代雙(2-硝基苯甲酸)(5,5’-dithiobis-(2-nitrobenzoic acid),DTNB),4 mg/mL),在黑暗處反應1 h,以不含DTNB的樣品作為對照。反應結束后將樣品5000×g離心10 min并取上清液在412 nm波長處測定吸光度。測定蛋白質游離巰基的計算公式如下:
式中:A412nm為在412 nm波長處的吸光度;C為樣品質量濃度/(mg/mL);D為稀釋系數1.01;73.53為106與1.36×104的比值(1.36×104為摩爾消光系數)。
測定二硫鍵含量時,將3 mg蛋白質樣品溶解在含有10 mol/L尿素的1 mL Tris-Gly緩沖液中。然后加入60 μLβ-巰基乙醇以破壞二硫鍵,反應1 h后,加入5 mL質量分數12%三氯乙酸(trichloroacetic acid,TCA)溶液繼續暗反應1 h以沉淀蛋白質。然后將混合物5000×g離心10 min,回收沉淀,用12% TCA洗滌2 次以除去β-巰基乙醇。沉淀中加入3 mL含8 mol/L尿素的Tris-Gly緩沖液和50 μL DTNB在黑暗中反應1 h。5000×g離心10 min后取上清液在412 nm波長處測定吸光度。計算公式如下:
式中:A412nm為412 nm波長處的吸光度;C為樣品質量濃度/(mg/mL);D為稀釋系數3.05;總游離巰基含量為式(1)的計算結果,μmol/L。
1.3.9 SDS-PAGE分析
參照Peng Weiwei等[15]的研究方法稍作修改。蛋白樣品與SDS上樣緩沖液(150 mmol/L Tris-HCl、1% SDS、20%甘油、2%β-巰基乙醇、8 mol/L尿素,pH 6.8)按體積比1∶1混合。混合后在99 ℃變性10 min后冷卻至室溫,2000×g離心2 min后取上清液20 μL置于膠孔中。電泳使用5%的濃縮膠和12%的分離膠在室溫70 V運行直到條帶從濃縮膠遷移到分離膠中,然后在120 V運行1.5 h。使用考馬斯亮藍染液(30%甲醇、10%乙酸和0.2%考馬斯亮藍R-250)進行染色2 h,然后用脫色液(10%乙酸、30%甲醇、60%超純水)脫色過夜。脫色后通過凝膠成像系統進行顯影。
1.3.10 傅里葉變換紅外光譜的測定
通過傅立葉變換紅外光譜測定Glu在4000~500 cm-1范圍內的紅外光譜。結果通過OMNIC 8.2軟件和Peakfit 4.12進行擬合分析Glu的二級結構。
1.3.11 蛋白質微觀形貌觀察
制備質量分數0.1%的Glu溶液,用滴樣法將樣品滴在銅網上晾干,使用TEM在80 kV下觀察Glu的聚集情況。
1.4 統計分析
所有結果均測量3 次取平均值。采用IBM SPSS Statistics 26.0軟件進行方差分析,分析組間差異是否具有統計學意義(P<0.05,差異顯著)。
2 結果與分析
2.1 pH值偏移處理對Glu溶解度的影響
良好的溶解性是食品蛋白質加工利用的前提條件[16]。如圖1A所示,經過不同pH值偏移處理后Glu的溶解度均有所增加。這是由于pH值偏移處理過程中Glu發生了脫酰胺,酰胺鍵斷裂,使酰胺基團轉變為羧基,因而蛋白質帶負電荷增加且靜電斥力變大,同時蛋白質結構中氫鍵及范德華作用力減弱,導致蛋白質結構展開,水合能力增加[17]。其中堿偏移處理下溶解度明顯提高,特別是Glu-13的溶解度接近90%。在圖1B可以直接觀察到蛋白質溶液的宏觀差異,堿偏移處理條件下蛋白溶液較均勻,溶液底部沉淀較少,其中Glu-12和Glu-13底部無明顯沉淀。Glu溶解性增加可能是因為蛋白質結構在堿處理條件下形成了熔融球狀,這增強了蛋白質-水相互作用的能力,導致Glu的溶解性顯著增加;也可能是由于蛋白質構象變化和可溶性蛋白質聚集體的形成[18]。因此堿偏移處理是提高Glu在中性條件下溶解度的有效途徑。Zhang Jingnan等[19]研究發現,豌豆蛋白經堿處理后表面疏水性有所增加的同時溶解度也有所改善,這可能是由于蛋白表面疏水基團之間的分子相互作用減弱所致。此外由于蛋白質結構的重排可能會產生新的疏水區域[20]。而Yildiz等[21]也認為,蛋白質的溶解度并不完全取決于疏水區域的暴露程度。
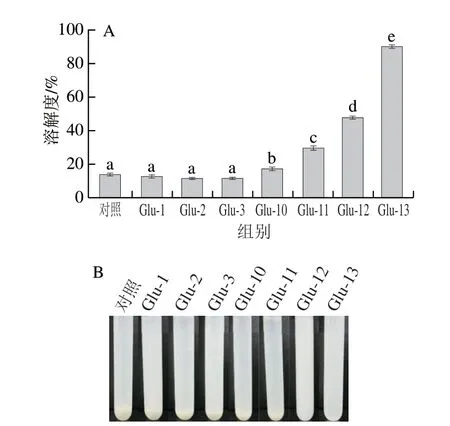
圖1 不同 pH 值偏移處理下Glu的溶解度(A)及表觀形態(B)Fig.1 Solubility (A) and visual morphology (B) of Glu under different pH-shifting treatments
2.2 粒徑、Zeta電位與形貌分析
不同pH值偏移處理下Glu的平均粒徑如圖2A所示。結果表明,與未處理的Glu相比,不同pH值偏移處理后的Glu平均粒徑均顯著減小。這可能是因為pH值偏移處理使Glu中的谷氨酰胺發生脫酰胺轉換為谷氨酸,增加了蛋白質側鏈羧基含量,增加相同條件下Glu的帶電量,增大分子間靜電斥力,降低氫鍵相互作用,抑制蛋白質分子的聚集行為,從而致使Glu粒徑減小[22]。此外,堿偏移處理效果優于酸偏移處理。一般來說粒徑越小的蛋白質聚集體越容易溶解,較小的蛋白質聚集體有助于增加水溶性,因為蛋白質和水分子之間的相互作用面積更大[23]。此外,在pH值偏移處理后Glu的PDI均減小,堿偏移處理下PDI更小,溶液分散性更好。結果表明在堿偏移處理條件下使Glu遠離其等電點(pH 4.9),產生了強烈的靜電斥力,從而使其分散性更加均勻[24]。
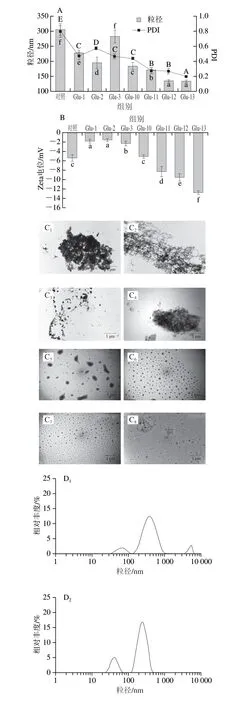
圖2 不同pH值偏移處理后Glu的粒徑及多分散指數(A)、Zeta電位(B)、TEM圖像(C)和粒徑分布(D)Fig.2 Particle size and PDI (A),zeta potential (B),TEM images (C)and particle size distribution (D) of Glu solution under different pH-shifting treatments
從圖2B可以看出,經過pH值偏移處理后的Glu都帶負電荷,這可能是在pH值偏移處理的過程中Glu發生了脫酰胺。大量不帶電荷的極性天門冬酰胺和谷氨酰胺的中性酰胺側鏈轉變成帶負電荷的羧酸基,從而生成了天冬氨酸和谷氨酸[25]。堿偏移處理下凈負電荷顯著升高,表明在一定程度上改變了蛋白質的構象使其暴露了內部的極性基團,因此隨著表面極性基團的電離,更多的電荷積聚在分子表面以獲得更高的凈負電荷。而酸偏移處理下凈負電荷略微減小可能是由于蛋白質的重新聚集掩埋了暴露在蛋白質內部分子表面的極性基團。一般情況下由于蛋白質顆粒之間存在較強的靜電斥力,因此高凈電荷體系相對穩定。帶相同電荷的蛋白質鏈更容易相互排斥、解離或展開[26]。蛋白質的表面電荷受親水性和疏水性極性殘基之間平衡的影響,這Xiong Wenfei等[27]結論一致。
此外,利用TEM觀察Glu粒子的形態變化。由圖2C可知,未經處理的Glu聚集體尺寸較大且分散不均一,經pH 1~3偏移處理后,Glu的聚集程度沒有明顯改善,仍處于緊密聚集狀態。然而,經堿偏移處理后,其聚集程度顯著減弱,且圖2D粒徑分布也顯示粒子尺寸分布較為均勻,這與粒徑分析結果一致。
2.3 蛋白質表面疏水性分析
如圖3所示,經pH值偏移處理后的Glu表面疏水性均有不同程度的提高。堿偏移處理下Glu的表面疏水性顯著高于酸偏移處理,其中pH 13偏移處理下Glu的表面疏水性增加最顯著。這可能是由于蛋白質結構在堿處理早期部分展開,導致一種變性與未變性的熔融球態[28]。在此狀態下蛋白質的疏水肽段和氨基酸殘基的疏水側鏈基團暴露增加[29]。許多研究表明在極端酸堿處理條件下,蛋白的三級結構會發生變化,二硫鍵可能斷裂,從而削弱了側鏈之間的相互作用,增加了疏水性和分子靈活性[30]。當蛋白質回到中性狀態時,蛋白間的重折疊過程會重新排列蛋白質表面的疏水基團。蛋白質表面疏水性受蛋白質表面與極性介質接觸的疏水性區域數量的影響[20,31-32]。此外pH值偏移處理過程中Glu發生了脫酰胺,隨著脫酰胺的進行能夠有效展開蛋白質的高級結構,使本來包埋在蛋白質內部的疏水基團暴露且使蛋白質的兩親性增加,同時增加了蛋白質在水中的溶解性[33]。因此Glu表面疏水性的變化也反映了pH值偏移處理下其溶解性的變化。
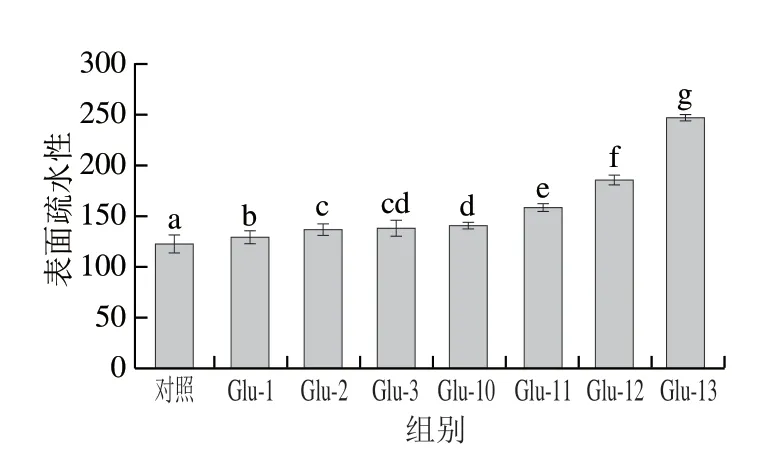
圖3 不同pH值偏移處理下Glu的表面疏水性Fig.3 Surface hydrophobicity of Glu under different pH-shifting treatments
2.4 蛋白質內源熒光光譜與紫外光譜分析
如圖4A所示,對照組最大發射熒光波長為352 nm,而經過pH值偏移處理Glu樣品的最大發射熒光波長均出現藍移且熒光強度均發生不同程度的增加,堿偏移處理樣品的熒光強度增幅更大,結果表明,pH值偏移處理誘導Glu構象發生解折疊,更多的熒光基團暴露出來。Glu的色氨酸微環境向更疏水的微環境偏移,更多疏水基團的暴露致使蛋白質環境更加疏水,這與疏水性結果一致。蛋白質中氨基酸微環境的變化也會改變紫外吸收波長,因此可以用紫外光譜表征蛋白質結構的變化。如圖4B所示,對照組最大峰值為276 nm,較對照相比pH值偏移處理后Glu的最大峰值均發生偏移。酸偏移處理下最大峰值偏移更顯著(8 nm)。這些最大吸收峰的差異與苯丙氨酸、色氨酸和酪氨酸的殘留有關,最大吸收峰的紅移表明了Glu氨基酸環境的變化。此外,從圖中也可以看出酸偏移處理后的特征吸收峰明顯增強,堿偏移處理后的特征吸收峰降低,說明pH值偏移處理會致使Glu構象發生轉變[34]。
2.5 蛋白質游離巰基及二硫鍵含量分析
Glu本身含有巰基及大量分子間二硫鍵和分子內二硫鍵,二硫鍵有助于蛋白質結構的形成[35]。由圖5A可知,經pH值偏移處理后Glu中巰基含量增加且總游離巰基含量均高于暴露游離巰基含量,說明蛋白質內部結構中仍存在大量巰基。經過pH值偏移處理后總游離巰基和暴露游離巰基含量均有所增多,較高的游離巰基含量表明由于蛋白質去折疊從而暴露了內部巰基,或是天然蛋白質中S—S鍵的斷裂而產生新的巰基所致。從圖5B中二硫鍵含量上也可以看出,pH值偏移處理后樣品的二硫鍵含量均減少,這說明在pH值偏移處理條件下蛋白質的二硫鍵發生不同程度的斷裂,進而生成新的游離巰基,這也是導致總游離巰基增加的原因之一。同時暴露游離巰基含量的增加可能是由于pH值偏移處理后,Glu顆粒的大小和形態發生了變化,使得隱藏在Glu中的巰基暴露于蛋白質表面[29]。
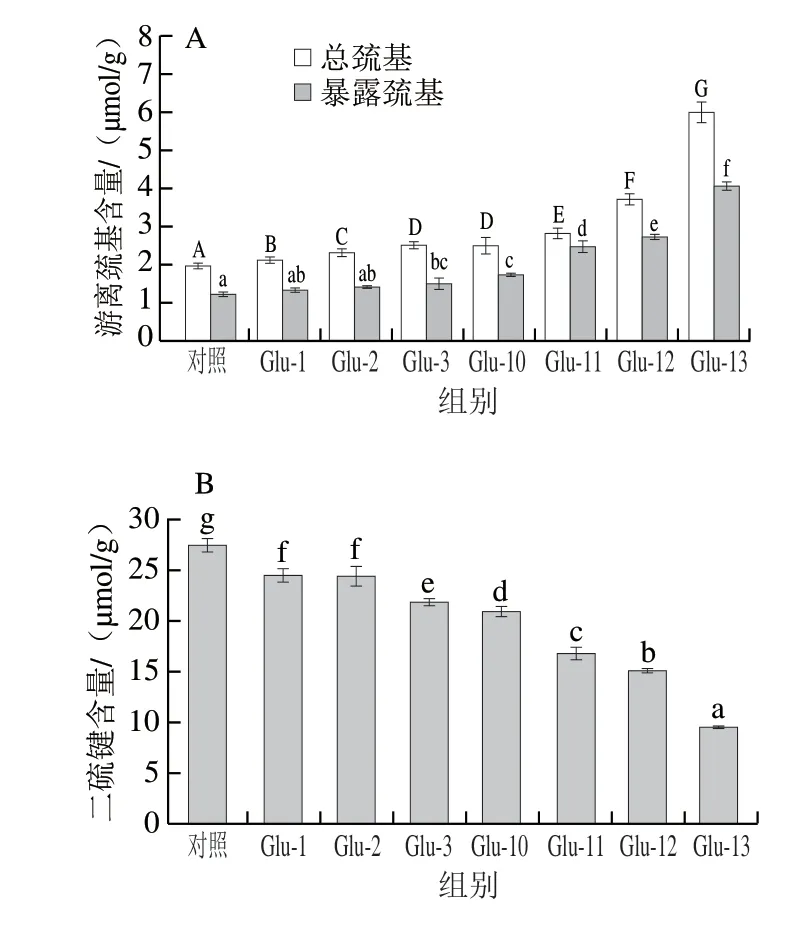
圖5 不同pH值偏移處理下Glu的總游離巰基和暴露巰基(A)及二硫鍵含量(B)Fig.5 Total free sulfhydryl group and exposed sulfhydryl group (A) and disulfide bond contents (B) of Glu under different pH-shifting treatments
2.6 SDS-PAGE分析
采用SDS-PAGE分析pH值偏移處理后Glu分子質量及其主要亞基的變化。Glu由分子間二硫鍵相連的GS組成,GS中也存在分子內二硫鍵[1]。通常GS由高分子質量GS和低分子質量GS組成[1]。其中分子質量在20~70 kDa的是低分子質量GS,占Glu的90%,分子質量為80~130 kDa的是高分子質量GS,占Glu的10%。從圖6可以觀察到,Glu的主要條帶集中在20~70 kDa處,在35 kDa處條帶最深,表明分子質量大部分集中在此處。經過堿偏移處理后樣品在20~25 kDa處產生了新的條帶,表明堿偏移處理使Glu分解成了更小分子質量的肽段,這些低分子質量多肽可能是通過β-巰基乙醇分解S—S鍵而產生[29]。
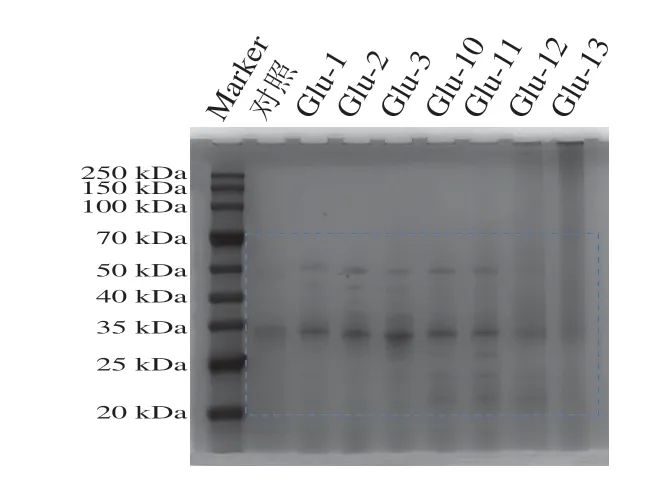
圖6 不同pH值偏移處理下Glu的SDS-PAGE圖像Fig.6 SDS-PAGE patterns of Glu under different pH-shifting treatments
2.7 蛋白質的二級結構分析
蛋白質有3 條典型的紅外吸收帶:酰胺I帶位于1600~1700 cm-1,主要為C=O及少數C—N;酰胺II帶1525~1550 cm-1,主要為N—H及部分C—N;酰胺III帶位于1230~1350 cm-1,主要為C—N及少數N—H[36]。從圖7可知,Glu在1637、1525 cm-1附近有2 個明顯的吸收峰,分別為酰胺I帶的C=O和酰胺II帶的N—H振動引起的。另外在3300 cm-1附近有較寬的吸收峰,這歸因于羥基的伸縮振動。其中,酰胺I帶對蛋白二級結構的影響最具價值,因此對酰胺I帶進行研究且通過擬合后發現酰胺I帶可獲得4 個條帶,分別是β-折疊、無規卷曲、α-螺旋和β-轉角。從表1可以看出,通過pH值偏移處理后Glu的α-螺旋含量下降,有研究表明表面疏水性與α-螺旋含量呈負相關,表面疏水性會隨著α-螺旋含量的降低而增加[37],這與疏水性結果一致。另外pH值偏移處理過程中Glu發生了脫酰胺,使谷氨酰胺轉變為谷氨酸,從而降低了含有氫鍵的β-折疊結構,使其轉變為更具柔性的無規卷曲和β-轉角結構。

表1 不同pH值偏移處理下Glu的二級結構含量Table 1 Secondary structure content of Glu under different pH-shifting treatments %
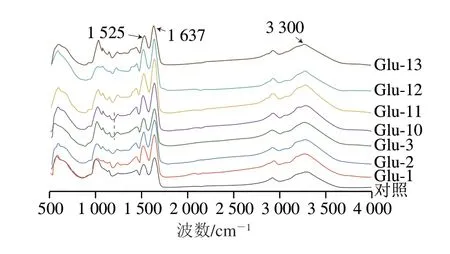
圖7 不同pH值偏移處理下Glu的紅外光譜圖Fig.7 FTIR spectra of Glu under different pH-shifting treatments
3 結論
本研究考察了pH值偏移處理對Glu結構及理化性質的影響。結果表明,堿偏移處理可顯著降低Glu分子的聚集程度,有利于Glu的溶解。經pH值偏移處理的Glu表面疏水性均有不同程度的增加,且堿偏移處理下表面疏水性要高于酸偏移處理。此外,pH值偏移處理會導致Glu分子中二硫鍵不同程度的斷裂,且堿偏移處理下更多二硫鍵斷裂生成巰基,使Glu分子中游離巰基含量增加。二級結構分析結果表明,經pH值偏移處理后α-螺旋和β-折疊含量下降,而β-轉角和無規卷曲結構含量有所增加。本研究對改善Glu功能特性,拓寬其在食品工業的應用范圍具有積極的意義。

