正丁烷芳構化九集總反應動力學模型研究
陳永浩,董 晨,王杰廣,王子健
(中石化石油化工科學研究院有限公司,北京 100083)
輕烴芳構化技術是指在改性擇形分子篩的催化作用下,將重整抽余油及煉油廠液化氣等輕烴組分轉化為芳烴并副產氫氣的石油煉制技術。該技術具有工藝流程簡單、原料適應性強、產品價值高、建設費用低等優點,與其他裝置組合配套使用能大大提高煉化一體企業的原料利用率[1-2]。然而,對輕烴芳構化反應過程的影響因素的認識目前仍有不足,限制了芳構化工藝條件的優化,因而開展輕烴芳構化反應動力學研究,不僅可以預測產物分布和產品性質,而且對裝置運行優化和反應器設計也具有重要意義。
輕烴芳構化反應過程可分為烷烴活化和烯烴芳構化兩個階段[3-4],其催化劑同時具有酸性功能和金屬功能。在烷烴活化階段,烷烴通過脫氫或裂化生成烯烴,催化劑上的B酸位點主要負責活化C—C鍵,使烷烴發生裂解反應;而金屬脫氫位點主要負責活化C—H鍵,使烷烴發生脫氫或氫轉移反應生成烯烴[5]。在烯烴芳構化階段,烷烴活化階段生成的烯烴在催化劑的B酸位點上質子化形成碳正離子,并與另一烯烴形成新的C—C鍵,從而實現鏈增長;而質子轉移到酸性位上,完成鏈終止并恢復活性。實現鏈增長后的烯烴,既可以在金屬活性位上進行脫氫環化,也可以在酸性活性位上發生環化反應,最終均生成芳烴。在該反應過程中,同時伴有裂化、異構、氫轉移等一系列副反應[6]。此外,分子篩催化劑的孔道空間位阻限制烯烴難以形成大尺寸的聚合物,從而抑制了大分子副產物的生成。
輕烴芳構化反應體系含有數百種化合物(主要為C1~C12),涉及的反應更是不計其數,要詳細模擬每一種反應幾乎是不可能的。因此,在對其反應過程進行動力學模擬時,可以用虛擬的集總組分替代性質相似的組分,構建集總組分的反應網絡動力學模型,從而進行簡化的近似計算。自1959年Smith[7]針對催化重整工藝提出四集總動力學模型以來,有關重整過程的集總動力學模型已有大量的文獻報道[8],并在反應產物預測、工業裝置設計及運行優化方面取得了很好的效果。此外,很多學者利用集總動力學模型對催化裂化反應過程進行模擬,也取得了理想的效果[9]。
然而,對輕烴芳構化的反應過程,目前鮮有集總動力學模型的研究報道。為了提升對輕烴芳構化過程的認知,深入探究其產物分布和影響因素以優化輕烴芳構化工藝條件,本課題以正丁烷為模型化合物進行芳構化,考察其在不同條件下芳構化的產物分布規律,同時利用Python平臺建立正丁烷芳構化九集總反應動力學模型,對反應產物分布進行模擬預測,并與試驗結果比較,驗證模型的預測效果。
1 實 驗
1.1 原 料
正丁烷,化學純,國藥集團化學試劑有限公司產品。RF-4型輕烴芳構化催化劑,中石化石油化工科學研究院有限公司提供。
1.2 正丁烷芳構化試驗
利用固定床微反裝置進行正丁烷芳構化試驗,其流程如圖1所示。試驗方法:首先,在固定床微反裝置的反應器恒溫段中部加入4 g RF-4型催化劑,在N2中干燥活化1 h;然后,斷開N2,啟動計量泵將正丁烷送入反應器進行芳構化反應;反應產物組成用在線氣相色譜儀分析,每隔1.5 h測定1次,在連續3次產物組成測試值相近時結束試驗;取3次測試的平均值作為產物分布結果,并取出催化劑分析其碳含量。
2 結果與討論
在進料質量空速為0.5 h-1、反應壓力為0.2 MPa的非臨氫條件下,考察反應溫度變化對正丁烷芳構化反應的影響,結果如表1所示。由表1可知,隨著反應溫度升高,正丁烷的轉化率、芳烴產率均呈上升趨勢。
在反應溫度為510 ℃、反應壓力為0.2 MPa的非臨氫條件下,考察進料空速對正丁烷芳構化反應的影響,結果如表2所示。由表2可知,隨著空速增大,反應物停留時間變短,正丁烷的轉化率和芳烴產率均下降。
在反應溫度為510 ℃、進料質量空速為0.5 h-1的非臨氫條件下,考察反應壓力對正丁烷芳構化反應的影響,結果如表3所示。由表3可知,隨著反應壓力增加,正丁烷轉化率逐漸提高,而芳烴產率變化較小。
此外,分析催化劑碳含量測試結果發現,由于單次試驗過程持續時間均較短,試驗后催化劑的碳含量均較低,其質量分數在1.0%~3.0%范圍內,因此忽略反應過程中積炭對催化劑活性的影響。
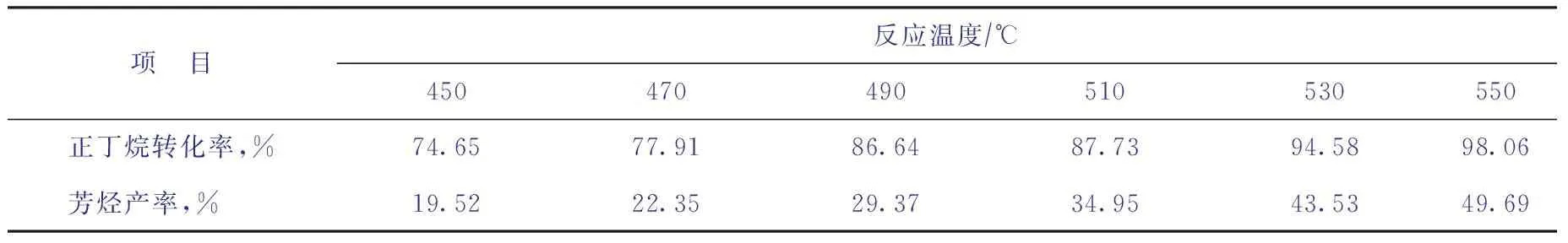
表1 溫度對正丁烷芳構化反應轉化率與芳烴產率的影響
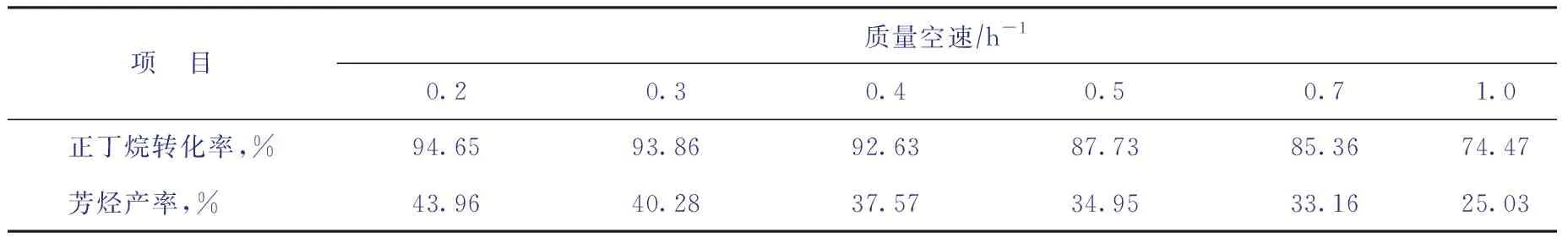
表2 空速對正丁烷芳構化反應轉化率與芳烴產率的影響
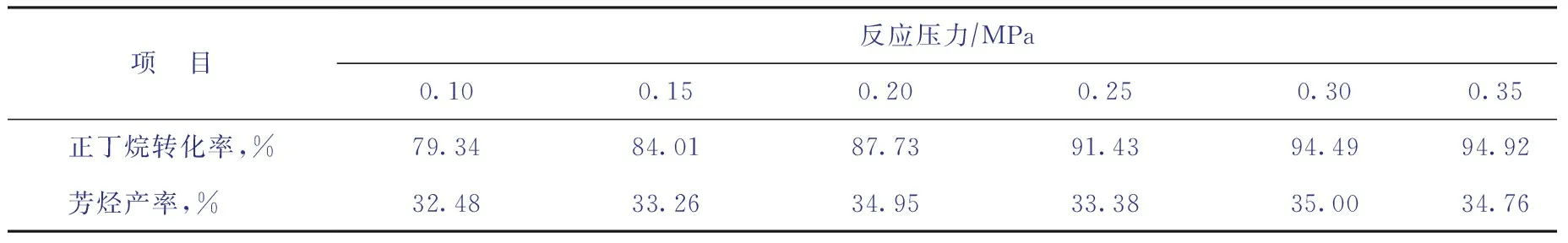
表3 壓力對正丁烷芳構化反應轉化率與芳烴產率的影響
3 反應網絡構建
3.1 集總劃分
輕烴芳構化反應體系包含C1~C12烴類組分,在集總劃分時,將反應產物按以下原則進行簡化:①反應產物中的烯烴含量較低,其質量分數不超過3.0%,因而將其與同碳數的烷烴歸為一類組分,不單獨列出;②反應產物中的環烷烴質量分數之和不超過1.0%,因而忽略;③反應產物中的C5和C6烷烴質量分數之和不超過1.0%,因而忽略;④C9+產物組成復雜,包括各種烷烴、芳烴,但其中芳烴質量分數超過95%,故將其均視為C9芳烴。
集總劃分采用烴族組成與碳數相結合的方式,將反應體系劃分為反應物、中間產物、生成物3個部分。反應物正丁烷劃分為一個集總P4;中間產物指由反應物生成,并可以繼續反應的物質,包括丙烷集總P3和C9芳烴集總A9;生成物則包括甲烷集總P1、乙烷集總P2、苯集總A6、甲苯集總A7、二甲苯集總A8、氫氣集總H2共6個集總。因此,整個反應體系被劃分為9個集總。
3.2 反應網絡

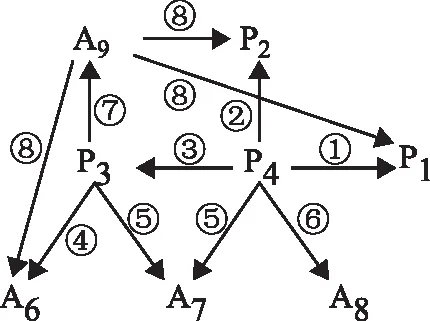
圖2 正丁烷芳構化九集總動力學反應網絡
在正丁烷芳構化反應過程中,正丁烷可以直接裂解,也可以轉化為大分子烷烴或烯烴后再發生裂解,涉及到的反應過程較為復雜。考慮到裂解產物主要為甲烷、乙烷和丙烷[10]。因此忽略中間步驟,設計用反應①至反應③來代表裂解反應。
輕烴芳構化反應的烷烴活化階段,主要為烷烴通過裂解、脫氫、氫轉移等反應生成烯烴的過程,該過程的反應速率較低,是輕烴芳構化反應的決速步驟[11];在烯烴芳構化階段,主要發生烯烴齊聚生成環烯烴反應,而環烯烴進一步發生氫轉移反應生成芳烴。烯烴芳構化階段反應的速率非常高[12],其中多個反應的反應速率是烷烴活化階段反應速率的數千倍。因此,為簡化反應網絡,可以認為低碳烷烴直接生成芳烴,即由反應物P4與中間產物P3反應生成各類對應碳數的芳烴,包括反應④至反應⑦。此外,部分芳烴會發生脫烷基反應[13],且碳數越高的芳烴越容易發生該反應。有研究表明[14],在反應溫度為570 ℃時,甲苯與二甲苯的脫烷基反應轉化率均不足2%,而相同反應條件下的混合重質芳烴脫烷基反應轉化率高于60%。因此,為了簡化計算,僅考慮A9的脫烷基反應,即反應⑧。
4 正丁烷芳構化反應動力學參數
4.1 反應速率方程
為簡化反應動力學計算過程,假設所有反應均為一級不可逆反應,將反應器近似為平推流反應器并忽略擴散對反應的影響,對于每一種反應均按式(1)和式(2)計算反應速率。
(1)
(2)
式中:r為反應速率,mol/(g·h);F為反應物摩爾流量,mol/h;W為催化劑質量,g;k為反應速率常數,mol/(g·h·Pa);k0為指前因子,mol/(g·h·Pa);p為壓力,Pa;E為活化能,J·mol;R為氣體常數,8.314 J/(mol·K);T為反應溫度,K;i為反應編號;x為反應物。
4.2 動力學參數的計算
以反應物正丁烷集總P4為例進行分析,P4參與的反應包括反應①、反應②、反應③、反應⑤、反應⑥,其總反應速率由式(3)計算。
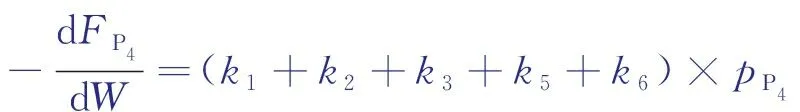
(3)
設kP4=k1+k2+k3+k5+k6,稱作反應物P4的總反應速率常數。
設反應在恒壓條件下進行,由于該反應為分子數增加的反應,故反應體系體積膨脹。考慮反應體系膨脹率ε,得到:
(4)
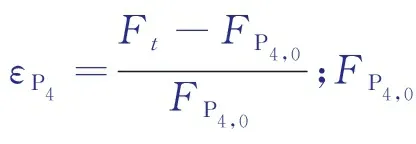
在試驗條件下,體系膨脹率與反應溫度(T)、質量空速(u)相關,采用最小二乘法建立膨脹率與溫度、空速的經驗式,如式(5)所示。
ε=0.006 89T-0.349u-4.165
(5)
圖3(a)和圖3(b)分別為膨脹率與溫度、空速的關系擬合曲線。由圖3可見,膨脹率的計算值與實際值相對誤差均小于5.0%。
對式(4)積分得:
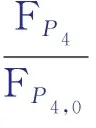
(6)
其中ε,FP4,0,FP4,p,W均為已知量,可以求得kP4。
同理,對每一個反應構建動力學方程,建立動力學方程組。之后以試驗數據為基礎,基于Python平臺,使用least-squares函數求解非線性方程組,可以得到各個反應在不同溫度下的反應速率常數k。進而通過Arrhenius方程就可以計算出各反應的活化能Ea及其指前因子k0。各反應的動力學參數求解結果見表4,其中k為510 ℃下的反應速率常數。
需要說明的是,由于正丁烷芳構化反應體系非常復雜,因而在模型建立和求解的各個階段需要設定若干假設條件或進行近似處理,因此表4中的動力學參數并不能代表各反應的真實本征動力學特征。
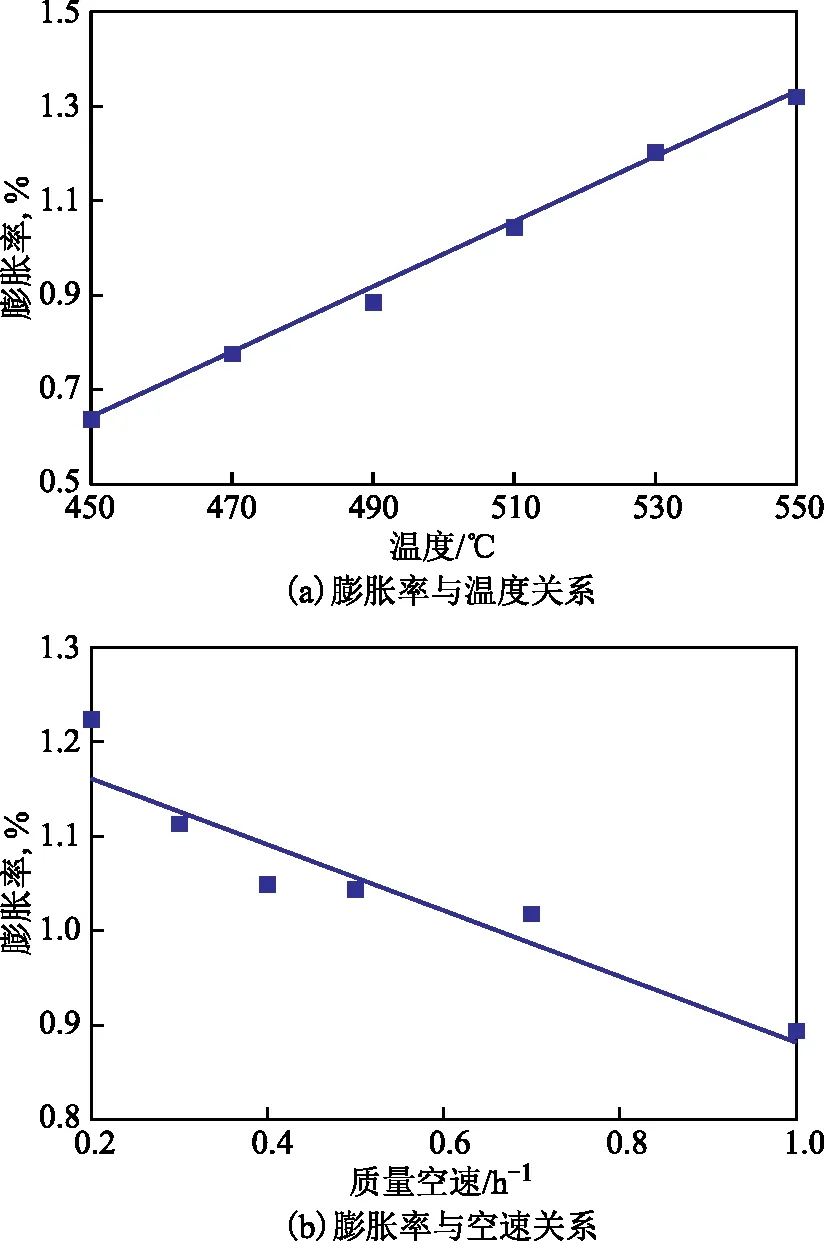
圖3 膨脹率與溫度和空速的關系 —ε計算值; ■—ε實際值
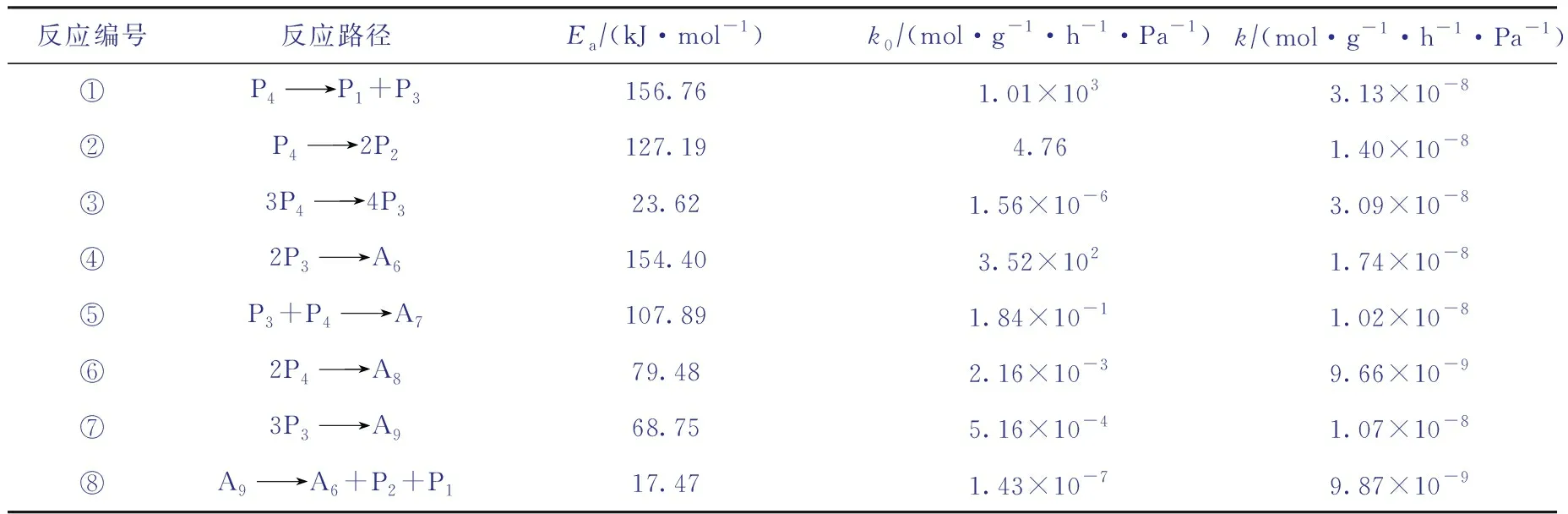
表4 正丁烷芳構化反應網絡中各反應的動力學參數計算結果
5 模型預測效果
利用表2和表3中12種不同反應條件下的正丁烷芳構化試驗數據來驗證所建九集總動力學模型的預測效果,圖4為正丁烷芳構化反應的產物分布模型預測值與試驗實測值的比較結果,而預測結果的絕對誤差列于表5。由圖4和表5可知,該九集總動力學模型對氫氣集總H2、甲苯集總A7和二甲苯集總A8含量預測較為準確,平均絕對誤差在0.5%以下,最大絕對誤差約1.0%;對其他產物預測的最大絕對誤差不超過5.0%,表明該九集總動力學模型對正丁烷芳構化產物分布的預測準確性較高。
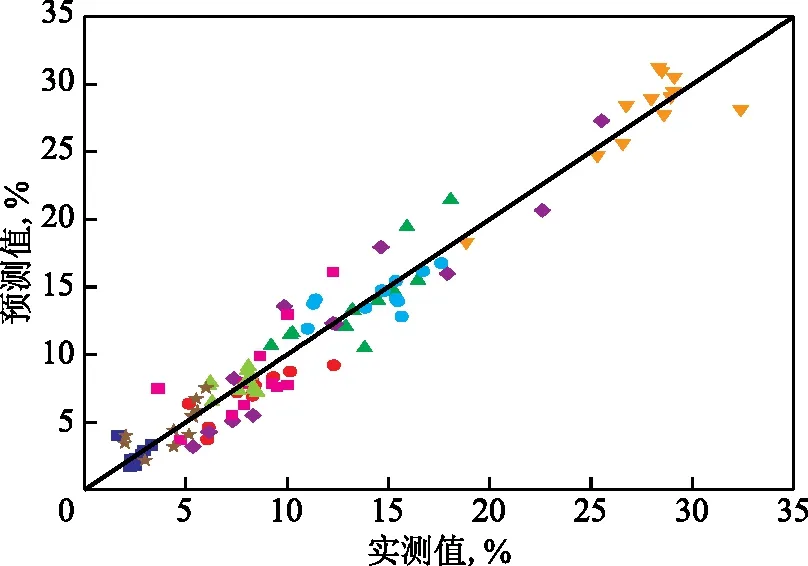
圖4 正丁烷芳構化產物組成模型預測值與實測值比較
6 結 論
利用固定床微反評價裝置考察了正丁烷在不同反應條件下的產物分布規律。根據反應機理和產物分布特點進行合理的假設和近似,建立了正丁烷芳構化集總反應動力學模型,該模型共包含9個集總組分及8個基本化學反應。
利用Python平臺求解了九集總正丁烷芳構化模型的反應動力學參數,并與試驗實測值進行了比較。結果表明,該九集總動力學模型的產物分布預測準確性較高,其預測12種不同反應條件下產物氫氣、甲苯和二甲苯分布的平均絕對誤差均在0.5%以下,最大絕對誤差約1.0%,且對其他產物的預測最大絕對誤差均不超過5.0%。

