應用16S rRNA基因測序比較分析不同品系1型糖尿病小鼠腸道菌群的異同*
劉 軍 丁登峰 高 偉 陳 華 牛苗苗
(中國人民解放軍總醫院,北京 100853)
糖尿病已成為當今社會最嚴重和最常見的慢性疾病之一[1]。流行病學研究顯示,2022年1型糖尿病(type 1 diabetes mellitus,T1DM)患者有875萬人,是2017年的8倍,其中152萬T1DM患者的年齡不到20歲,嚴重影響兒童和青少年的生命健康[2-3]。T1DM是一種復雜的自身免疫性疾病,其特征是由自身反應性T細胞引起的β細胞功能障礙和死亡,導致胰島素合成和分泌異常[4-5],使患者出現以胰島素絕對缺乏和高血糖為特征的葡萄糖代謝紊亂[6-8]。目前雖然已有大量研究關注T1DM的病理生理機制,但其確切機制仍不明確。目前已知的T1DM病因涉及多種因素,主要包括自身免疫、遺傳易感、病毒感染、飲食、腸道菌群等[9-11]。近年的大量研究顯示,腸道菌群在T1DM的發生和發展中起著越來越重要的作用[12]。B6和FVB小鼠T1DM模型是研究T1DM的重要動物模型,對于其腸道菌群特征目前研究報道較少。本研究采用腹腔注射STZ的方法制備B6和FVB小鼠T1DM模型,采集各組小鼠成模后6周的糞便進行16S rRNA測序,研究兩種T1DM模型小鼠腸道菌群的組成特征和功能,并分析與人類T1DM患者腸道菌群的異同,為探索兩模型在T1DM相關腸道菌群研究中的進一步應用提供背景數據。
所有數據輸入SPSS 16.0軟件進行統計分析,計量資料均以表示,符合正態性分布,兩組獨立樣本均數比較使用t檢驗,多組間比較使用方差分析,組間相互比較使用LSD檢驗,計數資料使用χ2分析。
1 材料和方法
1.1 材料
1.1.1實驗動物分組及處理:SPF級B6小鼠,雄性,8周齡,體質量22~25 g左右,20只,購自斯貝福(北京)生物技術有限公司,生產許可證號【SCXK(京) 2019-0010】。SPF級FVB小鼠,雄性,8周齡,體質量22~25 g左右,20只,購自北京華阜康生物科技股份有限公司,生產許可證號【SCXK(京) 2020-0004】。動物飼養于中國人民解放軍總醫院實驗動物中心屏障系統內,使用許可證號【SYXK(軍) 2017-0019】,室溫22~24 ℃,相對濕度在40%~60%,適應性喂養1周后,每只小鼠每天按照40 mg/kg的劑量腹腔注射STZ(pH 4.5的0.01 mmol/L檸檬酸鹽緩沖液配制),連續注射5 d。小鼠空腹血糖連續2周≥11.1 mmol/L為T1DM建模成功。本實驗通過解放軍總醫院實驗動物福利倫理委員會的審查,倫理審批號:2022-x18-130,實施過程中嚴格遵守其指導原則。
1.1.2主要試劑及儀器:STZ(西格瑪奧德里奇公司),血糖儀(Johnson &Johnson公司),MOBIO強力糞便基因組DNA提取試劑盒(QIAGEN公司),Microfuge R22R Centrifuge臺式高速低溫離心機(貝克曼庫爾特公司);NanoDrop 2000/2000C超微量分光光度計(Thermo公司);PCR儀(杭州朗基科學儀器有限公司的 A200 基因擴增儀)。
1.2 方法
1.2.1糞便標本的收集、保存及DNA的提取:分別收集兩組小鼠出現糖尿病癥狀6周后的糞便各10份。每次收集糞便前將每只小鼠單獨放在一個消毒的動物籠盒里,自由活動30 min,收集小鼠糞便約0.2 g,糞便置于1.5 mL無菌EP管中,-80 ℃冰箱保存待用。按照QIAGEN糞便基因組DNA提取試劑盒說明書提取實驗動物糞便中的細菌DNA;測量DNA濃度后,將樣品置于-80 ℃冰箱儲存待用。
1.2.2細菌DNA的擴增及測序結果分析:使用杭州聯川生物技術股份有限公司合成的Barcode 通用引物341F (5′-CCTACGGGNGGCWGCAG-3′)和805R(5′-GACTACHVGGGTATCTAATCC-3′)在16S rRNA V3-V4高可變區進行PCR擴增,PCR反應擴增條件:98 ℃預變性30 s;隨后98 ℃變性10 s,54 ℃退火30 s,72 ℃延伸45 s,共計擴增35個循環;最后72 ℃延伸10 min。對擴增產物采用2%的瓊脂糖凝膠電泳定量檢測后,進行16S rRNA基因高通量測序(DNA建庫測序工作由杭州聯川生物技術股份有限公司完成)。獲得原始數據Raw Data,利用overlap將雙端數據進行拼接,并進行質控、嵌合體過濾,獲得高質量的Clean Data。DADA2(Divisive Amplicon Denoising Algorithm)不再以序列相似度進行聚類,而是通過“去重復”等步驟,進而獲得單堿基精度的代表序列,大大提升了數據精確度與物種分辨率。DADA2的核心是去噪,然后使用ASVs (Amplicon Sequence Variants)的概念構建類OTUs (Operational Taxonomic Units)表,獲得最終的ASVs特征表以及特征序列,進一步進行多樣性分析、物種分類注釋和差異分析等。
1.3 統計學分析
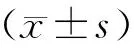
2 結果
2.1 16S rRNA測序
那是我離滿目星河最近的時刻,站在天與地之間,踩著4000米海拔的色達。那時夏天初來,我裹著棉襖,腳踝冰冷,耳垂滾燙。
注:A.兩組小鼠糞便測序得到無重復的ASVs數目;B.兩組小鼠糞便測序得到平均ASVs數目。 Note:A. Faecal sequencing of two groups of mice yielded the number of ASVs without duplication;B. The average number of ASVs was obtained by fecal sequencing of two groups of mice.圖1 兩組T1DM小鼠糞便測序得到的ASVs數量Fig.1 Number of ASVs obtained from fecal sequencing of two groups of T1DM mice
2.2 兩組小鼠腸道菌群物種組成分析
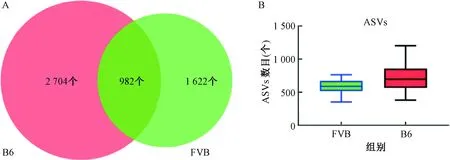
在“科”水平上,B6組主要以屬于擬桿菌門的Muribaculaceae菌科(33.91%)和普雷沃菌科(Prevotellaceae,5.25%),屬于厚壁菌門的乳酸桿菌科(Lactobacillaceae,30.22%)、毛螺菌科(Lachnospiraceae,5.6%)、未分類梭菌科菌屬(Clostridiales_unclassified,2.20%)、未分類梭菌屬_UCG-014(Clostridia_UCG-014_unclassified,1.11%)和丹毒絲菌科(Erysipelotrichaceae,1.02%),屬于脫硫桿菌門的脫硫弧菌科(Desulfovibrionaceae,3.38%),屬于疣微菌門的阿克曼菌科(Akkermansiaceae,2.67%),屬于髕骨細菌門的Saccharimonadaceae菌科(1.04%)為主,優勢菌科為Muribaculaceae、Lactobacillaceae、Lachnospiraceae、Prevotellaceae、Desulfovibrionaceae、Akkermansiaceae;FVB組主要以屬于厚壁菌門的毛螺菌科(Lachnospiraceae,21.02%)、乳酸桿菌科(Lactobacillaceae,15.63%)、未分類梭菌科菌屬(Clostridiales_unclassified,4.36%)、鏈球菌科(Streptococcaceae,3.18%)、瘤胃球菌科(Ruminococcaceae,2.89%)和丹毒絲菌科(Erysipelotrichaceae,2.64%)和未分類梭菌屬_UCG-014(Clostridia_UCG-014_unclassified,1.31%),屬于擬桿菌門的Muribaculaceae菌科(17.15%)、普雷沃菌科(Prevotellaceae,4.84%)、Marinifilaceae菌科(3.25%)、擬桿菌科(Bacteroidaceae,2.44%)和理研菌科(Rikenellaceae,2.32%),屬于髕骨細菌門的Saccharimonadaceae菌科(3.33%),屬于疣微菌門的阿克曼菌科(Akkermansiaceae,2.03%)為主,優勢菌科為Lachnospiraceae、Muribaculaceae、Lactobacillaceae、Prevotellaceae、Clostridiales_unclassified、Saccharimo-nadaceae、Marinifilaceae,見圖2B。
注:A.兩組小鼠腸道菌群在菌門水平的分類組成;B.兩組小鼠腸道菌群在菌科水平的分類組成。 Note:A. Taxonomic composition of the gut microbiota at the phylum level; B. Taxonomic composition of the gut microbiota at the family level.圖2 分類圖顯示兩組在不同分類水平的相對豐度Fig.2 Taxonomic plots showing relative abundance of the two groups at phylum and family levels
在“門”水平上,B6組主要以厚壁菌門(Firmicutes,45.91%)、擬桿菌門(Bacteroidetes,42.21%)、脫硫桿菌門(Desulfobacterota,3.38%)、疣微菌門(Verrucomicrobia,2.67%)、變形菌門(Proteobacteria,2.59%)、放線菌門(Actinobacteriota,1.55%)、髕骨細菌門(Patescibacteria,1.05%)為主,優勢菌門為Firmicutes、Bacteroidetes和Desulfobacterota;FVB組主要以厚壁菌門(Firmicutes,58.68%)、擬桿菌門(Bacteroidetes,30.15%)、髕骨細菌門(Patescibacteria,3.34%)、變形菌門(Proteobacteria,2.62%)、疣微菌門(Verrucomicrobia,2.03%)、放線菌門(Actinobacteriota,1.77%)為主,優勢菌門為Firmicutes、Bacteroidetes、Patescibacteria和Patescibacteria,見圖2A。
2.3 兩組小鼠糞便中菌群多樣性分析
為了進一步評估宿主腸道菌群的功能及作用,本研究使用PICRUSt2軟件對T1DM小鼠腸道菌群的16S rRNA基因進行功能通路的預測。PICRUSt2對腸道菌群的通路分析顯示,B6和FVB組T1DM小鼠中共有30個代謝通路發生了顯著改變。兩組相比,有9條通路在B6組T1DM小鼠中表達上調(P< 0.05);其余21條通路在FVB組T1DM小鼠中表達下調(P<0.05);這些功能通路集中在以氨基酸代謝、糖代謝及核苷酸代謝為主的代謝途徑中,如圖8所示。兩組T1DM小鼠的腸道菌群都參與了多條代謝途徑,在T1DM小鼠體內有更多的代謝途徑被激活,這與T1DM的代謝性疾病相一致。
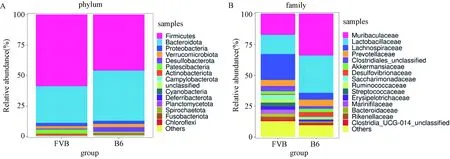
注:A.Observed species指數;B. Chao1指數;C. Simpson指數;D. Shannon指數。Note:A. Observed species index; B. Chao1 index; C. Simpson index; D. Shannon index.圖3 兩組T1DM小鼠腸道菌群Alpha多樣性指數的比較Fig.3 Comparison of Alpha diversity index of gut microbiome in two groups of T1DM mice
2.3.2Beta多樣性分析:B6組與FVB組相比腸道菌群組成不同。在菌門水平上,UPGMA聚類樹和PCoA分析結果都表明,B6與FVB組小鼠在菌群構成上明顯不同,見圖4A(ANOSIMP=0.001)和C;從PCA和NMDS分析結果來看,B6與FVB組小鼠在菌群構成上有一定的相似性,見圖4B(ANOSIM,P=0.001)和D。上述分析結果表明,B6組和FVB組小鼠T1DM模型的腸道菌群構成存在差異,但也有一定相似性。
B6和FVB組20份糖尿病小鼠糞便樣本16S rRNA測序共觀察到5 308個獨特的擴增子序列變異(ASVs)數目,B6組特有2 704個ASVs,FVB組特有1 622個ASVs,兩組共有982個ASVs,見圖1A。B6組平均每個樣品獲得726個ASVs,FVB組平均每個樣品獲得584個ASVs(包括兩組間重復的ASVs),對兩組的ASVs數據進行比較分析,差異無統計學意義(P>0.05),見圖1B。平均每個樣品測序序列數為75 672條,經過篩選后有效序列占86.88%,兩組樣品平均覆蓋率(goods coverage)為100%,差異無統計學意義(P>0.05)。序列長度為400~500 bp,與16S rRNA V3-V4 區域序列長度吻合,該數據符合后續結果分析標準。
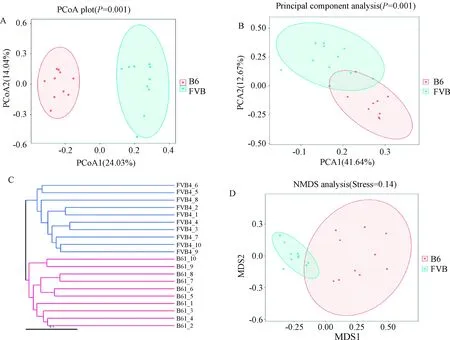
注:A.腸道菌群加權的主成分分析圖;B.腸道菌群主坐標分析圖;C.腸道菌群加權的UPGMA聚類分析圖;D.腸道菌群加權的NMDS分析圖。Note:A. PCoA Map of the weighted mice gut microbiome in two groups; B. PCA Map of the mice gut microbiome in two groups;C. UPGMA cluster analysis of the weighted mice gut microbiome in two groups; D.NMDS Map of the weighted mice gut microbiome in two groups.圖4 兩組T1DM小鼠腸道菌群Beta多樣性指數的比較Fig.4 Comparison of Beta diversity index of gut microbiome in two groups of T1DM mice
2.3.3腸道菌群的差異分析:B6與FVB組小鼠腸道菌群在菌科水平的豐度對比分析熱圖結果顯示,B6組的Muribaculaceae、Lactobacillaceae、Prevotell-aceae、Akkermansiaceae和Desulfovibrionaceae菌科的相對豐度比FVB組高;B6組的Lactobacillaceae、Clostridiales_unclassified、Saccharimonadaceae、Rumino-coccaceae、Streptococcaceae、Erysipelotrichaceae、Marinifil-aceae、Bacteroidaceae、Rikenellaceae和Clostridia_UCG-014_unclassified菌科的相對豐度比FVB組低,見圖5A。在菌屬水平的熱圖結果顯示,B6組的Muribaculaceae_unclassified、Ligilactobacillus、Lactoba-cillus、Muribaculum、Alloprevotella、Akkermansia和Desulfovibrio菌屬的相對豐度比FVB組高;B6組的Lachnospiraceae_NK4A136_group、HT002、Clostridiales_unclassified、Candidatus_Saccharimonas、Prevotell-aceae_UCG-001、Odoribacter、Bacteroides和Lactococcus菌屬的相對豐度比FVB組低,見圖5B。上述分析結果表明,B6和FVB組T1DM小鼠的腸道菌群構成比例存在差異。
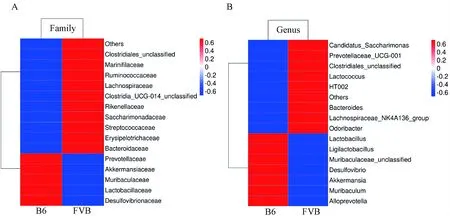
注:A.科水平熱圖結果;B.屬水平熱圖結果。Note:A. Results of families heat map; B. Results of genus heat map.圖5 兩組T1DM小鼠腸道菌群在科和屬水平熱圖顯示存在不同Fig.5 Heat map comparison of gut microbiome of two groups of T1DM mice at family and genus levels
2.4 腸道菌群生物標志物的篩選分析
LEfse結果分析顯示,B6與FVB組相比,有2個菌科、2個菌屬和3個菌種有顯著差異;FVB組與B6組相比,有1個菌門、2個菌綱、4個菌目、5個菌科、5個菌屬和5個菌種有顯著差異,見圖6A,B。在B6組中,顯著改變的菌科是Muribaculaceae和Lactobacillaceae,顯著改變的菌屬是Muribaculaceae_unclassified和Ligilactobacillus;FVB組中,顯著改變的菌門是Patescibacteria,顯著改變的菌科是Lachnospiraceae、Marinifilaceae、Streptococcaceae和Saccharimonadaceae,顯著改變的菌屬是Lachnospiraceae_NK4A136_group、HT002、Odoribacter、Lactococcus和Candidatus_Saccharimonas。
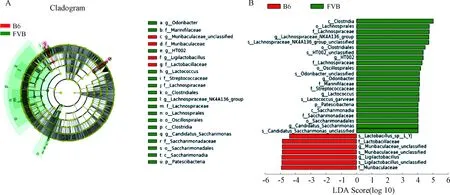
注:A.LEfSe分析提供了門到種的系統發育分布;B.LDA評分識別兩組之間的差異菌(LDA評分≥4.0)。Note:A. LEfSe analysis providing phylum-to-species phylogenetic distribution; B. LDA scores identifying differential entities between the two groups (LDA score ≥4.0).圖6 B6和FVB組T1DM小鼠腸道差異菌的分布Fig.6 Distribution of gut differential bacteria in T1DM mice in the B6 and FVB groups
2.5 腸道菌群厚壁菌門與擬桿菌門比值分析
4.2 固定資產管理 固定資產管理是整個系統的核心部分,在該部分可以看到每臺設備的詳細狀況,包括固定資產卡片、安裝培訓、驗收、合同、招標、購置申請等整個生命周期的信息,具體運行效果見圖5。
研究發現,厚壁菌門和擬桿菌門存在一種相互促進的共生關系,它們共同促進宿主吸收和儲存能量,兩者在消化道的比例對發酵多糖非常重要,厚壁菌門與擬桿菌門的比值(F/B)升高有助于促進肥胖的發病[14]。厚壁菌門與擬桿菌門的比值升高或降低說明腸道菌群已經失調,機體發生疾病的風險就會增加。B6組T1DM的F/B為1.09,與參考文獻[15]研究的B6對照組小鼠在4、7和9周的F/B(分別為0.26、0.23和0.21)的平均值0.23相比增加了3.74倍;FVB組T1DM的F/B為1.95,與參考文獻[16]研究的FVB對照組小鼠F/B等于0.53相比增加了3.70倍。結果顯示,B6組和FVB組小鼠T1DM腸道菌群的F/B值都增加了,說明兩組T1DM腸道菌群發生了失調(圖7)。
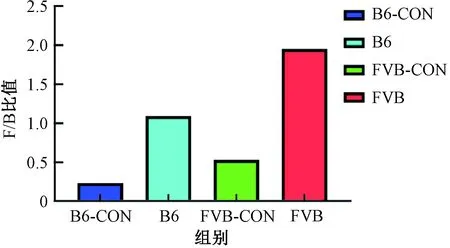
圖7 厚壁菌門與擬桿菌門比值Fig.7 Ratio of Firmicutes to Bacteroidetes
2.6 腸道菌群功能預測分析
2.3.1Alpha多樣性分析:B6組T1DM小鼠腸道菌群的Observed species指數和Chao1指數都高于FVB小鼠,但差異無統計學意義(P>0.05),見圖3A,B;B6組小鼠腸道菌群的Simpson指數和Shannon指數都低于FVB組小鼠,但差異無統計學意義(P>0.05)見圖3C,D。B6和FVB組1型糖尿病小鼠腸道菌群的豐富度和多樣性無差異,不同品系對T1DM小鼠腸道菌群的豐富度和多樣性影響較小。
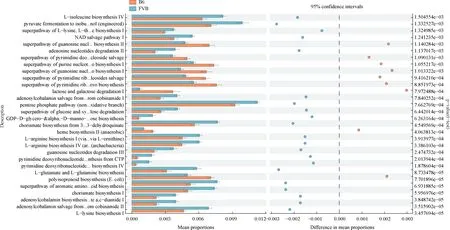
圖8 B6組和FVB組T1DM小鼠腸道微生物群的PICRUSt2功能預測結果分析Fig.8 Analysis of PICRUSt2 function prediction results of gut microbiome in two groups of T1DM mice
3 討論
T1DM動物模型的建立多采用經典的小劑量多次腹腔注射STZ,劑量通常為50 mg/kg,連續5 d,低劑量注射逐步損傷胰島細胞,可以引發自身對胰島的免疫應答,最終使模型動物血糖調節失代償,出現多飲、多尿、血糖持續偏高的1型糖尿病癥狀,相比于單次大劑量注射,多次低劑量注射的成模率高,且死亡率低[19]。本研究采用經典的小劑量多次腹腔注射STZ的方法建立T1DM小鼠模型,小鼠空腹血糖連續2周≥11.1 mmol/L 為T1DM建模成功。在此基礎上,我們重點研究不同品系T1DM小鼠腸道菌群的變化,以了解哪些菌群的改變與T1DM密切相關,以及哪一種T1DM小鼠模型腸道菌群譜的改變與人類T1DM菌群譜相似。前期研究發現,T1DM腸道菌群的多樣性和豐富度在患兒和小鼠的腸道中都顯著降低,且兩者的Beta多樣性與對照組相比也顯著不同,這些研究結果表明,T1DM的患兒和小鼠腸道菌群的組成和功能發生了顯著改變[20-21]。本研究結果顯示,B6和FVB組T1DM小鼠腸道菌群的多樣性和豐富度在兩組中無顯著差異(P>0.05),菌群組成以厚壁菌門、擬桿菌門和變形菌群為主,與研究人員[20-21]的T1DM腸道菌群結果基本一致。但是B6和FVB組T1DM小鼠的腸道菌群Beta多樣性結果顯示在兩組間有顯著差異(P<0.05)。研究發現,B6組和FVB組T1DM小鼠腸道菌群的優勢菌群沒有發生改變,但是優勢菌群在不同模型中的組成比例發生了改變[20-21],這與本研究中的兩組T1DM模型的結果一致。
宿主的健康與腸道菌群的多樣性和穩定性密切相關,這些菌群與宿主相互作用有利于宿主營養物質的消化吸收和能量代謝,菌群代謝產物可以調節腸道局部和全身免疫應答,來維持腸道穩態[13]。研究發現,菌群紊亂與糖尿病的發展密切相關,腸道菌群參與T1DM發病機制的自身免疫反應可能與肽能腸神經元有關,它調節免疫細胞功能,影響前抗炎細胞因子的產生,導致神經退行性變和胰島炎性反應[17-18]。
在本研究中,厚壁菌門和擬桿菌門是兩組T1DM小鼠的優勢菌門,占比88%左右,研究顯示它們與肥胖和糖尿病密切相關,一些學者將厚壁菌門定義為“脂肪細菌”,將擬桿菌門定義為“瘦細菌”,隨著厚壁菌門與擬桿菌門(F/B)比例的增加,這代表著腸道菌群已經發生紊亂,導致炎性反應和體質量指數的增加,胰島素抵抗更容易發生,最終導致糖尿病的發生[22-23]。在本研究中,與其他研究的對照組小鼠相比,B6和FVB組T1DM小鼠腸道中F/B的比例明顯增加(圖7),提示T1DM的發生可能與F/B的比例變化有關。此外,在B6和FVB組T1DM小鼠腸道菌群中放線菌門豐度顯著增加及其所屬種類的豐富,可使宿主產生一系列炎性反應,增加代謝性、慢性疾病的發病風險。研究顯示,T1DM的發病風險和進展與腸道菌群紊亂有關,與健康兒童相比T1DM患者和胰島抗體陽性的親屬后來發展為T1DM的兒童表現出腸道菌群紊亂和革蘭陽性菌與革蘭陰性菌的比率降低,這些失衡可能會產生促炎環境和腸道滲漏,從而激活自身免疫過程導致T1DM的發生[22]。在本研究中B6組T1DM小鼠的優勢菌科為Muribaculaceae菌科、乳酸菌科、毛螺菌科、普雷沃菌科、脫硫弧菌科和阿克曼菌科;FVB組T1DM小鼠的優勢菌科為Muribaculaceae菌科、乳酸菌科、毛螺菌科、普雷沃菌科、未分類梭菌科菌屬和Saccharimonadaceae菌科;毛螺菌科和乳酸桿菌科是厚壁菌門的主要成分,其中乳酸桿菌科是一種典型的能拮抗糖尿病的益生菌,近年來已被用于糖尿病的預防和治療,在本研究中,B6和FVB組T1DM中乳酸桿菌科和毛螺菌科顯著增加,乳酸桿菌科豐度增加可能與T1DM小鼠機體的免疫耐受有關,以便機體更好的應對疾病狀態;毛螺菌科可以降解植物多糖,為宿主提供能量,從而使宿主獲得更多的能量,毛螺菌科植豐度的異常增加可能是導致糖尿病、肥胖等代謝性疾病發病的因素之一。有研究顯示,10歲左右T1DM患兒腸道中的Lachnospiraceae菌科相對豐度為5.8%、Erysipelotrichaceae菌科的相對豐度為0.6%和Ruminococcaceae菌科的相對豐度為0.4%[24],與本研究的B6組T1DM小鼠腸道的Lachnospiraceae菌科(5.6%)、Erysipelotrichaceae菌科(1.0%)和Ruminococcaceae菌科(0.98%)的構成比例基本一致,與本研究的FVB組T1DM小鼠腸道的Lachnospiraceae菌科(21.2%)、Erysipelotrichaceae菌科(2.64%)和Ruminococcaceae菌科(2.89%)的構成比例相差較大。有研究發現,在小于2.9歲的T1DM患兒腸道中的ClostridiumclusterIV的相對豐度為9.1%,與本研究中FVB組T1DM小鼠腸道的Clostridiales_unclassified(4.36%)的比例較為接近[25]。Clostridiumcluster在免疫調節和腸道穩態中發揮重要作用,因為它們通過產生短鏈脂肪酸(SCFA)來誘導輔助T細胞(Th)17細胞和控制著腸道固有層中Th17細胞的數量[26]。
2.選聘信息平臺建設有利于優秀職業經理人的合理流動(使用)及信用體系的建立。有了被各方信任的職業經理人信息庫,企業可以從中獲得自己需要的職業經理人的真實信息,經理人不誠信行為必然被受到挑戰,不敢隨意做出損害企業或社會的事件。同時企業也必須建立起誠信的形象,才能吸引優秀的職業經理人加入。這樣用人雙方都必須維護自己的信用,才能獲得更好的發展,良好的信用體系才能被建立。
詳細的構建企業年度資金制度,結合企業此年內企業發展方向,收益分配制度、員工薪資待遇制度等實行項目決策,正確掌握企業的發展的經濟狀況。通過企業在市場上的發展和內部發展形式,將企業的融資方向,準則,方法等進行明確的計劃。在實施過程中對可能出現的風險和融資成本進行預算估計,制定融資方案,對于涉及金額大的融資制度還需要進行可執行性的報告。
研究人員通過使用T1DM大鼠16S rRNA基因序列的功能預測顯示,主要集中在以碳水化合物代謝、氨基酸代謝、核苷酸代謝、能量代謝、脂質代謝等為主要代謝途徑中[27],這與本研究T1DM小鼠16S rRNA基因功能預測結果(集中氨基酸代謝、糖代謝及核苷酸代謝為主的代謝途徑中)一致,符合T1DM的代謝機制。
(1)該水源地歷年變化分析得出氨氮、總磷等水質指標有逐年好轉的趨勢,但是COD存在一定的水質惡化風險。
本研究結果顯示,B6和FVB兩組T1DM小鼠的腸道菌群的Alpha多樣性和豐富度相同,但是腸道菌群的組成及比例不盡相同,為兩模型在T1DM相關腸道菌群研究中的進一步應用提供了背景數據。

