湘西酸肉中降解亞硝酸鹽菌種的篩選與鑒定
于 杜,周錦悅,陳圓圓,劉 鑫,瞿朝霞,唐珊珊
(1.懷化學院,民族藥用植物資源研究與利用湖南省重點實驗室,湘西藥用植物與民族植物學湖南省高校重點實驗室,湖南 懷化 418008;2.湖南省農業信息與工程研究所,湖南 長沙 410125)
硝酸鹽和亞硝酸鹽是自然界中最為普遍的含氮化合物[1]。硝酸鹽可在微生物作用下還原為亞硝酸鹽,其外觀和味道與食鹽相似,被允許以有限的量用作肉制品著色劑。但亞硝酸鹽對人體有危害,一次攝入0.3~0.5 g 亞硝酸鹽即可中毒,一次攝入量達3 g 就可致命[2];同時,亞硝酸鹽還可直接造成水產養殖動物病害或死亡[3-4]。湘西酸肉是湖南西部少數民族自治州傳承下來的風味佳肴,其生產過程中,亞硝酸鹽含量會隨著發酵天數的增加呈S 形曲線變化。大量研究證實,湘西酸肉中亞硝酸鹽出現降低拐點的原因可能與其富含多種益生菌有關。
在湘西酸肉或者其同類產品泡菜中,有降亞硝酸鹽能力且活性較強的就是乳酸菌。張曉娟等[5]在無菌條件下用生理鹽水對來自成都和溫江的泡菜汁樣品進行梯度稀釋,從中分離出亞硝酸鹽降解能力強、產酸量高、耐酸耐鹽的菌株,經鑒定為植物乳桿菌。劉笑笑等[6]從具有民族特色的延邊朝鮮族地區采集24 份傳統發酵櫻菜,從中分離篩選具有降解亞硝酸鹽功能的菌株,通過形態觀察、生理生化試驗和16S rRNA 序列分析進行鑒定,獲得1 株具有降解亞硝酸鹽功能的腸膜明串珠菌(Leuconostocmesenteroides)。Fu 等[7]從水產養殖魚塘污泥中分離出一株能有效降解亞硝酸鹽的施氏假單胞菌,該菌在亞硝酸鹽混合溶液中連續馴化后,其亞硝酸鹽氮還原能力顯著提高。曹海鵬等[8]從養殖污泥中分離篩選了一株優良的亞硝酸鹽降解菌YX01,被鑒定為解淀粉芽孢桿菌(Bacillus amyloliquefaciens)。陳曦等[9]從貴州自然發酵的酸肉中分離出19 株乳酸菌,在MRS 培養基中篩選出降亞硝酸鹽能力最強的3 株乳酸菌,經鑒定3 株乳酸菌分別為植物乳桿菌CMRC 3、戊糖片球菌CMRC 7 和植物乳桿菌CMRC 19。王會聰等[10]從水產養殖污泥中分離篩選了一株優良的亞硝酸鹽降解菌AQ-3,其濃度為1.0×107CFU/mL 時對50 mg/L 亞硝酸鹽的去除率高達99.47%,該菌株被鑒定為鮑曼氏不動桿菌(Acinetobacter baumannii)。綜上所述,乳桿菌、腸膜明串珠菌、假單胞菌、芽孢桿菌、片球菌和不動桿菌等對食品中殘留的亞硝酸鹽都有比較明顯的去除效果。
基于前人的研究結果,筆者以亞硝酸鹽降解率為指標,對從湘西酸肉中分離出的若干菌種進行初篩和復篩,獲得可高效降解亞硝酸鹽的優勢菌種,并對其進行形態學、分子生物學鑒定,為生產降解亞硝酸鹽的發酵劑提供原料。
1 材料與方法
1.1 試驗材料
供試材料:新鮮五花肉,鹽,糯米粉。試驗設備:無菌水,三角瓶,MRS 固、液培養基,恒溫箱,顯微鏡等。
1.2 試驗方法
1.2.1 酸肉制作 取肥、瘦相間的新鮮五花肉300 g,洗凈瀝水,切成一指寬的薄塊,加入30 g 鹽腌制4 h,加入充足的糯米粉拌勻,裝入壇中密封,放置在陰涼干燥處自然發酵14 d 即制作完成。
1.2.2 菌種的分離純化 (1)菌株的富集培養。稱取10 g 湘西酸肉,剪碎后加入到盛有90 mL 無菌水的三角瓶中,將無菌水和酸肉混合均勻后,吸取1 mL 的混合液體加到MRS 液體培養基中,在37℃下培養48 h。(2)梯度稀釋。從培養基中取1 mL 液體逐步稀釋成10-2、10-3、10-4、10-5、10-6,每個釋倍數取0.1 mL 添加至MRS 固體培養基上,在37℃溫度下培養48 h。(3)菌株的分離純化與鏡檢。從顏色、大小、粗糙程度等方面挑選典型的菌株,觀察其形態,反復劃線、分離純化獲得純化菌株,再對分離純化后的菌株進行革蘭氏染色,顯微鏡下觀察其形態并記錄結果。
1.2.3 降解高亞硝酸鹽菌株的篩選 將經過多次純化的菌株接種于MRS 液體培養基中,于37℃條件下培養18 h,取培養好的菌液按4%的體積分數接種于含有200 mg/L NaNO2的100 mL MRS 液體培養基中,在37℃下培養48 h,通過鹽酸萘乙二胺顯色法觀察各菌株培養液的顏色變化,選出顏色較淺的菌株,再進行復篩[11]。復篩菌株按1%(體積分數)接種于100 mL 含有300 mg/L NaNO2的MRS 液體培養基中,在37℃下培養48 h 之后測定培養液中的NaNO2含量,計算菌株的亞硝酸鹽降解率,然后選出對亞硝酸鹽有較強降解能力的菌株[12]。復篩后的菌株于37℃條件下進行搖瓶發酵,增加菌株濃度后妥善低溫保存[13]。
1.2.4 指標檢測 (1)亞硝酸鹽含量測定。參照GB/T 5009.33—2016 通過鹽酸萘乙二胺分光光度法測定培養液中亞硝酸鹽的含量。(2)標準曲線制作。用容量瓶配置好5.0 mg/mL 的亞硝酸鈉標準液。吸取0.00、0.50、1.00、1.50、2.00、3.00、4.00 mL 亞硝酸鈉標準液,依次加入到50 mL 的比色管中;每個比色管中加入2 mL 對氨基苯磺酸,輕微搖晃混勻后靜置3~5 min;再加入1 mL 鹽酸萘乙二胺,添加水至刻度線,輕晃搖勻,暗處靜置15 min;將配置好的溶液倒入1 cm 玻璃比色皿中,用零號管調節零點,測量538 nm 處吸光度。根據吸光度值(y)和對應的亞硝酸鈉溶液濃度(x)繪制標準曲線(圖1)。
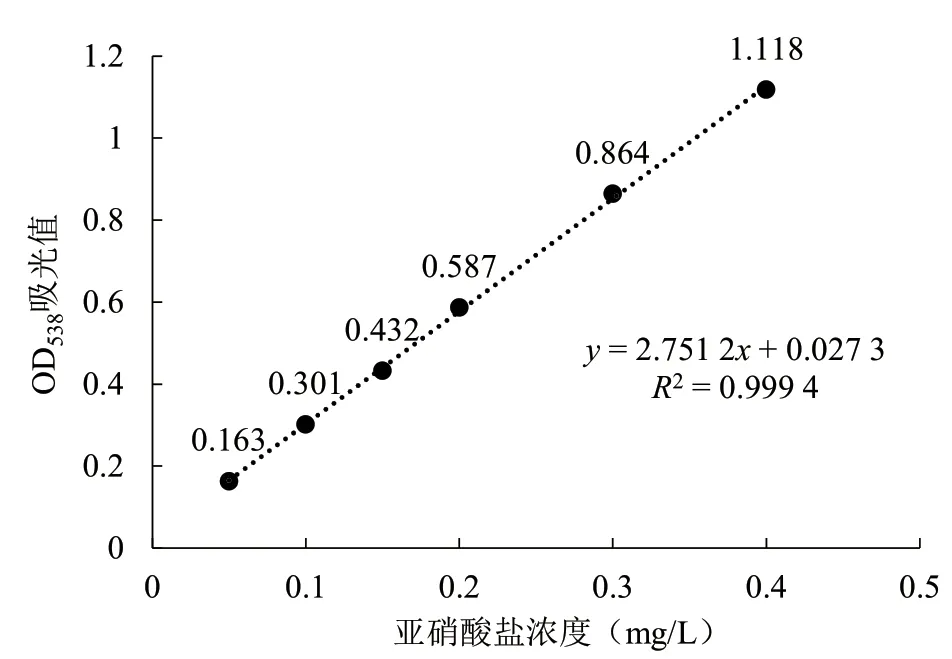
圖1 亞硝酸鹽標準曲線
1.2.5 菌種鑒定 提取復篩所得菌株的DNA 進行PCR 擴增[14],然后進行測序,將各菌株DNA 序列在NCBI 網站上進行blastn 比對,確定近似菌株。用MEGA 軟件構建復篩菌株與近似菌株的16S rDNA系統發育樹,根據復篩菌株在其屬類中的親緣關系確定菌種名稱。
1.2.6 降亞硝酸鹽菌株發酵條件優化 以菌1 為供試菌株,以發酵液在538 nm 處的吸光度值為考察指標,通過單因素試驗從亞硝酸鹽添加量(100、200、300、400、500 mg/L)、pH 值(3、4、5、6、7)、接種量(1%、2%、3%、4%、5%)3 個方面對發酵條件進行優化,固定條件:亞硝酸鹽濃度為300 mg/L,pH 值為6.5,接種量為1%,37℃下培養48 h,檢測各處理菌液的OD538值,得出菌液中亞硝酸的濃度,再計算亞硝酸鹽降解率。每個處理3 次重復。
1.2.7 不同亞硝酸鹽對菌液中生物量的影響 配置亞硝酸鹽濃度為100、200、300、400、500 mg/L 的培養基,接入1 %菌種1 菌懸液,37℃下培養48 h,檢測菌液的OD600值,測定菌液中生物量的濃度,根據菌種在不同亞硝酸鹽濃度下的生物量變化判斷其是否耐受亞硝酸鹽。
2 結果與分析
2.1 湘西酸肉中分離所得微生物的形態特征
將從酸肉中分離得到的菌株進行純化后,得到了5 株在MRS 瓊脂培養基上生長良好的菌株,將獲得的5 株菌編號為1~5,菌株形態見表1,5 株菌的菌落大多呈光滑圓形,基本呈白色,都有凸起存在且不透明。在顯微鏡下,從酸肉中分離得到的5 株菌株均符合一般微生物形態特征,都沒有假菌絲,細胞形態有橢圓狀、球狀、桿狀。
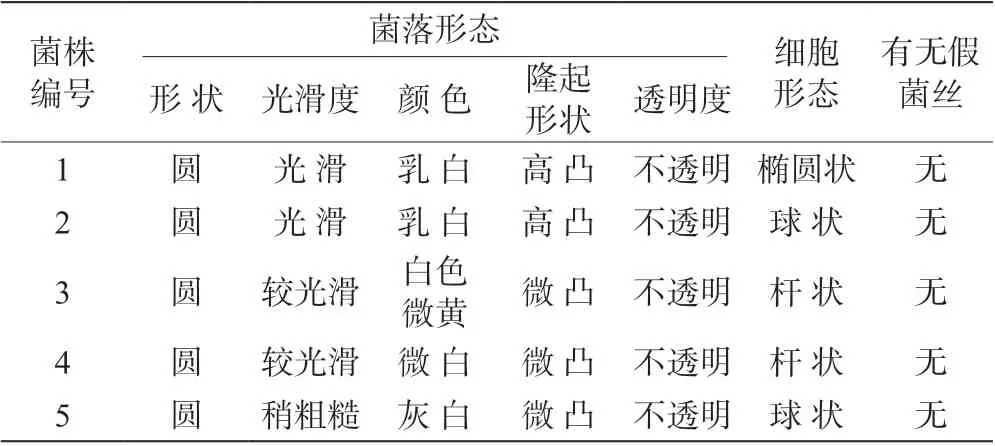
表1 湘西酸肉中分離所得微生物的形態
2.2 初篩結果
利用鹽酸萘乙二胺顯色法對5 種菌株降亞硝酸鹽能力進行初篩,結果如圖2 所示,有4 個試管溶液顏色變化明顯,說明這4 個菌株的降亞硝酸鹽能力較強,而5 號試管(圖2 中從左到右數第5 管)與空白對照顏色變化不明顯,說明該菌株降解亞硝酸鹽的能力不強。選擇降亞硝酸鹽能力較強的4 個菌株進行復篩。

圖2 湘西酸肉中降解亞硝酸鹽菌株的初篩結果
2.3 復篩結果
將初篩出的4 株菌株接種于100 mL 含300 mg/L NaNO2的MRS 液體培養基中,37℃條件下培養48 h后測定培養液中NaNO2含量,并計算各菌株的亞硝酸鹽降解率,結果如表2 所示,菌1 降解亞硝酸鹽的能力最強,能達到71.06%,其余3 種菌也有較強的亞硝酸鹽降解能力,有一定的研究價值。
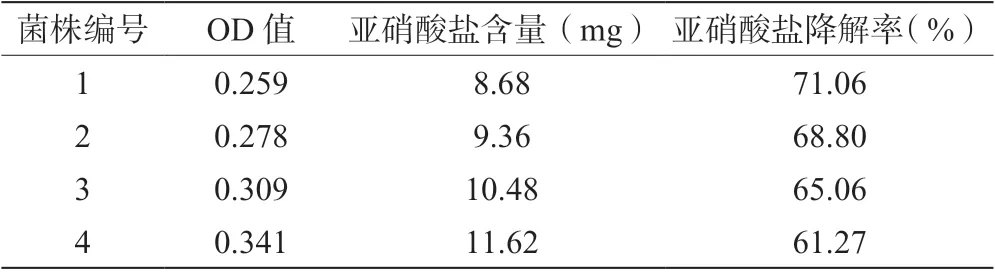
表2 湘西酸肉中降解亞硝酸鹽菌株的復篩結果
2.4 降解亞硝酸鹽菌株的鑒定結果
提取4 個菌株的DNA 進行PCR 擴增,其中菌1、菌2 擴增的是ITS序列,菌3、菌4 擴增的是16S rDNA 序列;所得條帶經電泳檢測,結果如圖3 所示,4 個菌種均顯示出明亮無雜峰的條帶,說明菌種純化效果好,菌種純度高。

圖3 復篩所得菌株的DNA 擴增結果
切取目的條帶測序,獲得4 個菌株的部分基因序列,用ContigExpress 拼接測序結果,并去除兩端不準的部分,再將拼接好的序列在NCBI 數據庫(blast.ncbi.nlm.nih.gov)中進行比對分析,結果見表3。
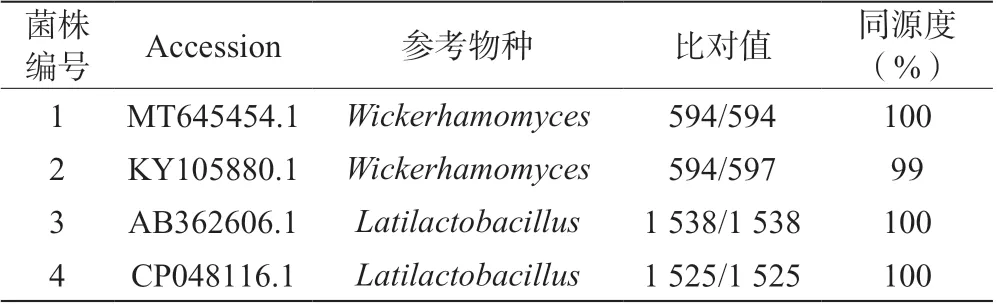
表3 菌株基因比對結果
菌1、菌2 的ITS區段為5 000 bp 的DNA 片段。將拼接好的序列上傳至Genbank 數據庫中,獲得登錄號為MT645454.1 和KY105880.1,將該序列進行BLAST,顯示菌1、菌2 與GenBank 中已登錄的威克漢姆酵母(Wickerhamomyces)序列的同源性分別為100%和99%,從而在分子生物學的水平上說明了菌1、菌2 為Wickerhamomycessp.。為了進一步比較該分離菌與威克漢姆酵母的親緣關系,與數據庫中其他酵母屬的菌株構建的系統進化樹如圖4 和圖5 所示,菌1、菌2 與已報道的W.anomalus有90%以上的相似度,聚合在一起。因此,結合菌1、菌2 的形態學特征以及基于ITS序列的系統發育樹可知,菌1 和菌2 均為Wickerhamomyces anomalus。
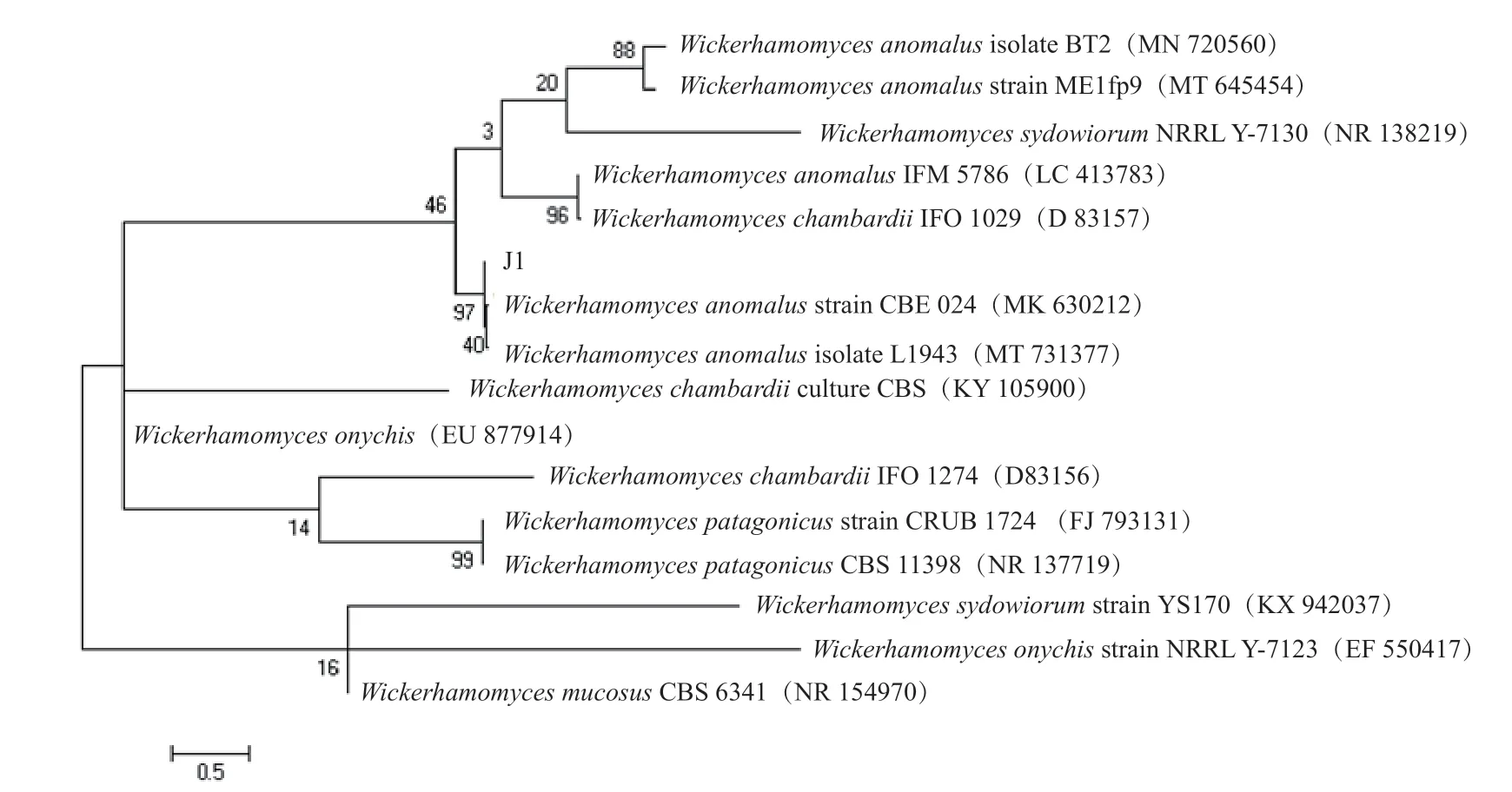
圖4 基于ITS 序列的菌種1 系統發育樹
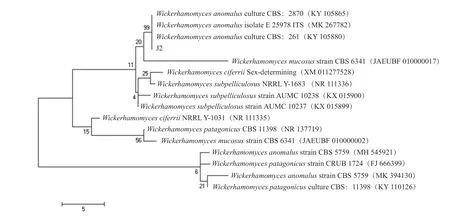
圖5 基于ITS 序列的菌種2 系統發育樹
菌3、 菌4 的16S rDNA 區 段 為5 000 bp 的DNA 片段。將拼接好的序列上傳至Genbank 數據庫中,獲得登錄號為AB362606.1 和CP048116.1,將該序列進行BLAST,顯示該菌株與GenBank 中已登錄的乳酸菌(Latilactobacillus)序列同源性都為100%,從而在分子生物學水平上說明獲得的菌株為Latilactobacillussp.。為了進一步比較該分離菌與乳酸菌的親緣關系,與數據庫中其他乳酸菌屬的菌株構建的系統進化樹如圖6 和圖7 所示,菌3、菌4 與已報道的L.sakei有90%以上的相似度,聚合在一起。因此,結合菌3、菌4 的形態學特征以及基于16S rDNA 序列的系統發育樹可知,菌3 和菌4 均為Latilactobacillus sakei。
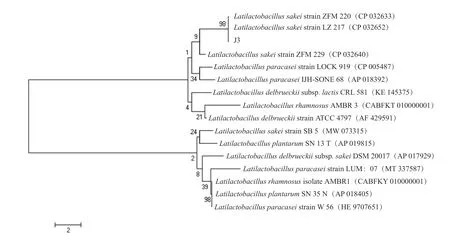
圖6 基于16S rDNA 序列的菌種3 系統發育樹
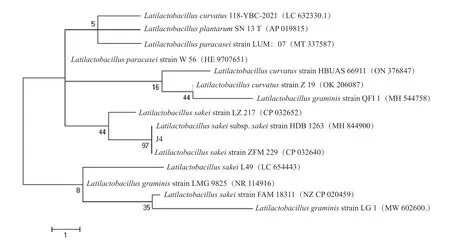
圖7 基于16S rDNA 序列的菌種4 系統發育樹
2.5 菌1 發酵條件的優化結果
2.5.1 亞硝酸鹽含量 從圖8 可以看出,在pH 值、接種量、培養時間不變的情況下,隨著亞硝酸鹽含量的增加,菌1 的亞硝酸鹽降解率不斷升高,說明菌1 的亞硝酸鹽降解能力不隨亞硝酸鹽濃度的增加而減弱,反而有所提升,表明菌1 的亞硝酸鹽降解力強。
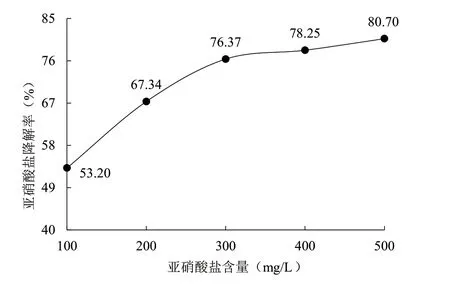
圖8 亞硝酸鹽含量對菌株1 亞硝酸鹽降解能力的影響
2.5.2 pH 值 從圖9 可看出,在接種量、亞硝酸鹽濃度、培養時間不變的情況下,隨著pH 值的提高,菌1 的亞硝酸鹽降解率呈現出先升高后降低的變化趨勢,pH 值為4 時,菌1 的亞硝酸鹽降解率最高,達到了78.35%,表明菌1 在pH 值為4 時活性最高,對亞硝酸鹽分解效率最大。
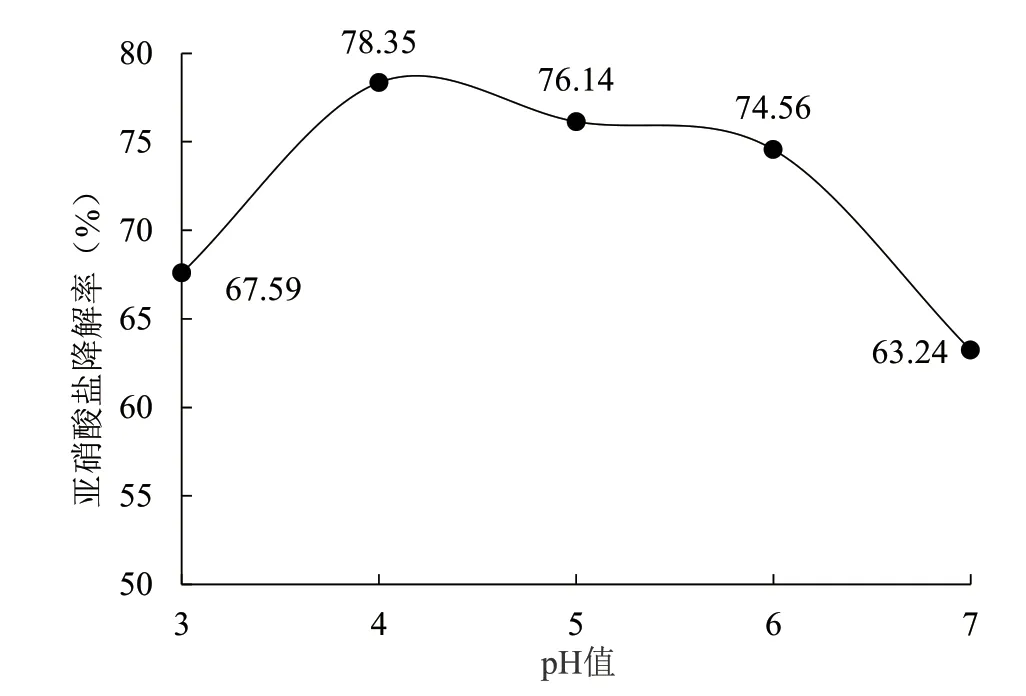
圖9 pH 值對菌株1 亞硝酸鹽降解能力的影響
2.5.3 接種量 由圖10 可知,在pH 值、亞硝酸鹽濃度、培養時間不變的情況下,隨著接種量的提高,菌1 的亞硝酸鹽降解率有所升高。接種量為4%時,菌1 的亞硝酸鹽降解率最大,達到82.74%。當接種量小于4%時,細胞初始濃度較低,需要一定時間來生長繁殖,導致亞硝酸鹽降解率低;當接種量大于4%時,菌種更快地達到種群密度的最高點,減少雜菌的生長機會,但接種量過大會更快產生競爭抑制,使菌株的種間競爭加劇,從而降低亞硝酸鹽降解率。
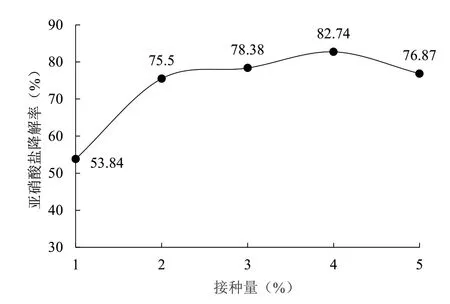
圖10 接種量對菌株1 亞硝酸鹽降解能力的影響
2.6 亞硝酸鹽濃度對菌液中生物量的影響
在溫度、接種量、pH 值等條件一致的情況下,培養基中亞硝酸鹽濃度對菌1 生物量的影響如圖11所示,隨著亞硝酸鹽濃度的增加,菌1 的生物量成下降趨勢,說明亞硝酸鹽可以抑制菌1 的生長,并且隨著亞硝酸鹽濃度的升高,對菌1 生長的抑制作用越強,但是降幅不大,說明該菌種耐受亞硝酸鹽。
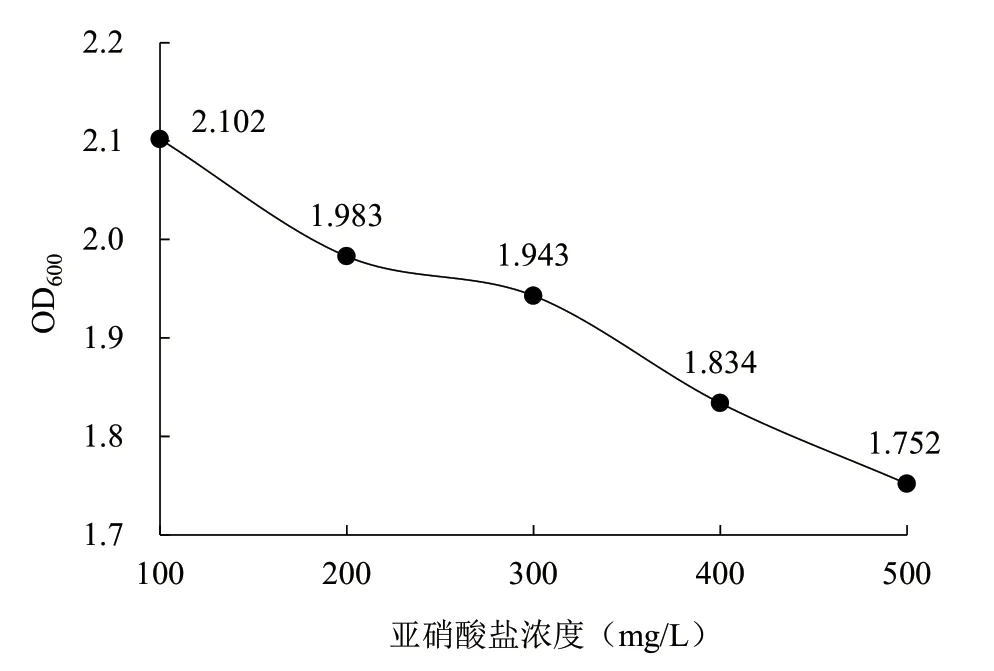
圖11 亞硝酸鹽濃度對菌株1 生物量的影響
3 結 論
從自制湘西酸肉中分離純化出了4 株亞硝酸鹽降解能力強的菌株,其中菌1 和菌2 在培養過程中散發出明顯酒精氣味,且菌落較大,顯微鏡下呈圓球狀;菌3 和菌4 散發出濃烈的酸味,且菌落較小,顯微鏡下呈桿狀。研究中發現這4 株菌株均有一定降解亞硝酸鹽的能力,其中菌1 的降解能力最強,在300 mg/L 的亞硝酸鹽發酵液中培養48 h 后,亞硝酸鹽的降解率達到70%以上。對篩選出來的4 種菌進行分子生物學鑒定,確定菌1 和菌2 屬于酵母菌,菌3 和菌4 屬于乳酸菌,分別構建基于IST和16S rDNA 序列的系統發育樹,發現菌1 和菌2 與Wickerhamomyces anomalus的親緣關系最近,歸類為異常威克漢姆酵母;菌3 和菌4 與Lactobacillus sakei的親緣關系最近,確認為清酒乳桿菌。
試驗還以菌1 為研究對象,對其發酵條件進行了優化,結果表明,菌1 在接種量為4%,pH 值為4 時,對亞硝酸鹽的降解率達到最大值;菌1 對亞硝酸鹽的降解率隨著亞硝酸鹽含量的增加而提升,但其生物量隨著亞硝酸鹽濃度的增加而減少,但是降幅較小,說明該酵母菌具有較強的高亞硝酸鹽耐性,且對亞硝酸鹽的降解能力較強。
目前,有關降解亞硝酸鹽菌株的研究中,關于酵母菌的研究報道尚不多見,該研究結果為以后酸肉、泡菜等發酵食品的菌種選擇提供了參考,也為生產廠家提供了明確的菌種資源。

