化學反應速率和化學平衡考情解讀
■廣東省佛山市高明區(qū)教師發(fā)展中心 雷范軍
目前我國高考命題理念已經(jīng)由“知識立意、能力立意”轉(zhuǎn)向“價值引領、素養(yǎng)導向、能力為重、知識為基”,因此化學反應方向、限度與速率的復習需要我們制定精準的復習策略,系統(tǒng)建構化學反應速率、可逆反應與化學平衡狀態(tài)、化學平衡常數(shù)、化學平衡移動、化學反應自發(fā)進行的方向、工業(yè)生產(chǎn)中反應條件的控制等必備知識,通過模型構建、模型解釋、模型預測、模型推理等活動培養(yǎng)我們的學科思維能力,能夠用微觀本質(zhì)解釋宏觀現(xiàn)象,落實科學態(tài)度、社會責任等素養(yǎng)的發(fā)展。
一、知識點重現(xiàn)
(一)化學反應速率。
1.概念理解。
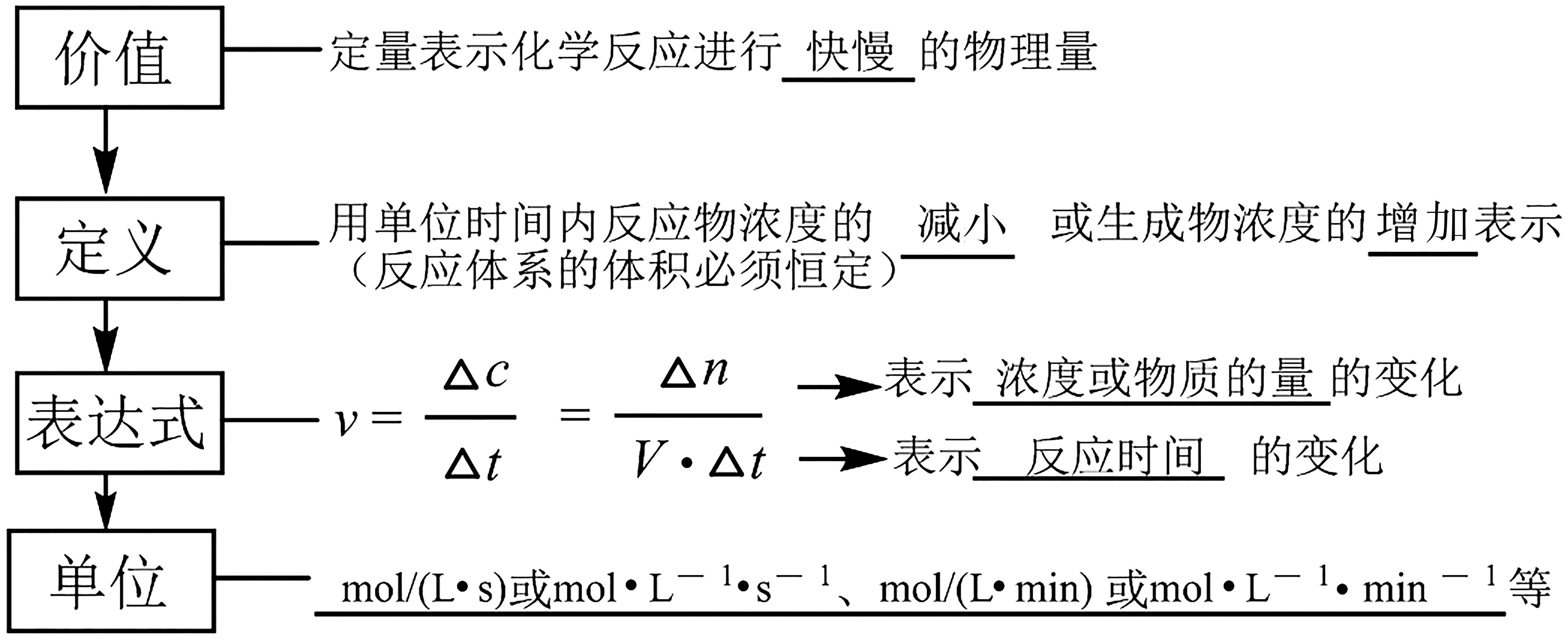
2.注意事項。
(2)固體或純液體(不是溶液),其濃度可視為常數(shù),因此對于有純液體或固體參加的反應一般不用其表示反應速率。
(3)隨著反應的進行,反應物濃度將逐漸減小,v會逐漸減慢。因此化學反應速率通常是指某一段時間內(nèi)的平均反應速率,而不是瞬時反應速率,沒有負值,均取正值。
(4)比較化學反應速率大小的前提是同一反應、同一物質(zhì)、同一單位,步驟是:①變換單位(將各化學反應速率的單位統(tǒng)一);②轉(zhuǎn)換物質(zhì)(將各化學反應速率轉(zhuǎn)換成用同一物質(zhì)表示的化學反應速率);③比較大小(各物質(zhì)的速率除以相應的化學計量數(shù),數(shù)大的速率快)。
(6)實驗測定化學反應速率時,常用物理量:①氣體的體積、體系的壓強、顏色的深淺、光的吸收、導電能力等(用精密儀器);②測反應時間(用秒表或計時器)。
3.利用活化能與碰撞理論解釋外界條件對化學反應速率的影響。
(1)概念理解。
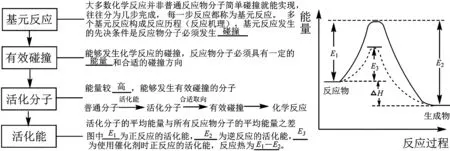
(2)注意事項。
①決速反應:活化能最大的反應或速率最慢的反應。決速濃度:最慢反應中反應物的濃度決定總反應的反應速率。
②活化分子的百分數(shù)越大,單位時間內(nèi)有效碰撞的次數(shù)越多,化學反應速率越快。
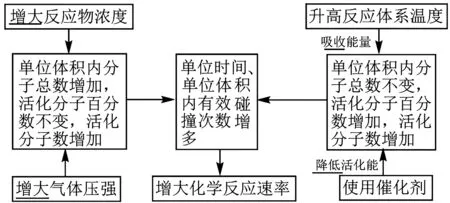
③其他條件相同時,僅改變一個變量對化學反應速率的影響規(guī)律:
(二)化學平衡。
1.概念理解。
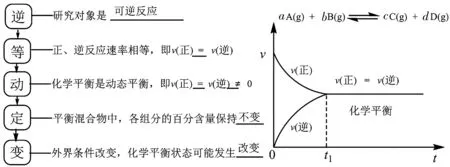
2.注意事項。
(1)化學平衡狀態(tài)是在一定條件下可逆反應所能達到的最大程度,即該反應進行的限度,化學反應的限度決定了反應物在該條件下的最大轉(zhuǎn)化率。
(2)判斷達到化學平衡的標志:①用速率判斷,先找出正、逆反應速率,再看物質(zhì),若同一物質(zhì),則正逆速率相等,若不同物質(zhì),則速率之比=系數(shù)之比;②用宏觀標志,變量(反應前后發(fā)生改變的物理量等)不變能夠說明已達化學平衡,不變量不變不能說明平衡;③限度標志,圖像中的極限點(即平衡點,此時生成物的產(chǎn)率最大,百分含量最大,或反應物的轉(zhuǎn)化率最大,百分含量最小),極限點前(非平衡點,受反應速率控制,加催化劑,反應物的轉(zhuǎn)化率變大),極限點后(新平衡點,受平衡控制,加催化劑,反應物的轉(zhuǎn)化率不變)。
(3)化學平衡的計算模式及解題思路。
①計算模式——三行數(shù)據(jù)法。
②解題思路:先巧設未知數(shù)(具體題目要具體分析,靈活設立,一般設某物質(zhì)的轉(zhuǎn)化量為x),再確定三個量(根據(jù)反應物、生成物及變化量的三者關系代入未知數(shù)確定平衡體系中各物質(zhì)的起始量、變化量、平衡量,并按①中“模式”計算),然后解決題設問題(明確“始”“變”“平”三行數(shù)據(jù),根據(jù)相應關系求平衡時某成分的濃度、反應物轉(zhuǎn)化率等,得出題目答案)。
(4)化學平衡常數(shù)。

(5)速率方程、速率常數(shù)和平衡常數(shù)的關系。
③升溫對k正、k逆的影響。放熱反應:K值減小,k正值增大,k逆值增大,k逆變化更大;吸熱反應:K值增大,k正值增大,k逆值增大,k正變化更大。
3.外界條件對化學平衡的影響。
(1)原理理解。

(2)影響因素及規(guī)律。
①濃度:在其他條件不變的情況下,增大反應物的濃度或減小生成物的濃度,都可以使平衡向正反應方向移動。增加固體或純液體的量,平衡不移動;改變的濃度必須是真正參與反應的物質(zhì)的濃度,否則平衡不移動;在溶液中進行的反應,稀釋溶液,平衡向方程式中化學計量數(shù)之和增大的方向移動。工業(yè)生產(chǎn)中,適當增加廉價反應物的濃度,可提高較高價格原料的轉(zhuǎn)化率,降低成本,其本身的轉(zhuǎn)化率降低 。
②壓強:在其他條件不變的情況下,增大壓強,平衡向氣體體積減小的反應方向移動;減小壓強,平衡向氣體體積增大的反應方向移動。只適用于有氣體參與的反應;壓強對平衡的影響實際上就是濃度對平衡的影響,只有當這些“改變”能改變反應物或生成物的濃度時,平衡才能移動;恒溫恒容條件下,充入無關氣體,平衡不移動,因為原平衡體系總壓強增大→體系中各組分的濃度不變→平衡不移動;恒溫恒壓條件下,充入無關氣體,平衡發(fā)生移動,因為原平衡體系容器容積增大,各反應氣體的分壓減小→體系中各組分的濃度同倍數(shù)減小;對反應前后氣體體積不變的反應,改變壓強,平衡不移動;溶液稀釋或濃縮與氣體減壓或增壓的化學平衡移動規(guī)律相似;同等程度改變反應混合物中各物質(zhì)的濃度時,可視為壓強的改變。
③溫度:在其他條件不變的情況下,升高溫度,平衡向吸熱反應的方向移動;降低溫度,平衡向放熱反應的方向移動。
④催化劑:催化劑同等程度地改變正、逆反應速率,所以平衡不受催化劑的影響,不移動。但是,使用催化劑能改變反應達到平衡所需的時間。
(3)化學平衡圖像。
勒夏特列原理(化學平衡移動原理):如果改變影響平衡的條件之一(如溫度、壓強及參加反應的物質(zhì)的濃度),平衡就向著能夠減弱這種改變的方向移動。
①如圖1,百分含量(或轉(zhuǎn)化率)-時間-溫度(或壓強)圖像。
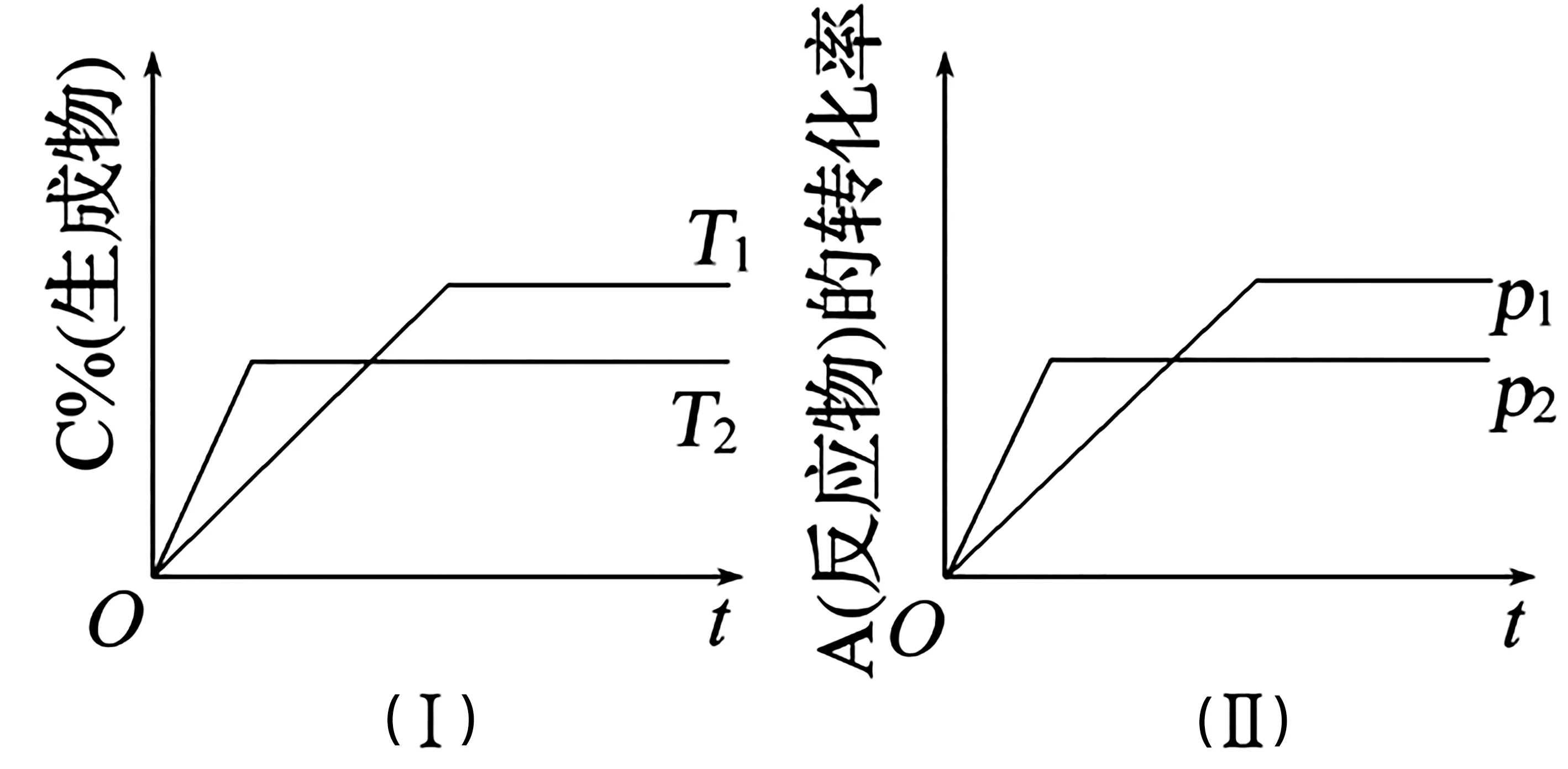
圖1
解題原則——“先拐先平條件高”:先出現(xiàn)拐點的反應先達到平衡,反應條件高,即溫度高、壓強大;圖1(Ⅰ)表示T2>T1,生成物的百分含量降低,說明正反應是放熱反應,溫度升高,平衡逆向移動;圖1(Ⅱ)表示p2>p1,A 的轉(zhuǎn)化率減小,說明正反應是氣體總體積增大的反應,壓強增大,平衡逆向移動。
②如圖2,為百分含量(或轉(zhuǎn)化率)與壓強、溫度的關系圖像。
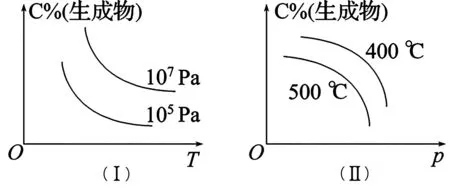
圖2
解題原則——“定一議二”:如圖2(Ⅰ)中確定壓強為105Pa或107Pa,則生成物C的百分含量隨溫度T的升高而逐漸減小,說明正反應是放熱反應;再確定溫度T不變,作橫坐標的垂線,與壓強線出現(xiàn)兩個交點,分析生成物C 的百分含量隨壓強p的變化可以發(fā)現(xiàn),壓強增大,生成物C 的百分含量增大,說明正反應是氣體總體積減小的反應。
(三)化學反應自發(fā)進行方向的判據(jù)。
1.綜合焓變和熵變判斷反應是否自發(fā)進行。

焓變 熵變自由能變化學反應能否自發(fā)進行ΔH<0 ΔS>0 ΔG=ΔH-TΔS<0任何溫度都能自發(fā)進行ΔH>0 ΔS<0 ΔG=ΔH-TΔS>0不能自發(fā)進行ΔH<0 ΔS<0 ΔG=ΔH-TΔS<0 較低溫度自發(fā)進行ΔH>0 ΔS>0 ΔG=ΔH-TΔS<0高溫時自發(fā)進行
2.溫度對反應方向的影響。

二、考點例析
1.化學反應速率的計算及外界條件對其影響。
例1在相同條件下研究催化劑Ⅰ、Ⅱ?qū)Ψ磻猉→2Y 的影響,各物質(zhì)濃度c隨反應時間t的部分變化曲線如下頁圖3 所示,下列說法正確的是( )。
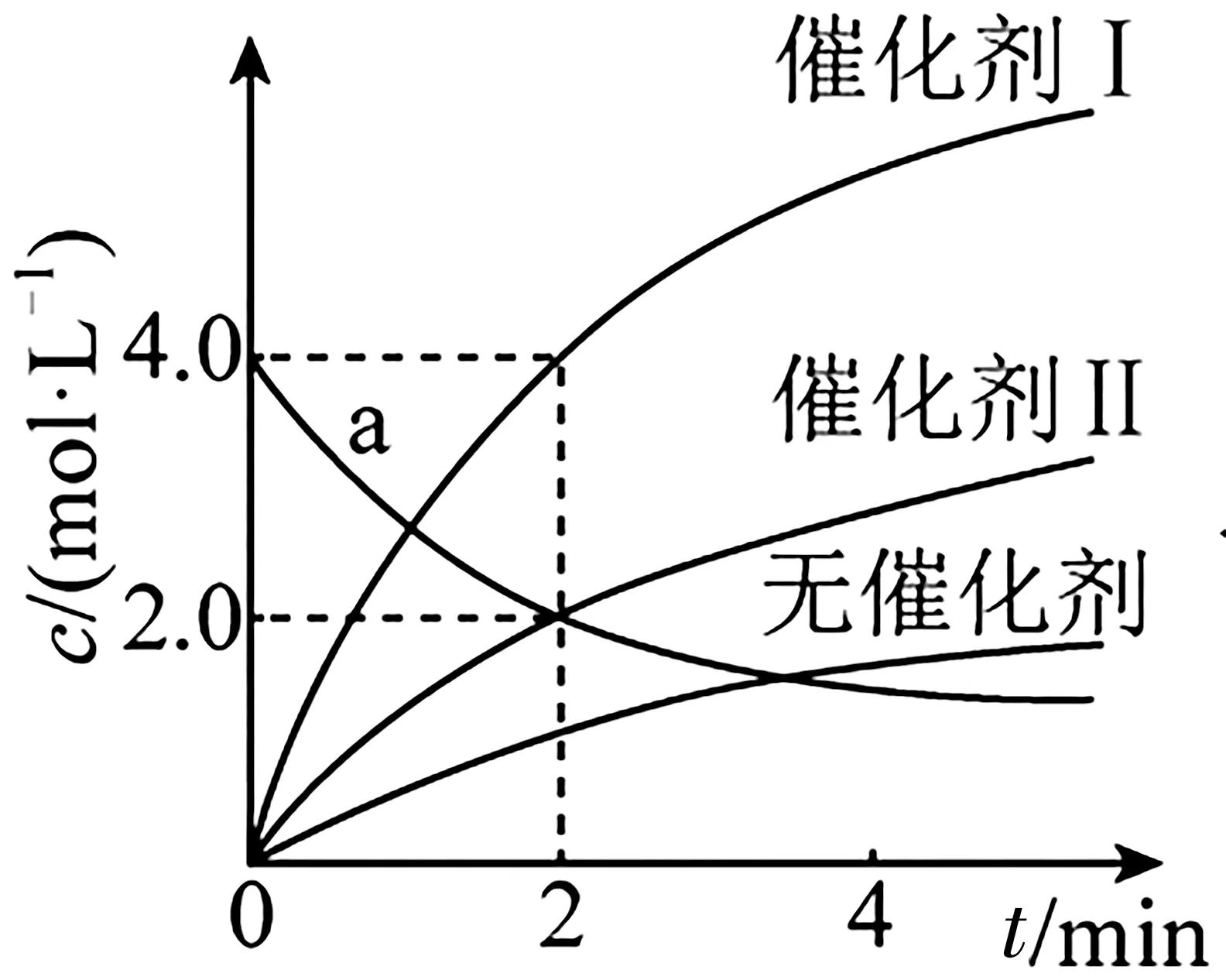
圖3
A.無催化劑時,反應不能進行
B.與催化劑Ⅰ相比,催化劑Ⅱ使反應活化能更低
C.a曲線表示使用催化劑Ⅱ時X 的濃度隨t的變化
D.使用催化劑Ⅰ時,0~2 min 內(nèi),v(X)=1.0 mol·L-1·min-1
解析:由圖可知,無催化劑時,隨反應進行,生成物濃度也在增加,說明反應也在進行,A 項錯誤。由圖可知,催化劑Ⅰ比催化劑Ⅱ催化效果好,說明催化劑Ⅰ使反應活化能更低,反應更快,B 項錯誤。由圖可知,使用催化劑Ⅱ時,在0~2 min 內(nèi)Y 的濃度變化了2.0 mol·L-1,而a曲線表示X 的濃度變化了2.0 mol·L-1,二者變化量之比不等于化學計量數(shù)之比,所以a曲線不表示使用催化劑Ⅱ時X 濃度隨時間t的變化,C 項錯誤。使用催化劑Ⅰ時,在0~2 min 內(nèi),Y 的濃度變化了4.0 mol·L-1,則=1.0 mol·L-1·min-1,D 項正確。
答案:D
點撥:催化劑的選擇性是高考中常見的問題,本題中生成物濃度曲線的斜率越大,說明活化能越低,可能改變的外界條件是使用更高效的催化劑或增大催化劑的比表面積。學習化學反應速率時,我們應扎實掌握相關的基礎知識,在訓練中不斷進行總結歸納并優(yōu)化改進解題思維模型。
2.基元反應的速率方程。
例2恒溫恒容條件下,向密閉容器中加入一定量X,發(fā)生反應的化學方程式為反應①的速率v1=k1·c(X),反應②的速率v2=k2·c(Y),式中k1、k2為速率常數(shù)。圖4(甲)為該體系中X、Y、Z濃度隨時間變化的曲線,圖4(乙)為反應①和②的曲線。下列說法錯誤的是( )。
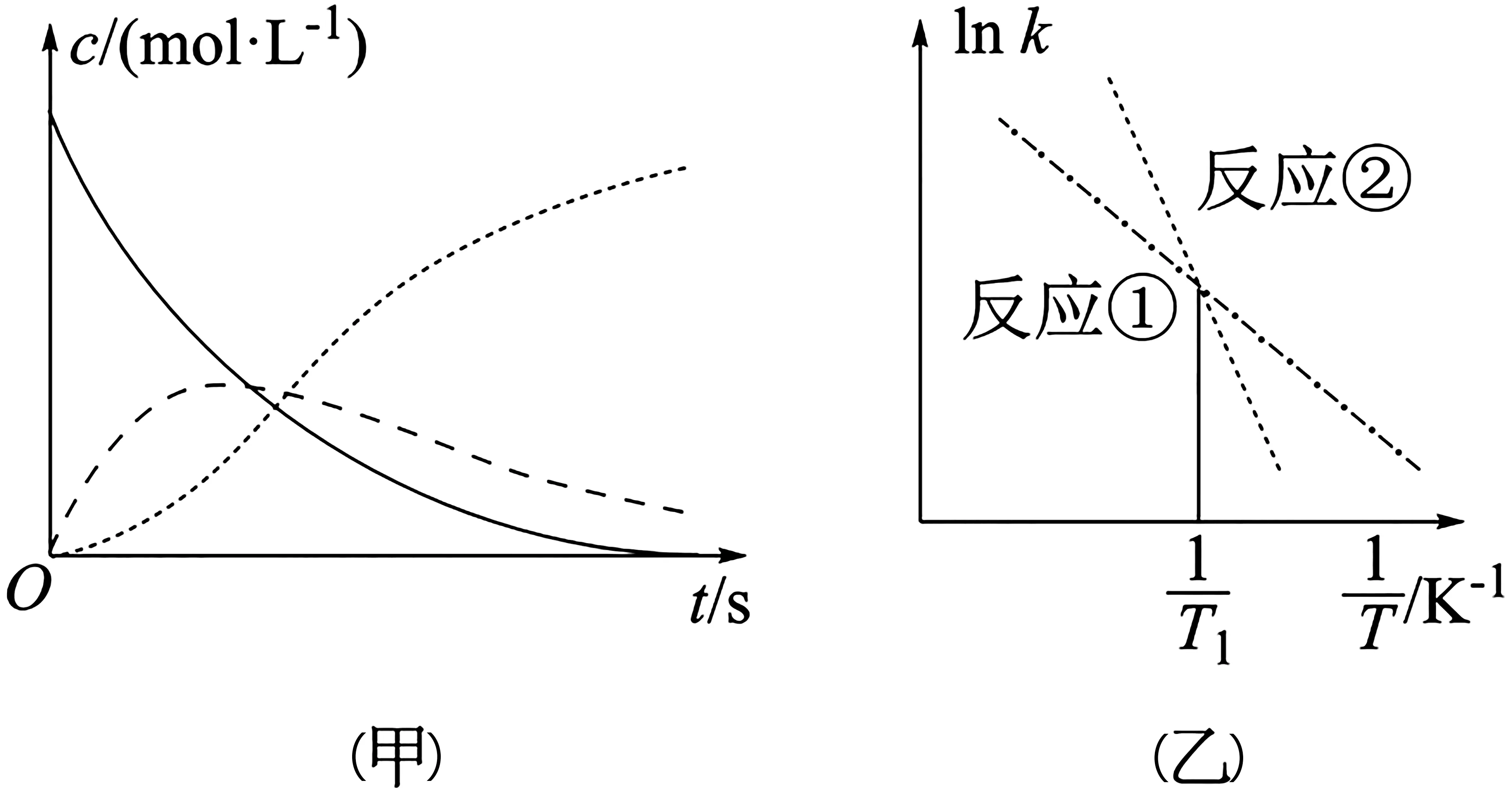
圖4
A.隨c(X)的減小,反應①②的速率均降低
B.體系中v(X)=v(Y)+v(Z)
C.欲提高Y 的產(chǎn)率,需提高反應溫度且控制反應時間
D.溫度低于T1時,總反應速率由反應②決定
解析:由圖4(甲)中的信息可知,隨c(X)的減小,c(Y) 先增大后減小,c(Z)增大,因此,反應①的速率隨c(X)的減小而減小,而反應②的速率先增大后減小,A 項錯誤。根據(jù)體系中發(fā)生的反應可知,在Y 的濃度達到最大值之前,單位時間內(nèi)X 的減少量等于Y和Z 的增加量,因此,v(X)=v(Y)+v(Z),但是,在Y 的濃度達到最大值之后,單位時間內(nèi)Z 的增加量等于Y 和X 的減少量,v(X)+v(Y)=v(Z),B項錯誤。升高溫度可以加快反應①的速率,但是反應①的速率常數(shù)隨溫度升高增大的幅度小于反應②,且反應②的速率隨著Y 的濃度的增大而增大,因此,欲提高Y 的產(chǎn)率,需提高反應溫度且控制反應時間,C 項正確。由圖4(乙)信息可知,溫度低于T1時,k1>k2,反應②為慢反應,因此,總反應速率由反應②決定,D 項正確。
答案:AB
點撥:由圖中的信息可知,濃度隨時間變化逐漸減小的是X,濃度隨時間變化逐漸增大的是Z,濃度隨時間變化先增大后減小的是Y;反應①的速率常數(shù)隨溫度升高增大的幅度小于反應②。
3.外界條件對化學平衡移動的影響。
例3某溫度下,反應在密閉容器中達到平衡,下列說法正確的是( )。
A.增大壓強,v正>v逆,平衡常數(shù)增大
B.加入催化劑,平衡時CH3CH2OH(g)的濃度增大
C.恒容下,充入一定量的H2O(g),平衡向正反應方向移動
解析:該反應是一個氣體分子數(shù)減少的反應,增大壓強可以加快化學反應速率,正反應速率增大的幅度大于逆反應的,v正>v逆,平衡向正反應方向移動,但是因為溫度不變,故平衡常數(shù)不變,A 項不正確。催化劑不影響化學平衡狀態(tài),因此,加入催化劑不影響平衡時CH3CH2OH(g)的濃度,B項不正確。恒容下,充入一定量的H2O(g),H2O(g)的濃度增大,平衡向正反應方向移動,C項正確。恒容下,充入一定量的,平衡向正反應方向移動,但是的平衡轉(zhuǎn)化率減小,D 項不正確。
答案:C
點撥:通過對矛盾雙方(正反應和逆反應)的深度剖析,能夠幫助我們理解化學反應速率與化學平衡之間的內(nèi)在聯(lián)系,認識溫度、濃度、壓強、催化劑等外界條件是通過影響反應速率從而引起平衡移動的,可避免對外界條件影響反應速率與影響平衡移動的混淆。
4.化學平衡圖像分析與評價。
例4恒容密閉容器中,BaSO4(s)+4H2(g)在不同溫度下達平衡時,各組分的物質(zhì)的量(n)如圖5所示。下列說法正確的是( )。
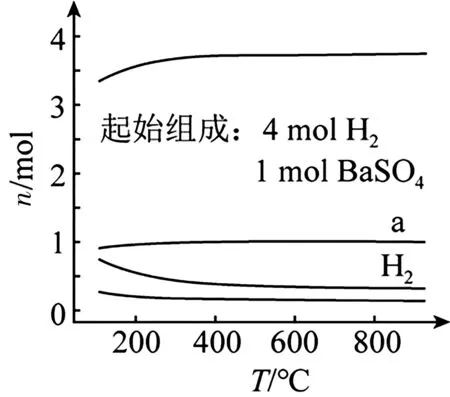
圖5
A.該反應的ΔH<0
B.a為n(H2O)隨溫度的變化曲線
C.向平衡體系中充入惰性氣體,平衡不移動
D.向平衡體系中加入BaSO4,H2的平衡轉(zhuǎn)化率增大
解析:從圖示可以看出,平衡時升高溫度,氫氣的物質(zhì)的量減少,則平衡正向移動,說明該反應的正反應是吸熱反應,即ΔH>0,A 項錯誤。從圖示可以看出,在恒容密閉容器中,隨著溫度升高,氫氣的物質(zhì)的量減少,則平衡隨著溫度升高正向移動,水蒸氣的物質(zhì)的量增加,而a曲線表示的是物質(zhì)的量不隨溫度變化而變化,B 項錯誤。容器體積固定,向容器中充入惰性氣體,沒有改變各物質(zhì)的濃度,平衡不移動,C 項正確。BaSO4是固體,向平衡體系中加入BaSO4,不能改變其濃度,因此平衡不移動,氫氣的轉(zhuǎn)化率不變,D 項錯誤。
答案:C
點撥:本題通過陌生情境下運用化學平衡移動原理分析解決真實且有挑戰(zhàn)性的問題,要求我們注重信息獲取和理解能力提升,注重問題解決思維模型的構建和高通路的遷移應用。
5.真實情境下化學反應速率和化學平衡圖表綜合題。
例5某空間站的生命保障系統(tǒng)功能之一是實現(xiàn)氧循環(huán),其中涉及反應:CO2(g)+
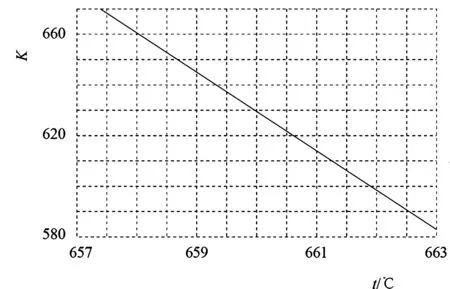
圖6
①若反應為基元反應,且反應的ΔH與活化能(Ea)的關系為|ΔH|>Ea。補充完成該反應過程的能量變化示意圖(圖7)。
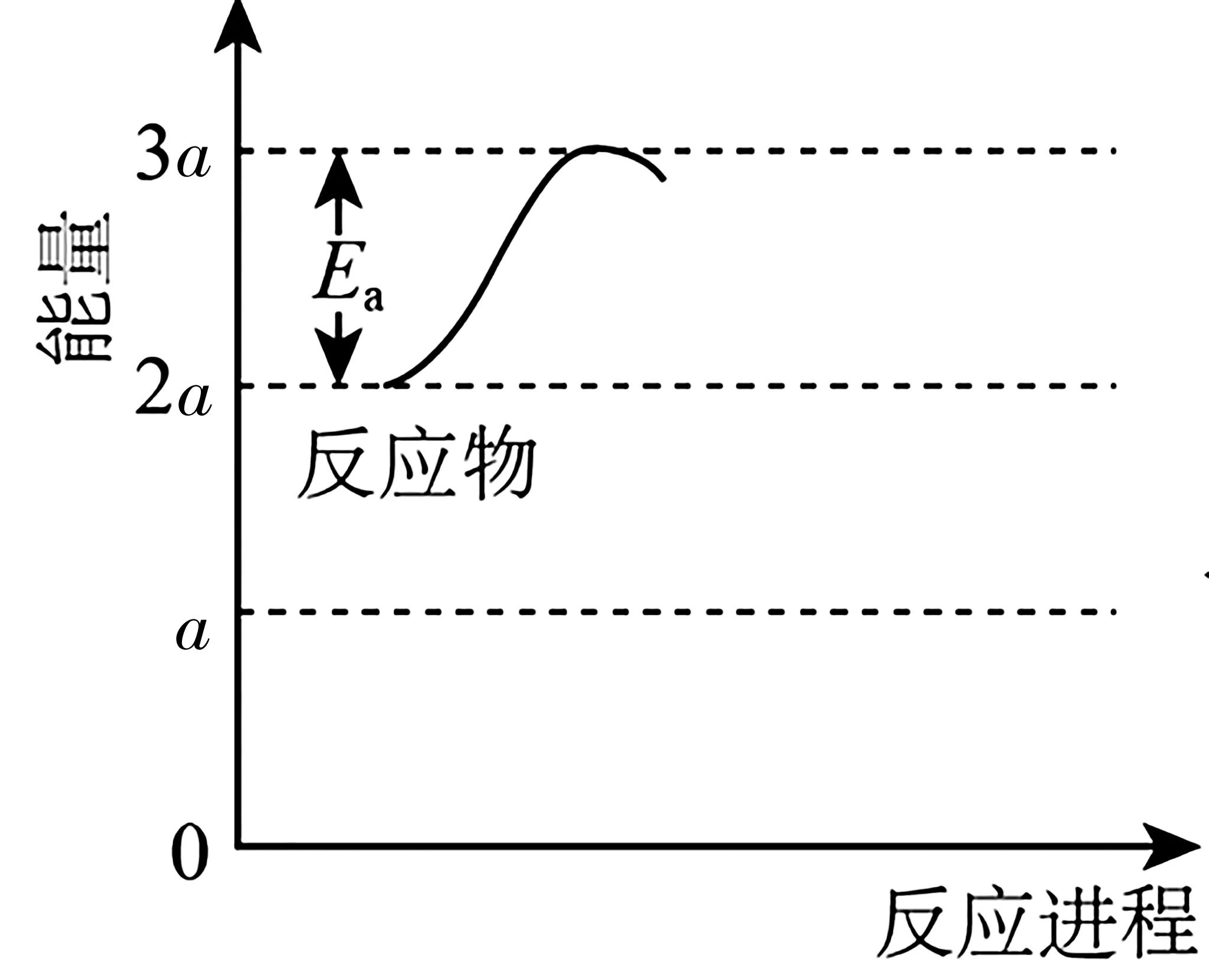
圖7
②某研究小組模擬該反應,溫度t下,向容積為10 L 的抽空的密閉容器中通入0.1 mol CO2(g)和0.4 mol H2(g),反應平衡后測得容器中n(CH4)=0.05 mol。則CO2的轉(zhuǎn)化率為____,反應溫度t約為_____℃。
(2)在相同條件下,CO2(g)與H2(g)還會發(fā)生不利于氧循環(huán)的副反應CO2(g)+,在反應器中按n(CO2)∶n(H2)=1∶4通入反應物,在不同溫度、不同催化劑條件下,反應進行到2 min 時,測得反應器中CH3OH、CH4濃度(μmol·L-1)如表1所示。

表1
在選擇使用催化劑Ⅰ和350 ℃條件下反應,0~2 min生成CH3OH 的平均反應速率為____μmol·L-1·min-1;若某空間站的生命保障系統(tǒng)實際選擇使用催化劑Ⅱ和400 ℃的反應條件,原因是____。
解析:(1)①由2H2O(g)+CH4(g)的平衡常數(shù)(K)與反應溫度(t)之間的關系圖可知,K隨著溫度升高而減小,該反應為放熱反應。若反應為基元反應,則反應為一步完成,由于反應的ΔH與活化能(Ea)的關系為|ΔH|>Ea,由圖7 信息可知Ea=akJ·mol-1,則|ΔH|>akJ·mol-1,該反應為放熱反應,生成物的總能量小于反應物的,因此該反應過程的能量變化如圖8所示。
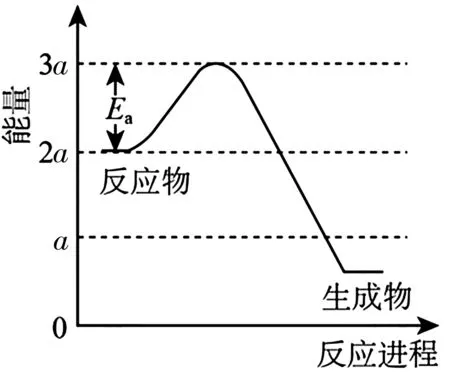
圖8
②溫度t下,向容積為10 L 的抽空的密閉容器中通入0.1 mol CO2和0.4 mol H2,反應平衡后測得容器中n(CH4)=0.05 mol,則CO2的轉(zhuǎn)化率為根據(jù)C元素守恒可知,CO2的平衡量為0.05 mol,CO2和H2是按化學計量數(shù)之比投料的,則H2的平衡量為0.2 mol,H2O(g)的平衡量是CH4(g)的2 倍,則n(H2O)=0.1 mol,CO2(g)、H2(g)、H2O(g)、CH4(g)的平衡濃度分別為 0.005 mol·L-1、 0.02 mol·L-1、0.01 mol·L-1、 0.005 mol·L-1,則該反應的平衡常數(shù),根據(jù)圖6中的信息可知,反應溫度t約為660.2 ℃。
(2)在選擇使用催化劑Ⅰ和350 ℃條件下反應,由表中信息可知,0~2 min CH3OH的濃度由0 增加到10.8 μmol·L-1,因此,0~2 min 生成CH3OH 的平均反應速率為由表中信息可知,在選擇使用催化劑Ⅰ和350 ℃條件下反應, 0~2 min CH3OH 的濃度由0 增加到10.8 μmol·L-1,c(CH4)∶c(CH3OH)=12 722∶10.8≈1 178;在選擇使用催化劑Ⅱ和350 ℃的反應條件下,0~2 min CH3OH 的濃度由0 增加到9.2μmol·L-1,c(CH4)∶c(CH3OH)=10 775∶9.2≈1 171;在選擇使用催化劑Ⅰ和400 ℃條件下反應,0~2 min CH3OH 的濃度由 0 增加到 345.2 μmol· L-1,c(CH4)∶c(CH3OH)=42 780∶345.2 ≈124;在選擇使用催化劑Ⅱ和400 ℃的反應條件下,0~2 min CH3OH 的濃度由0 增加到34μmol·L-1,c(CH4)∶c(CH3OH)=38 932∶34≈1 145。因此,若某空間站的生命保障系統(tǒng)實際選擇使用催化劑Ⅱ和400 ℃的反應條件的原因是:相同催化劑,400 ℃的反應速率更快,相同溫度,催化劑Ⅱ副產(chǎn)物濃度低,甲烷與甲醇比例高。
答案:(1)①略 ②50%或0.5 660.2(或660.1或660.3,其他答案酌情給分)
(2)5.4 相同催化劑,400 ℃的反應速率更快,相同溫度,催化劑Ⅱ副產(chǎn)物濃度低,甲烷與甲醇比例高
點撥:單元復習需要有效提取我們腦海中散亂的知識點,并優(yōu)化原有的認知結構。認識化學平衡狀態(tài)及其移動的宏觀現(xiàn)象、微觀內(nèi)因、定量判斷,建立起分析同類問題的思維模型。真實情境的復雜性和可變性,正是我們提高分析、解決化學反應速率和化學平衡問題的良好載體。

