基于PGGB途徑優化桫欏組織培養繁殖體系研究
楊 姣,楊衛誠,吳高殷,車冰潔,梁紅飛,周壁波
(貴州師范大學 生命科學學院,貴州師范大學喀斯特洞穴研究中心,貴陽 550025)
桫欏(Alsophilaspinulosa)屬桫欏科(Cyatheaceae)桫欏屬(Alsophila),國家二級保護植物,現存唯一的木本蕨類植物,主要生長于溫暖潮濕的熱帶及亞熱帶地區,中國主要分布于貴州、重慶、四川等地[1]。外形上,桫欏樹形高雅飄逸、青翠碧綠,特別是排列整齊的孢子囊群是自然界的奇特景觀。桫欏莖、葉含有豐富的黃酮、多酚、多糖、有機酸等活性物質,具有較高的觀賞價值和藥用價值,運用及開發潛力大[2-5]。然而,桫欏營養葉易被桫欏葉蜂(Rhoptroceroscyatheae)和綠帶妒尺蛾(Phthonolbaviridifasciata)幼蟲取食和破壞,且其孢子繁殖周期長,生長緩慢。野外調查發現地質表層桫欏幼苗極少,自然更新困難,極大地限制了桫欏種群的發展[6]。植物組織培養技術作為一種高效的無性繁殖方法,具有繁殖周期短、繁殖效率高和不受季節限制等特點。原葉體綠色球狀體(prothallus green globular body,PGGB)是由原葉體不斷增殖形成似球狀的特殊結構。
蕨類植物組織培養中可通過PGGB途徑建立高效的繁殖體系,通過相應的生長調節劑及濃度來實現該途徑。張港隆等通過芒萁(Dicranopterispedata)孢子誘導萌發的原葉體在6-BA與KT的組合下成功誘導出PGGB,實現PGGB高效增殖,建立了穩定、高效的芒萁繁殖體系[7]。朗月婷等[8]以陰生桫欏(Alsophilalatebrosa)、大葉黑桫欏(Alsophilagigantea)和侯夢丹等[9]以桫欏孢子為外植體,通過不同生長調節劑及比例初步建立其繁殖體系。但孢子萌發率、分化率和生根率均較低,其技術尚未成熟,未能得以推廣應用。本文在前人研究基礎上進一步優化桫欏孢子萌發條件、配子體增殖、分化以及組培苗移栽等過程,以期構建1個高效的桫欏再生繁殖體系,為進一步探究桫欏體外培養發育機制、新品種培育、規模生產及應用提供技術支持。
1 材料和方法
1.1 桫欏孢子采集與保存
1.2 桫欏孢子預處理與無菌孢子獲取
試驗前對孢子浸泡12 h后消毒,無菌孢子獲取參照郎月婷等[8]的方法,制成無菌孢子懸浮液。
1.3 桫欏孢子誘導配子體
將無菌孢子懸浮液接種至1/8 MS(大量元素濃度為MS的1/8,鐵鹽、微量元素、有機物濃度與MS等量)基本培養基中,培養基中添加蔗糖20 g/L,瓊脂10 g/L,6-BA(0.5,1.0,1.5 mg/L),NAA(0.05,0.10,0.20,0.30 mg/L),以不添加植物生長調節劑作為空白,每皿接種無菌懸浮液400 μL,每個處理接種3皿,重復3次。
培養條件:溫度(25±2) ℃,光照強度為3 000 lx,12 h/d,每周觀察1次(下同),30 d后記錄誘導率。在OLYMPUS SZ體式顯微鏡(奧林巴斯(深圳)工業有限公司)下任取10個視野觀察、記錄桫欏孢子誘導配子體情況。
1.4 桫欏配子體誘導PGGB
把處于蝶形原葉體時期的配子體切割成4 mm×4 mm方塊,鮮重約0.102 g接種至1/2 MS培養基中,添加6-BA(0.2,0.3,0.5 mg/L),NAA(0.2,0.4,0.6 mg/L),兩兩對應組合,蔗糖30 g/L,瓊脂6 g/L,以不添加植物生長調節劑作為空白,pH 5.8。
每組處理接種10瓶,每瓶接種4個配子體,重復3次。培養2個月后,統計PGGB的誘導率、鮮重、直徑以及球狀體的顏色與長勢情況。
1.5 桫欏PGGB分化
將誘導成功的PGGB分割成直徑約為1.2 cm的小球接種于1/2 MS培養基,加入KT(0.3,0.5,0.7 mg/L)、IBA(0.1,0.2,0.3,0.4 mg/L)、蔗糖30 g/L、瓊脂6 g/L,以不添加植物生長調節劑作為空白,pH 5.8。每隔15 d用消毒后的噴壺在PGGB表面噴施無菌水0.3 mL。每組接種10瓶,每瓶接種3個,重復3次。培養1個月后統計PGGB分化率、分化的莖芽數,孢子體長勢與顏色。
1.6 桫欏孢子體生根
將孢子體接種在1/2 MS培養基中,添加蔗糖30 g/L、瓊脂6 g/L、IAA(0.3,0.5,0.7,1.0 mg/L)和IBA(0.3,0.5,0.7,1.0 mg/L),以不添加植物生長調節劑作為空白,pH 5.8。每組接種30瓶,每瓶接種1個,重復3次,培養1個月后統計生根情況。
1.7 桫欏組培苗練苗、移栽培養
將高為5 cm以上的桫欏再生植株在人工氣候室進行馴化,練苗1周后移栽至不同滅菌后基質(表1)中,并用保鮮膜覆蓋。每組移栽30株,重復3次。每周觀察桫欏組培苗的生長情況,培養30 d,統計組培苗成活率。煉苗培養條件:溫度(24±2) ℃,濕度(89±2)%,光質為白光,光照周期為16 h/d。
3.大數據管理決策能力。 “互聯網+”時代,政府治理主體和對象數據信息呈爆發式增長,局限于傳統的監測、管理、應對手段無法摸清經濟社會發展及政府行政真實情況,更難做出科學有效的治理決策,只有借助大數據技術獲取、處理和分析海量信息,支撐經濟管理、政務服務和社會關系塑造等治理活動,才能夠保障政府行為的精確度和科學性。
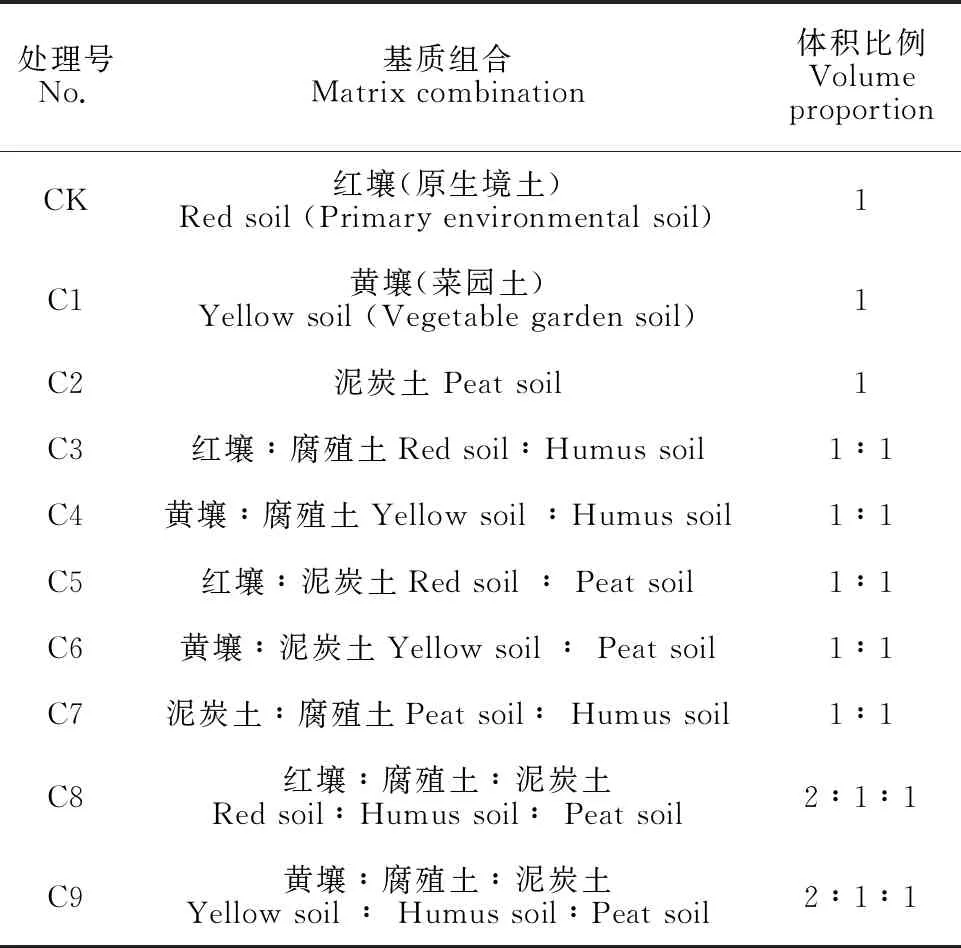
表1 不同的土壤基質及體積比例
1.8 數據收集與統計分析
用Excel 2021和SPSS統計分析數據,Origin作圖。數據以平均值±標準誤差表示,采用單因素檢驗進行方差分析,顯著性水平P<0.05。
配子體誘導率=視野里誘導形成的配子體數/視野里總的孢子數×100%;PGGB誘導率=誘導形成的PGGB數/接種總數×100%;PGGB分化率=分化的PGGB數/接種總數×100%;生根率=生根的孢子體數/接種的孢子體總數×100%;成活率=成活的桫欏試管苗/移栽的桫欏試管苗×100%;增殖倍數=PGGB的鮮重/0.102,0.102是配子體誘導PGGB前的初始鮮重(g)。
2 結果與分析
2.1 桫欏孢子組織培養過程的形態特征
桫欏孢子(圖1,A)接種于培養基上20 d后變綠,誘導形成配子體。首先是綠色細胞增殖發育成絲狀體(圖1,B),絲狀體不斷生長發育形成片狀體(圖1,C)、蝶形原葉體(圖1,D)、成熟配子體(圖1,E)。

A.孢子;B.絲狀體;C.片狀體;D.蝶形原葉體;E.成熟配子體;F.PGGB;G.精子器;H.頸卵器;I.配子體分化;J.孢子體;K.孢子體的根;L.幼苗移栽。
配子體后期誘導成PGGB團(圖1,F),隨PGGB增殖,其配子體腹面上的精子器(圖1,G)與生長點上的頸卵器(圖1,H)不斷發育成熟,經噴施無菌水后,促進受精過程,而生長出無拳卷的葉、葉脈呈二叉狀分枝形成孢子體(圖1,I),在生根培養基上誘導孢子體生根,并將桫欏再生植株移栽在基質中(圖1,J、圖1,K和圖1,L)。
2.2 桫欏孢子誘導配子體
不同植物生長調節劑對配子體誘導率、誘導時間差異顯著(P<0.05)(表2)。同一NAA濃度下,配子體誘導率隨6-BA濃度升高逐漸下降,誘導時間延長。同一6-BA濃度下,配子體誘導率隨NAA濃度升高整體上呈先升高后降低的趨勢,在高濃度6-BA中誘導時間延長,然而,在L2中誘導率最高(64.62%),誘導時間最少(23 d),均與CK差異顯著(P<0.05)。
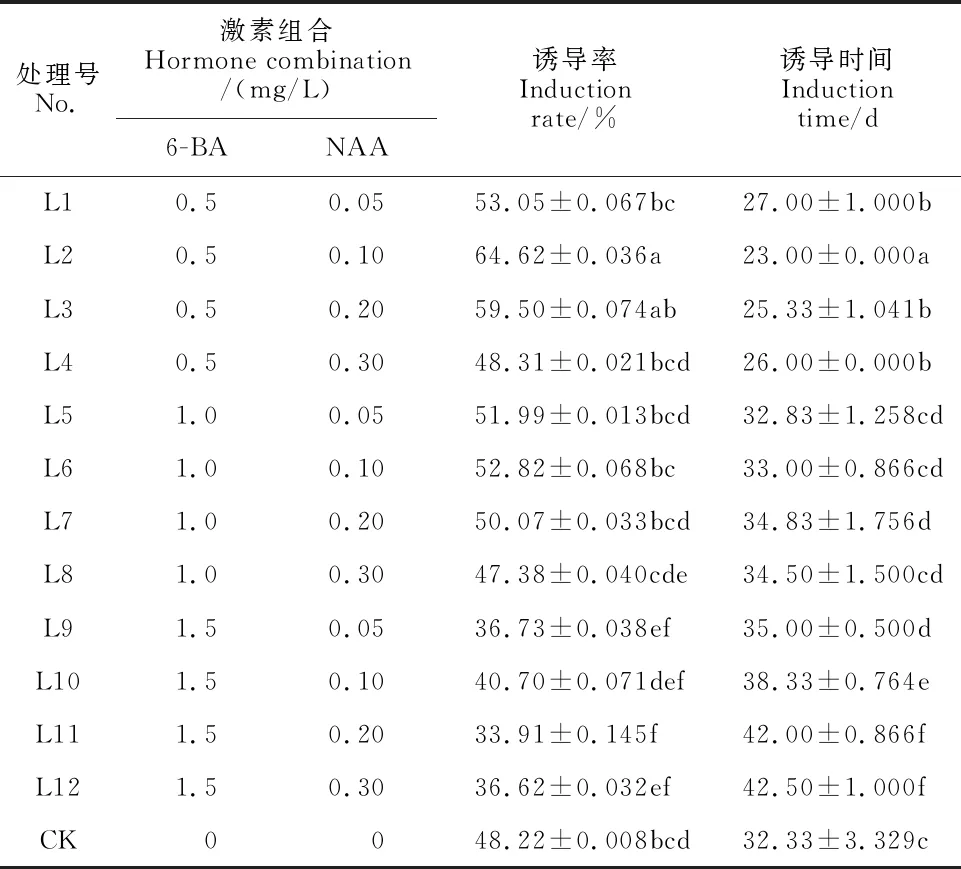
表2 不同生長調節劑濃度組合對桫欏孢子誘導配子體的影響
2.3 配子體誘導PGGB
將處于蝶形原葉體時期的配子體接種于Z1~Z9培養基中誘導PGGB(圖2),PGGB誘導率(100%)不具顯著性差異(P>0.05),均顯著高于CK(P<0.05),其增殖倍數、鮮重差異顯著(P<0.05),PGGB直徑差異不顯著(P>0.05)。同一6-BA濃度下,隨著NAA濃度上升,PGGB鮮重、PGGB直徑、PGGB增殖倍數均整體下降;同一NAA濃度下,6-BA的濃度上升,PGGB鮮重、PGGB直徑、PGGB增殖倍數整體呈現上升趨勢。其中,Z5組PGGB鮮重、PGGB直徑、PGGB增殖倍數最高,并且與CK有顯著差異(P<0.05,見表3)。因此,選取1/2 MS+ 0.3 mg/L 6-BA+0.4 mg/L NAA作為配子體誘導PGGB適宜培養基。

圖2 Z1~Z9對應不同培養基下誘導成功的PGGB
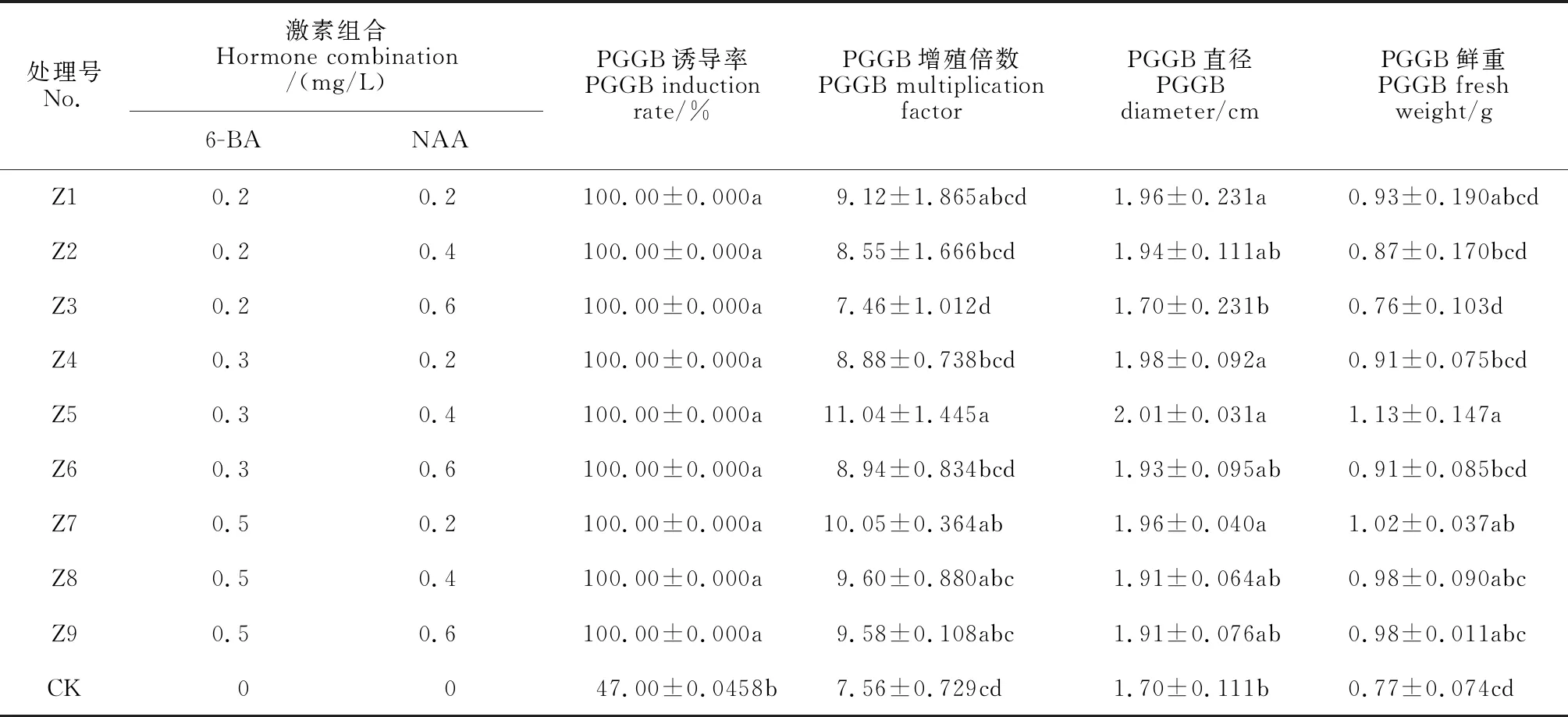
表3 不同生長調節劑濃度組合對PGGB誘導增殖的影響
2.4 植物生長調節劑對PGGB分化的影響
將PGGB轉接至H1~H12分化培養基中,其分化率、總莖芽數、株高、莖葉長以及寬均具顯著差異(P<0.05)(圖3、表4)。隨著KT濃度增加,分化率、分化莖芽數、株高、莖葉的長及寬總體上呈現先增加后減少。當KT濃度小于0.5 mg/L時,PGGB分化率、分化莖芽數隨著IBA濃度升高而增加;相反,當KT濃度大于0.5 mg/L時,其隨IBA濃度升高而降低。綜上所述,PGGB在H4組(1/2 MS+0.3 mg/L KT +0.4 mg/L IBA)培養基中的分化率、總莖芽數、株高、莖葉的長及寬是最好的,并且與CK均有顯著性差異(P<0.05)。

圖3 H1~H12對應不同的培養基的PGGB分化
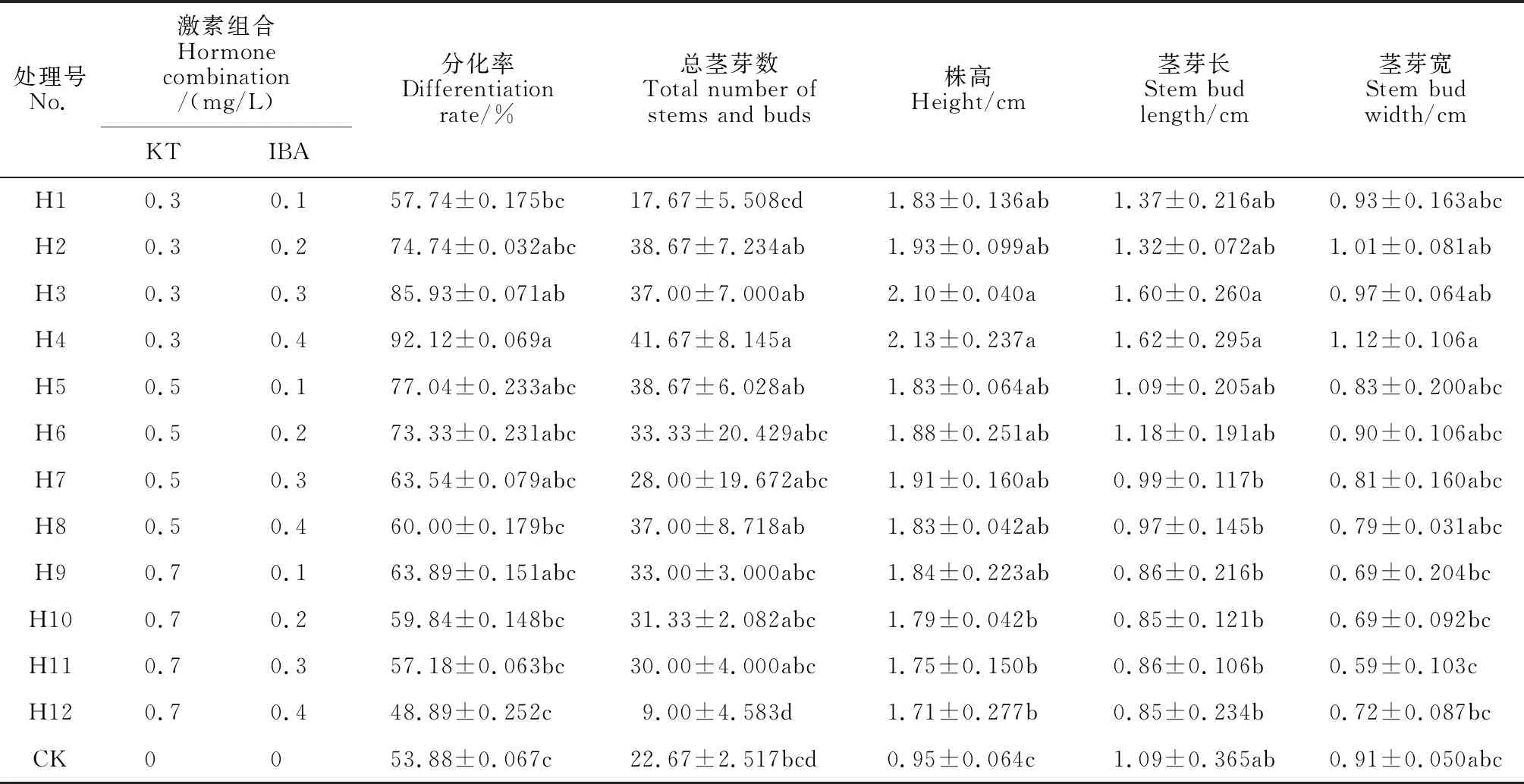
表4 不同生長調節劑濃度組合對PGGB分化率、總莖芽、株高、莖長及莖寬的影響
2.5 生長調節劑對桫欏孢子體生根及生長發育的影響
將分化的的桫欏孢子體接種于F1~F8生根誘導培養基中,其生根率均為100%(表5),顯著高于CK(33.3%)(P<0.05)。隨著IBA濃度增加,桫欏植株的根數、根長、株高、葉片數量、葉長、葉寬呈現上升趨勢,均在F4中最高;而隨著IAA濃度增加,桫欏植株的根數、根長、株高、葉片數量、葉長、葉寬呈現下降趨勢,但其根長、生根數、株高、葉片數量、葉長及寬無顯著性差異(P>0.05)(表6)。由此可知,H4組(1/2 MS+1.0 mg/L IBA)是桫欏孢子體最適合的生根誘導及生長發育培養基(圖4)。

F3、F4孢子體誘導根有分支、有根毛。

表6 不同生長調節劑濃度組合對桫欏孢子體葉片數量、株高、葉長以及葉寬的影響
2.6 桫欏組培苗練苗、移栽培養
將高為5 cm以上的桫欏組培苗移栽至不同基質中,結果(圖5)表明不同基質對桫欏組培苗成活率具有顯著性差異(P<0.05)。

A.黃壤∶泥炭土(1∶1)∶桫欏幼苗葉片邊緣變黃;B.紅壤基質的桫欏幼苗;C.紅壤∶泥炭土∶腐殖土(2∶1∶1)的桫欏幼苗。
其中,桫欏組培苗在C8基質中成活率最高達96.3%(表7),顯著高于C2基質,與CK、C1、C3~C9無顯著差異(P>0.05),但其葉片翠綠,生長勢較強。因此,選擇C8中紅壤∶腐殖土∶泥炭土(2∶1∶1)的基質作為桫欏組培苗適宜的移栽基質。

表7 不同基質對桫欏組培苗移栽的影響
3 討 論
研究利用PGGB途徑與組織培養技術相結合的繁殖方式,以桫欏孢子為外植體進行優化,并構建桫欏快繁體系,提高配子體誘導率、PGGB誘導率、PGGB分化率、孢子體生根率,最后進行移栽。前人研究表明,桫欏孢子誘導配子體、配子體誘導PGGB及分化、孢子體生根等過程受諸多外部因素影響,如溫度、濕度、光照強度、光周期、培養基種類、無機鹽濃度、糖的種類以及濃度、生長調節劑種類以及濃度、pH值等[10-13]。其中,植物生長調節劑對蕨類植物孢子組織培養過程中的發育及生長具有重要作用。
PGGB途徑作為蕨類植物組織培養中特有的繁殖路徑,具有用材少、繁殖效率高和增殖系數大等特點。通過PGGB途徑來構建桫欏的組培體系,在桫欏配子體誘導PGGB、分化、生根的過程中,生長調節劑的種類與濃度對其誘導、分化、生根有重要作用。赤霉素(gibberellins,GA)、成精子囊素(anteridiogen,An)、細胞分裂素(cytokinin,CK)、生長素(auxin,AUX)、茉莉酸(jasmonic acid,JA)、乙烯(ethylene,Eth)、脫落酸(abscisic acid,ABA)、油菜素內脂(Brassinolide,BR)等不同種類的植物生長調節劑能不同程度地影響蕨類植物孢子萌發、配子體的生長發育、孢子體的形成等過程[14-16]。生長素激活細胞,促進有絲分裂;細胞分裂素能刺激細胞分裂和生長過程;赤霉素協調細胞分裂的過程、性別決定,促進了蕨類植物配子體腹面的精子器形成[17]。細胞分裂素6-BA、生長素NAA在蕨類植物組培中常搭配使用于孢子萌發與配子體的增殖。王陽[18]在研究東北對開蕨(Phyllitisscolopendrium)的組培中發現6-BA對孢子萌發、原葉體增殖中有明顯促進作用,特別是0.5 mg/L 6-BA的增殖效果最好;但是,6-BA的濃度越大、原葉體增殖效果不佳、鮮重越小。陳朋等[19]的研究表明6-BA濃度低于1.5 mg/L可觀察到粵紫萁(Osmundamildei)孢子萌發,并且6-BA在0.5~1.0 mg/L范圍與低濃度NAA組合有利于原葉體增殖,6-BA大于1.5 mg/L時則抑制其增殖,這與本研究桫欏孢子誘導配子體結果一致,表明低濃度6-BA與NAA組合對孢子誘導配子體的誘導率及誘導時間具有顯著促進作用。實驗中還發現KT、ZT雖然都能使孢子誘導配子體,但存在誘導時間較長,誘導時會出現有絨毛狀假根,原葉體增殖停滯,顏色黃綠。然而,0.5 mg/L 6-BA與0.1 mg/L NAA或者0.1 mg/L 2,4-D組合時,都能一定程度上縮短了誘導時間;但是,6-BA與 NAA配合時,配子體顏色碧綠、長勢好;而6-BA與2,4-D組合時,配子體顏色變淡,不僅出現假根現象,且部分出現褐化;這與Bonomo等[20]對樹蕨(Alsophilaodonelliana)的孢子萌發、配子體發育研究結果相似,在6-BA的濃度為0.01,0.1,1.0 mg/L時,促進了原葉體的形成;0.1 mg/L的2,4-D會縮短絲狀體蛋白的形成而促進了絲狀體的形成。就PGGB誘導而言,與朗月婷等[8]研究陰生桫欏GGB誘導結果一致,低濃度的6-BA與NAA組合能夠緩解PGGB的原葉體碎小、假根現象,PGGB誘導率為100%,特別是0.3 mg/L 6-BA與0.4 mg/L NAA組合使PGGB直徑、增殖倍數和鮮重達到最佳,這可能與不同蕨類植物誘導GGB或者PGGB時,對激素種類及濃度適應度不同有關。
在研究蕨類植物的世代交替的繁殖過程中,配子體向孢子體轉化的關鍵是成熟配子體上的精子器與頸卵器能夠進行受精作用,故PGGB進行分化前,受精是分化的關鍵。過去研究表明,赤霉素、成精子囊素、光等因素會影響精子器的形成[21-22]。本研究發現KT是影響PGGB分化的主要因子,與張艷琴等[23]研究鐵線蕨(Adiantumcapillus-veneris)孢子體的產生以及朗月婷等[8]研究陰生桫欏GGB分化的結果相似,KT的濃度越大,分化率降低。前人研究表明,不加任何激素也會誘導孢子體的分化。比如粵紫萁[19]、大葉黑桫欏[24]。還有研究表明,波斯頓蕨(Nephrolepisexaltata‘Bostoniensis’)的GGB在1.2 mg/L 6-BA與0.4 mg/L NAA的濃度下能分化出大量孢子體[25],而桫欏配子體在0.1 mg /L NAA 與0.5 mg /L BA組合下分化出大量孢子體[12],這可能與分化前配子體增殖或者PGGB誘導使用的激素不同有關,也與不同物種其內部激素的差異有關。試驗中還發現,除了KT能促進PGGB的分化外,ZT也能影響PGGB的分化,不過ZT誘導分化時,會使PGGB增大、分化莖葉少、孢子體不長高、孢子體的葉片變黃。低濃度KT與IBA組合時,IBA的濃度越高,越能促進PGGB分化以及莖葉、莖芽的長及寬、孢子體株高的伸長。
桫欏的孢子體分化后,需對其進行生根誘導,而生長素IBA、NAA、IAA等是植物再生苗常用的生根誘導激素。葉秀仙等[26]與劉偲[27]等報道了生長素NAA對鹿角蕨(Platyceriumwallichii)孢子體的生根有促進作用,并且NAA的濃度越大,既能縮短生根時間,也能促進生根率以及生根數。桂皮紫萁孢子體在IBA 0.5 mg/L中生根率最高,并且生根率隨IBA濃度升高呈先增加后減少趨勢[28]。大葉黑桫欏在IAA與NAA組合下的生根率最佳,而單一激素IAA的濃度越高,生根數越多、根長越長[8],這與本研究中IAA誘導桫欏孢子體生根的結果一致。許姍[29]在槲蕨(Drynariaroosii)組培中發現,槲蕨在IBA激素下誘導的生根率、生根數、根長有顯著差異,其濃度越高,效果越好與本研究桫欏孢子體在IBA誘導生根情況一致。本研究還表明,桫欏孢子體在IAA與IBA組合下誘導生根時,其生根率低,莖芽不伸長,而莖芽下的配子體繼續增殖,不如單一的IBA或者IAA效果好,而質量濃度為1 mg/L的IBA,生根率100%,根數、莖葉數、莖芽長、寬以及株高都明顯增高,并且根毛豐富、有分支,為煉苗、移栽提供好的基礎。
前人研究表明,煉苗基質對桫欏組培苗的成活率影響較大,加上桫欏喜潮濕環境,對其引種、移栽時對濕度、溫度的要求高。侯夢丹等[9]使用泥炭土、菜園土、營養土不同配比對桫欏組培苗進行移栽煉苗,發現其移栽后幼苗成活率很低;朗月婷等[8]在泥炭土、菜園土中成功移栽陰生桫欏,其成活率達60%以上;而在同樣基質上對大葉黑桫欏(A.gigantea)組培苗的移栽卻沒有成功。這可能因為不同的桫欏科植物的內部輸水系統與根系對不同土壤基質的敏感度不同,也可能與移栽時組培苗的質量和移栽有關。然而,本試驗在前人研究基礎上,進一步優化移栽煉苗基質,采用赤水桫欏保護區原生境的紅壤與腐殖土和泥炭土進行混合對桫欏再生苗進行移栽,其成活率大大提高,這可能與紅壤作為桫欏生境土壤,其理化性質和微生物類型對桫欏組培苗的生長具有促進作用有關,從而提高桫欏組培苗移栽成活率。
4 結 論
本研究中桫欏PGGB途徑不僅繁殖系數大,而且較穩定、高效,出苗率大。(1)1/2 MS+6-BA 0.5 mg/L+NAA 0.1 mg/L是孢子誘導配子體的最適培養基;(2)1/2 MS+6-BA 0.3 mg/L+NAA 0.4 mg/L是誘導PGGB最合適的培養基;(3)PGGB分化最佳的培養基是1/2 MS+KT 0.3 mg/L+IBA 0.4 mg/L;(3)桫欏孢子體在1/2 MS+IBA 1.0 mg/L培養基里生根誘導效果最好;(4)桫欏組培苗移栽在基質紅壤∶腐殖土∶泥炭土=2∶1∶1中成活率最高,且生長良好。

