枯草桿菌蛋白酶水解對大豆蛋白肽譜變化規律的影響
焦艷玲,陶曉露,許偉洲,于文娟,路福平,王洪彬
(天津科技大學生物工程學院,天津 300457)
大豆蛋白是世界上最具價值的植物蛋白之一,可以提供人類所有的必需氨基酸,是人類補充蛋白質的良好來源。但是大豆蛋白中含有胰蛋白酶抑制劑,易引起消化不良、胃脹氣等不良反應。將大豆蛋白水解加工成大豆肽,不僅提高了其營養價值,而且產生的多肽具有多種生理功能,包括抗肥胖、調節腸道微生物群、降血脂和降血糖等。大豆蛋白包含多種蛋白質成分,按照沉降系數的差異進行分類,主要分為分子量340~375 kDa 的11S 球蛋白(β-大豆球蛋白)和分子量140~170 kDa 的7S 球蛋白(β-大豆伴球蛋白),兩者堿性條件下易溶解,約占蛋白總量的70%,其中β-大豆球蛋白含量最高,占蛋白質總量的52%[1-3]。大豆蛋白加工成大豆肽,常用的方法是酸堿水解法和酶解法。雖然酸堿水解法簡單操作、成本較低,但使用酸堿水解法處理不僅改變了水解物的外觀、溶解性、風味,而且在食品安全性上也存在諸多問題。因此,大豆蛋白水解主要采用安全溫和、環境友好的酶解法來代替酸堿水解法[4-6]。
芽孢菌來源的枯草桿菌蛋白酶,耐堿性好,且具有極強的水解能力,是應用最廣泛的堿性蛋白酶制劑種類,也是大豆蛋白水解的主要用酶[7]。關于堿性蛋白酶水解大豆蛋白生產大豆肽的研究,以往主要集中在水解條件優化和產品性能評價上[8-10],對水解過程中肽譜的動態變化及其規律研究較少。解析水解過程中肽譜的變化規律,有助于獲得酶水解底物蛋白氨基酸序列時位點選擇傾向性等信息[11-13]。目前對蛋白質酶切肽譜的分析方法主要是基于質譜的蛋白質組學分析方法[14-15]。對于大豆蛋白水解多肽的研究,近年來主要關注的是發掘水解后產生的新肽及其功能。Torres 等[16]通過基質輔助激光解析-飛行時間質譜(matrix-assisted laser desorption/ionization time-of-flight mass spectrometry,MALDI-TOF MS)研究了蘿藦蛋白酶水解胰島素B 鏈的動態過程,從而揭示了該酶的底物特異作用位點,最終利用該酶降解大豆蛋白組分并探究了產物的功能特性。Daliri 等[17]利用鼠李糖乳桿菌EBD1 發酵胃蛋白酶,并使用該酶水解大豆蛋白,通過質譜分析挖掘出水解產物中3 個血管緊張素轉換酶(angiotensin converting enzyme,ACE)的抑制肽,發現的新肽可以作為一種抗高血壓功能食品的添加劑。Feng 等[18]通過質譜分析發現,堿性絲氨酸蛋白酶SF1 處理的大豆蛋白產生了4 個主要的親水肽,有利于降低大豆蛋白水解產物的苦味。Reyes Jara 等[19]使用植物乳膠中提取的蛋白酶水解大豆蛋白,通過MALDI-TOF MS 分析和生物信息學分析,推導出14 個包含抗氧化氨基酸的理論肽序列。Taniguchi 等[20]使用高效液相色譜(high performance liquid chromatography,HPLC)和MALDI-TOF MS在大豆蛋白水解物中純化和鑒定出14 種多功能陽離子肽,并發現它們具有多種生物活性,如溶解血栓、中和脂多糖、抗菌等。Wu 等[21]用高效液相色譜純化大豆多肽,并用MALDI-TOF MS 鑒定到一種新型大豆肽,該肽可改善高脂小鼠的胰島素抵抗。但這些研究均未對酶法水解大豆蛋白所得肽譜的動態變化過程進行深入的解析,不利于大豆肽水解工藝的控制和新型大豆肽的發現。
枯草桿菌蛋白酶位點特異性較弱,因此其水解肽譜的鑒定不能使用蛋白質組學研究中常用的肽譜鑒定方法,而是應使用位點非特異性酶切肽譜的分析方法[22]。本研究使用高效液相色譜-電噴霧四極桿飛行時間串聯質譜(high performance liquid chromatographyelectrospray quadrupole time-of-flight mass spectrometry,HPLC/ESI-QTOF MS)檢測枯草桿菌蛋白酶水解大豆蛋白肽譜,通過Mascot 軟件使用位點非特異性酶切肽譜的鑒定方法解析肽譜的動態變化,以闡明水解過程中酶切位點氨基酸種類的選擇傾向性和分布規律。
1 材料與方法
1.1 材料與試劑
大豆分離蛋白(純度90%):上海源葉生物科技有限公司;枯草桿菌蛋白酶(活力8 540 U/mg,最適pH10.5,最適溫度40 ℃):天津市諾奧科技發展股份有限公司;乙腈、甲酸(均為色譜純):美國費希爾公司;硼酸鈉(分析純)、4×蛋白上樣緩沖液(含巰基還原劑):北京索萊寶科技有限公司;氫氧化鈉(分析純):天津市風船化學試劑科技有限公司;考馬斯亮藍染色液(R-250)、脫色液:武漢賽維爾生物科技有限公司;蛋白Marker(14.4~116.0 kDa):北京百奧萊博科技有限公司;十二烷基硫酸鈉聚丙烯酰胺凝膠(12%)、電泳緩沖液:金斯瑞生物科技股份有限公司。
1.2 儀器與設備
高效液相色譜-電噴霧四極桿飛行時間串聯質譜儀(1200-6450 型):美國安捷倫公司;超純水裝置(Milli-Q):美國密理博公司;聚丙烯酰胺凝膠電泳儀(Mini-PROTEAN Tetra):美國伯樂公司;移液槍(eppendorf):德國艾本德公司;凝膠成像儀(GenoSens2100):上海勤翔科學儀器有限公司。
1.3 方法
1.3.1 溶液配制
氫氧化鈉溶液(10 mol/L):取40 g 氫氧化鈉于燒杯中,加入適量超純水溶解,冷卻后倒入100 mL 容量瓶中,超純水定容至100 mL。
硼酸緩沖液(pH10.5):硼酸鈉9.45 g 加超純水1 L,混勻,用氫氧化鈉溶液調節pH 值至10.5±0.5。
水相:取1 mL 甲酸加入到999 mL 超純水中。
有機相:取1 mL 甲酸加入到999 mL 乙腈中。
1.3.2 堿性蛋白酶水解大豆蛋白過程的電泳分析
使用硼酸緩沖液(pH10.5)溶解大豆分離蛋白,配制成濃度為1 g/L 的溶液。溶解好的大豆蛋白溶液中加入千分之一的枯草桿菌蛋白酶,40 ℃水浴條件下進行水解反應。分別在水解0、10、30、60、90、120、150 min時取樣1 mL,取樣后立即沸水浴5 min 使酶滅活,12 000 r/min 離心5 min 后取上清液,0.45 μm 針式濾器過濾處理后用于后續檢測。將不同上清液分別與上樣緩沖液按3 ∶1 的體積比混合,用移液槍吸取5 μL標準蛋白Marker 或10 μL 混合液分別加入到蛋白膠上樣孔中,80 V 恒壓電泳約15 min,然后120 V 恒壓至電泳結束。電泳結束后取出蛋白膠至容器,使用考馬斯亮藍染色液染色1 h,脫色液脫色6 h。最后,使用凝膠成像儀拍攝蛋白膠圖。
1.3.3 基于HPLC/ESI-QTOF MS 的肽譜檢測
取枯草桿菌蛋白酶水解大豆蛋白不同時間獲得的肽段樣品,使用HPLC/ESI-QTOF MS 進行檢測。色譜條件:色譜柱ZORBAX300SB(C18,5μm,2.1mm×150mm),流速0.2 mL/min,流動相變化梯度參考文獻[22],有機相0~5 min 保持3%,5~75 min 由3%上升至50%。質譜條件:正離子模式,霧化壓力310 kPa,干燥氣溫度300 ℃,干燥氣流速12 mL/min。一級質譜質荷比掃描范圍300~1 000,二級質譜掃描范圍100~1 200,動態排除條件為0.5 min 2 次。
1.3.4 位點非特異性酶切肽譜鑒定方法
使用Masshunter 工作站軟件,將HPLC/ESI-QTOF MS 檢測出的原始數據轉換成mgf 格式,然后導入到Mascot 軟件進行位點非特異性酶切肽譜鑒定,鑒定參數:蛋白質數據庫選擇Swissprot 來源的大豆蛋白數據庫,酶種類選擇“None”,母離子質量誤差為±0.01%,子離子誤差為±0.01%,肽段母離子電荷種類選擇為1~3。
1.4 數據處理
根據Mascot 軟件鑒定獲得的肽段序列信息,使用Masshunter 軟件通過提取離子流分析提取多肽豐度信息,在此基礎上對所有肽段及酶切位點進行統計分析,并用Origin 軟件作圖。
2 結果與分析
2.1 枯草桿菌蛋白酶水解大豆蛋白過程的電泳分析
將枯草桿菌蛋白酶水解大豆蛋白不同時間點的產物,進行十二烷基硫酸鈉聚丙烯酰胺凝膠電泳(sodium dodecyl sulphate-polyacrylamide gel electrophoresis,SDS-PAGE)分析,檢測蛋白降解情況,結果如圖1所示。
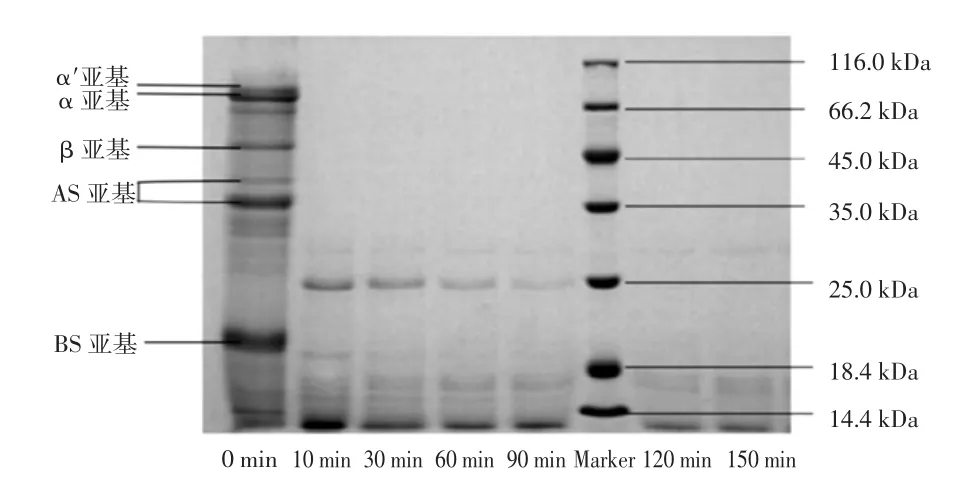
圖1 枯草桿菌蛋白酶水解大豆蛋白不同時間點的SDS-PAGE 分析Fig.1 SDS-PAGE analysis of the soy protein hydrolyzed by subtilisin protease in different time periods
圖1 第一泳道展示了未水解大豆蛋白樣品的電泳條帶,主要條帶是7S 組分中的β-大豆伴球蛋白(α 亞基、α′亞基和β 亞基)和11S 組分中的β-大豆球蛋白(AS 亞基和BS 亞基)。與未水解樣品的電泳圖相比,水解10 min 時大豆蛋白中的多數蛋白質就已經被降解,顯示了堿性蛋白酶對大豆蛋白超強的水解能力。隨著水解時間的延長,前10 min 未完全降解的蛋白或長肽段也逐漸被降解。圖1 中10~90 min 4 個泳道內出現的25 kDa 附近條帶,推測是所添加的枯草桿菌蛋白酶,其分子量約為27 kDa。隨著水解時間延長,酶的條帶也逐漸變淺,說明在水解大豆蛋白過程中酶也在不斷自切失去活性,120 min 和150 min 泳道內已經基本看不到酶的條帶。枯草桿菌蛋白酶屬于位點非特異性蛋白酶,且水解位點比較廣泛,相較于位點特異性比較強的蛋白酶,如胰蛋白酶、糜蛋白酶等,枯草桿菌蛋白酶能夠在更短的時間將底物蛋白切割成分子量大小不一的肽段。
2.2 酶切肽譜和氨基酸位點的動態變化
枯草桿菌蛋白酶水解大豆蛋白過程中,水解肽譜在不斷發生變化。水解10、30、60、90、120 min 和150 min的樣品,通過HPLC/ESI-QTOF MS 和位點非特異性肽譜分析方法鑒定水解肽譜,結果如圖2所示。
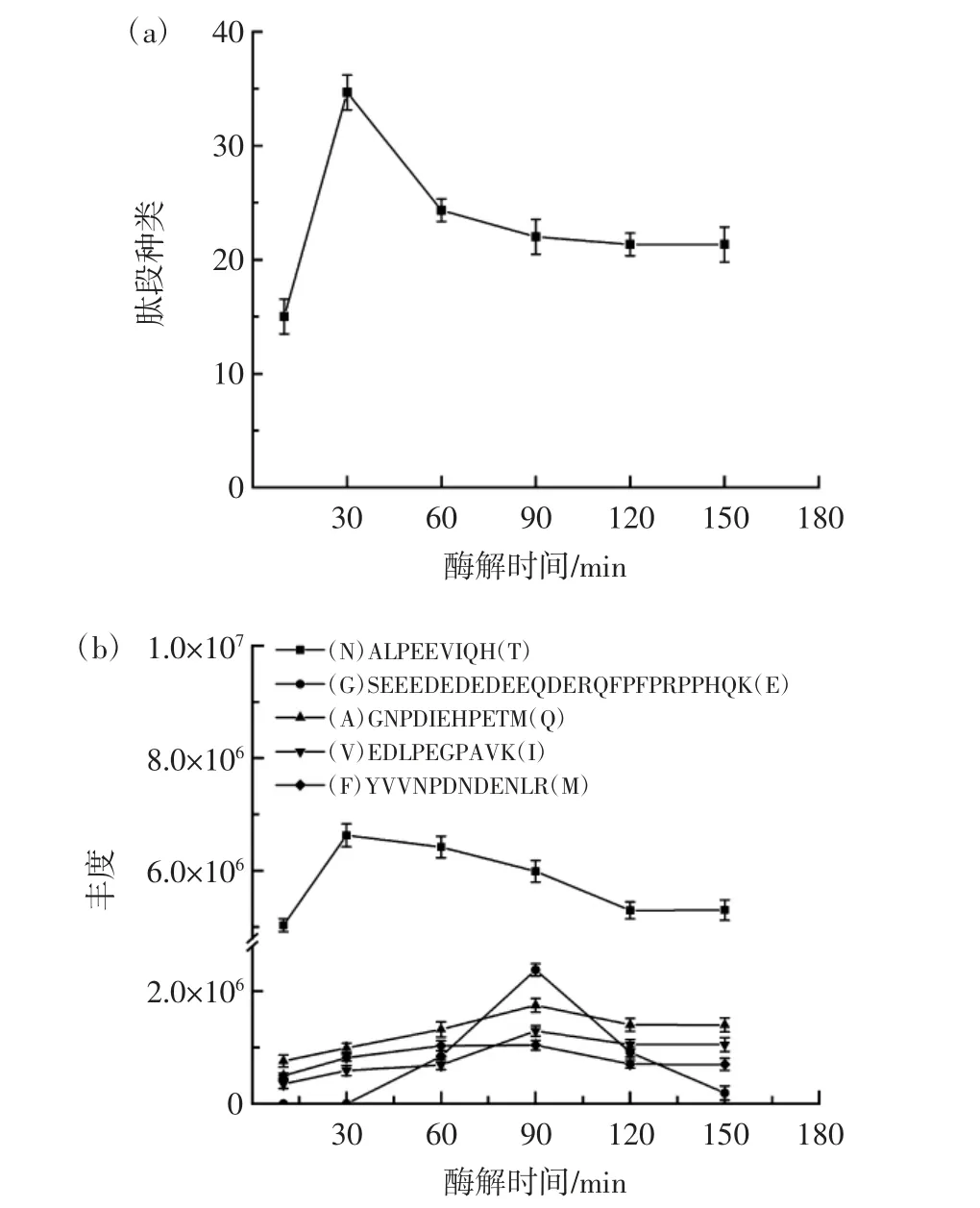
圖2 枯草桿菌蛋白酶水解大豆蛋白過程中多肽產物的動態變化Fig.2 Dynamic changes of polypeptide products during soybean protein hydrolysis by subtilisin protease
由圖2(a)可知,水解30 min 鑒定到的肽段種類最多,隨著水解時間的延長,可鑒定到的肽段種類數目不斷下降,最后穩定在21 種肽段。肽段分子量過大或過小都會影響質譜的鑒定結果。隨著水解程度的加深,一些肽段可能會被降解成更小的二肽、三肽,甚至是游離氨基酸,進而無法鑒定。由圖2(b)可知,豐度最高的肽(N)ALPEEVIQH(T)來自于大豆球蛋白G1 亞基,其豐度在水解10~30 min 內上升,水解30~120 min 內緩慢下降,水解120~150 min 內保持平衡。肽段(G)SEEEDEDEDEEQDERQFPFPRPPHQK(E)來自于β-伴大豆球蛋白,在10 min 和30 min 水解樣品中并沒有檢測到,水解60 min 后其豐度變化的整體趨勢為先升高后下降。肽段(A)GNPDIEHPETM(Q)、(V)EDLPEGPAVK(I)、(F)YVVNPDNDENLR(M)的豐度變化趨勢大致相同,先升高后降低并在120~150 min 內保持平衡。不同種類肽段呈現不同的豐度變化趨勢,這與肽段在水解過程中是否穩定存在很大關系,許多肽段只是中間產物,可能會被繼續水解成更小片段。
枯草桿菌蛋白酶位點特異性較弱,酶切時可選擇的位點較多,可切割幾乎所有的常見氨基酸,但仍然展現了對特定氨基酸的切割偏向性。通過對枯草桿菌蛋白酶水解大豆蛋白所得肽譜的分析,可以進一步獲知其水解位點選擇的氨基酸種類、位置及相對水解強度。圖3 分別展示了不同水解時間枯草桿菌蛋白酶對大豆蛋白的酶切位點的相對強度分布。
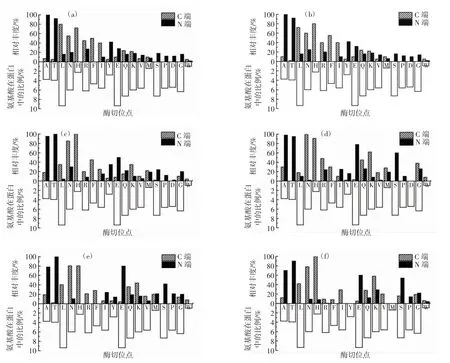
圖3 枯草桿菌蛋白酶對大豆蛋白酶切位點的強度分布Fig.3 Intensity distribution of hydrolysis sites of the subtilisin protease on soy protein
由圖3 可知,枯草桿菌蛋白酶具有寬泛的氨基酸水解位點選擇性,可以水解近乎所有種類氨基酸的肽鍵。但不同種類氨基酸位點被酶切的相對頻率明顯不同。其中,酶切更傾向于發生在丙氨酸(A)和蘇氨酸(T)的N 端,以及組氨酸(H)和天冬酰胺(N)的C 端。同一種氨基酸的C 端和N 端肽鍵被酶切的程度明顯不同,如丙氨酸(A)和蘇氨酸(T)的N 端肽鍵易被水解,而其C 端肽鍵幾乎不被水解,而H、N 則相反,它們的C 端肽鍵易被水解,N 端肽鍵幾乎不易水解。不同水解時間點枯草桿菌蛋白酶對大豆蛋白酶切位點的強度分布也不同,如組氨酸(H)和天冬酰胺(N)的C 端肽鍵在不同時間均易被水解,但不同時間點水解的相對強度不同。枯草桿菌蛋白酶更易切割C 端的組氨酸、天冬酰胺,N 端的蘇氨酸和丙氨酸,其中組氨酸是雜環族氨基酸,蘇氨酸、丙氨酸、天冬氨酸是脂肪族氨基酸,這說明枯草桿菌蛋白酶在水解大豆蛋白時更傾向于酶切雜環族氨基酸和脂肪族氨基酸的兩端。
2.3 大豆蛋白主要水解肽的空間結構分布
隨著枯草桿菌蛋白酶水解時間的延長,理論上由大豆蛋白水解肽組成的肽譜將最終趨于穩定。圖4 為水解150 min 時檢測到的大豆球蛋白G5 亞基5 種高豐度多肽在蛋白質空間結構上的分布。
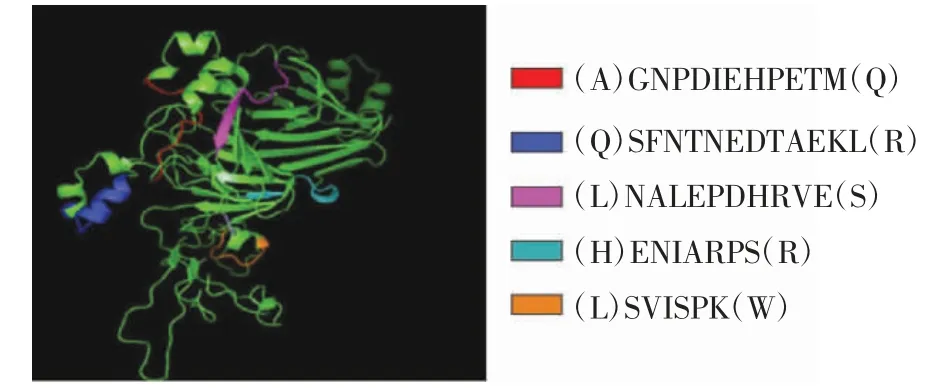
圖4 枯草桿菌蛋白酶酶切位點在大豆球蛋白空間結構上的分布Fig.4 Structure distribution of subtilisin protease cleavage on glycinin
由圖4 可知,5 種肽均分布在蛋白結構的外圍,這顯示了蛋白酶酶切過程中,更易切割空間結構外部的位點,因此底物蛋白的空間結構對蛋白酶酶切效果有很大影響。
3 結論
枯草桿菌蛋白酶適合大豆蛋白的高效水解,可快速地制備多肽,篩選其中具有不同生物活性的肽段。針對其水解過程,本研究通過位點非特異性肽譜鑒定的方法,揭示了其水解肽譜的動態變化規律,并在此基礎上分析了對大豆蛋白水解位點選擇的傾向性,結果表明枯草桿菌蛋白酶在水解大豆蛋白時,更傾向于在大豆蛋白分子的組氨酸、天冬酰胺的C 端,蘇氨酸和丙氨酸的N 端發生水解。本研究揭示的水解肽譜變化規律,有助于指導堿性蛋白酶在大豆蛋白水解中的理性應用和水解過程控制,提高主要植物源蛋白——大豆蛋白的水解加工水平。鑒于枯草桿菌蛋白酶的耐堿性和高效水解能力,它也非常適合于大米蛋白、花生蛋白等其他谷物蛋白的水解,因此本文也為研究堿性蛋白酶水解其他谷物蛋白肽譜提供了借鑒和參考。

