嵌合抗原受體自然殺傷細胞免疫治療多發(fā)性骨髓瘤研究進展
唐文嬌 李燕 鄭宇歡 張麗 牛挺
摘要:盡管新藥的進展使多發(fā)性骨髓瘤(MM)患者的生存得到明顯改善,但復發(fā)難治MM仍缺乏有效治療方案,且預后差。嵌合抗原受體T細胞(CAR-T)免疫治療技術雖然在復發(fā)難治MM中有不錯的療效,但仍存在局限性,如細胞因子釋放綜合征、神經(jīng)毒性等不良反應和脫靶效應等。自然殺傷(NK)細胞作為機體固有免疫的重要成分,在腫瘤免疫監(jiān)視中發(fā)揮重要功能,因此基于NK細胞的嵌合抗原受體自然殺傷細胞(CAR-NK)免疫治療技術也越來越受到關注。目前CAR-NK免疫治療MM的研究顯示,多個靶點可作為CAR-NK免疫治療技術特異性治療靶點,并且在MM細胞及動物實驗中也證實其抗腫瘤效應。本文總結了MM腫瘤微環(huán)境中NK細胞抗腫瘤機制、生物學特點和功能缺陷情況,以及CAR-NK免疫治療MM的基礎和臨床研究進展。
關鍵詞:多發(fā)性骨髓瘤;嵌合抗原受體自然殺傷細胞;復發(fā);難治;治療
中圖分類號: R559文獻標志碼: A文章編號:1000-503X(2023)02-0290-08
DOI:10.3881/j.issn.1000-503X.14785
Progress in Chimeric Antigen Receptor-Modified Natural Killer Cells for Multiple Myeloma
TANG Wenjiao,LI Yan,ZHENG Yuhuan,ZHANG Li,NIU Ting
ABSTRACT:Although the development of novel drugs has significantly improved the survival of patients with multiple myeloma (MM) over the past decades,the lack of effective therapeutic options for relapsed and refractory MM results in poor prognosis.The chimeric antigen receptor (CAR) T-cell therapy has achieved considerable progress in relapsed and refractory MM.Nevertheless,this therapy still has limitations such as cytokine release syndrome,neurotoxicity,and off-target effects.Natural killer (NK) cells,as a critical component of the innate immune system,play an essential role in tumor immunosurveillance.Therefore,CAR-modified NK (CAR-NK) cells are put forward as a therapeutic option for MM.The available studies have suggested that multiple targets can be used as specific therapeutic targets for CAR-NK cell therapy and confirmed their antitumor effects in MM cell lines and animal models.This review summarizes the anti-tumor mechanisms,biological characteristics,and dysfunction of NK cells in the MM tumor microenvironment,as well as the basic and clinical research progress of CAR-NK cells in treating MM.
Key words:multiple myeloma;chimeric antigen receptor-modified natural killer cells;relapsed;refractory;treatment
Acta Acad Med Sin,2023,45(2):290-297
多發(fā)性骨髓瘤(multiple myeloma,MM)目前仍是不可治愈的疾病,尤其多線治療后,復發(fā)難治MM(relapsed and refractory multiple myeloma,RRMM)依然預后差[1]。2021年3月美國食品及藥物管理局首次批準了靶向B細胞成熟抗原(B cell mature antigen,BCMA)的嵌合抗原受體T細胞(chimeric antigen receptor T,CAR-T)免疫治療技術新藥Idecabtagene Vicleucel用于治療RRMM,為RRMM患者帶來新的希望[2]。盡管CAR-T免疫治療技術在RRMM展現(xiàn)出顯著的療效[3-7],但目前其仍存在一定局限性,例如自體T細胞來源受到患者T細胞功能狀態(tài)的影響,CAR-T免疫治療技術相關的不良反應,如細胞因子釋放綜合征(cytokine release syndrome,CRS)、神經(jīng)毒性等[8],同時大多數(shù)患者不能實現(xiàn)長期持續(xù)緩解而最終出現(xiàn)腫瘤復發(fā)等情況[9],CAR自然殺傷細胞(natural killer cell,NK細胞)免疫治療MM可能是克服上述缺陷一種新的治療手段,CAR-NK免疫治療技術可能為治愈RRMM帶來了希望。
在MM中,已發(fā)現(xiàn)多個靶點可作為CAR-NK免疫治療技術的MM特異性治療靶點[10-11],而且CAR-NK細胞治療MM已經(jīng)在臨床試驗研究中。最新的Ⅰ/Ⅱ期臨床研究結果也驗證了臍血來源的人類白細胞抗原錯配抗白細胞分化抗原(cluster of defferentiation,CD)19 CAR-NK細胞成功治療復發(fā)難治CD19陽性淋巴系統(tǒng)腫瘤,總體有效率達到73%,并且沒有發(fā)生CRS、神經(jīng)毒性及移植物抗宿主病(graft verse host disease,GVHD)等嚴重不良反應[12]。
本文將探討MM腫瘤微環(huán)境中NK細胞生物特點和功能缺陷情況,以及CAR-NK免疫治療技術治療MM的基礎和臨床研究進展。
MM腫瘤微環(huán)境NK細胞生物學特征
NK細胞作為機體固有免疫系統(tǒng)的重要組成成分,具有細胞毒作用和抗腫瘤效應,可通過多種機制發(fā)揮抗腫瘤效應[13]。首先,NK細胞在趨化因子的誘導下歸巢到腫瘤微環(huán)境,可以極大發(fā)揮其抗腫瘤活性。歸巢NK細胞主要包括兩群NK細胞:CD56brightNK細胞亞群和CD56dimNK細胞亞群,不同的細胞亞群表達不同的趨化因子受體從而歸巢到不同的組織,例如CD56brightNK通常表達與配體CCR2、CCR5、CCR7、CXCR3、CXCR4和CD62L結合的受體,CD56dimNK通常表達與配體CXCR1、CXCR2、CXCR4和CX3CR1等結合的受體。其次,NK細胞可表達兩種類型受體,一種為抑制性受體,如殺傷細胞免疫球蛋白樣受體家族,可識別靶細胞表面的主要組織相容性復合體(major histocompatibility complex,MHC)Ⅰ類分子啟動抑制性信號;一種為活化性受體,如天然細胞毒受體 (NKp46,NKp30,NKp44)、DNAM-1和NKG2D家族等,識別相應的配體可以激活NK細胞殺傷信號。NK細胞可通過抑制性受體與活化性受體之間的平衡狀態(tài)發(fā)揮細胞毒功能,當腫瘤細胞表面缺失MHCⅠ類分子或高表達活化性受體配體時,將啟動NK細胞活化殺傷信號,清除腫瘤細胞[14]。此外,NK細胞還可通過抗體依賴細胞介導的細胞毒作用(antibody-dependent cell-mediated cytotoxicity,ADCC)、穿孔素-顆粒酶途徑或者釋放IFNγ和TNF等細胞因子等殺傷腫瘤細胞[15-16]。NK細胞免疫功能缺陷在MM發(fā)病和進展機制中發(fā)揮重要作用,大量研究證實不同疾病階段MM腫瘤微環(huán)境中自體NK細胞的數(shù)量、表型及功能出現(xiàn)異常,提示MM疾病進展可能和自體NK細胞的分布及功能發(fā)生改變相關[17]。深入了解MM中NK細胞免疫監(jiān)視和殺傷功能的損傷機制,以及如何重塑NK細胞功能以增強抗MM治療療效是非常重要。
MM中NK細胞數(shù)量異常,NK細胞水平與MM臨床預后相關 通過對MM不同疾病階段骨髓細胞進行單細胞RNA測序發(fā)現(xiàn),可通過漿細胞克隆性增殖轉化為MM的意義未明的單克隆免疫球蛋白血癥(病前期)及低腫瘤負荷的早期MM中自體NK細胞數(shù)量增加并且伴有趨化因子受體表達改變,而隨著MM疾病進展到中晚期,骨髓微環(huán)境中自體NK細胞數(shù)量下降,同時其免疫功能及抗腫瘤細胞毒性明顯下降[18]。
通過臨床研究還證實NK細胞水平與MM的生存預后相關[19]。MM接受移植治療后NK細胞數(shù)量恢復水平與更好的預后相關[20]。NK細胞是自體移植后最早恢復免疫重建的淋巴細胞并且其恢復水平影響移植療效[21]。近期研究發(fā)現(xiàn)移植后NK細胞亞群也重新分布,不成熟表型NK細胞增加且增殖能力增強,移植后30 d及100 d NKG2A-CD57+成熟NK細胞亞群比例越低的MM患者無進展生存期越長[21]。
MM中NK細胞免疫表型及功能缺陷 NK細胞在MM腫瘤免疫反應中發(fā)揮重要免疫監(jiān)視功能,然而隨著疾病進展MM腫瘤細胞可能通過多種機制逃逸NK細胞殺傷作用[19]。
有研究發(fā)現(xiàn),相比于健康對照者,復發(fā)難治MM患者骨髓中NK細胞表型更加不成熟且活化性受體DNAM-1、NKG2D和CD16的表達水平下降,隨著疾病進展與腫瘤慢性持續(xù)作用可出現(xiàn)NK細胞耗竭情況[22]。此外,MM患者中NK細胞活化性受體NKp30和NKp46水平明顯降低,血清中可溶性NKG2D配體水平升高,也會引起NK細胞殺傷活性下降[23]。通過對MM中不同NK細胞亞群功能研究發(fā)現(xiàn),CD56lowCD16low NK細胞的細胞毒效應比其他NK細胞亞群更強,為MM中發(fā)揮抗腫瘤效應的主要NK細胞亞群,但隨著疾病進展CD56lowCD16low NK細胞表面的DNAM-1表達下降,導致與細胞表面相應的配體結合減少,發(fā)揮殺傷作用不明顯,失去抗腫瘤功能[24]。MM腫瘤細胞可通過上調MHC Ⅰ 類分子與NK表面抑制性受體如殺傷細胞免疫球蛋白樣受體結合,啟動殺傷抑制信號避免被NK細胞殺傷,或下調NKG2DLs表達避免被NK細胞表面活化性受體NKG2D結合從而逃逸NK細胞的殺傷作用[25-28]。有研究還發(fā)現(xiàn)MM患者NK細胞高表達程序性死亡受體1,可與骨髓瘤細胞表面的程序性死亡受體配體1結合,抑制NK細胞的抗腫瘤效應[29]。
此外,骨髓腫瘤微環(huán)境中MM腫瘤細胞以及免疫抑制細胞,如髓系來源抑制性細胞、調節(jié)性T細胞等,可通過分泌細胞因子抑制NK細胞功能,例如分泌白細胞介素(interleukin,IL)-6、IL-10、轉化生長因子-β等因子抑制NK細胞擴增及功能[17,30]。MM腫瘤細胞還可通過上調CXCR3配體CXCL9和CXCL10水平或者下調CXCR4配體CXCL12水平阻止NK細胞趨化骨髓遷移及發(fā)揮抗腫瘤效應[31],同樣有研究證實IP10/CXCL10的水平與MM骨髓中NK細胞的分布密切相關[32]。
重塑NK細胞功能有望治療MM 免疫抑制細胞、細胞因子、NK細胞耗竭以及NK細胞表面抑制性受體及或活化性受體表達失衡均可能導致NK細胞功能障礙,從而不能殺傷MM腫瘤細胞。總之,NK可能早期參與控制惡性漿細胞克隆的進展,而隨著疾病進展逐漸減弱,因此,重塑NK細胞免疫監(jiān)視功能的有望治療MM,其中CAR-NK免疫治療技術是一種有前景的增強NK細胞抗腫瘤效應功能的治療手段。
CAR-NK免疫治療MM研究進展
CAR-NK免疫治療技術概述 CAR-NK是通過基因編輯手段構建具有靶向性抗腫瘤作用的細胞,其不僅具有通過CAR特異性識別抗原表達腫瘤細胞的能力,還可以通過NK細胞受體自身來殺傷腫瘤細胞,是一種潛在的MM細胞免疫治療方式[33]。與CAR-T不同的是,NK抗腫瘤效應的活性取決于活化和抑制信號的平衡,以及ADCC效應等,因此,CAR-NK免疫治療技術的靶向裂解基于CAR依賴和NK受體依賴機制[34]。此外,NK細胞還可通過表達活化性受體與抗體聯(lián)合使用,增強NK細胞的ADCC作用從而提高抗腫瘤效應[34]。
由于NK細胞可不受MHCⅠ類分子識別的限制,可來源于異體細胞,如臍血細胞、NK細胞系以及誘導多能干細胞來源的NK細胞,故能克服部分患者因自身T細胞功能缺陷導致CAR-T細胞擴增的不足,具有成為“通用型”產(chǎn)品的潛力[11]。此外,CAR-NK免疫治療技術相比于CAR-T免疫治療技術可降低GVHD及CRS的發(fā)生率[11]。
CAR-NK的分子基本結構主要由單鏈抗體可變區(qū)構成的抗原識別區(qū)、胞外鉸鏈區(qū)、跨膜區(qū)和胞內(nèi)信號區(qū)組成[35]。不同的單鏈抗體可變區(qū)可以結合不同抗原表位,因此該區(qū)域決定CAR-NK細胞的特異性及功能,故應盡可能選擇腫瘤相關的特異性抗原作為CAR的靶點[35]。胞內(nèi)信號區(qū)決定NK細胞的活化信號強弱,和CAR-T相似,第1代CAR-NK免疫治療技術只有1個胞內(nèi)信號域,通常采用CD3ζ胞內(nèi)段;第2代CAR-NK免疫治療技術增加了CD28或腫瘤壞死因子受體超家族9等共刺激信號結構域;第3代CAR-NK免疫治療技術包含2個共刺激域[36],也有研究采用NK細胞特異性更強的共刺激信號如DAP10、DAP12、TNFR或者2B4等[34];第4代CAR-NK免疫治療技術中的CAR,即“armored CARs” 或“TRUCKs”,通過修飾增加細胞因子使效應NK細胞存活時間延長,增強抗腫瘤活性以及避免抗原逃逸[37]。近來有研究通過CRISPR/Cas-9敲除CISH基因,即IL-15信號的關鍵負調節(jié)分子,組裝第4代IL-15 CAR-NK,可增強NK細胞功能,通過雙重步驟增強IL-15信號對于腫瘤微環(huán)境中低水平IL-15的情況獲益更顯著[38]。
目前關于MM的CAR-NK免疫治療研究正在開展,但大多數(shù)處于臨床前及臨床Ⅰ/Ⅱ期試驗階段中。
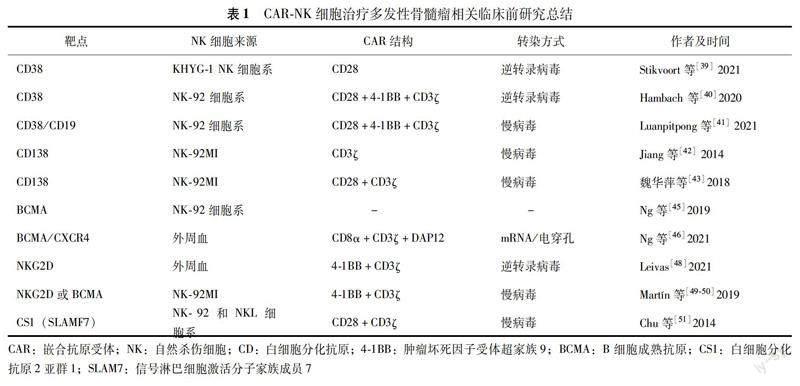
CAR-NK免疫治療技術在MM臨床前相關研究 目前已有多項臨床前研究發(fā)現(xiàn)CAR-NK免疫治療技術在MM腫瘤細胞及動物模型中具有抗腫瘤效應,靶點選擇多樣,而靶點選擇是CAR-NK識別殺傷腫瘤細胞的關鍵。目前關于CAR-NK免疫治療技術靶點主要包括腫瘤特異性抗原和腫瘤相關抗原,前者由于只在腫瘤細胞表面表達而在正常組織細胞不表達,是CAR-NK免疫治療技術最理想的靶點,但是,只在腫瘤細胞表面表達的抗原非常稀少,因此大部分CAR-NK免疫治療技術靶向于腫瘤細胞高表達而正常組織低表達的腫瘤相關抗原,如CD38、CD138、BCMA和信號淋巴細胞激活分子家族成員7(signaling lymphocytic activation molecule 7,SLAM7),這些抗原可在漿細胞表面高表達,而在正常組織細胞低表達,從而成為MM潛在的治療靶點(表1)。
有多項靶向CD38的CAR-NK細胞在臨床前研究中都顯示出成功的抗腫瘤效應。有研究采用KHYG-1 NK細胞系構建CD38-CAR-NK,發(fā)現(xiàn)CD38-CAR-NK對MM腫瘤細胞系、原代MM細胞以及小鼠動物模型均有抗腫瘤效應,并且通過分選Daratumumab耐藥患者的腫瘤細胞進行體外實驗發(fā)現(xiàn)仍具有抗腫瘤活性[39]。然而,由于人體內(nèi)正常造血細胞和組織細胞可以不同程度表達CD38,從而增加脫靶的可能,因此有研究利用CAR-NK對不同程度CD38表達水平的親和力不同,區(qū)分CD38強表達的腫瘤細胞與CD38弱表達的非腫瘤細胞從而增強其抗腫瘤靶向性[39]。由于傳統(tǒng)抗體可變區(qū)通過疏水基與抗原識別結合,因其親和力低可能導致CAR結構中的單鏈抗體可變區(qū)不穩(wěn)定以及具有黏性[40],故有研究通過納米技術合成CD38特異性納米抗體作為配體構建Nb-CAR,增強CAR融合蛋白的穩(wěn)定性,顯示Nb-CAR-NK-92對MM細胞系及原代MM細胞均具有抗腫瘤效應[40]。此外,有研究采用CD19-CAR-NK-92和CD38-CAR-NK-92共同處理MM細胞系增強抗腫瘤效應,并且CD19-CAR-NK-92和CD38-CAR-NK-92的比例將影響NK細胞細胞毒作用的強度,故在臨床轉化應用中可能需要根據(jù)患者特點探索使用個體化輸注量[41]。中國研究者通過構建CD138-CD3ζ-CAR-NK-92MI細胞發(fā)現(xiàn)其對MM細胞系和原代MM細胞抗腫瘤活性均較空白對照組增強[42],同時在NOD-SCID小鼠異體腫瘤移植模型中也證實其有效性,并且能夠檢測到粒酶B、干擾素-γ以及CD107a脫顆粒活性明顯增強[42]。隨著CAR技術的發(fā)展,通過基因工程進一步優(yōu)化CAR結構構建的CD138-CD28-CD3ζ-CAR-NK-92MI細胞,同樣能殺傷MM腫瘤細胞從而發(fā)揮抗腫瘤效應[43]。
BCMA由于在分化后期的B細胞和惡性漿細胞表面呈特異性表達,已成為CAR-T和CAR-NK免疫治療技術研究較多的靶點[44]。有研究通過NK92細胞構建BCMA-CAR-NK細胞與MM細胞系OPM2共培養(yǎng),檢測到干擾素-γ釋放并且具有抗腫瘤細胞效應,并且通過CRISPR/Csa9篩選顯示需要硫酸乙酰肝素等調節(jié)因子參與該CAR-NK細胞毒效應[45]。由于腫瘤微環(huán)境可能存在募集NK細胞功能缺陷以及促進NK細胞歸巢的細胞因子下調,可能影響CAR-NK定位到腫瘤部位從而降低其抗腫瘤效應[46],故有研究通過CXCR4修飾BCMA-CAR-NK細胞,發(fā)現(xiàn)其能夠在MM小鼠腫瘤模型中增強抗腫瘤效應并延長小鼠生存時間,提示共表達CXCR4及anti-BCMA CAR的NK細胞可能是一種提高NK骨髓細胞歸巢和存活從而增強抗腫瘤效應的方式[46]。
NKG2D是位于NK細胞表面的活化性受體,可以識別表達NKG2DL的腫瘤細胞從而激活NK細胞和T細胞活性發(fā)揮抗腫瘤效應,此外NKG2DL在正常健康組織中未觀察到明顯表達,因此也成為CAR-NK免疫治療技術研究的靶點[47]。檢測發(fā)現(xiàn)MM腫瘤細胞系中高表達NKG2DL,而MM患者樣本中腫瘤細胞呈不同水平的表達[48]。通過分離患者外周血NK細胞構建NKG2D-CAR-NKAE細胞,在體外實驗中對MM細胞系具有非常強的抗腫瘤效應而對正常組織細胞無明顯細胞毒效應,在小鼠模型中能夠降低小鼠腫瘤負荷并延長生存期[48]。此外,通過NK92MI細胞分別構建BCMA-CAR-NK和NKG2D-CAR-NK細胞來處理不同的MM細胞系,對比兩者抗腫瘤效應,發(fā)現(xiàn)兩者在清除腫瘤細胞效力方面沒有顯著差異,同時對健康供者來源的外周血單個核細胞均沒有細胞毒效應,證明NKG2D也是一種潛在CAR-NK細胞治療MM的靶點[49-50]。
信號淋巴細胞激活分子家族成員7或白細胞分化抗原2亞群1(CD2 subset 1,CS1)可在MM腫瘤細胞表面高表達,正常漿細胞、NK細胞、T細胞低表達,干細胞及其他正常組織細胞表面幾乎不表達[51]。通過NK-92細胞系構建抗CS1-CAR-NK-92對原代MM細胞以及免疫缺陷小鼠異體腫瘤移植模型均具有抗腫瘤效應[51]。
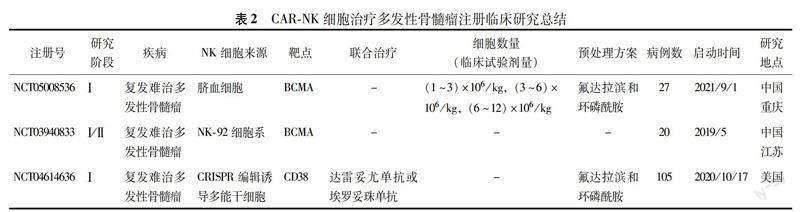
CAR-NK在MM臨床研究進展 雖然已有多種CAR-NK在MM腫瘤細胞及動物模型顯示出顯著的抗腫瘤效應,目前臨床轉化應用中尚處于臨床試驗研究階段,大多處于Ⅰ/Ⅱ期(表2),尚無確切的臨床研究結果公開發(fā)表。FT-538是一種基于CRISPR編輯技術的誘導多能干細胞來源靶向CD38的CAR-NK免疫治療技術,目前正在美國開展Ⅰ期臨床試驗,探索其在RRMM患者中的療效及安全性(NCT04614636)。此外,有兩項靶向BCMA的CAR-NK免疫治療技術正在中國開展Ⅰ/Ⅱ期臨床研究,分別采用臍血來源NK細胞和NK92細胞系,目前正在招募患者試驗階段,結果有待進一步追蹤。
雖然目前關于CAR-NK免疫治療技術治療MM的轉化進入臨床階段的研究較少,但在其他疾病中已有相關臨床研究結果發(fā)表,如靶向CD19的CAR-NK細胞治療11例CD19陽性復發(fā)難治非霍奇金淋巴瘤或慢性淋巴細胞白血病患者,其中4例非霍奇金淋巴瘤和3例慢性淋巴細胞白血病患者達到完全緩解,并且沒有發(fā)生嚴重的CRS、GVHD以及神經(jīng)系統(tǒng)毒性[12]。有研究首次應用靶向CD33的CAR-NK-92細胞治療3例復發(fā)難治性急性髓細胞白血病患者,其中1例異基因造血干細胞移植后復發(fā)的伴RUNX1-RUNX1T1陽性的急性髓系白血病患者,接受CD33-CAR-NK-92治療1個月后實現(xiàn)骨髓細胞形態(tài)學緩解,微小殘留病灶陽性,但病情短期內(nèi)再次復發(fā),另外2例患者對CD33-CAR-NK-92免疫治療沒有明顯的療效[52]。
CAR-NK免疫治療技術當前面臨的挑戰(zhàn)及展望 雖然CAR-NK免疫治療技術具有巨大的前景,但要實現(xiàn)臨床轉化應用仍然面臨一些挑戰(zhàn)和問題有待進一步解決。
首先,優(yōu)化CAR結構設計從而提升CAR-NK免疫治療技術的安全性減少相關不良反應,如CRS和神經(jīng)毒性等,有研究通過引入安全開關設計,如CAR結構中加入誘導型半胱天冬酶 9作為自殺基因控制CAR-NK的體內(nèi)存活時間[53]。
其次,關于CAR基因轉染技術相關的不良反應及轉染效率問題,慢病毒和逆轉錄病毒轉染臨床應用都仍面臨問題未解決,如插入突變導致耐藥腫瘤克隆產(chǎn)生或者導致其他腫瘤風險[54],慢病毒介導的p53活化影響細胞增殖[55]。隨著病毒載體技術和檢測技術的進步,可能會進一步通過優(yōu)化減少相關不良反應,無病毒的載體轉染和電穿孔mRNA轉染也可能是一種探索使用的轉染方法。
最后,關于NK細胞體外擴增培養(yǎng)及凍存優(yōu)化問題。目前正在研究無滋養(yǎng)細胞擴增體系工藝有望通過NK細胞體外培養(yǎng)擴增得到足夠治療數(shù)量級別的純化NK細胞,也可減少混雜細胞,避免臨床應用的其他潛在風險,但工藝穩(wěn)定性還需進一步優(yōu)化[12]。同時CAR-NK免疫治療技術要實現(xiàn)向“通用型”產(chǎn)品轉化,凍存介質應盡可能減少凍融損傷并保證其質量及活性,最新關于采用納米顆粒介導的NK細胞胞內(nèi)保護作用可能避免NK-92細胞的凍存損傷,但對于原代NK細胞的效果尚待進一步研究[56]。
總結
盡管MM治療取得不錯的進展,目前患者的中位生存期從以往的3~5年提高到10年左右,但仍有提升空間,尤其對多線治療后的RRMM依舊缺乏有效治療方案。近年來備受關注的CAR-NK免疫治療技術在大量臨床前研究中已證實其抗腫瘤效應及安全性,未來可轉化應用于臨床治療MM患者。NK細胞免疫功能缺陷與MM疾病進展密切相關,重塑NK細胞功能可增強機體抗腫瘤效應,CAR-NK免疫治療技術有望成為MM新的治療手段,優(yōu)化NK細胞來源、培養(yǎng)擴增純化體系、改良CAR的結構設計及探索適合NK細胞的CAR結構也為實現(xiàn)持續(xù)抗腫瘤效應和減少不良反應提供方向,還有CAR-NK細胞聯(lián)合其他治療手段(如單克隆抗體、基因編輯方法等)可進一步增強免疫效應細胞功能及發(fā)揮抗腫瘤效應,這些都有望成為治療MM有效手段。
參 考 文 獻
[1]Gandhi UH,Cornell RF,Lakshman A,et al.Outcomes of patients with multiple myeloma refractory to CD38-targeted monoclonal antibody therapy[J].Leukemia,2019,33(9):2266-2275.DOI:10.1038/s41375-019-0435-7.
[2]Mikkilineni L,Kochenderfer JN.CAR T cell therapies for patients with multiple myeloma[J].Nat Rev Clin Oncol,2021,18(2):71-84.DOI:10.1038/s41571-020-0427-6.
[3]Munshi NC,Anderson LD,Shah N,et al.Idecabtagene Vicleucel in relapsed and refractory multiple myeloma[J].N Engl J Med,2021,384(8):705-716.DOI:10.1056/NEJMoa2024850.
[4]Berdeja JG,Madduri D,Usmani SZ,et al.Ciltacabtagene autoleucel,a B-cell maturation antigen-directed chimeric antigen receptor T-cell therapy in patients with relapsed or refractory multiple myeloma (CARTITUDE-1):a phase 1b/2 open-label study[J].Lancet,2021,398(10297):314-324.DOI:10.1016/S0140-6736(21)00933-8.
[5]Xu J,Chen L,Yang S,et al.Exploratory trial of a biepitopic CAR T-targeting B cell maturation antigen in relapsed/refractory multiple myeloma[J].Proc Natl Acad Sci USA,2019,116(19):9543-9551.DOI:10.1073/pnas.1819745116.
[6]Raje N,Berdeja J,Lin Y,et al.Anti-BCMA CAR T-cell therapy bb2121 in relapsed or refractory multiple myeloma[J].N Engl J Med,2019,380(18):1726-1737.DOI:10.1056/NEJMoa1817226.
[7]Zhao W,Liu J,Wang B,et al.A phase 1,open-label study of LCAR-B38M,a chimeric antigen receptor T cell therapy directed against B cell maturation antigen,in patients with relapsed or refractory multiple myeloma[J].J Hematol Oncol,2018,11(1):141.DOI:10.1186/s13045-018-0681-6.
[8]Brudno JN,Kochenderfer JN.Recent advances in CAR T-cell toxicity:mechanisms,manifestations and management[J].Blood Rev,2019,34:45-55.DOI:10.1016/j.blre.2018.11.002.
[9]Wudhikarn K,Mailankody S,Smith EL.Future of CAR T cells in multiple myeloma[J].Hematology,2020,2020(1):272-279.DOI:10.1182/hematology.2020000111.
[10]Liu P,Jin Y,Sattar H,et al.Natural killer cell immunotherapy against multiple myeloma:progress and possibilities[J].J Leukoc Biol,2018,103(5):821-828.DOI:10.1002/JLB.2RU0517-176RR.
[11]Shah UA,Mailankody S.CAR T and CAR NK cells in multiple myeloma:expanding the targets[J].Best Pract Res Clin Haematol,2020,33(1):101141.DOI:10.1016/j.beha.2020.101141.
[12]Liu E,Marin D,Banerjee P,et al.Use of CAR-transduced natural killer cells in CD19-positive lymphoid tumors[J].N Engl J Med,2020,382(6):545-553.DOI:10.10 56/NEJMoa1910607.
[13]Tomaipitinca L,Russo E,Bernardini G.NK cell surveillance of hematological malignancies.Therapeutic implications and regulation by chemokine receptors[J].Mol Aspects Med,2021,80:100968.DOI:10.1016/j.mam.2021.100968.
[14]崔蕊,鄧琦.嵌合抗原受體自然殺傷細胞在血液系統(tǒng)惡性腫瘤中的研究進展[J].國際生物醫(yī)學工程雜志,2021,44(1):77-82.DOI:10.3724/zdxbyxb-2022-0055.
[15]Cózar B,Greppi M,Carpentier S,et al.Tumor-infiltrating natural killer cells[J].Cancer Discov,2021,11(1):34-44.DOI:10.1158/2159-8290.CD-20-0655.
[16]Chiossone L,Dumas P,Vienne M,et al.Natural killer cells and other innate lymphoid cells in cancer[J].Nat Rev Immunol,2018,18(11):671-688.DOI:10.1038/s41577-018-0061-z.
[17]Guillerey C,Nakamura K,Vuckovic S,et al.Immune responses in multiple myeloma:role of the natural immune surveillance and potential of immunotherapies[J].Cell Mol Life Sci,2016,73(8):1569-1589.DOI:10.1007/s00018-016-2135-z.
[18]Zavidij O,Haradhvala NJ,Mouhieddine TH,et al.Single-cell RNA sequencing reveals compromised immune microenvironment in precursor stages of multiple myeloma[J].Nat Cancer,2020,1(5):493-506.DOI:10.1038/s43018-020-0053-3.
[19]Fionda C,Stabile H,Molfetta R,et al.Translating the anti-myeloma activity of Natural Killer cells into clinical application[J].Cancer Treat Rev,2018,70:255-264.DOI:10.1016/j.ctrv.2018.10.005.
[20]Kim SY,Lee H,Han M,et al.Post-transplantation natural killer cell count:a predictor of acute graft-versus-host disease and survival outcomes after allogeneic hematopoietic stem cell transplantation[J].Clin Lymphoma Myeloma Leuk,2016,16(9):527-535.DOI:10.1016/j.clml.2016.06.013.
[21]Orrantia A,Terrén I,Astarloa-Pando G,et al.NK cell reconstitution after autologous hematopoietic stem cell transplantation:association between NK cell maturation stage and outcome in multiple myeloma[J].Front Immunol,2021,12:748207.DOI:10.3389/fimmu.2021.748207.
[22]Pazina T,Macfarlane AW,Bernabei L,et al.Alterations of NK cell phenotype in the disease course of multiple myeloma[J].Cancers,2021,13(2):226.DOI:10.3390/cancers13020226.
[23]韓文敏,張修文,賈祝霞,等.多發(fā)性骨髓瘤患者NK細胞殺傷功能異常的研究[J].中華血液學雜志,2015,36(11):922-925.DOI:10.3760/cma.j.issn.0253-2727.2015.11.007.
[24]Vulpis E,Stabile H,Soriani A,et al.Key role of the CD56lowCD16low natural killer cell subset in the recognition and killing of multiple myeloma cells[J].Cancers,2018,10(12):473.DOI:10.3390/cancers10120473.
[25]Myers JA,Miller JS.Exploring the NK cell platform for cancer immunotherapy[J].Nat Rev Clin Oncol,2021,18(2):85-100.DOI:10.1038/s41571-020-0426-7.
[26]Carbone E.HLA class I,NKG2D,and natural cytotoxicity receptors regulate multiple myeloma cell recognition by natural killer cells[J].Blood,2005,105(1):251-258.DOI:10.1182/blood-2004-04-1422.
[27]Zingoni A,Cecere F,Vulpis E,et al.Genotoxic stress induces senescence-associated ADAM10-dependent release of NKG2D MIC ligands in multiple myeloma cells[J].J Immunol,2015,195(2):736-748.DOI:10.4049/jimmunol.1402643.
[28]Petillo S,Capuano C,Molfetta R,et al.Immunomodulatory effect of NEDD8-activating enzyme inhibition in multiple myeloma:upregulation of NKG2D ligands and sensitization to natural killer cell recognition[J].Cell Death Dis,2021,12(9):836.DOI:10.1038/s41419-021-04104-w.
[29]Ray A,Das DS,Song Y,et al.Targeting PD1-PDL1 immune checkpoint in plasmacytoid dendritic cell interactions with T cells,natural killer cells and multiple myeloma cells[J].Leukemia,2015,29(6):1441-1444.DOI:10.1038/leu.2015.11.
[30]Kawano Y,Roccaro AM,Ghobrial IM,et al.Multiple myeloma and the Immune microenvironment[J].Curr Cancer Drug Targets,2017,17(9):806-818.DOI:10.2174/1568009617666170214102301.
[31]Ponzetta A,Benigni G,Antonangeli F,et al.Multiple myeloma impairs bone marrow localization of effector natural killer cells by altering the chemokine microenvironment[J].Cancer Res,2015,75(22):4766-4777.DOI:10.1158/0008-5472.CAN-15-1320.
[32]Bernardini G,Vulpis E,Bonanni V,et al.High expression levels of IP10/CXCL10 are associated with modulation of the natural killer cell compartment in multiple myeloma[J].Leuk Lymphoma,2017,58(10):2493-2496.DOI:10.1080/10428194.2017.129 5144.
[33]Marofi F,Saleh MM,Rahman HS,et al.CAR-engineered NK cells;a promising therapeutic option for treatment of hematological malignancies[J].Stem Cell Res Ther,2021,12(1):374.DOI:10.1186/s13287-021-02462-y.
[34]Daher M,Rezvani K.Outlook for new CAR-based therapies with a focus on car NK cells:what lies beyond CAR-engineered T cells in the race against cancer[J].Cancer Discov,2021,11(1):45-58.DOI:10.1158/2159-8290.CD-20-0556.
[35]Gong Y,Klein Wolterink RGJ,Wang J,et al.Chimeric antigen receptor natural killer (CAR-NK) cell design and engineering for cancer therapy[J].J Hematol Oncol,2021,14(1):73.DOI:10.1186/s13045-021-01083-5.
[36]殷書磊,于益芝,曹雪濤.CAR-NK抗腫瘤研究的現(xiàn)狀與發(fā)展趨勢[J].中國腫瘤生物治療雜志,2016,23(1):1-10.DOI:10.3872/j.issn.1007-385X.2016.01.001.
[37]Chmielewski M,Abken H.TRUCKs:the fourth generation of CARs[J].Expert Opin Biol Th,2015,15(8):1145-1154.DOI:10.1517/14712598.2015.1046430.
[38]Daher M,Basar R,Gokdemir E,et al.Targeting a cytokine checkpoint enhances the fitness of armored cord blood CAR-NK cells[J].Blood,2021,137(5):624-636.DOI:10.1182/blood.2020007748.
[39]Stikvoort A,van der Schans J,Sarkar S,et al.CD38-specific chimeric antigen receptor expressing natural killer KHYG-1 Cells:a proof of concept for an “off the shelf” therapy for multiple myeloma[J].HemaSphere,2021,5(7):e596 DOI:10.1097/HS9.0000000000000596.
[40]Hambach J,Riecken K,Cichutek S,et al.Targeting CD38-expressing multiple myeloma and burkitt lymphoma cells in vitro with nanobody-based chimeric antigen receptors (Nb-CARs)[J].Cells,2020,9(2):321.DOI:10.3390/cells9020321.
[41]Luanpitpong S,Poohadsuan J,Klaihmon P,et al.Selective cytotoxicity of single and dual anti-CD19 and anti-CD138 chimeric antigen receptor-natural killer cells against hematologic malignancies[J].J Immunol Res,2021,2021:1-16.DOI:10.1155/2021/5562630.
[42]Jiang H,Zhang W,Shang P,et al.Transfection of chimeric anti-CD138 gene enhances natural killer cell activation and killing of multiple myeloma cells[J].Mol Oncol,2014,8(2):297-310.DOI:10.1016/j.molonc.2013.12.001.
[43]魏華萍,楊楠,谷振陽,等.嵌合抗原受體設計的NK細胞在多發(fā)性骨髓瘤中的應用研究[J].中國實驗血液學雜志,2018,26(3):796-801.DOI:10.7534/j.issn.1009-2137.2018.03.027.
[44]Yu B,Jiang T,Liu D.BCMA-targeted immunotherapy for multiple myeloma[J].J Hematol Oncol,2020,13(1):125.DOI:10.1186/s13045-020-00962-7.
[45]Ng K,Pasion J,Wendel H.CAR-directed cytotoxicity of NK cells:an alternative tool to treat and to study multiple myeloma and NK biology[J].Clin Lymphoma Myeloma Leuk,2019,19(10):e355.DOI:10.1016/j.clml.2019.09.586.
[46]Ng YY,Du Z,Zhang X,et al.CXCR4 and anti-BCMA CAR co-modified natural killer cells suppress multiple myeloma progression in a xenograft mouse model[J].Cancer Gene Ther,2022,29(5):475-483.DOI:10.1038/s41417-021-00365-x.
[47]Salih HR,Antropius H,Gieseke F,et al.Functional expression and release of ligands for the activating immunoreceptor NKG2D in leukemia[J].Blood,2003,102(4):1389-1396.DOI:10.1182/blood-2003-01-0019.
[48]Leivas A,Valeri A,Córdoba L,et al.NKG2D-CAR-transduced natural killer cells efficiently target multiple myeloma[J].Blood Cancer J,2021,11(8):146.DOI:10.1038/s41408-021-00537-w.
[49]Martín EM,Encinas J,García-Ortiz A,et al.NKG2D and BCMA-CAR NK cells efficiently eliminate multiple myeloma cells.A comprehensive comparison between two clinically relevant CARs[J].HemaSphere,2019,3(S1):550-551.DOI:10.1097/01.HS9.0000563120.66927.63.
[50]Martín EM,Encinas J,García-Ortiz A,et al.Exploring NKG2D and BCMA-CAR NK-92 for adoptive cellular therapy to multiple myeloma[J].Clin Lymphoma Myeloma Leuk,2019,19(10):e24-e25.DOI:10.1016/j.clml.2019.09.036.
[51]Chu J,Deng Y,Benson DM,et al.CS1-specific chimeric antigen receptor (CAR)-engineered natural killer cells enhance in vitro and in vivo antitumor activity against human multiple myeloma[J].Leukemia,2014,28(4):917-927.DOI:10.1038/leu.2013.279.
[52]Tang X,Yang L,Li Z,et al.First-in-man clinical trial of CAR NK-92 cells:safety test of CD33-CAR NK-92 cells in patients with relapsed and refractory acute myeloid leukemia[J].Am J Cancer Res,2018,8(6):1083-1089.
[53]Liu E,Tong Y,Dotti G,et al.Cord blood NK cells engineered to express IL-15 and a CD19-targeted CAR show long-term persistence and potent antitumor activity[J].Leukemia,2018,32(2):520-531.DOI:10.1038/leu.2017.226.
[54]Ruella M,Xu J,Barrett DM,et al.Induction of resistance to chimeric antigen receptor T cell therapy by transduction of a single leukemic B cell[J].Nat Med,2018,24(10):1499-1503.DOI:10.1038/s41591-018-0201-9.
[55]Piras F,Riba M,Petrillo C,et al.Lentiviral vectors escape innate sensing but trigger p53 in human hematopoietic stem and progenitor cells[J].EMBO Mol Med,2017,9(9):1198-1211.DOI:10.15252/emmm.201707922.
[56]Yao X,Jovevski JJ,Todd MF,et al.Nanoparticle-mediated intracellular protection of natural killer cells avoids cryoinjury and retains potent antitumor functions[J].Adv Sci,2020,7(9):1902938.DOI:10.1002/advs.201902938.
(收稿日期:2021-12-13)
基金項目:四川省自然科學基金(2022NSFSC1299)、四川大學華西醫(yī)院臨床研究孵化項目(19HXFH0303)、四川大學華西醫(yī)院成果轉化項目(CGZH21001)、四川大學華西醫(yī)院學科卓越發(fā)展1.3.5工程(ZYJC21007) 和國家血液系統(tǒng)疾病臨床醫(yī)學研究中心轉化研究課題(2021WWB03)

