Cdc42蛋白參與中性粒細胞彈性蛋白酶誘導的人氣道上皮細胞黏蛋白高分泌
何明欣,周向東,楊雅樓,徐立,張華,李琪
氣道黏液高分泌是慢性氣道炎性疾病的重要病理特征,長期的黏液高分泌易造成病原菌定植,進而引起持續性的感染和難以緩解的氣道阻塞,從而嚴重影響患者的預后。氣道黏蛋白 (mucin, MUC) 5AC是氣道黏液最具代表的病理性表達產物,在各種炎性介質、致病菌產物、蛋白酶及冷空氣等始動因素刺激下易導致其過度表達[1-2]。然而在眾多促黏液因子中,目前已知中性粒細胞彈性蛋白酶 (neutrophil elastase, NE) 對病理性黏蛋白分泌的促進作用最強,極易促成黏液栓的形成[3-4]。氣道慢性炎性狀態下,MUC5AC的合成儲備量已較正常時明顯增加,而當氣道炎性反應急性發生時,胞漿中的黏蛋白儲存量無法在短時間內進一步增多,因此,急性發作時出現氣道黏液大量分泌的現象勢必與胞內某種強有力的極性誘導因素導致黏蛋白出胞增多有關[5-6]。已有研究表明,Rho作為一種小分子G蛋白,在蛋白囊泡出胞過程中起著至關重要的作用,其亞型細胞分裂周期蛋白 (cell division cycle,Cdc) 42在細胞信號通路中具有分子開關的功能,參與細胞的黏附、遷移與極化,是蛋白出胞領域中研究最為廣泛的小分子G蛋白之一[7-8]。目前,Cdc42在癌細胞轉移領域的研究較多,有關氣道黏液高分泌的研究甚少,故本實驗以NE作為黏液高分泌刺激因子構建體外細胞模型,采用siRNA干擾技術探究Cdc42與氣道黏蛋白高分泌的關系及其可能的介導作用,報道如下。
1 材料與方法
1.1 實驗材料 (1)細胞、試劑:人支氣管氣道上皮細胞(16HBE) (ATCC,美國)、DMEM培養液、HEPES、Trizol、胎牛血清 (FBS)、HNE、抗GAPDH單克隆抗體(Sigma,美國)、Cdc42 siRNA及陰性對照(Santa Cruz,美國)、兔抗Cdc42蛋白抗體(博奧森,北京)、小鼠抗MUC5AC單克隆抗體,HRP-羊抗兔抗體(Santa Cruz,美國)、HRP-羊抗鼠抗體(Sigma,美國)BAC蛋白濃度測定試劑盒(碧云天,上海)、人MUC5AC ELISA試劑盒(凡科維)、LipofectamineTM2000試劑(Invitrogen,中國)。(2)儀器:SynergyHTX型多功能酶標儀(Bio-TeK,美國),LightCycler 480 Ⅱ型熒光定量PCR儀(Roche,瑞士),ABLX5全自動化學發光圖像分析系統(Tanon,中國)。
1.2 細胞培養及分組 將16HBE細胞培養于含10%的胎牛血清和雙抗(100 U/ml青霉素、100 μg/ml鏈霉素)的DMEM培養基中,置于37℃、5% CO2培養箱內孵育,常規換液培養。當細胞貼壁達80%~90% 時將其傳代至6孔板內,細胞數量為 (2~5)×105/孔,分為6組。(1)對照組:無FBS和雙抗的基礎DMEM培養基培養細胞;(2)NE組:無FBS培養基中加入NE 25 nmol/L;(3)NE + Cdc42 siRNA組:細胞Cdc42 siRNA 5 μmol/L預處理30 min后加入25 nmol/L NE;(4)NE+陰性siRNA組:以陰性siRNA轉染后加入NE 25 nmol/L;(5)Cdc42 siRNA組:無FBS培養基中加入Cdc42 siRNA 5 μmol/L預處理;(6)陰性siRNA組:以陰性siRNA轉染后,無FBS培養基培養。每組設5個復孔進行統計學分析,實驗重復5次。
1.3 細胞轉染 將處于對數生長期的細胞調整濃度至(1~2)×105/L,加入無雙抗的培養基孵育12~24 h,當細胞融合達70%~80%時進行轉染,按轉染試劑LipofectamineTM2000說明書的實驗步驟將Cdc42 siRNA及陰性對照轉染入16HBE細胞中,以陰性siRNA為陰性對照,轉染后24~48 h進行細胞處理及相關檢測。
1.4 Western印跡檢測Cdc42蛋白含量 將細胞置于冰上,每孔加入100 μl的RIPA強裂解液(含PMSF∶RIPA=1 μl∶100 μl)裂解5 min,轉移至提前預冷的EP管中勻速搖15 min,使細胞充分裂解。4℃條件下14 000 r/min離心15 min,用BCA蛋白分析試劑盒測定上清液總蛋白并調平。選擇10% SDS-PAGE分離膠和5%濃縮膠,電泳跑膠,濕轉至PVDF (0.45 μm) 膜上。轉膜后把膜放入QuickBlock Western封閉液中低速振蕩封閉15 min。棄掉封閉液加入兔抗Cdc42蛋白一抗(1∶500) 勻速搖床30 min后放4℃搖床過夜。次日用1×TBST洗膜3次加入HRP標記的二抗(1∶1 000)室溫下搖床1 h,再次洗膜后用濾紙吸取多余水份,滴加ECL化學發光底物,放置1~3 min。使用凝膠成像儀對膜進行曝光和顯影,并用Image J軟件分析結果。GAPDH作為內參蛋白,實驗重復3次。
1.5 ELISA法測MUC5AC蛋白水平 采用雙抗夾心ELISA法檢測樣品中MUC5AC靶蛋白濃度。取6組已經過處理的細胞培養液,離心20 min后收集上清液。設置標準品孔、樣本孔,標準品孔各加入不同濃度的標準品50 μl,樣本孔內加入待測樣品50 μl(10 μl樣品+40 μl樣品稀釋液),每孔加入酶標試劑100 μl(空白孔不加樣品及酶標試劑),用封板膜封住反應孔置37℃孵育60 min。隨后PBS洗板5次,拍干,每孔加入顯色劑避光15 min。加終止液50 μl,測各孔A值(λ=450 nm),測量結果與標準品比值計算黏蛋白MUC5AC的相對值。
1.6 免疫熒光檢測各組細胞MUC5AC蛋白表達 將貼壁生長良好的細胞消化后接種于35 mm玻底共聚焦培養皿中,細胞密度為1×105/ml,分別對各種細胞進行加藥刺激。處理結束后PBS洗滌3次,每次3~5 min,隨后使用4%多聚醛室溫下固定30 min;PBS洗滌3次,0.1 Triton X-100室溫下通透20 min,PBS洗滌3次,5%山羊血清室溫封閉30 min,滴加MUC5AC蛋白一抗 (1∶300) 后置于4℃濕盒過夜;次日PBS洗3次,避光滴加羊抗鼠熒光二抗 (1∶500) 室溫放置30 min;PBS洗滌3次,避光滴加DAPI染色液5 min;PBS洗3遍,滴加防淬滅劑。共聚焦激光掃描生物顯微鏡下觀察并拍片,采用Image Pro Plus 軟件分析細胞相對熒光強度。
2 結 果
2.1 各組細胞內Cdc42蛋白表達水平比較 Cdc42 siRNA組的Cdc42蛋白表達量相較于對照組和陰性siRNA組顯著降低 (P<0.05),表明轉染成功。與對照組相比,NE組以及NE+陰性siRNA組的Cdc42表達量有明顯升高 (P<0.001),顯示NE可刺激Cdc42蛋白的表達;NE+Cdc42 siRNA組相對于NE組其Cdc42蛋白表達有明顯的下降 (P<0.001);對照組與NE+Cdc42 siRNA組以及陰性siRNA組的Cdc42蛋白表達無明顯差異(P>0.05),見圖1。
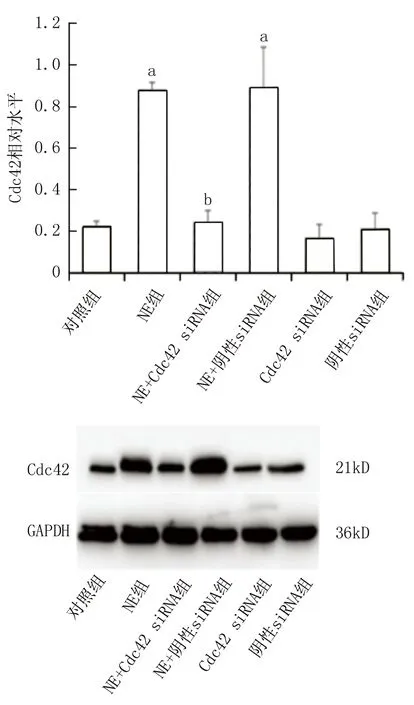
注:與對照組比較,aP<0.001;與NE組比較,bP<0.001。圖1 各組細胞內Cdc42蛋白的表達水平比較Fig.1 Comparison of the expression levels of Cdc42 protein in each group of cells
2.2 各組細胞分泌至上清液中的MUC5AC蛋白水平比較 與對照組相比,NE組以及NE+陰性siRNA組MUC5AC蛋白分泌水平明顯上升(P<0.001);而NE+Cdc42 siRNA組MUC5AC蛋白分泌水平與對照組比較差異無統計學意義(P=0.400),但與NE組以及NE+陰性siRNA組相比MUC5AC蛋白水平明顯下降(P<0.001);對照組與陰性siRNA組比較MUC5AC蛋白水平無明顯差異(P=0.450),見圖2。

注:與對照組比較,aP<0.001;與NE組比較,bP<0.001。圖2 各組細胞培養上清中MUC5AC蛋白水平比較Fig.2 Comparison of MUC5AC protein levels in cell culture supernatant of each group
2.3 各組細胞中MUC5AC蛋白水平比較 免疫熒光結果顯示,與對照組相比, NE組和NE+陰性siRNA組的MUC5AC表達明顯增高 (P<0.001);NE+Cdc42 siRNA組MUC5AC蛋白分泌與對照組相比差異無明顯統計學意義(P>0.05),而與NE組以及NE+陰性siRNA組相比MUC5AC蛋白表達水平明顯下調(P<0.05);對照組與陰性siRNA組比較MUC5AC蛋白水平差異無統計學意義(P>0.05),見圖3。
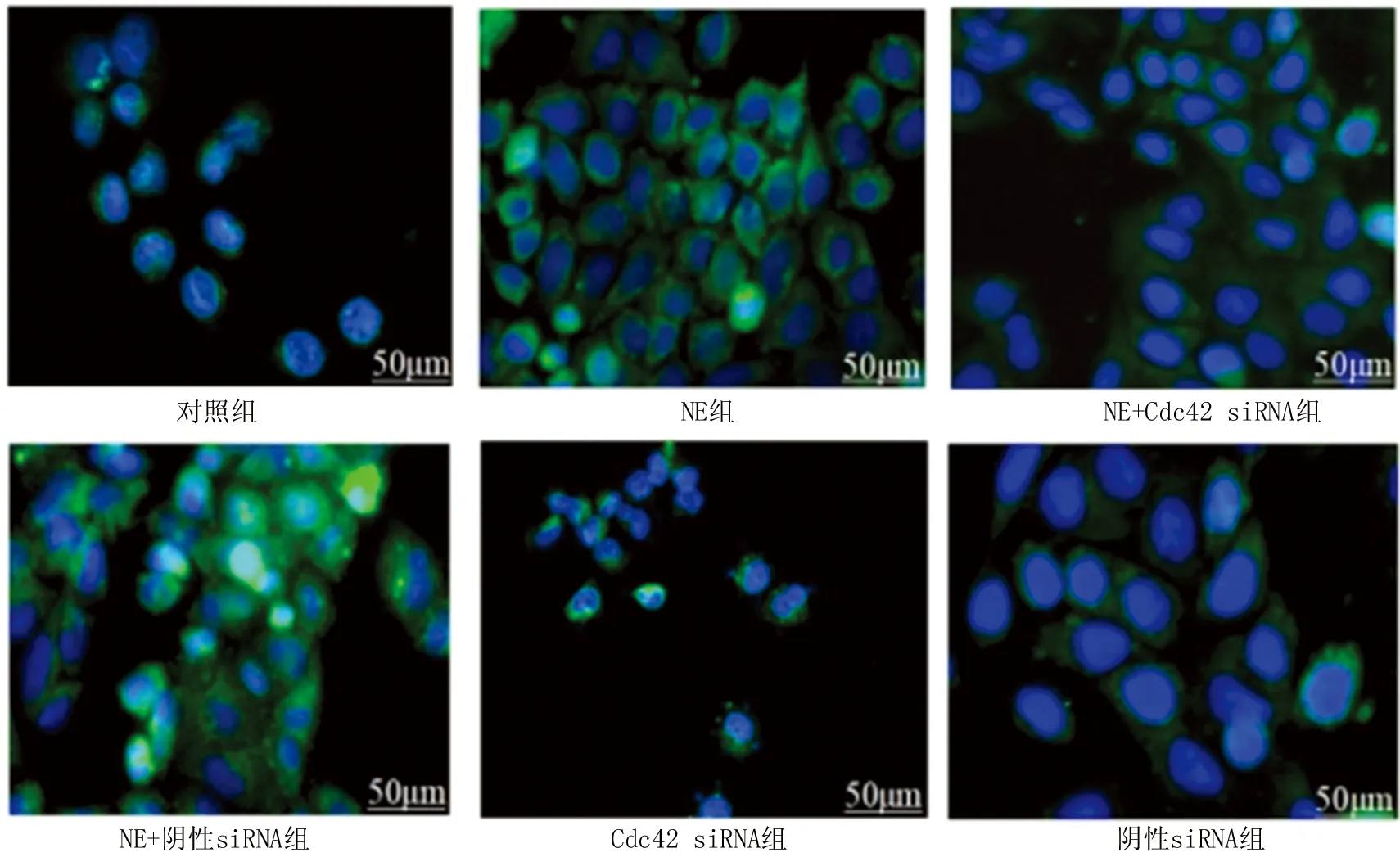
注:綠色熒光表示MUC5AC蛋白,藍色熒光表示細胞核。圖3 各組細胞中MUC5AC蛋白的表達水平比較Fig.3 Comparison of the expression levels of MUC5AC protein in each group of cells
3 討 論
正常分泌的氣道黏液能抵御部分外來的致病因子和刺激因子,起到保護氣道、濕潤空氣等作用。但各種致病因子長期反復作用于氣道黏膜時,會引起黏膜下腺體過度增生及杯狀細胞過度化生,從而產生大量的黏稠黏液,表現為氣道黏液高分泌。該狀態是諸多慢性氣道炎性疾病如哮喘、慢性支氣管炎等最早出現也是最常伴隨的癥狀之一[9]。此類疾病除了黏液分泌過多以外其纖毛清除功能也呈不同程度的下降,導致病理性的黏液無法隨纖毛擺動而順勢排出,常隨潴留時間的延長而形成黏液栓,有利于氣道細菌的生存與繁殖,如此周而復始誘導氣道黏液高分泌現象的進一步惡化,最終嚴重影響患者的治療和預后[10-11]。
NE作為絲氨酸蛋白酶超家族成員,由中性粒細胞生成,是目前病理性黏蛋白高分泌過程中已知的最強刺激因子,破壞性極強,可誘導氣道重塑引發肺纖維化等[12-13]。現已證實諸多促進黏蛋白生成的因素同時也會促進其分泌至胞外,而Rho蛋白是調控囊泡出胞的蛋白之一,其作為GTPase的Ras超家族成員,廣泛存在于真核細胞中膜相關的細胞器內,當它與GTP結合時處于活性狀態 (Rho-GTPase),與GDP結合時處于失活狀態,該機制使其可通過類似分子開關的作用調控蛋白囊泡的出胞過程[14]。而Rho蛋白又包含諸多亞型,如Rac、Cdc42、Rif等,其中Cdc42蛋白亞型是細胞極性建立過程中的關鍵因子,起初隨機分布在細胞內,被激活后就會富集到細胞膜上,然后啟動一系列下游生物過程,輔助相關蛋白囊泡的出胞運動[15]。因此,氣道炎性反應急性發作時出現的黏液分泌大量增多,很可能與胞內有極強的介導因素促使黏蛋白出胞相關[16-17],故而Cdc42蛋白在黏液高分泌中的作用值得進一步詳細研究。
本實驗以NE作為刺激因子,構建黏液高分泌的體外細胞模型,分別對轉染前和轉染后的16HBE細胞進行刺激。結果發現,16HBE在NE刺激后其細胞外MUC5AC以及細胞內的Cdc42蛋白水平表達明顯增加;而轉染Cdc42 siRNA后,再用NE刺激,胞內Cdc42蛋白水平分泌量相較對照組沒有明顯升高,相較于NE組卻出現了明顯的下降,同時上清液中的MUC5AC與之結果相一致。由此可見,NE這些促黏液因子會通過刺激Cdc42蛋白的表達,進而促進MUC5AC的分泌和出胞,反之亦然。因此推測抑制Cdc42蛋白很可能成為控制慢性氣道炎性疾病的病理性黏液高分泌的又一重要靶點。
綜上所述,Cdc42蛋白是NE刺激下氣道MUC5AC蛋白高分泌的重要上游信號分子。但Cdc42如何促進MUC5AC出胞的具體膜介導機制還尚不十分清楚,未來需要更多的體內和體外實驗來進一步闡明Cdc42在黏液高分泌中的確切機制。
利益沖突:所有作者聲明無利益沖突
作者貢獻聲明
何明欣:設計研究方案,實施研究過程,論文撰寫;周向東、李琪、張華:提出研究思路,分析試驗數據,論文審核;徐立:實施研究過程,資料搜集整理,論文修改;楊雅樓:進行統計學分析

